TGF-β对胃癌细胞干性因子Oct4、Nanog表达的影响及机制
2018-01-06李欣庹必光文国容金海安家兴王乾兴谢睿
李欣,庹必光,文国容,金海,安家兴,王乾兴,谢睿
(1遵义医学院细胞生物学教研室,贵州遵义563000;2贵州省消化病研究所;3遵义医学院附属医院)
TGF-β对胃癌细胞干性因子Oct4、Nanog表达的影响及机制
李欣1,2,庹必光2,3,文国容2,3,金海2,3,安家兴2,3,王乾兴1,谢睿2,3
(1遵义医学院细胞生物学教研室,贵州遵义563000;2贵州省消化病研究所;3遵义医学院附属医院)
目的探讨TGF-β对胃癌细胞干性因子Oct4、Nanog表达的影响。方法将培养的胃癌MKN45细胞分为对照组、TGF-β(10 ng/mL)组和TGF-β+BAPTA-AM组,对照组不进行任何处理,其余两组分别采用相应试剂刺激24 h。采用qRT-PCR、Western blotting技术检测胃癌相关干性因子Nanog、Oct4的mRNA和蛋白表达水平。高速离子成像系统检测加入正常的PSS液(空白对照组)、加入TGF-β(20 ng/mL)(单独TGF-β组)及加入TGF-β+BAPTA-AM (联合组)作用后胃癌细胞MKN45内Ca2+浓度的变化。结果与对照组比较,TGF-β组Nanog和Oct4 mRNA及蛋白的表达上调(P均<0.05),与TGF-β组比较,TGF-β+BAPTA-AM组Nanog和Oct4 mRNA及蛋白的表达下调(P均<0.05)。与空白对照组比较,TGF-β组细胞内钙增加(P<0.05);与单独TGF-β组比较,联合组细胞内钙减少(P<0.05)。结论TGF-β可能通过增加细胞内钙浓度而使胃癌细胞干性因子Oct4、Nanog的表达增强。
胃癌;转化生长因子β; 肿瘤细胞干性因子;Nanog
胃癌是消化道最常见恶性肿瘤,其复发转移和病死率都极高。肿瘤干细胞是肿瘤复发和转移的关键,传统的治疗药物不能杀死肿瘤干细胞。目前已知促进肿瘤细胞干性功能的基因主要有Oct4、Nanog和CD44等。转化生长因子β (TGF-β)是公认的调节肿瘤干性的细胞因子[1]。TGF-β在多种消化道肿瘤如食管癌、胃癌、肝癌、大肠癌等的侵袭、转移以及促进肿瘤的细胞生物学行为中发挥了重要作用。研究证实,在肿瘤的发生发展中,肿瘤细胞内钙信号重构被认为是促进肿瘤细胞增殖、迁移、侵袭的关键事件。有文献报道,在多种肿瘤干细胞和肿瘤细胞中,Ca2+参与调控肿瘤细胞的侵袭、迁移,而P物质可以显著升高胃癌细胞内钙离子浓度,进而作用于胃癌细胞,调控其发生发展[2,3];并且细胞内钙信号活化和神经胶质瘤干细胞密切相关[4]。但是,目前有关TGF-β是否可以参与调控胃癌细胞内钙活化,进而影响胃癌细胞干性因子表达鲜有报道。2016年8月~2017年7月,本试验进行了相关探讨,为胃癌的发病机制提供相关理论基础和研究线索。
1 材料与方法
1.1 材料及其来源 胃癌MKN45细胞株购自中科院上海细胞库。人胃癌细胞系MKN45为贴壁生长的细胞,用含10%的牛血清、1%双抗(含青霉素、链霉素)的MEM培养基于50 mL培养瓶中进行传代培养。传代时用已高压灭菌过的PBS洗1~2次,用含0.25%的猪胰蛋白酶、0.02% EDTA、酚红,不含钙镁离子的消化液对其进行消化,按1∶4的比例传代,每隔2~3 d换液1次,5~7 d传代1次。37 ℃、5% CO2条件下生长。试剂与药品:MEM培养基购自美国HyClone公司;mRNA提取试剂盒、逆转录、荧光定量PCR试剂盒购自北京全式金生物公司,一抗(β-actin、Nanog、Oct4)和二抗辣根过氧化物酶标记(山羊抗兔)购自美国Abcam公司,BAPTA-AM购自美国Sigma公司,TGF-β购自美国Sigma公司,Flua-2钙荧光染料购自美国Invitrogen公司, ECL发光剂Western blotting Substract Reagent购自上海复泰生物公司。实验仪器:高速低温冷冻离心机购自德国Eppendorff公司,全波段酶标仪购自美国Thermo公司,CO2培养箱购自美国Thermo公司,细胞培养超净台购自苏州安泰空气技术有限公司,激光扫描共聚焦显微镜购自德国Leica公司,荧光定量PCR仪、ChemiDocTMTouch Imaging System 购自美国百乐公司。
1.2 细胞分组及处理 MKN45细胞随机分为对照组、TGF-β组和TGF-β+BAPTA-AM组,对照组不进行任何处理,其余两组分别用TGF-β(10 ng/mL)、 TGF-β(10 ng/mL)+BAPTA-AM(5 μmol/mL)作用24 h。
1.3 MKN45细胞中干性因子Nanog和Oct4 mRNA 表达的检测 采用qRT-PCR法。按照TRAN说明书提取MKN45细胞总mRNA。采用Easy ScriptR One-Step gDNA Removal and cDNA Synthesis SuperMix进行逆转录反应,根据Primer Bank 进行引物设计,引物由上海生工公司合成。Nanog基因上游引物:5′- TCTTCCTAACAAGACAACTTTGG-3′,下游引物:5′-TTGTTCCAGGTCGGCCATCACGC-3′;Oct4基因上游引物:5′-TATTCAGCCAAACGACCATCT-3′,下游引物:5′-TTGTTCCAGGTCGGCC ATCACGC-3′;GAPDH基因上游引物:5′-TATCGTGGAAGGCCTAT-3′,下游引物:5′-CACAGTTTCGGCATTCT-3′。使用TipGreen qPCR SuperMix 扩增试剂盒进行qRT-PCR反应。循环参数:94 ℃、30 s,94 ℃、5 s,60 ℃、30 s,40~45 个循环。每次反应过程结束均进行溶解曲线、溶解峰和扩增曲线的分析,以GAPDH为内参,采用2-ΔΔCT法计算目的基因相对表达量。
1.4 MKN45细胞中干性因子Nanog和Oct4蛋白表达的检测 采用Western blotting法。收集MKN45细胞置于1.5 mL EP管中,加入4 ℃已预冷的RIPA裂解液1 mL,离心(4 ℃,12 000 r/min,30 min),根据BCA试剂盒测蛋白浓度。95 ℃,蛋白变性5 min,以十二烷基磺酸钠-聚丙烯酰胺凝胶电泳80 V分离蛋白30 min,然后110 V继续分离蛋白约30 min。采用半干转仪器转膜。5%脱脂牛奶封闭1.5 h,然后孵育一抗(β-actin 1∶3 000,Nanog 1∶1 000,Oct4 1∶1 000 ),4 ℃摇床过夜。于次日,30 min复温后,TBST洗3次,每次10~15 min。二抗山羊抗兔(1∶5 000)常温摇床孵育1 h后,再次洗膜,同前述。ECL发光剂按说明书操作,以ChemiDocTMTouch Imaging System 进行曝光后β-actin为内参,用Image Lab软件分析对照组和实验组蛋白条带的灰度值,并计算目的蛋白的相对表达量。
1.5 MKN45细胞内钙浓度的测定 采用高速离子成像系统。将消化好的MKN45细胞以2×104/mL接种密度接种于24 mm×24 mm的载玻片上,置于37 ℃、5% CO2恒温培养箱中培养48 h待贴壁,至生长状态良好。按说明书配制Fura-2钙荧光染料和PSS液(pH 7.4)。取出培养好的细胞,以Fura-2钙荧光染料室温避光孵育1 h。上机观察:打开灌流系统,在0~200 s给予正常的PSS液(空白对照组)待钙荧光基线平稳后,关闭灌流系统,给予细胞TGF-β(20 ng/mL)(单独TGF-β组)预孵100 s后,开启灌流系统,在200~400 s持续动态刺激,观察单独TGF-β组刺激后胃癌MKN45细胞内钙浓度(即细胞作用强度)的变化。在400~600 s的时间范围内给予TGF-β和BAPTA-AM(5 μmol/mL)共同刺激胃癌MKN45细胞(联合组),刺激方法与单独TGF-β组方法相同。结果以GraphPad 5.0 软件分析对照组与实验刺激组的细胞作用强度的变化情况。
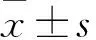
2 结果
2.1 各组干性因子Nanog、Oct4 mRNA及蛋白表达比较 见表1。
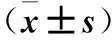
表1 各组干性因子Nanog、Oct4 mRNA及蛋白表达比较
注:与对照组比较,*P<0.05;与TGF-β组比较,#P<0.01。
2.2 各组细胞内钙浓度的变化 空白对照组胃癌MKN4细胞无明显反应,作用强度平均在1.561;单独TGF-β组细胞内钙浓度瞬时升高,作用强度平均在4.631;联合组细胞内钙无明显反应,作用强度平均在0.034。与空白对照组及联合组比较,单独TGF-β组细胞内钙浓度升高 (P均<0.05),其余两组间比较,P>0.05。
3 讨论
胃癌肿瘤干细胞的存在是胃癌复发和转移侵袭的关键。肿瘤干细胞是肿瘤组织中存在的一小部分具有干细胞性质的细胞群体,具有无限自我更新能力和多向分化的潜能。在肿瘤进展期,肿瘤干细胞一旦被激活,则可通过促进肿瘤血管生成和肿瘤细胞上皮间质转化促进肿瘤的发生发展。成熟肿瘤的逆分化是导致肿瘤细胞侵袭、迁移的又一个可能的来源。研究证实,一些因素可以参与调控肿瘤干细胞的生理功能,例如,肿瘤细胞微环境、炎症因子、细胞因子、细胞内外pH、肿瘤坏死因子、生长因子等,而细胞因子中的TGF-β尤为重要[5]。研究证实,TGF-β在肿瘤细胞的生长、分化及上皮间质转化等方面发挥越来越重要的作用。TGF-β与其特异性的受体结合后可以激活细胞内多种信号分子[6],进而促进相关细胞的生物学行为。近年,研究者们发现在肺癌和食管癌细胞,TGF-β可以通过上皮间质转化相关蛋白及干性相关因子如Oct4、Nanog、Sox2 和 CD133的表达增加,促进肿瘤干细胞的成球成瘤能力,进而促进肺癌和食管癌细胞的侵袭、转移[7,8]。Cheng等[9]研究显示,SOC型钙通道参与了TGF-β诱导的肿瘤干细胞的形成。
Nanog和Oct4是干细胞核心干性转录因子[10],具有自我更新和多能性,在调控肿瘤细胞的增殖、迁移和侵袭、肿瘤干性以及肿瘤免疫逃避等方面发挥了重要作用[11,12]。Ho等[13]研究表明,在乳腺癌、大肠癌等肿瘤细胞中Nanog的过表达可以诱导黏着斑激酶(FAK)的表达,而在Nanog的siRNA沉默后可减少FAK的表达,抑制肿瘤的生长和进展,而Nanog的过表达可以增强细胞的侵袭程度。Nanog、Oct4、Sox2可作用于肿瘤干细胞并影响Wnt信号通路,促进肿瘤的发生发展。本研究发现,在胃癌细胞中,TGF-β可以诱导胃癌干性因子Nanog、Oct4 mRNA和蛋白的表达增加。提示TGF-β可以调控胃癌的干性,并在此过程中发挥了重要作用。
Ca2+作为细胞内重要的第二信使和离子通道,参与调控了体内重要的生命活动。细胞内钙的增高主要有两种来源:细胞外钙的内流和细胞内钙的释放。对于膜上的钙通道有多种,如SOC型钙通道、VGCC钙通道、磷脂酶C通道等。这些钙通道具有选择性和开放性的特点,在某些特定的条件下发挥不同的作用。既往研究报道,TGF-β通过激活细胞内的钙依赖PKC途径诱导胰腺癌细胞中10号染色体缺失的磷酸酶及张力蛋白同源物的减少进而参与了促进胰腺癌细胞侵袭[14]。本研究结果显示,TGF-β刺激胃癌细胞后可以使胃癌细胞内钙浓度升高,提示TGF-β诱导胃癌细胞干性因子表达可以通过促进胃癌细胞内钙信号活化来实现。
综上所述,TGF-β促进细胞内钙的增加从而促进胃癌细胞干性因子Nanog、Oct4的表达上调,这为肿瘤的治疗和开发抗肿瘤药物提供了线索,具有广阔的前景。但除此之外,是否还有其他作用机制的参与,目前尚不清楚,需要进一步研究证实。
[1] Pirozzi G, Tirino V, Camerlingo R, et al. Epithelial to mesenchymal transition by TGF-β1induction increases stemness characteristics in primary non small cell lung cancer cell line[J]. PLoS One, 2011,6(6):e21548.
[2] Mahdi SH, Cheng H, Li J, et al. The effect of TGF-beta-induced epithelial-mesenchymal transition on the expression of intracellular calcium-handling proteins in T47D and MCF-7 human breast cancer cells[J]. Arch Biochem Biophys, 2015,583:18-26.
[3] 管臣,张洪伟,王为忠,等.P物质对体外培养的胃癌细胞内游离钙浓度的影响[J].中国普外基础与临床杂志,2008,15(1):8-11.
[4] Wee S, Niklasson M, Marinescu VD, et al. Selective calcium sensitivity in immature glioma cancer stem cells[J]. PLoS One, 2014,9(12):e115698.
[5] Kajdaniuk D, Marek B, Borgiel-Marek H. Transforming growth factor β1(TGFβ1) in physiology and pathology[J]. Endokrynol Pol, 2013,64(5):384-396.
[6] Colak S, Ten DP. Targeting TGF-β signaling in cancer[J]. Trends Cancer, 2017,3(1):56-71.
[7] Santaliz-Ruiz LE, Xie X, Old M, et al. Emerging role of nanog in tumorigenesis and cancer stem cells[J]. Int J Cancer, 2014,135(12):2741-2748.
[8] Yue D, Zhang Z, Li J, et al. Transforming growth factor-beta1 promotes the migration and invasion of sphere-forming stem-like cell subpopulations in esophageal cancer[J]. Exp Cell Res, 2015,336(1):141-149.
[9] Cheng H, Wang S, Feng R. STIM1 plays an important role in TGF-β-induced suppression of breast cancer cell proliferation[J]. Oncotarget, 2016,7(13):16866-16878.
[10] Saunders A, Dan L, Faiola F, et al. Context-dependent functions of NANOG phosphorylation in pluripotency and reprogramming[J]. Stem Cell Reports, 2017,8(5):1115-1123.
[11] King HW, Klose RJ. The pioneer factor OCT4 requires the chromatin remodeller BRG1 to support gene regulatory element function in mouse embryonic stem cells[J]. Elife, 2017,13(6):e22631.
[12] Karwackineisius V, Gke J, Osorno R, et al. Reduced Oct4 expression directs a robust pluripotent state with distinct signaling activity and increased enhancer occupancy by Oct4 and Nanog[J]. Cell Stem Cell, 2013,12(5):531.
[13] Ho B, Olson G, Figel S, et al. Nanog increases focal adhesion kinase (FAK) promoter activity and expression and directly binds to FAK protein to be phosphorylated[J]. J Biol Chem, 2012,287(22):18656-18673.
[14] Chow JYC, Dong H, Quach KT, et al. TGF-β mediates PTEN suppression and cell motility through calcium-dependent PKC-α activation in pancreatic cancer cells[J]. Am J Physiol Gastrointest Liver Physiol, 2008,294(4):G899-G905.
EffectsofTGF-βonexpressionofgastriccancerstemgenesOct4andNanog
LIXin1,TUOBiguang,WENGuorong,JINHai,ANJiaxing,WANGQianxing,XIERui
( 1DepartmentofCellBiology,ZunyiMedicalCollege,Zunyi563000,China)
ObjectiveTo investigate the influence of transforming growth factor-β (TGF-β) on the expression of gastric cancer stem genes Oct4 and Nanog in gastric cancer cells.MethodsThe cultured gastric cancer cells MKN45 were divided into the control group, TGF-β (10 ng/mL) group, and TGF-β+BAPTA-AM group. The control group was not treated and the other two groups were stimulated with the corresponding reagent for 24 h. The mRNA and protein expression levels of Nanog and Oct4 were detected by qRT-PCR and Western blotting. High-speed ion imaging system was used to examine the changes of intracellular Ca2+concentrations in gastric cancer MKN45 cells with normal PSS solution (control group), TGF-β (20 ng/ml) (TGF-β group) and intracellular calcium chelator BAPTA-AM (BAPTA-AM group).ResultsCompared with the control group, the mRNA and protein expression levels of Nanog and Oct4 in the TGF-β group were up-regulated (bothP<0.05); compared with the TGF-β group, the mRNA and protein expression levels of Nanog and Oct4 in the TGF-β+ BAPTA-AM group were down-regulated (bothP<0.05). Compared with the control group, the intracellular calcium increased in the TGF-β group (P<0.05); compared with the TGF-β group, the intracellular calcium decreased in the BAPTA-AM group (P<0.05).ConclusionTGF-β could enhance the expression of cancer stem genes Oct4 and Nanog in gastric cancer cells by increasing the intracellular calcium concentration.
gastric carcinoma; transforming growth factor-β; cytokines of tumor cells; Nanog; Oct4
10.3969/j.issn.1002-266X.2017.45.002
R735.2
A
1002-266X(2017)45-0005-04
国家自然科学基金资助项目(81660412);遵义医学院附属医院博士科研启动基金[院字(2015)08号]。
李欣(1990-),女,硕士研究生,主要从事消化系统恶性肿瘤的研究。E-mail:18786221478@163.com
王乾兴(1974-),男,硕士研究生导师,主要从事恶性肿瘤的研究。E-mail:317002641@qq.com;谢睿(1984-),女,硕士研究生导师,主要从事消化系恶性肿瘤的研究。E-mail: xr19841029@aliyun.com
2017-09-10)
