基于EnVision多标记读板仪的细胞内钙信号检测技术的研究
2015-12-16殷爱红武文琦赵春娟赵君朋首都医科大学医学实验与测试中心北京00069首都医科大学基础医学院生物化学与分子生物学系通讯作者mailjp7563com
杨 颖,殷爱红,武文琦,赵春娟,赵君朋(首都医科大学医学实验与测试中心,北京 00069;首都医科大学基础医学院生物化学与分子生物学系;通讯作者,E-mail:jp75@63.com)
钙离子Ca2+是最简单也是最复杂的细胞信使,快速变化的细胞内钙信号与肌肉收缩、神经递质传导、激素分泌等重要生理过程直接相关[1,2]。异常变化的钙信号在肿瘤的侵袭和转移中起着关键作用[3]。钙信号的检测广泛应用于钙信号偶联的细胞功能以及小分子药物筛选等研究领域。由于胞质Ca2+浓度很低,而且变化迅速,因此,准确检测Ca2+浓度比较困难。目前研究细胞内钙信号变化主要借助于具有高选择性、高灵敏度和高时间分辨率的Ca2+指示剂。当细胞内Ca2+浓度发生变化时,其荧光发射强度(如Fluo-3、Fluo-4、Indo-5F等)或荧光激发波长(如Fura-2)会发生相应改变。共聚焦显微镜等成像系统是目前检测钙信号的主要仪器[4,5]。该技术通过细胞成像,检测个体细胞的荧光强度变化,虽然灵敏度高,但个体细胞之间钙信号差异大,很难进行组间细胞的统计学分析,其次,后期数据处理繁琐。EnVision多标记读板仪是目前国内外荧光检测速度和灵敏度最高的酶标仪之一,并且该仪器配有双通道自动加样器,可以进行动力学检测,更为重要的是,其具有高通量检测性能,可以提高多样本检测的工作效率,从理论上看,这些优良的检测性能可以弥补成像技术的不足。然而,至今尚无关于应用EnVision多标记读板仪检测钙信号方面的报道。本次试验旨在利用该仪器建立一套快速、稳定和灵敏的细胞内钙信号检测技术。
1 材料和方法
1.1 材料
1.1.1 试剂 DMEM干粉培养基、胎牛血清和胰酶购自美国 HyClone公司,Fluo-4/AM购自美国 Invitrogen公司,卡巴胆碱、凝血酶和U73122购自美国Calbiochem公司。
1.1.2 细胞 胶质瘤细胞株LN229和神经元母细胞瘤细胞株SKN-MC购自美国ATCC细胞库。
1.1.3 仪器 3111型 CO2培养箱和1300 Series A2型生物安全柜,美国ThermoFisher科技有限公司;DMIL型倒置显微镜,德国Leica公司;EnVision多标记读板仪,美国PerkinElmer公司。
1.2 方法
1.2.1 细胞培养 LN229和 SKN-MC细胞用含10%胎牛血清和100 U/mL青、链霉素的DMEM培养基,在37℃、5%CO2培养箱内进行培养,每2 d更换1次培养基,传代一次。
1.2.2 细胞内钙信号检测 将LN229或SKN-MC细胞以2×104/孔的密度接种于96孔底透黑壁微孔板中,待细胞生长24 h后,吸出培养液,在含有2 μmol/L Fluo-4/AM的无血清DMEM培养基中继续孵育30 min,加入不含钙的HBSS缓冲液(内含pH 7.4 的 20 mmol/L HEPES、120 mmol/L NaCl、5.4 mmol/L KCl、1 mmol/L MgCl2、10 mmol/L glucose 和0.2 mmol/L EGTA),洗2次,置于 EnVision多标记读板仪内,通过自动加样器向孔内加入相应浓度的卡巴胆碱或凝血酶,使用(500±10)nm的激发光和(535±15)nm的发射光滤光片,每5 s由孔底部采集荧光信号一次,空白对照组为未染色的细胞。研究EnVision多标记读板仪检测细胞内钙信号的灵敏度时,分别用 0,2,10,50 μmol/L 卡巴胆碱刺激LN229细胞;研究凝血酶刺激细胞内钙信号时,分别加入0,2 U/ml凝血酶;研究U73122对钙信号的抑制作用,细胞分别在室温下用 0,1,5 μmol/L U73122(5 μmol/L为抑制磷脂酶C活性的常规使用浓度)预处理10 min后,加入2 U/mL凝血酶。每个检测组设3个复孔,结果取3个复孔数据的平均值,所得荧光强度数值FI与刺激前的数值FI0进行标化。每个实验均重复三次。
1.2.3 统计学分析 用GraphPad Prism 5统计学软件进行分析,数据用±s表示,组间比较采用单因素方差分析及t检验。
2 结果
2.1 递增浓度的卡巴胆碱诱导下LN229细胞内钙信号的变化
结果显示,作为阴性对照,未加卡巴胆碱(0 μmol/L)未检测到荧光强度的变化。卡巴胆碱浓度低至2 μmol/L亦无明显的钙信号强度的变化,细胞内钙信号水平在10 μmol/L或常规浓度50 μmol/L卡巴胆碱刺激后5 s均达到峰值,分别上升到基础水平的3倍或5倍左右,并随着刺激时间的延长,钙信号水平逐渐下降,到80 s时,降至基础水平(见图1)。
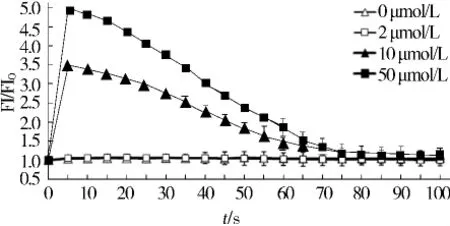
图1 LN229细胞受不同浓度卡巴胆碱刺激后细胞内钙信号强度的变化Figure 1 Calcium signaling induced by increasing concentrations of carbachol in LN229 cells
2.2 凝血酶诱导下LN229细胞内钙信号的变化
结果显示,与卡巴胆碱刺激相比,在LN229细胞内,凝血酶诱导的钙信号上升速度较缓慢,至15-20 s时达到峰值,于80 s后降至基础水平(见图2)。
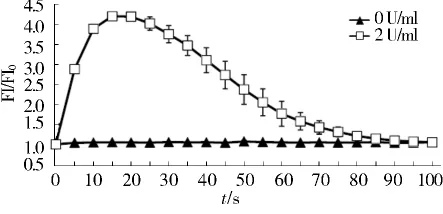
图2 LN229细胞受凝血酶刺激后细胞内钙信号强度的变化Figure 2 Thrombin-induced calcium signaling in LN229 cells
2.3 凝血酶诱导下SKN-MC细胞内钙信号的变化
结果显示,与LN229细胞内钙信号比较,SKNMC细胞内凝血酶诱导的钙信号上升速度更快,于刺激后10 s达到峰值,然后迅速减弱,于40 s后降至基础水平(见图3)。
2.4 U73122对凝血酶诱导的LN229细胞内钙信号的抑制作用
结果显示,随着磷脂酶C抑制剂U73122处理浓度升高,凝血酶诱导的LN229细胞内钙信号强度逐渐减弱。5 μmol/L U73122完全抑制了凝血酶诱导的细胞内钙信号(见图4)。

图3 SKN-MC细胞受凝血酶刺激后细胞内钙信号强度的变化Figure 3 Thrombin-induced calcium signaling in SKNMC cells
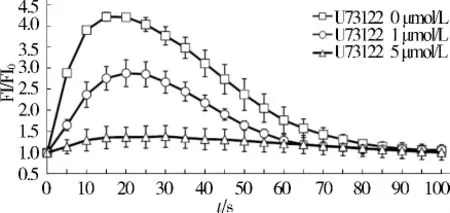
图4 U73122抑制作用下凝血酶诱导的SKN-MC细胞内钙信号强度的变化Figure 4 Inhibitory effect of U73122 on thrombin-induced calcium signaling in SKN-MC cells
3 讨论
在真核细胞中,80%-90%Ca2+储存于钙库,其中内质网是细胞最主要的钙库,在静息状态下,内质网腔中的Ca2+浓度比细胞质溶质中的浓度高万倍,激活细胞内钙信号主要是通过G蛋白偶联受体(GPCR)-磷脂酶C(PLC-β)信号传递途径。GPCR是目前全世界市场上40%-50%处方药的分子靶标,生物对许多外界刺激,如神经递质、激素、味觉、嗅觉甚至光线等发生的反应都是通过GPCR介导的细胞信号转导来实现的[6]。PLC-β介导的钙信号研究也成为GPCR研究领域中最为活跃的一个分支[7]。但是,目前细胞内钙信号的检测手段有限,主要依赖细胞成像技术。本实验分别使用GPCR激动剂卡巴胆碱或凝血酶激活PLC-β介导的钙信号通路,使用PLC-β特异性抑制剂U73122抑制凝血酶诱导的钙信号,利用EnVision多标记读板仪检测细胞内的钙信号变化。检测结果显示,卡巴胆碱诱导的LN229细胞内钙信号变化具有浓度依赖性,卡巴胆碱和凝血酶诱导的细胞内钙信号变化趋势不同,此外,凝血酶诱导的钙信号变化具有细胞特异性,U73122对凝血酶诱导的钙信号的抑制作用呈现剂量依赖性。由此可见,EnVision多标记读板仪可以作为钙信号检测的主要仪器使用。
用EnVision多标记读板仪检测钙信号与常用的细胞成像技术相比有许多优势。首先,从检测的灵敏度看,EnVision多标记读板仪使用滤光片系统检测微孔内细胞荧光强度总和的变化,不仅能检测出激动剂或抑制剂与细胞内钙信号变化的剂量相关性,而且能区别不同类细胞内钙信号的差异,因此,与检测个体细胞内钙信号的细胞成像技术相比,更适合进行小分子抑制剂的筛选及激动剂敏感度的检测实验。其次,从检测流程考虑,使用EnVision多标记读板仪,从上样到动力学检测的程序已自动化,从而减少了多次实验之间产生差异的可能性,保证了测试结果的均一性;同时,也加快了检测速度,不仅最大程度上保留了检测细胞的活力,而且可增加单次检测的样本数量。最后,从后期数据处理的角度分析,使用细胞成像技术检测,需要通过相应的软件选取15-20个细胞分析并且导出数据,再进行统计学分析;而使用EnVision多标记读板仪获得的数据可以直接在普通的图表软件上分析,较前者便捷,耗时短。
综上所述,EnVision多标记读板仪检测细胞内钙信号技术具有快速、重复性好、灵敏度高的优势,适用于PLC介导的钙信号通路领域的研究工作。因此,本技术有着很广阔的应用前景。
[1]Berridge MJ,Lipp P,Bootman MD.The versatility and universality of calcium signalling[J].Nat Rev Mol Cell Biol,2000,1:11-21.
[2]Clapham DE.Calcium signaling[J].Cell,2007,131:1047-1058.
[3]Prevarskaya N,Skryma R,Shuba Y.Calciumin tumour metastasis:new roles for known actors[J].Nat Rev Cancer,2011,11:609-618.
[4]Ishida S,Matsu-Ura T,Fukami K,et al.Phospholipase C-beta1 and beta4 contribute to Non-Genetic Cell-to-Cell Variability in Histamine-Induced Calcium Signals in HeLa Cells[J].PLoS One,2014,9:e86410.
[5]Kim JK,Kwon O,Kim J,et al.PDZ domain-containing 1(PDZK1)protein regulates phospholipase C-beta3(PLC-beta3)-specific activation of somatostatin by forming a ternary complex with PLC-beta3 and somatostatin receptors[J].J Biol Chem,2012,287:21012-21024.
[6]Bridges TM,Lindsley CW.G-protein-coupled receptors:from classical modes of modulation to allosteric mechanisms[J].ACS Chem Biol,2008,3:530-541.
[7]Ritter SL,Hall RA.Fine-tuning of GPCR activity by receptor-interacting proteins[J].Nat Rev Mol Cell Biol,2009,10:819-830.
