杂原子多环芳烃的合成
2017-12-18殷江辉张灯青李贤英金武松
殷江辉, 张灯青, 李贤英, 金武松
(东华大学 a. 化学化工与生物工程学院; b. 环境科学与工程学院, 上海 201620)
杂原子多环芳烃的合成
殷江辉a, 张灯青a, 李贤英b, 金武松a
(东华大学 a. 化学化工与生物工程学院; b. 环境科学与工程学院, 上海 201620)
以2- 己基-1-癸醇(2)为起始原料,依次经Appel反应、Williamson反应、溴取代反应、Suzuki偶联反应、三聚反应、Scholl氧化脱氢关环反应得到含硫原子的目标化合物1a.采用类似合成方法,合成目标化合物1b.这些化合物的结构均通过核磁共振(1H NMR)和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)表征,并对其光谱特征、热性能及电学性能进行了初步的研究.从紫外荧光光谱中可知这类化合物在甲苯中呈现砖红色荧光,可作为一种新型的砖红色主体发光材料,用于荧光传感器等光电材料.热失重分析结果表明这类化合物热稳定性良好,有望应用于对热稳定性要求较高的有机纳米器件.另外,由循环伏安曲线可知此类杂原子多环芳烃是强电子供体,在光伏器件中有着潜在的应用前景.
杂原子; 多环芳烃; Scholl氧化关环; 噻吩
π电子材料由于其独特的电子、光电子和磁等性能,在分子电子学方面有着潜在的应用价值.然而,相比π共轭的聚合物,多环芳烃(PAH)已被广泛应用于超分子材料中[1]. 另外,与全碳的多环芳烃相比,在骨架中含有硫[2]、氧[3]、氮[4]等富电子或电负性强的杂原子的多环芳烃衍生物,可以通过改变分子的电子亲和势、偶极等,在诸如晶体生长、液晶相及光电性能等方面呈现出独特的理化性质,成为一类非常有潜力的新型有机功能分子.因此,对杂原子多环芳烃的合成及性能的研究已经成为一个热门领域.
噻吩是一种富电子的五元芳杂环,其电子的流动性大,具有独特的光学性质和电子传输能力[5].随着有机光电材料研究的迅猛发展,含噻吩类衍生物因其掺杂前后具有良好稳定性、容易进行结构修饰等特点,对其合成与开发的研究越来越受到学术界的广泛关注[6].目前,诸如苯[7]、萘[8]、蒽[9-10]、菲[11]、并四苯[12]、蔻[13]等骨架中含硫原子的多环芳烃衍生物已经被广泛研究[14].例如,文献[15]以硫杂苝为起始原料合成的二噻吩苝能够显示出典型的P型场效应晶体管特征;文献[16]采用共价自组装的合成策略,在三氯化铁促进下能够实现π- 扩展硫杂三噻吩并三苯并苯并蒄(TBTTCs)的合成; 文献[17]利用环化脱氢反应合成的硫杂多环芳烃(HTC)能够显示出优异的自组装性能和电子特性等.因此,笔者课题组着眼于开发新型功能性含杂原子的多环芳烃衍生物,设计合成了一类新型噻吩并多环芳烃衍生物1,并对其基本物性进行初步探讨.
本文以2- 己基 -1- 癸醇(2)起始原料,经Appel反应制取相应的溴代烃(3);化合物3在强碱NaH催化作用下,与2- 噻吩乙醇(4)通过Williamson反应制取相应的醚(5a);化合物5a通过NBS溴取代反应制得化合物12a;化合物12a在Pd(PPh3)4催化下与化合物11发生Suzuki偶联反应制得三聚前体(13a),随即进行三聚反应,即八羰基二钴为催化剂、1, 4- 二氧六环为溶剂加热回流,顺利制得氧化前驱体(14a);化合物14a在FeCl3作用下发生Scholl氧化脱氢关环反应得到目标化合物1a.采用类似合成方法(见图1),合成目标化合物1b. 其结构通过基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)确认,并且对合成的目标化合物1a及1b做了紫外吸收等基本物性测试.
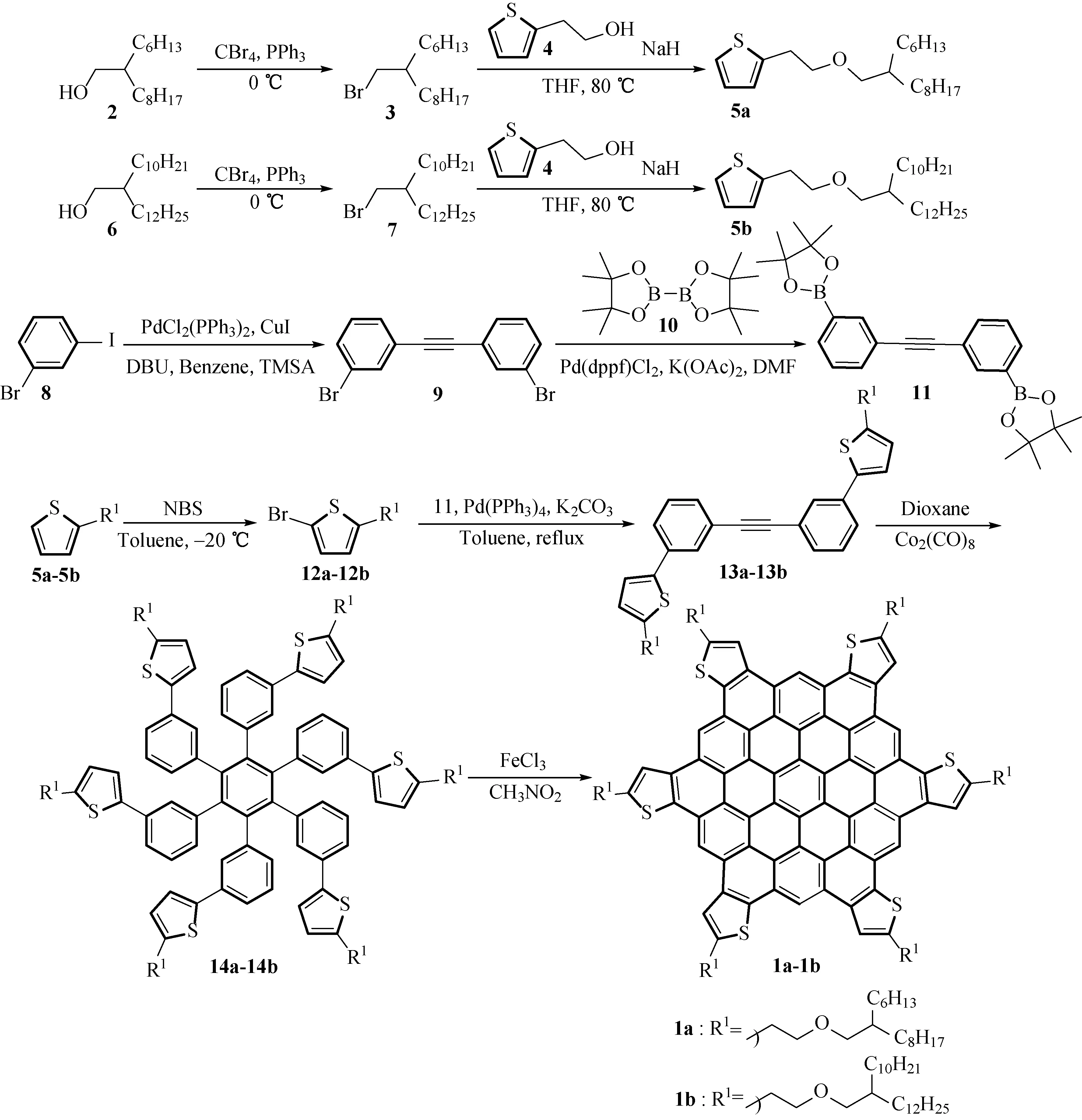
图1 新型噻吩并多环芳烃衍生物1的合成路线Fig.1 Synthetic route of a novel thiophene-fused polycyclic aromatic hydrocarbon derivative 1
1 试验部分
1.1 仪器与试剂
Brucker Model Avance DMX 400(400 MHz)型核磁共振波谱仪;ABSciex 4800型MALDI-TOF MS; Persee model TU-1901型紫外可见分光光度计,扫描波长200~900 nm,比色皿(1 cm×1 cm),25 ℃下测定; HORIBA model Fluoromax-4 型荧光光谱仪,比色皿(1 cm×1 cm),25 ℃下测定;TG-2091F1型热重分析仪(德国耐驰仪器有限公司); CHI600E型系列电化学工作站(上海辰华仪器有限公司).
采用分析纯试剂,药品购自梯希爱、西格玛奥德里奇、韶远化学科技有限公司.化合物3与7、化合物9和化合物11分别依照文献[18]、[19]和[20]方法合成.
1.2 化合物5a的合成
向50 mL两口瓶中依次加入化合物3(5.00 g, 16.43 mmol),化合物4(3.16 g, 24.66 mmol), NaH(1.97 g, 60%, 49.32 mmol),氩气保护下,抽换气3次,加入25 mL THF,随后在80 ℃下回流反应7 d,停止反应,冷却至室温,二氯甲烷(DCM)萃取,无水MgSO4干燥,过滤,旋蒸,柱层析分离(洗脱剂: 石油醚(PE)/DCM=5/1),得到黄色液体2.32 g, 产率40%.
1H NMR (400 MHz, CDCl3),δ: 7.17 (dd,J=5.1, 1.1 Hz, 1H), 6.97 (dd,J=5.1, 3.4 Hz, 1H), 6.90~6.88(m, 1H), 3.68 (t,J=6.8 Hz, 2H), 3.38 (d,J=5.9 Hz, 2H), 3.14 (t,J= 6.7 Hz, 2H), 1.62 (s, 1H), 1.32 (s, 24H), 0.94 (d,J=7.0 Hz, 6 H).13C NMR (101 MHz, CDCl3)δ: 141.64, 126.55, 124.99, 123.49, 74.33, 71.66, 38.33, 31.98, 31.94, 31.48, 30.57, 30.13, 29.80, 29.67, 29.41, 26.90, 26.87, 22.74, 14.16.
1.3 化合物5b的合成
向50 mL两口瓶中依次加入化合物7(6.84 g, 16.43 mmol),化合物4(3.16 g, 24.66 mmol), NaH(1.97 g, 60%, 49.32 mmol),在氩气保护下,抽换气3次,加入25 mL THF,随后在80 ℃下回流反应7 d,停止反应,冷却至室温,DCM萃取,无水MgSO4干燥,过滤,旋蒸,柱层析分离(洗脱剂: PE/DCM=4/1),得到黄色液体3.20 g,产率42%.
1H NMR (400 MHz, CDCl3),δ: 7.16 (dd,J=5.1, 1.2Hz, 1H), 6.96 (dd,J=5.1, 3.4 Hz, 1H), 6.90~6.87 (m, 1H), 3.67 (t,J=6.8 Hz, 2H), 3.37 (d,J=5.9 Hz, 2H), 3.13 (t,J=6.7 Hz, 2H), 1.61 (s, 1H), 1.32 (s, 40 H), 0.94 (t,J=6.8 Hz, 6 H).13C NMR (101 MHz, CDCl3),δ: 141.64, 126.55, 124.98, 123.48, 74.33, 71.66, 38.32, 31.98, 31.47, 30.56, 30.13, 29.76, 29.72, 29.42, 26.90, 22.74, 14.15.
1.4 化合物12a的合成
向100 mL两口瓶中依次加入化合物5a(1.20 g, 3.40 mmol),甲苯50 mL,在-20 ℃下避光反应,随即加入N-溴代丁二酰亚胺(NBS)(666 mg, 3.74 mmol),搅拌反应过夜,柱层析分离(洗脱剂: PE/DCM=6/1),得黄色液体1.20 g,产率82%.
1H NMR (400 MHz, CDCl3),δ: 6.87 (d,J=3.7 Hz, 1), 6.62 (dd,J=2.9, 0.8 Hz, 1H), 3.61 (t,J=6.3 Hz, 2H), 3.35 (d,J=5.8 Hz, 2H), 3.03 (dt,J=6.4, 3.1Hz, 2H), 1.60 (s, 1H), 1.31 (s, 24H), 0.92 (dt,J=6.9, 3.3 Hz, 6 H).13C NMR (101 MHz, CDCl3)δ: 143.73, 129.11, 125.35, 109.65, 74.32, 71.04, 38.31, 31.97, 31.94, 31.48, 31.48, 31.13, 30.13, 29.80, 29.68, 29.41, 26.89, 26.86, 22.75, 22.74, 14.16.
1.5 化合物12b的合成
向100 mL两口瓶中依次加入化合物5b(1.20 g, 2.58 mmol),甲苯50 mL,在-20 ℃下避光反应,随即加入N-溴代丁二酰亚胺(NBS)(506 mg, 2.84 mmol),搅拌反应过夜,柱层析分离(洗脱剂:PE/DCM=4/1),得黄色液体1.19 g,产率85%.
1H NMR (400 MHz, CDCl3),δ: 6.87 (d,J=3.6 Hz, 1H), 6.62 (d,J=3.6 Hz, 1H), 3.61 (t,J=6.3 Hz, 2H), 3.34 (d,J=5.8 Hz, 2H), 3.02 (t,J=6.3 Hz, 2H), 1.59 (s, 1H), 1.30 (s, 40 H), 0.96~0.87 (m, 6 H).13C NMR (101 MHz, CDCl3),δ: 143.71, 129.11, 125.35, 109.65, 74.33, 71.03, 38.30, 31.97, 31.46, 31.11, 30.12, 29.75, 29.72, 29.70, 29.41, 26.88, 22.73, 14.14.
1.6 化合物13a的合成
向100 mL两口瓶中依次加入化合物12a(1.00 g, 2.32 mmol),化合物11(334 mg, 0.78 mmol), Pd(PPh3)4(90 mg, 0.08 mmol, 10%),氩气保护下抽换气3次,依次加入60 mL甲苯,4 mL K2CO3水溶液(2 mol/L),随后在110 ℃下回流反应2 d,停止反应,冷却至室温,DCM萃取,无水MgSO4干燥,过滤,旋蒸,柱层析分离(洗脱剂: PE/DCM=3/1),得黄色液体466 mg,产率68%.
1H NMR (400 MHz, CDCl3),δ: 7.78 (d,J= 1.5 Hz, 1H), 7.57~7.53 (m, 1H), 7.44 (dd,J=6.4, 1.3 Hz, 1H), 7.36 (t,J=7.7 Hz, 1H), 7.20 (d,J=3.6 Hz, 1H), 6.85 (d,J=3.6 Hz, 1H), 3.69 (t,J=6.6 Hz, 2H), 3.37 (d,J=5.9 Hz, 2H), 3.12 (t,J=6.5 Hz, 2H), 1.58 (s, 1H), 1.28 (s, 24H), 0.90 (dd,J=6.8, 5.5 Hz, 6H).13C NMR (101 MHz, CDCl3),δ: 142.08, 141.40, 134.95, 130.10, 128.84, 128.52, 126.19, 125.48, 123.70, 123.09, 89.37, 74.38, 71.42, 38.30, 31.94, 31.92, 31.48, 30.92, 30.14, 29.80, 29.71, 29.66, 29.38, 26.89, 26.86, 22.71, 14.14. MALDI-TOF MS表征:m/z=901.18([M+Na]+,按C58H86O2S2Na的理论计算值为901.60).
1.7 化合物13b的合成
向100 mL两口瓶中依次加入化合物12b(1.08 g, 2.0 mmol),化合物11(286 mg, 0.66 mmol),Pd(PPh3)4(76 mg, 0.07 mmol, 10%),氩气保护下抽换气3次,依次加入60 mL甲苯,3 mL K2CO3水溶液(2 mol/L),随后在110 ℃下回流反应2 d,停止反应,冷却至室温,DCM萃取,无水MgSO4干燥,过滤,旋蒸,柱层析分离(洗脱剂: PE/DCM=4/1),得黄色液体478 mg,产率65%.
1H NMR (400 MHz, CDCl3),δ: 7.78 (d,J= 1.5 Hz, 1H), 7.57~7.53 (m, 1H), 7.44 (dd,J=6.4, 1.3 Hz, 1H), 7.36 (t,J=7.7 Hz, 1H), 7.20 (d,J=3.6 Hz, 1H), 6.85 (d,J=3.6 Hz, 1H), 3.69 (t,J=6.6 Hz, 2H), 3.37 (d,J=5.9 Hz, 2H), 3.12 (t,J=6.5 Hz, 2H), 1.58 (s, 1H), 1.28 (s, 40 H), 0.90 (dd,J=6.8, 5.5 Hz, 6 H).13C NMR (101 MHz, CDCl3),δ: 142.07, 141.40, 134.94, 130.11, 128.84, 128.51, 126.19, 125.48, 123.71, 123.08, 89.38, 74.38, 71.42, 38.30, 31.95, 31.47, 30.92, 30.14, 29.73, 29.69, 29.39, 26.89, 22.72, 14.14. MALDI-TOF MS表征:m/z=1 102.46([M]+,按C74H118O2S2的理论计算值为1 102.86).
1.8 化合物14a的合成
在氩气保护下,往50 mL两口瓶中依次加入化合物13a(400 mg, 0.46 mmol)、60 mL 1,4- 二氧六环,Co2(CO)8(16 mg, 0.05 mmol, 10%),随后在125 ℃下回流反应过夜,停止反应,冷却至室温,DCM萃取,无水MgSO4干燥,过滤,旋蒸,柱层析分离(洗脱剂:PE/DCM=3/ 1),得到黄色固体424 mg,产率80%.
1H NMR (400 MHz, CDCl3),δ: 7.20 (dd,J= 18.5, 11.9 Hz, 1H), 7.05 (s, 1H), 6.92 (d,J=16.4 Hz, 1H), 6.81 (d,J=26.1Hz, 1H), 6.71 (s, 1H), 6.65 (d,J=15.6 Hz, 1H), 3.59 (d,J=7.3 Hz, 2H), 3.33 (d,J=5.8 Hz, 2H), 3.01 (d,J=6.6 Hz, 2H), 1.62 (s, 1H), 1.28 (s, 24H), 0.89 (d,J=6.5 Hz, 6 H). MALDI-TOF MS表征:m/z=2 659.47([M+Na]+,按C174H258O6S6Na 的理论计算值为2 660.83);m/z=2 675.44([M+K]+,按C174H258O6S6K的理论计算值为2 676.80).
1.9 化合物14b的合成
在氩气保护下,往50 mL两口瓶中依次加入化合物13b(400 mg, 0.36 mmol)、60 mL 1,4- 二氧六环,Co2(CO)8(14 mg, 0.04 mmol, 10%),随后在125 ℃下回流反应过夜,停止反应,冷却至室温,DCM萃取,无水MgSO4干燥,过滤,旋蒸,柱层析分离(洗脱剂: PE/DCM=3/1),得到黄色固体424 mg,产率80%.
1H NMR (400 MHz, CDCl3),δ: 7.26~7.10 (m, 1H), 7.05 (s, 1H), 6.97~6.88 (m, 1H), 6.82 (dd,J=16.7, 7.8 Hz, 1H), 6.74 (d,J=23.7 Hz, 1H), 6.64 (d,J=15.3 Hz, 1H), 3.66~ 3.51 (m, 2H), 3.33 (d,J=5.5 Hz, 2H), 3.08~2.90 (m, 2H), 1.59 (s, 1H), 1.27 (s, 40 H), 0.90 (t,J=6.3 Hz, 6 H). MALDI-TOF MS表征:m/z=3 334.77([M+Na]+,按C222H354O6S6Na 的理论计算值为3 335.58);m/z=3 350.36([M+K]+,按C222H354O6S6K的理论计算值为3 351.56).
1.10 化合物1a的合成
氩气保护下,往250 mL两口瓶中依次加入化合物14a(160 mg, 0.06 mmol),100 mL无水DCM,氩气鼓泡15 min,将FeCl3(474 mg, 2.92 mmol)溶解在5 mL CH3NO3中,缓慢注射到250 mL两口瓶中. 120 min后向反应液中加入CH3OH淬灭反应,析出沉淀,CHCl3溶解,过柱,先用乙酸乙酯(EA)作洗脱剂除去杂质,再用热THF作洗脱剂,旋蒸溶剂后得到黑色固体. 再用少量THF溶解,加入500 mL CH3OH,析出沉淀,过滤得到黑色固体64 mg, 产率40%.
MALDI-TOF MS表征:m/z=2 615.41([M+H]+,按C174H235O6S6的理论计算值为2 615.15).
1.11 化合物1b的合成
在氩气保护下,向250 mL两口瓶中依次加入化合物14b(160 mg, 0.05 mmol),100 mL无水DCM,氩气鼓泡15 min,将FeCl3(376 mg, 2.32 mmol)溶解在4 mL CH3NO3中,缓慢注射到250 mL两口瓶中.120 min后向反应液中加入CH3OH淬灭反应,析出沉淀,CHCl3溶解,过柱,先用EA作洗脱剂除去杂质,再用热THF作洗脱剂,旋蒸溶剂后得到黑色固体,再用少量THF溶解,加入500 mL CH3OH,析出沉淀,过滤得到黑色固体66 mg,产率42%.
MALDI-TOF MS表征:m/z=3 288.45([M+H]+,按C222H331O6S6的理论计算值为3 288.44).
2 结果与讨论
2.1 MALDI-TOF MS表征
由于分子1a和1b分子间存在很大的π共轭体系,π-π堆积作用非常强,因而1a和1b都是以某种动态的聚集体形态存在,无法使用核磁来进行验证.因此,本文采用MALDI-TOF MS来确定目标化合物1a和1b的结构.化合物1a和1b的MALDI-TOF MS谱图如图2所示.检测值均与理论计算值相符,表明所合成的目标化合物1a和1b结构正确.

(a) 1a (b) 1b
图2化合物1a和1b的MALDI-TOFMS谱图
图Fig.2GraphsofMALDI-TOFMSof1aand1b
2.2 紫外吸收光谱
目标化合物1a和1b的紫外可见光谱如图3所示.该光谱均在浓度为1×10-5mol/L下进行测定,结果表明,目标化合物1a在甲苯溶液中的最大吸收波长为438 nm,为π-π*典型特征吸收,并在波长为284 nm以及550 nm处有吸收;对于目标化合物1b,其在甲苯溶液中的最大吸收波长和目标化合物1a一致,也为438 nm,均为π-π*典型特征吸收,并在波长为286 nm以及548 nm处也有吸收.由目标化合物1a及1b的紫外可见光谱图可知,两种目标化合物1a和1b的光谱形状相似且波长位移较小,可能是由1a和1b具有的相同母体环所致.

图3 浓度为1×10-5 mol/L的1a和1b在甲苯溶液中的紫外可见光谱Fig.3 UV-Vis of 1a and 1b (1×10-5 mol/L) in Toluene
2.3 荧光光谱
目标化合物1a和1b的荧光光谱如图4所示.目标化合物1a和1b在甲苯溶液(1×10-5mol/L)中的荧光光谱是在其最大吸收波长438 nm条件下激发测得.结果表明,目标化合物1a和1b的最大发射波长分别为666和676 nm,属于近红外区域,且在该浓度下得到的峰均为宽峰,这种现象进一步表明目标化合物1a和1b在甲苯溶液中极容易通过π-π堆积相互作用形成聚集体形态.通过荧光光谱图可知,目标化合物1a及1b均具有一定强度的荧光性能,将来在荧光材料等领域有着潜在应用.

图4 浓度为1×10-5 mol/L的1a和1b在甲苯溶液中的荧光光谱Fig.4 Fluorescence spectra of 1a and 1b (1×10-5 mol/L) in Toluene
2.4 热性能研究
为了探究目标化合物1a和1b的热学性质,对其分别进行了热重(TG)测试,结果如图5所示.目标化合物1a和1b的TG测试均从30 ℃开始测量,在N2下升温至900 ℃(升温速率:10 ℃/min).结果表明:目标化合物1a的热分解温度约为350 ℃,到900 ℃时约有35%的残留;目标化合物1b的热分解温度约为370 ℃,到900 ℃时约有50%的残留.通过热失重分析可知,目标化合物1a和1b的热稳定性良好,有望将其应用于对热稳定性要求比较高的有机纳米器件.

图5 化合物1a、 1b的TG曲线Fig.5 TG curves of 1a and 1b

图6 化合物1a和1b的循环伏安曲线Fig.6 Cyclic voltammetric profile of 1a and 1b
2.5 电学性能研究
有机电致发光材料能带的准确测定对于有机电致发光器件的研究至关重要,通过循环伏安法对有机光电材料的全部能带结构参数进行测定.在测定氧化还原电位时采取的试验条件为:玻碳工作电极;铂丝辅助电极;银参比电极(Ag/AgNO3- 乙腈溶液),避光密封;二氯甲烷溶剂;四丁基四氟硼酸铵电解质.化合物1a和1b的循环伏安曲线如图6所示.最终测定化合物1a和1b的氧化电位分别是0.422和0.418 V.通过进一步计算,可知化合物1a和1b的HOMO(highest occupied molecular orbital)值分别为-4.961和-4.957 eV,由此可判定化合物1a和1b属于强电子供体,在光伏器件中存在着潜在的应用前景.
3 结 语
本文以2- 己基 -1- 癸醇作为起始原料,经Appel反应制取相应的溴代烃,随后在强碱NaH催化作用下,与2- 噻吩乙醇通过Williamson反应制取相应的醚,接着通过NBS溴取代反应成功制得溴代化合物,该溴代化合物与硼酸酯衍生物在Pd(PPh3)4催化下通过经典的Suzuki偶联反应得到三聚前体,随即进行三聚反应得到氧化前驱体,最后再利用FeCl3作为氧化剂发生Scholl氧化脱氢关环反应,得到目标化合物1a.通过合成目标化合物1a的类似方法,也成功得到了化合物1b.这些化合物的结构均通过MALDI-TOF MS确认.从目标化合物1a和1b的紫外荧光光谱图中可知,这两种化合物在甲苯中呈现砖红色荧光,可作为一种新型的砖红色主体发光材料,将来在荧光材料等领域有着潜在应用.热失重分析结果表明,目标化合物1a和1b热稳定性良好,在对热稳定性要求较高的有机纳米器件上有着潜在应用.另外,通过循环伏安曲线可知,此类可溶性圆盘型多环芳烃是强电子供体,将来可在光伏器件中有着潜在的应用.
[1] KATZ H E, BAO Z, GILAT S L. Synthetic chemistry for ultrapure, processable, and high-mobility organic transistor semiconductors[J]. Accounts of Chemical Research, 2001,34(5):359-369.
[2] CHERNICHENK K Y, SUMERIN VV, SHPANCHENKO R V, et al. “Sulflower”: A new form of carbon sulfide[J]. Angewandte Chemie, International Edition, 2006,45(44):7367-7370.
[3] WU D, PISULA W, HABERECHT M C, et al. Oxygen- and sulfur-containing positively charged polycyclic aromatic hydrocarbons[J]. Organic Letters, 2009,11(24):5686-5689.
[4] MATENA M, STOEHR M, RIEHM T, et al. Aggregation and contingent metal/surface reactivity of 1,3,8,10-tetraazaperopyrene (TAPP) on Cu(111)[J]. Chemistry-A European Journal, 2010,16(7):2079-2091.
[5] KLEIN M F G, PASKER F M, KOWARIK S, et al.Carbazole-phenylbenzotriazole copolymers as absorber material in organic solar cells[J]. Macromolecules, 2013,46(10):3870-3878.
[6] GAO P, FENG X, YANG X, et al. Conjugated ladder-typeheteroacenes bearing pyrrole and thiophene ring units: Facile synthesis and characterization[J]. Journal of Organic Chemistry, 2008,73(23):9207-9213.
[7] NICOLAS Y, BLANCHARD P, LEVILLAIN E, et al.Planarized star-shaped oligothiophenes with enhanced π-electron delocalization[J]. Organic Letters, 2004,6(2):273-276.
[8] OSAKA I, ABE T, SHINAMURA S, et al. High-mobility semiconducting naphthodithiophene copolymers[J]. Journal of the American Chemical Society, 2010,132(14):5000-5001.
[9] MAMADA M, MINAMIKI T, KATAGIRI H, et al. Synthesis, physical properties, and field-effect mobility ofisomerically pure syn-/anti-anthradithiophene derivatives[J]. Organic Letters, 2012,14(16):4062-4065.
[10] LEHNHERR D, HALLANI R, MCDONALD R, et al. Synthesis and properties ofisomerically pure anthrabisbenzothiophenes[J]. Organic Letters,2012,14(1):62-65.
[11] ENDOU M, IE Y, ASO Y. Synthesis, structure, and properties of 2,5,8,11,14,17-hexamethyltri-phenyleno [2,1-b:3,4-b′:6,5-b″:7,8-b‴:10,9-b'''':11,12- b'''''] hexathiophene[J]. Heterocycles, 2008,76(2):1043-1048.
[12] TANG M L, OKAMOTO T, BAO Z. High-performance organic semiconductors: asymmetric linearacenes containing sulphur[J]. Journal of the American Chemical Society, 2006,128(50):16002-16003.
[13] CHIU C Y, KIM B, GORODETSKY A A, et al. Shape-shifting in contorted dibenzotetrathieno-coronenes[J]. Chemical Science, 2011,2(8):1480-1486.
[14] CHEN L, PUNIREDD S R, TAN Y Z, et al.Hexathienocoronenes: Synthesis and self-organization[J]. Journal of the American Chemical Society, 2012,134(43):17869-17872.
[15] JIANG W, ZHOU Y, GENG H, et al. Solution-processed, high-performance nanoribbon transistors based on dithioperylene[J]. Journal of the American Chemical Society, 2011,133(1):1-3.
[16] ZHANG Q, PENG H, ZHANG G, et al. Facile bottom-up synthesis ofcoronene-based 3-fold symmetrical and highly substituted nanographenes from simple aromatics[J]. Journal of the American Chemical Society, 2014,136(13):5057-5064.
[17] CHEN L, MALI K S, PUNIREDD S R, et al. Assembly and fiber formation of agemini-type hexathienocoronene amphiphile for electrical conduction[J]. Journal of the American Chemical Society, 2013,135(36):13531-13537.
[18] LIU S, KAN Z, THOMAS S, et al.Thieno[3,4-c]pyrrole-4,6-dione-3,4-difluorothiophene polymer acceptors for efficient all-polymer bulk heterojunction solar cells[J]. Angewandte Chemie, International Edition, 2016,55(42):12996-13000.
[19] MIO M J, KOPEL L C, BRAUN J B, et al. One-pot synthesis of symmetrical and unsymmetrical bisarylethynes by a modification of the sonogashira coupling reaction[J]. Organic Letters, 2002,4(19):3199-3202.
[20] TAKASE M, NAKAJIMA A, TAKEUCHI T. Synthesis of an extended hexagonal molecule as a highly symmetrical ligand[J]. Tetrahedron Letters,2005,46(10):1739-1742.
SynthesisofHeteroatomPolycyclicAromaticHydrocarbons
YINJianghuia,ZHANGDengqinga,LIXianyingb,JINWusonga
(a. College of Chemistry, Chemical Engineering and Biotechnology; b. College of Environmental Science and Engineering,Donghua University, Shanghai 201620, China)
2-hexy-1-decanol (2) was used as starting material, followed by Appel reaction, Williamson reaction, Bromine substitution reaction, Suzuki coupling reaction, Trimerization reaction, and Scholl cyclodehydrogenation reaction to obtain the S-doped target compound1a. The similar synthesis method was used to obtain the target compound1b. The structures of these compounds were characterized by nuclear magnetic resonance (1H NMR) and matrix-assisted laser desorption/lonization time of flight mass spectrometry(MALDI-TOF MS), and their spectral characteristics, thermal and electrical properties were investigated. The ultraviolet and fluorescence emission spectra shows that these compounds exhibit brick red fluorescence in toluene, and can be used as a new type of brick red luminescent material for fluorescent materials such as fluorescence sensors. Thermogravimetric analysis results suggest that they have high thermal stability, which can be applied to organic nano devices with high thermal stability requirements. In addition, cyclic voltammetry indicates that the heteroatom polycyclic aromatic hydrocarbons (PAHs) are strong donors and have potential applications in photovoltaic devices in the future.
heteroatom; polycyclic aromatic hydrocarbon (PAH); Scholl cyclodehydrogenation; thiophene
1671-0444(2017)05-0661-07
2017-04-24
国家自然科学基金资助项目(21172035)
殷江辉(1988—),男,江苏泰州人,博士研究生,研究方向为功能性超分子材料. E-mail:yinjianghui110@126.com
金武松(联系人),男,教授,E-mail:wsjin@dhu.edu.cn
O 625.7
A
(责任编辑:杨静)
