腹腔镜、开腹手术治疗的右半结肠癌患者术后炎症状态及T细胞亚群分布比较
2017-12-12吕海栋刘国庆
吕海栋,刘国庆
(青海省人民医院,西宁810007)
腹腔镜、开腹手术治疗的右半结肠癌患者术后炎症状态及T细胞亚群分布比较
吕海栋,刘国庆
(青海省人民医院,西宁810007)
目的比较分析腹腔镜、开腹手术治疗的右半结肠癌患者术后炎症状态和T细胞亚群分布。方法选择48例采用腹腔镜结肠癌根治术治疗的右半结肠癌患者为腹腔镜组,47例采用开腹结肠癌根治术治疗的右半结肠癌患者为开腹手术组。术前、术后1天检测两组外周血白细胞数量(WBC)、血清C反应蛋白(CRP)、IL-6、IL-8、TNF-α水平及T细胞亚群分布。结果两组术前各指标比较差异均无统计学意义(P均>0.05)。术后1天两组WBC数量和血清CRP、IL-6、IL-8、TNF-α水平均较术前升高(P均<0.05),但腹腔镜组WBC数量和血清CRP、IL-6、IL-8、TNF-α均水平低于开腹手术组(P均<0.05)。与术前相比,术后1天两组外周血CD3+、CD4+T细胞比例及CD4+/CD8+降低(P均<0.05),CD8+T细胞比例升高(P均<0.05);术后1天腹腔镜组CD3+、CD4+T细胞比例及CD4+/CD8+高于开腹手术组(P均<0.05),CD8+T细胞比例低于开腹手术组(P<0.05)。结论与开腹结直肠癌根治术相比,采用腹腔镜结肠癌根治术治疗的右半结肠癌患者术后炎症反应程度较轻,T细胞亚群分布变化较小。
结肠癌;结肠癌根治术;腹腔镜;开腹手术;炎症;细胞免疫
随着科学技术的发展,外科手术已进入微创时代[1]。手术一定会对患者机体造成损伤,并导致炎症和免疫抑制,使机体的免疫系统无法发挥正常功能[2]。有研究表明,肿瘤患者术后T细胞功能对于消灭机体残留肿瘤细胞,促进患者康复有重要价值[3]。T细胞亚群分布是T细胞功能的直接体现。目前腹腔镜在结直肠癌切除手术中的应用日渐广泛,其优越性也得到广泛证实,并成为治疗结直肠癌的重要方法[4]。但是采用腹腔镜手术治疗的右半结肠癌患者术后炎症状态和T细胞亚群分布是否优于开腹手术目前未见文献报道[5]。2014年2月~2017年5月,本研究比较了采用腹腔镜、开腹结肠癌根治术治疗的右半结肠癌患者的术后炎症状态和T细胞亚群分布,探讨腹腔镜手术在这两个方面是否具有优越性。现报告如下。
1 资料与方法
1.1 临床资料 选择48例采用腹腔镜结肠癌根治术治疗的右半结肠癌患者为腹腔镜组,47例采用开腹结肠癌根治术治疗的右半结肠癌患者为开腹手术组。纳入标准:①符合《中国结直肠癌治疗规范》[6]中结肠癌的诊断标准;②经病理检查确诊为右半结肠癌;③患者的一般情况良好,可以耐受手术治疗。排除标准[7]:①患者术前检查证实有远处转移;②术前存在免疫功能异常及应用影响免疫功能药物者。腹腔镜组男26例、女22例,年龄42~78(56.73±13.02)岁;病理类型均为腺癌,分化程度高分化9例、中分化29例、低分化10例;Ducks分期A期5例、B期18例、C期22例、D期3例。开腹手术组男24例、女23例,年龄42~78(57.49±12.68)岁;病理类型均为腺癌,分化程度高分化8例、中分化28例、低分化11例;Ducks分期A期6例、B期17例、C期21例、D期3例。两组性别、年龄、病理分型、分化程度、Ducks分期均具有可比性。本研究已获我院医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 手术方法 所有患者需在术前纠正贫血、电解质紊乱等症状,于术前1天进行相关肠道准备工作,并在手术进行过程中使用适当剂量的抗生素。所有患者严格按照肿瘤的根治原则行结肠癌根治术,并行全肠系膜切除。开腹手术组采用中间入路开腹,在回结肠动脉投影处打开结肠系膜,分离回结肠血管,清扫血管根部的淋巴结和脂肪组织,阻闭并切断回结肠血管。在肠系膜静脉右缘由下向上切开右结肠系膜后叶,于结肠系膜后叶和肾前筋膜的无血管区向头部分离至肝区,完整切除肠系膜前后叶,清扫系膜内的淋巴和脂肪组织。沿肠系膜上静脉向上分离右结肠血管、共同干及结肠中动脉右支,阻闭并切断。于血管根部分离各主干动静脉,清扫中央组淋巴结。打开胃结肠韧带,切断肝结肠韧带和右膈结肠韧带,游离升结肠和结肠肝曲,置入伤口保护器,切除右半结肠的肿瘤及相应肠段和系膜,吻合器吻合回肠和结肠。腹腔镜手术组采用5孔法行腹腔镜右半结肠癌根治术,脐下置入10 mm的Trocar作为观察孔,手术径路选择中间入路,打开方式与开腹相同,在处共同干时,采用上下路径结合的方式。
1.3 炎症相关因子检测 术前、术后次日晨抽取两组患者外周血,行白细胞(WBC)计数,分离血清用全自动生化分析仪检测C反应蛋白(CRP),用酶联免疫吸附法检测血清IL-6、IL-8和TNF-α,试剂盒购自上海酶联生物科技有限公司。严格按照试剂盒和仪器说明书操作。
1.4 T细胞亚群检测 分别于手术前后次日晨采集两组患者外周静脉血2 mL,置枸橼酸钠抗凝管中,用流式细胞仪和流式细胞术检测T细胞亚群分布。操作按试剂盒说明书进行。
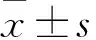
2 结果
2.1 两组手术前后炎症指标比较 两组手术前后WBC数量和血清CRP、IL-6、IL-8、TNF-α水平见表1。由表1可见,两组术前WBC数量和血清CRP、IL-6、IL-8、TNF-α水平相比P均>0.05。术后1天两组WBC数量和血清CRP、IL-6、IL-8、TNF-α水平均较术前升高(P均<0.05),但腹腔镜组低于开腹手术组(P均<0.05)。

表1 两组手术前后WBC数量和血清CRP、IL-6、IL-8、TNF-α水平比较
注:与同组术前比较,*P<0.05;与开腹手术组术后比较,#P<0.05。
2.2 两组手术前后T细胞亚群分布比较 两组术前CD3+、CD4+、CD8+T细胞比例及CD4+/CD8+相比P均>0.05。与术前相比,术后1天两组外周血CD3+、CD4+T细胞比例及CD4+/CD8+降低(P均<0.05),CD8+T细胞比例升高(P均<0.05);术后1天腹腔镜组CD3+、CD4+T细胞比例及CD4+/CD8+高于开腹手术组(P均<0.05), CD8+T细胞比例低于开腹手术组(P<0.05)。见表2。

表2 两组手术前后CD3+、CD4+、CD8+T细胞比例及CD4+/CD8+比较
注:与同组术前比较,*P<0.05;与开腹手术组术后比较,#P<0.05。
3 讨论
结直肠癌是临床上较为常见的消化系统恶性肿瘤,随着人们生活方式的改变,结直肠癌在我国的患病率和病死率逐年增高[7]。目前,临床上主要采用手术切除辅助放化疗的综合治疗方法治疗结直肠癌,且手术切除是根治结直肠癌的惟一方法[8]。传统开腹结直肠癌根治术创口较大,对患者机体损伤较严重。近年来,随着科技的发展,腹腔镜逐渐应用于结肠外科手术中,与传统开腹手术相比,其创口小,患者痛苦少,恢复快,患者生活质量得到明显提高。然而右半结肠癌手术较为复杂,实施腹腔镜手术难度较大。其原因主要由于右半结肠手术空间相对较小,同时手术区域内有较多的组织器官,解剖结构复杂,操作不慎可能损伤邻近器官[9]。近年来,由于外科医师对腹腔镜技术的日益熟练,使腹腔镜治疗术右半结肠癌成为可能。相关研究表明,腹腔镜治疗右半结肠癌的效果与传统开腹手术无显著差异[10,11]。本研究没有比较腹腔镜手术和开腹手术的疗效,而是将研究视野定在患者术后炎症状态和细胞免疫功能这两个方面。
本研究结果显示,术后1天两组WBC数量及血清CRP、IL-6、IL-8、TNF-α水平均较术前升高,但腹腔镜组WBC数量及血清CRP、IL-6、IL-8、TNF-α水平低于开腹手术组。WBC包括淋巴细胞、中性粒细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞等,主要参与机体防御和吞噬细菌的过程,其水平升高表明机体存在炎症[12]。CRP为急性时相反应蛋白,可灵敏地反应机体的炎症程度[13]。机体创伤越严重,则血液中CRP水平越高。IL-6、IL-8、TNF-α是常见的细胞因子,与炎症反应有关[14]。本研究结果表明,两种手术方式均会对机体造成一定程度的创伤,但腹腔镜组炎症反应较开腹手术组明显减轻。
机体对肿瘤的免疫作用主要与T淋巴细胞诱导的细胞免疫相关。总T淋巴细胞(CD3+细胞)水平与外周血中成熟淋巴细胞的表达相关,辅助T淋巴细胞(CD4+细胞)和细胞毒性T淋巴细胞(CD8+细胞)水平则反映机体的细胞免疫功能[15]。有研究表明,传统开腹手术会对恶性肿瘤患者的免疫系统造成严重损害,手术后患者的功能免疫细胞水平明显下降[16]。本研究结果显示,两组患者术后CD3+、CD4+、CD8+T细胞水平均有不同程度的下降,说明两种手术方式均对机体的免疫功能产生不同程度的抑制作用。但术后1天腹腔镜组CD3+、CD4+、CD4+/CD8+显著高于开腹手术组,CD8+水平显著低于开腹手术组,表明腹腔镜手术对机体免疫系统的损伤程度明显低于传统的开腹手术。可能是由于腹腔镜的切口比较小,手术较短,术后炎症反应较轻所致。
[1] 黄建国,孙钦立.两种手术方法行右半结肠癌根治术对机体免疫指标的影响[J].海军医学杂志,2015,36(5):419-420,469.
[2] 广兴凤.腹腔镜及开腹手术治疗右半结肠癌的疗效及对免疫功能的影响[J].结直肠肛门外科,2016,22(5):528-531.
[3] Wu H, Lin YY, Li WG, et al. Regulation of Nur77 expression by β-catenin and its mitogenic effect in colon cancercells[J]. FASEB J, 2011,25(1):192-205.
[4] Ichiro T, Mamoru U, Junichi N, et al. Feasibility of single-site laparoscopic colectomy with complete mesocolic excision for colon cancer: a prospective case-control comparison[J]. Surg Endosc, 2014,28(4):1110-1118.
[5] Zhao LY, Chi P, Ding WX, et al. Laparoscopic vs open extended right hemicolectomy for colon cancer[J]. World J Gastroenterol, 2014,20(24):7926-7932.
[6] 国家卫生计生委医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2015版)[J].中华胃肠外科杂志,2015,95(8):961-973.
[7] Han L, Smitha A, Krishnendu R, et al. Interleukin-4 and interleukin-13 increase NADPH oxidase 1-related proliferation of human colon cancer cells[J]. Oncotarget, 2017,8(24):38113-38135.
[8] 何盟国,沈乃营,毕建斌,等.腹腔镜与开腹结肠癌根治术对机体免疫功能和肿瘤转移潜能的影响[J].陕西医学杂志,2016,45(6):677-678.
[9] 向春华.腹腔镜手术和开腹手术对结肠癌患者血清恶性分子及机体免疫功能的影响[J].海南医学院学报,2016,22(15):1670-1672,1676.
[10] Junjie Z, Katarzyna B, Muhammet FG, et al. Human colon tumors express a dominant-negative form of SIGIRR that promotes inflammation and colitis-associated colon cancer in mice[J]. Gastroenterology, 2015,149(7):1860-1871.
[11] Gregory NA, Leah R, Malinda F, et al. Colon cancer growth and dissemination relies upon thrombin, stromal PAR-1 and fibrinogen[J]. Cancer Res, 2016,76(3):630-642.
[12] 莫波,马娟,郝志楠,等.结肠癌应用腹腔镜以及开腹手术治疗对机体免疫功能的影响比较[J].中国内镜杂志,2016,22(6):24-26.
[13] 钟俊斌,杨平,孙政,等.腹腔镜辅助右半结肠癌根治术与传统开腹术对免疫功能及疗效的临床观察[J].广州医药,2017,48(2):99-101.
[14] Masayoshi T, Yoshihito I, Mitsunobu T, et al. Single-port versus multi-port laparoscopic surgery for colon cancer in elderly patients[J]. Oncol Lett, 2016,12(2):1465-1470.
[15] 高峡,张波.腹腔镜与开腹术右半结肠癌根治术对患者免疫指标的影响[J].实用临床医药杂志,2016,20(13):67-69.
[16] 闫军,李亮,陈曦,等.腹腔镜直肠癌根治术与开腹手术近期疗效及对机体免疫的影响[J].中国现代普通外科进展,2016,19(8):592-595.
刘国庆(E-mail: 449282365@qq.com)
10.3969/j.issn.1002-266X.2017.40.021
R735.3
B
1002-266X(2017)40-0069-03
2017-09-15)
