护肠清毒微丸对慢加急性肝衰竭大鼠肝损伤的治疗效果及作用机制
2017-12-12孙欢娜张向磊石建美田瑞渊
孙欢娜,张向磊,石建美,田瑞渊
(1山东中医药大学附属医院,济南250014;2青岛市海慈医疗集团;3山东中医药大学第一临床学院;4山东大学齐鲁医院)
护肠清毒微丸对慢加急性肝衰竭大鼠肝损伤的治疗效果及作用机制
孙欢娜1,张向磊2,3,石建美3,田瑞渊4
(1山东中医药大学附属医院,济南250014;2青岛市海慈医疗集团;3山东中医药大学第一临床学院;4山东大学齐鲁医院)
目的探讨护肠清毒微丸对慢加急性肝衰竭大鼠肝损伤的治疗效果及其作用机制。方法将Wistar大鼠分为正常对照组、模型组、乳果糖组及护肠清毒微丸低、中、高剂量组。除正常对照组外,其余各组均制备慢加急性肝衰竭模型,乳果糖组及护肠清毒微丸低、中、高剂量组自肝衰竭造模后分别灌胃给予0.81 g/(kg·d)乳果糖及3.4、6.8、13.5 g/(kg·d)护肠清毒微丸,均连续给药4周。给药结束后12 h,收集各组尿液及血液标本。观察各组给药过程中一般状况,统计肝衰竭造模后第28天各组死亡情况。检测血清ALT、AST、PA、TBIL,血浆内毒素,凝血酶原活动度(PTA),血清炎性因子TNF-α、IL-1、IL-6、IL-8、IL-10,血浆D-乳酸、二胺氧化酶(DAO),尿乳果糖/甘露醇(L/M)。结果正常对照组处理过程中精神状态好,体质量增加较快;其他组造模过程中毛发凌乱、无光泽,饮食量少,活动少,甚至呼吸急促、球结膜水肿、死亡;护肠清毒微丸各组及乳果糖组随着灌胃给药时间的延长上述症状逐渐改善,以高剂量组改善最为明显。至肝衰竭造模后第28天,模型组死亡率高于其他各组,护肠清毒微丸中剂量组死亡率高于乳果糖组(P均<0.05)。与正常对照组比较,其他组血清ALT、AST、TBIL及血浆内毒素水平均升高,血清PA、PTA水平均降低;与模型组比较,护肠清毒微丸低、中、高剂量组及乳果糖组血清ALT、AST、TBIL及血浆内毒素水平均降低,血清PA、PTA水平均升高;与乳果糖组比较,护肠清毒微丸低、中、高剂量组血清ALT、AST、TBIL及血浆内毒素水平均降低,血清PA、PTA水平均升高;组间比较P均<0.05。与正常对照组比较,其他组血清TNF-α、IL-1、IL-6、IL-8、IL-10、D-乳酸、DAO及尿L/M水平均升高;与模型组比较,护肠清毒微丸低、中、高剂量组及乳果糖组均降低;与乳果糖组比较,护肠清毒微丸低、中、高剂量组均降低;组间比较P均<0.05。护肠清毒微丸高剂量组上述指标变化均较低、中剂量组显著(P均<0.05)。结论护肠清毒微丸可抑制慢加急性肝衰竭大鼠肝损伤, 抑制炎性细胞因子释放、纠正肠黏膜通透性、稳定内环境、阻断肠源性内毒素血症的发生等可能是其作用机制。
慢加急性肝衰竭;护肠清毒微丸;肠源性内毒素血症;肠黏膜屏障
肠源性内毒素是肝功能衰竭发生的物质基础[1]。肠源性内毒素血症与肝损害互为因果关系,内毒素不仅加重肝损害,而且是促进门脉高压、肾损害等多器官病变的重要因素[2]。护肠清毒微丸具有健脾调肠、化瘀解毒等功效,可用于肠源性内毒素血症的治疗,但其作用机制尚未明确[3,4]。2015年10月~2016年6月,我们探讨护肠清毒微丸结肠靶向给药对慢加急性肝衰竭大鼠肠源性内毒素血症的治疗效果及其作用机制。
1 材料与方法
1.1 材料 雄性Wistar大鼠120只,4周龄,体质量80~100 g,购于山东鲁抗集团,动物合格证编号SCXK(鲁)20130009。护肠清毒微丸(0.3 g/粒)由山东中医药大学附属医院制剂室负责制剂和质量控制,药物组成包括云苓、大黄、黄芩、赤芍、甘草等。乳果糖(0.3 g/粒)由山东中医药大学附属医院制剂室负责制剂和质量控制。乳果糖标准品、甘露醇标准品、羧甲基纤维素钠,IL-1、IL-2、IL-6、IL-8、IL-10试剂盒,ALT、AST、前白蛋白(PAlb)、总胆红素(TBIL)检测试剂盒均购自山东博科生物产业有限公司。
1.2 动物分组及处理 取10只大鼠作为正常对照组;其余110只制作慢加急性肝衰竭模型。造模方法:首先采用人血白蛋白(HSA)多点注射致敏制备肝纤维化模型,具体方法参考文献[5];然后以D-氨基半乳糖(D-gal)/脂多糖联合急性攻击肝纤维化大鼠,建立与人慢加急性肝衰竭形态学表现相似的实验动物模型,具体方法参考文献[6]。造模过程中15只死亡,余95只随机编码并分为5组,分别为模型组、护肠清毒微丸低剂量、护肠清毒微丸中剂量组、护肠清毒微丸高剂量、乳果糖组,每组19只。乳果糖组及护肠清毒微丸低、中、高剂量组自造模后开始连续灌胃,分别给予13.5 g/(kg·d)乳果糖及3.4、6.8、13.5 g/(kg·d)护肠清毒微丸(采用0.5%羧甲基纤维素钠溶液配成混悬液),均在每天上、下午8点各灌胃1次,连续给药4周。正常对照组及模型组以相同体积的蒸馏水灌胃。给药结束后12 h,利用代谢笼收集各组尿液,离心后取上清液,备用;将各组给予戊巴比妥钠溶液腹腔注射麻醉,待麻醉满意后沿腹正中线打开腹腔,暴露门静脉,结扎肝门口处门静脉,以取血针抽取门静脉血1 mL,装入抗凝管中待检内毒素;下腔静脉取血,3 000 r/min离心15 min,取上清液,-80 ℃冰箱保存备检。
1.3 相关指标观察 ①一般状况及死亡情况:观察并记录各组给药过程中一般状况,如体质量、被毛光泽度、大便、活动情况等统计造模后第28天各组死亡情况。②肝功能指标:采用奥林巴斯AU5400生化分析仪检测血清ALT、AST、PA、TBIL,具体步骤参照试剂盒说明书。③血浆内毒素:采用动态浊度法检测血浆内毒素。④凝血酶原活动度(PTA):采用Stago血凝仪检测PTA。⑤炎性因子:采用ELISA法检测血清TNF-α、IL-1、IL-6、IL-8、IL-10。⑥肠通透性指标:采用ELISA法检测血清D-乳酸,采用双抗体夹心法检测血二胺氧化酶(DAO)活性,采用高效液相色谱法检测尿乳果糖/甘露醇(L/M)。
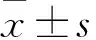
2 结果
2.1 各组造模后一般状况及死亡情况 正常对照组处理过程中精神状态好,饮食饮水量多,体质量增加较快,毛发有光泽。其他各组在造模过程中毛发凌乱、无光泽,饮食量少,活动少,对外界刺激反应迟钝;随着造模时间增加,上述状态持续加重,且出现呼吸急促、球结膜水肿,部分出现呼吸微弱、不能站立等濒死症状。护肠清毒微丸各组及乳果糖组大鼠随着灌胃给药时间的延长上述症状逐渐改善,以高剂量组改善最为明显。至给药处理后第28天,模型组死亡14只(73.7%),护肠清毒微丸小、中、高剂量组分别为9只(47.3%)、5只(26.3%)、4只(21.1%),乳果糖组为7只(36.8%),模型组死亡率均高于其他各组,护肠清毒微丸低剂量组死亡率高于护肠清毒微丸中、高剂量组及乳果糖组(P均<0.05)。
2.2 各组肝功能指标比较 与正常对照组比较,其他组血清ALT、AST、TBIL水平均升高,血清PAlb水平均降低;与模型组比较,护肠清毒微丸低、中、高剂量组及乳果糖组血清ALT、AST、TBIL水平均降低,血清PAlb水平均升高;乳果糖组及护肠清毒微丸低、中、高剂量组血清ALT、AST、TBIL水平逐渐降低,血清PAlb水平逐渐升高;组间比较,P均<0.05。见表1。

表1 各组血清ALT、AST、PAlb、TBIL水平比较
2.3 各组血浆内毒素及PTA水平比较 与正常对照组比较,护肠清毒微丸各组与乳果糖组血浆内毒素水平均升高、PTA均降低;与模型组比较,护肠清毒微丸低、中、高剂量组与乳果糖组血浆内毒素水平均降低、PTA均升高;与乳果糖组比较,护肠清毒微丸低、中、高剂量组血浆内毒素水平均降低,护肠清毒微丸中、高剂量组PTA均升高;护肠清毒微丸中、高剂量组血浆内毒素水平均低于、PTA水平均高于护肠清毒微丸低剂量组;组间比较,P均<0.05。见表2。

表2 各组血浆内毒素及PTA水平比较
2.4 各组血清炎症因子水平比较 与正常对照组比较,其他组血清TNF-α、IL-1、IL-6、IL-8、IL-10水平均升高;与模型组比较,护肠清毒微丸低、中、高剂量组及乳果糖组上述指标均降低;乳果糖组及护肠清毒微丸低、中、高剂量组上述指标均逐渐降低;组间比较,P均<0.05。见表3。
2.5 各组血清D-乳酸、DAO水平及尿L/M比较 与正常对照组比较,其他组血清D-乳酸、DAO水平及尿L/M均升高;与模型组比较,护肠清毒微丸低、中、高剂量组及乳果糖组上述指标均降低;与乳果糖组比较,护肠清毒微丸中、高剂量组上述指标均降低;护肠清毒微丸高剂量组上述指标均低于低、中剂量组;组间比较,P均<0.05。见表4。
3 讨论
慢加急性肝衰竭是指在慢性肝病基础上短期内发生急性肝功能失代偿的临床症候群,临床主要表现为极度乏力、明显的消化道症状、黄疸迅速加深、出血倾向、失代偿性腹水、伴或不伴有肝性脑病等。慢加急性肝衰竭发病机制复杂,病情进展迅速,病死率极高[7]。近年来,肠源性内毒素血症对于慢加急性肝衰竭的发展和转归逐渐被学者认同。生理状态下,肝脏具有很强的内毒素灭活能力[8],一旦肝脏受损,其对内毒素灭活的能力下降,则可诱发肠源性内毒素血症[9];肠道微生态失衡、肠道菌群易位是产生内毒素的重要原因。肝病患者存在细菌过度繁殖、肠道菌群结构改变[10],同时肠道蠕动能力、机械清除能力和屏障功能减弱,导致大量内毒素被吸收[11]。肝衰竭—肠道菌群失调—肠道屏障功能受损—肠源性内毒素血症形成一个恶性循环, 在慢加急性肝衰竭的发生、发展、 维持、恶化过程中发挥主导作用。

表3 各组血清TNF-α、IL-1 、IL-6、 IL-8、 IL-10水平

表4 各组血清D-乳酸、DAO水平及尿L/M比较
研究证实,应用肠道微生态调节剂、乳果糖或拉克替醇等可改善肝衰竭患者预后,减少肠道细菌易位、降低内毒素血症可能是其作用机制[7]。目前,肠源性内毒素血症的治疗多采用乳果糖。乳果糖是一种不被胃肠黏膜双糖酶分解的人工合成双糖,可酸化肠道,调节肠道菌群,抑制嗜碱性有害菌群繁殖,减少肠道内毒素产生;乳果糖作为一种轻泻剂可增加肠蠕动,促进肠道内腐败物质排出,减少内毒素等有害物质进入血循环,达到防治肠源性内毒素血症的目的[12];但长时间应用可导致肠道酸碱平衡失调。研究证实,中医药可通过调节免疫紊乱、改善肝脏微循环、修复肠黏膜屏障、恢复肠道微生态,阻断肠源性内毒素血症的发生、发展[13]。护肠清毒微丸是根据中医理论,结合慢加急性肝衰竭肠源性内毒素血症发生的病机特点,即本虚标实,以脾虚为本,湿、热、瘀、毒为标,制备的具有健脾护肠、清热凉血、化瘀解毒之效的方药;药物组成包括云苓、大黄、黄芩、赤芍、薏苡仁、甘草等。方中茯苓健脾益气渗湿;大黄泻热凉血,解毒逐瘀;黄疸诸火疮。云苓、大黄为君药,既能健脾清肠,又可清热凉血、化瘀解毒。薏苡仁健脾利水渗湿,使脾健湿自化;黄芩清热燥湿;赤芍清热凉血、活血化瘀。薏苡仁、黄芩、赤芍共为臣药,助君药以健脾活血、清热化湿、凉血解毒。甘草为佐使之药以调和诸药,又可补脾益气、清热解毒、缓急止痛。
本研究结果显示,模型组血清ALT、AST、TBIL快速升高,PA迅速降低,说明其肝脏功能急剧恶化,肝细胞大量坏死,一般状态差;给予护肠清毒微丸及乳果糖组肝指标均较模型组改善、一般状态好于模型组,死亡率低于模型组,且护肠清毒微丸组上述指标均好于乳果糖组,其中以护肠清毒微丸高剂量组[13.5 g/(kg·d)]效果最好;说明护肠清毒微丸可抑制慢加急性肝衰竭大鼠肝损伤,效果优于乳果糖,且呈剂量依赖性。
慢加急性肝衰竭患者发生肠源性内毒素血症时,机体释放大量TNF-α、IL-1、IL-6、IL-8、IL-10等促炎细胞因子[14,15],诱发持续性炎症反应,并不断自我增强,形成瀑布级联反应,造成对肝脏的二次打击[16],导致肝细胞大量坏死,表现为肝功能急剧恶化。清除内毒素及减少炎症介质释放对阻断病情进展,改善肝功能具有重要意义。凝血酶原是由肝脏合成的维生素K依赖因子,是血液凝固因子之一。PTA是判断肝细胞坏死严重程度及患者预后的敏感指标。本研究模型组血清TNF-α、IL-1、IL-6、IL-8、IL-10水平及血浆内毒素水平均显著升高,PTA水平下降。给予护肠清毒微丸及乳果糖干预大鼠炎性因子及血浆内毒素水平均显著下降,PTA水平升高;且护肠清毒微丸效果优于乳果糖,乳果糖高剂量组效果优于低、中剂量组。上述结果提示,护肠清毒微丸能够清除内毒素,抑制炎性细胞因子释放,稳定内环境,阻止炎症反应进展,防止肝细胞凋亡、坏死。
血浆 DAO和D-乳酸水平可反映肠黏膜损屏障功能[17]。D-乳酸是胃肠细菌发酵的代谢产物,生理情况下很少被吸收,且哺乳动物不具备将其快速降解的酶系统。当肠黏膜通透性增加时,血浆D-乳酸水平升高。DAO是小肠绒毛上皮细胞的胞内氧化酶,当肠黏膜细胞受损坏死时该酶释放入血,导致血浆DAO活性增高[18]。肠道通透性是最直接和最准确的反映肠黏膜功能的量化指标。肠黏膜通透性改变可使肠道吸收乳果糖增加,但对甘露醇的吸收无明显变化。L/M测定是上最常用的评估肠黏膜通透性的无创诊断方法[19]。本研究结果显示,护肠清毒微丸能够显著降低慢加急性肝衰竭大鼠血清D-乳酸、DAO水平及尿L/M水平,说明护肠清毒微丸可改善肠黏膜通透性,修复肠黏膜屏障,且效果好于乳果糖。
综上所述,护肠清毒微丸可抑制慢加急性肝衰竭大鼠肝损伤,抑制炎性细胞因子释放、纠正肠黏膜通透性、稳定内环境、阻断肠源性内毒素血症的发生等可能是其作用机制。
[1] 韩德五.肠源性内毒素血症所致“继发性肝损伤”的临床依据[J].世界华人消化杂志,1999,7(12):1055-1058.
[2] 高方媛,王宪波.肠源性内毒素血症在肝衰竭发生发展中的作用[J].临床肝胆病杂志,2014,30(8):825-828.
[3] 毛毛,李勇,黄书婷.大黄解毒汤灌肠治疗慢性乙型病毒性肝炎肠源性内毒素血症45例[J].陕西中医,2010,31(5):515-516.
[4] Li Y, Wang L, Su CH, et al. Clinical observation on the treatment of chronic severe hepatitis B by retention enema with huchang Jiedu Decoction[J]. Chin J Integr Med, 2010,16(4):348-352.
[5] 王宝恩,王志富,殷蔚荑,等.实验性免疫性肝纤维化模型的研究[J].中华医学杂志,1989,69(9):503-505.
[6] 张文中,刘旭华,赵军,等.慢加急性肝衰竭大鼠血TNF-α、白介素-10及肝细胞凋亡的动态变化[J].中国血液净化,2007,6(9):496-499.
[7] 中华医学会感染病学分会肝衰竭与人工肝学组.肝衰竭诊治指南(2012年版)[J].实用肝脏病杂志,2013,16(3):210-216.
[8] 汪承柏.重视慢性肝炎内毒素血症的防治[J].中西医结合肝病杂志,2001,11(4):193-194.
[9] Ding LA, Li JS, Li YS, et al. Intestinal barrier damage caused by tra-uma and lipopolysaccharide[J]. World J Gastroenterol, 2004,10(16):2373-2378.
[10] 袁林艳,吴亚云,李宏,等.微生态制剂治疗肝衰竭内毒素血症的研究进展[J].世界华人消化杂志,2013,21(14):1286-1291.
[11] Bauer TM, Schwacha H, Steinbrückner B, et al. Small intestinal bacterial overgrowth in human cirrhosis is associated with systemic endotoxemia[J]. Am J Gastroenterol, 2002,97(9):2364-2370.
[12] 占国清,谭华炳,刘翔,等.肝康Ⅱ号联合乳果糖保留灌肠治疗乙肝相关性肝衰竭肠源性内毒素血症[J].中国中西医结合消化杂志,2015,23(4):270-275.
[13] 张向磊,胡冬青,孙欢娜,李勇.护肠清毒微丸结肠靶向给药降低血浆内毒素及TNF-α、IL - 6、 IL-8临床研究[J].吉林中医药,2016,36(9):891-893.
[14] 杜立树,平龙玉,张曼俐.细胞因子在乙肝相关性肝衰竭患者中的表达意义[J].中国中西医结合消化杂志,2017,25(2):144-147.
[15] 陈海芬.慢性乙型肝炎和肝功能衰竭患者血清 IL-32、IL-6、IL-8检测的意义[J].现代实用医学,2015,27(4):474-475.
[16] 卢琳琳,陆伟,胡东胜,等.急性肝衰竭大鼠肠黏膜屏障功能变化特点分析[J].山东医药,2012,52 (39):51-53.
[17] 杜春武.阿德福韦酯联合谷氨酰胺治疗对乙肝肝硬化患者免疫功能及肠黏膜屏障的影响[J].四川解剖学杂志,2015,23(4):27-34.
[18] 张妮,朱保权,张庆立.危重症患儿血浆 D-乳酸水平和二胺氧化酶活性与胃肠功能障碍关系研究[J].临床儿科杂志,2006,24(10):794-796.
[19] 李鑫,王晨,聂娇,等.酒精性肝炎小鼠肝肠组织变化与内毒素血症的关系探讨[J].实用肝脏病杂志,2013,16(3):254-256.
TherapeuticeffectandmechanismofHuchangQingdupelletsintreatmentofliverinjuryofratswithacute-on-chronicliverfailure
SUNHuanna1,ZHANGXianglei,SHIJianmei,TIANRuiyuan
(1TheAffiliatedHospitalofShandongUniversityofTraditionalChineseMedicine,Jinan250014,China)
ObjectiveTo investigate the therapeutic effects and possible mechanism of Huchang Qingdu pellets in treatment of liver injury of rats with acute-on-chronic liver failure (ACLF).MethodsWistar rats were divided into the normal control group, model group, lactulose group, and Huchang Qingdu pellet groups (including low-, medium- and high-dose groups) randomly. In addition to the normal control group, we made ACLF models in the other groups. Rats in the lactulose group, the low-, medium- and high-dose Huchang Qingdu pellet groups were given 0.81 g/(kg·d) lactulose, 3.4, 6.8, and 13.5 g/(kg·d) Huchang Qingdu pellets, respectively, for 4 weeks. At 12 h after the end of the administration, urine and blood samples were collected from each group. The general condition of the rats in each group and the death of each group on the 28 th day after the modeling was observed. The levels of ALT, AST, PA, TBIL, plasma endotoxin (ET), prothrombin activity (PTA), TNF-α, IL-1, IL-6, IL-8, IL-10, plasma D-lactic acid (D-LAC), diamine oxidase (DAO), and lactulose/mannitol (L/M) were detected.ResultsThe rats in the normal control group had good mental state and the body weight increased rapidly. In the process of modeling, the rats in the other groups had messy hair, dullness, less diet, less activity and even shortness of breath, conjunctival edema and death. The above symptoms in the lactulose group and Huchang Qingdu pellet groups were improved over the time of intragastric administration, and the rats in the high-dose group were the most significant. On the 28th day after the modeling, the mortality rate in the model group was higher than those in the other groups. The mortality rate of the medium-dose group was higher than that of the lactulose group (P<0.05). Compared with the normal control group, the levels of serum ALT, AST, TBIL and plasma endotoxin increased, and the levels of serum PA and PTA decreased. Compared with the model group, the levels of serum ALT, AST, TBIL and plasma endotoxin in the lactulose group, the low-, medium- and high-dose Huchang Qingdu pellet groups decreased, and the levels of serum PA and PTA increased. Compared with the lactulose group, the serum levels of ALT, AST, TBIL and plasma endotoxin in the low-, medium- and high-dose Huchang Qingdu pellet groups decreased, and the serum PA and PTA levels increased (allP<0.05). The serum levels of TNF-α, IL-1, IL-6, IL-8, IL-10, D-LAC, DAO, and urinary L/M increased in the other groups as compared with those of the the normal control group; compared with the model group and the lactulose group, the low-, medium- and high-dose Huchang Qingdu pellet groups were lower (allP<0.05). The changes of the above indexes in the high-dose group were significantly lower than those in the medium- and low-dose groups (allP<0.05).ConclusionsHuchang Qingdu pellets can prevent liver injury of ACLF rats by inhibiting the release of inflammatory cytokines, improving the permeability of intestinal mucosa, stabilizing the internal environment, and blocking the occurrence of intestinal endotoxemia.
acute-on-chronic liver failure; Huchang Qingdu pellets; intestinal endotoxemia; intestinal mucosal barrier
山东省自然科学基金资助项目(ZR2015PH055)。
孙欢娜(1980-),女,主治医师,主要研究方向:肝胆病的中西医结合治疗。E-mail: nana_huan191@163.com
李勇(1958-),女,主任医师,教授,博士生导师,主要研究方向:肝胆病的中西医结合治疗。E-mail: liy1958@163.com
10.3969/j.issn.1002-266X.2017.40.003
R575.3
A
1002-266X(2017)40-0009-05
2017-05-02)
