HBVrt A181T/V突变慢乙肝患者的抗病毒治疗史、血清学特点及恩替卡韦挽救治疗效果观察
2017-12-12薛艳王磊张立新刘峰曲云东杨保华李涛王岩叶茜高林
薛艳,王磊,张立新,刘峰,曲云东,杨保华,李涛,王岩,叶茜,高林
(山东大学第二医院,济南250033)
·论著·
HBVrt A181T/V突变慢乙肝患者的抗病毒治疗史、血清学特点及恩替卡韦挽救治疗效果观察
薛艳,王磊,张立新,刘峰,曲云东,杨保华,李涛,王岩,叶茜,高林
(山东大学第二医院,济南250033)
目的观察HBV逆转录酶区181位点T/V突变(HBV rtA181T/V)患者的抗病毒治疗史、血清学特点、恩替卡韦挽救治疗效果。方法连续入组71例已经出现病毒学突破的核苷(酸)类似物(NAs)耐药乙肝患者。均采用直接测序法行HBV测序,且证实存在HBV rtA181T/V,其中HBV rtA181T突变41例、HBV rtA181V突变30例。回顾71例患者的NAs用药史。检测并比较rtA181T、rtA181V患者出现病毒学突破时的血清ALT、HBsAg、HBV-DNA水平。所有患者采用恩替卡韦为主的挽救方案治疗,比较rtA181T、rtA181V患者治疗24、52周时的病毒学应答情况。结果71例患者中既往应用单一NAs者为25例(以阿德福韦酯为主),序贯或联合应用多种NAs者46例。HBV rtA181T、rtA181V患者病毒学突破时中位血清ALT水平分别为55(15,474)、49(16,183)U/L,P>0.05;血清HBV-DNA的log10分别为5.71±1.02、6.04±0.97,P>0.05;血清HBsAg的log10分别为3.36±0.50、3.64±0.60,P<0.05。用以恩替卡韦为主的挽救方案治疗24周,病毒学完全应答55例(77.5%),病毒学不完全应答16例(22.5%),其中HBV rtA181T、rtA181V患者分别有33(80.5%)、22例(73.3%)达到病毒学完全应答,HBV rtA181T、rtA181V患者病毒学完全应答率相比P>0.05;治疗52周时病毒学完全应答62例(87.3%),病毒学不完全应答9例(12.7%),其中HBV rtA181T、rtA181V患者分别有37(90.2%)、25例(83.3%)达到病毒学完全应答,HBV rtA181T、rtA181V患者病毒学完全应答率相比P>0.05。结论HBV rtA181T/V突变患者多为序贯或联合应用阿德福韦酯及拉米夫定等多种NAs。HBV rtA181V患者发生病毒学突破时血清HBsAg水平高于HBV rtA181T患者。HBV rtA181T/V突变患者应用恩替卡韦挽救治疗效果满意,但HBV rtA181T、rtA181V患者治疗效果比较无统计学差异。
慢性乙型肝炎;乙型肝炎病毒;基因突变;逆转录酶区;拉米夫定;阿德福韦酯;替比夫定;恩替卡韦;病毒学应答
慢性乙型肝炎(慢乙肝)治疗的关键是抗病毒治疗。通过抗病毒治疗可以持续抑制患者HBV复制,延缓患者病情进展,减少肝脏失代偿、肝硬化、原发性肝细胞癌及其他并发症的发生。核苷(酸)类似物(NAs)是慢乙肝抗病毒最重要的一类药物,具有抑制病毒效力强、安全性好、适应证广、价格低廉等优点[1],既往常用的有拉米夫定、阿德福韦酯、替比夫定等。然而,长期使用拉米夫定、阿德福韦酯、替比夫定等NAs抗病毒治疗会诱导乙肝患者体内的HBV发生耐药突变,导致病毒学突破而发生耐药[2],这是NAs长期抗病毒治疗失败的重要因素之一。HBV逆转录酶区181位点突变是比较常见的耐药突变之一,目前此类患者的NAs抗病毒治疗史有何特点尚不明确。HBV逆转录酶区181位点突变有A→T突变(rtA181T)和A→V突变(rtA181V)两种突变模式。HBV rtA181T、rtA181V患者发生病毒学突破时HBV的血清学特点(抗原性、复制能力、毒力)及患者应用恩替卡韦挽救治疗的效果是否存在差异尚不清楚。为了解决上述问题,本研究回顾了出现HBV逆转录酶区A181位点突变患者NAs抗病毒治疗史的特点,并比较了HBV rtA181T、rtA181V突变患者发生病毒学突破时的血清ALT、HBV DNA、HBsAg水平,以及用恩替卡韦挽救治疗24 、52周时的病毒学应答情况。现报告如下。
1 资料与方法
1.1 临床资料 连续入组山东大学第二医院肝病科2009年10月~2016年7月收治的门诊及住院慢乙肝及相关肝硬化患者。患者均符合中国《慢性乙型肝炎防治指南》2005版中的慢乙肝或乙肝肝硬化诊断标准,有明确的NAs抗病毒治疗史,均已出现病毒学突破(患者治疗依从性好、坚持抗病毒治疗的情况下,血清HBV-DNA的log10值相比最低点上升1,或阴转阳,相隔1个月后用相同试剂重复检测仍如此)。HBV测序(由上海铂谊生物科技有限公司采用PCR产物直接测序法完成)发现rtA181T或rtA181V突变。排除同时感染甲、丙、丁、戊型肝炎病毒或者人类免疫缺陷病毒者,合并肝细胞癌、肝衰竭等终末期肝病者,合并药物性肝炎、酒精性肝炎、自身免疫性肝病或其他未知原因引起的肝功能异常者。共入组71例患者,其中男62例、女9例,年龄22~71岁、中位年龄42岁。28例合并肝硬化。其中rtA181T患者41例、rtA181V患者30例。本研究已获山东大学第二医院伦理委员会批准,患者均已签署知情同意书。
1.2 NAs抗病毒治疗史调查方法 回顾患者临床资料,收集患者NAs应用情况。
1.3 血清HBV DNA、HBsAg、ALT的检测方法 抽取入组患者病毒学突破时及再治疗4、12、24、52周时静脉血5 mL,分离血清,统一送山东大学第二医院检验科检测HBV DNA、HBsAg、ALT等生化值。采用美国Applied Biosystems的ABi7000实时PCR扩增仪检测HBV DNA,试剂盒购自北京鑫诺美迪检测技术有限公司,检测下限为1 000 copies/mL。采用美国Abbott的ARCHITCT i2000型HBV血清标记物的定量检测仪及配套试剂盒检测血清HBsAg,采用日本HITACHI公司生产的7170A全自动生物化学分析仪及配套试剂检测血清ALT。
1.4 恩替卡韦挽救治疗及效果评价方法 根据《慢性乙型肝炎防治指南》2005版,所有患者采用以恩替卡韦为主的抗病毒治疗方案,其中57例患者用单一恩替卡韦0.5 mg,1次/d口服,14例患者用恩替卡韦0.5 mg 联合阿德福韦酯10 mg,1次/d口服。随访至少52周。治疗24、52周时检测血清HBV-DNA,方法同1.3。血清HBV-DNA低于检测下限(即测不出)为完全病毒学应答;血清HBV- DNA值的log10较病毒学突破时下降2以上但仍可以检测到为病毒学不完全应答,其余情况为病毒学无应答。
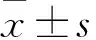
2 结果
2.1 NAs抗病毒治疗史 71例患者中46例(64.79%)曾采用序贯或联合应用多种 NAs抗病毒治疗,其中主要为以下三种模式:序贯应用拉米夫定及阿德福韦酯15例、拉米夫定耐药后采用拉米夫定联合阿德福韦酯14例、阿德福韦酯耐药后采用拉米夫定联合阿德福韦酯11例。25例(35.21%)患者既往采用单一NAs抗病毒治疗,其中22例采用阿德福韦酯,3例采用拉米夫定。
2.2 病毒学突破时间的血清ALT、HBV DNA、HBsAg水平 HBV rtA181T、rtA181V患者病毒学突破时血清ALT、HBV DNA、HBsAg水平见表1。HBV rtA181T、rtA181V患者病毒学突破时血清ALT、HBV-DNA相比P均>0.05; HBV rtA181V患者血清HBsAg水平高于HBV rtA181T患者(P均<0.05)。

表1 HBV rtA181T、rtA181V患者病毒学突破时血清ALT、HBV DNA、HBsAg、ALT水平比较
注:与rtA181T组相比,*P<0.05。
2.3 恩替卡韦挽救治疗效果 用以恩替卡韦为主的挽救治疗方案治疗24周,病毒学完全应答55例(77.5%),病毒学不完全应答16例(22.5%),其中HBV rtA181T、rtA181V患者分别有33(80.5%)、22例(73.3%)达到病毒学完全应答,HBV rtA181T、rtA181V患者病毒学完全应答率相比P>0.05;治疗52周时病毒学完全应答62例(87.3%),病毒学不完全应答9例(12.7%),其中HBV rtA181T、rtA181V患者分别有37例(90.2%)、25例(83.3%)达到病毒学完全应答,HBV rtA181T、rtA181V患者病毒学完全应答率相比P>0.05。
3 讨论
Yeh等[4]对23例拉米夫定抗病毒治疗失败患者进行HBV基因测序时首次发现了3例rtA181T突变。一些临床实验证实,rtA181T变异与NAs耐药相关。阿德福韦酯上市前的临床实验研究[5]发现有3例患者出现了rtA181V耐药突变。替比夫定的全球性临床研究[6]也发现在治疗应答不佳的患者中,有16例患者HBV出现了rtA181T突变。国内的一些临床研究[7,8]也发现了拉米夫定及阿德福韦酯治疗可以诱发rtA181位点突变,部分rtA181突变还同时伴有rtL180M或者rtN236T的变异,给这部分患者的再治疗增加了难度。邵幼林等[9]研究了阿德福韦酯初治耐药和阿德福韦酯挽救治疗拉米夫定耐药者再耐药时HBV毒株逆转录酶区基因突变情况,结果也发现了rtA181V突变。这些研究结果说明拉米夫定、阿德福韦酯、替比夫定抗病毒治疗可以诱发HBV逆转录酶区181位点基因突变,进而导致HBV对上述NAs耐药。本研究71例NAs耐药患者中46例既往序贯或联合应用多种NAs抗病毒治疗,说明HBV逆转录酶区181位点T/V突变主要是联合应用多种NAs抗病毒治疗导致的,与姬粉芝等[8]研究结果一致,提示临床工作者在用NAs行慢乙肝抗病毒治疗时,当既往应用拉米夫定、阿德福韦酯、替比夫定的患者考虑存在耐药突变,需调整抗病毒方案时,应先行HBV基因测序明确HBV逆转录酶区181位点基因突变情况,并根据结果选择合适治疗方案。
HBV逆转录酶区181位点氨基酸丙氨酸(A)的编码碱基为GCT,当第一位碱基G变异为A后,181为氨基酸变异为苏氨酸(T),产生rtA181T突变;当第二位碱基C变异为T后,181位氨基酸变异为缬氨酸(V),产生rtA181V变异。由于在HBV基因组中,病毒聚合酶编码基因与包膜蛋白编码基因(S) 的开放读码框存在重叠,S基因完全被聚合酶基因覆盖,核苷(酸)类似物治疗诱导的聚合酶编码基因的耐药突变,可能使HBsAg的S基因发生,从而导致HBsAg抗原性、结构或病毒适应性发生变化,产生免疫逃逸突变株等[10,11]。rtA181T变异可引起S基因第172位氨基酸由色氨酸突变成终止密码子,生成截短的S蛋白[12];体外的细胞实验已经证实rtA181T变异后截短的HBsAg糖基化程度降低,不能分泌出细胞,导致细胞内HBsAg、HBV-DNA聚集和血清HBsAg、HBV-DNA降低[12]。rtA181V则引起S基因第173位氨基酸由亮氨酸变异为苯丙氨酸,但不会影响HBV表达HBsAg和HBV-DNA。本研究结果显示,rtA181T患者血清HBsAg水平低于rtA181V患者,与上述研究结果相符合。但本研究中rtA181T、rtA181V 患者血清ALT水平比较差异无统计学意义,提示rtA181T、rtA181V HBV病毒株毒力差异不大,此结论是否在正确有待进一步大样本量的研究验证。rtA181T患者血清HBV-DNA水平低于rtA181V患者,但二者比较差异无统计学意义,可能与本研究样本量较小有关。发生rtA181T、rtA181V突变后,HBV的复制能力往往下降,应用NAs挽救治疗患者仍可获得病毒学应答[13]。我国慢乙肝患者的抗病毒治疗,存在许多不规范的情况,包括随意序贯治疗,频繁换药、加药及随意停药等,这些不规范治疗的后果将造成患者出现HBV耐药,增加了治疗的复杂性和难度。目前对HBV rtA181T/V耐药患者的再治疗干预,尚无循证医学证据推荐最佳的方案,也无临床实验对目前的治疗方法进行评价,仅有一些临床治疗的经验报道。2009年欧洲肝病学会慢性乙型肝炎(CHB)临床指南[14]提示rtAl81T/V耐药突变株对恩替卡韦及替比夫定敏感性下降。Cho等[15]报道,存在rtAl81T/V突变的24例慢乙肝患者采用恩替卡韦联合阿德福韦酯进行治疗疗效满意。Patterson等[16]对拉米夫定和阿德福韦酯联合治疗失败的患者换用或加用替诺福韦进行挽救治疗,结果显示疗效满意。本研究中对HBV rtA181T、rtA181V的NAs耐药患者主要采取以恩替卡韦为主的再治疗方法,结果显示大部分患者于治疗24周及52周时都取得了完全病毒学应答,效果满意,且HBV rtA181T、rtA181V患者治疗24、52周时病毒学完全应答率比较差异无统计学意义,说明对已经明确存在HBV rtA181T/V突变的NAs耐药慢乙肝患者,可以选用恩替卡韦单药或联合阿德福韦酯作为挽救治疗好方案,且有较好的治疗效果。但本研究样本量不大,今后还需继续积累病例资料。
[1] Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures[J]. J Viral Hepat, 2004,11(2):97-107.
[2] 庄辉,翁心华.核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理[J].中华肝脏病杂志,2013,21(1):15-22.
[3] 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 中华肝脏病杂志, 2011,19(1):13-24.
[4] Yeh CT, Chien RN, Chu CM, et al. Clearance of the original hepatitis B virus YMDD-motif mutants with emergence of distinct lamivudine-resistant mutants during prolonged lamivudine therapy[J]. Hepatology, 2000,31(6):1318-1326.
[5] Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, et al. Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B[J]. N Engl J Med, 2005,352(26):2673-2681.
[6] Lai CL, Gane E, Liaw YF, et al.Telbivudine versus lamivudine in patients with chronic hepatitis B[J]. N Engl J Med, 2007,357(25):2576,2588.
[7] 刘峰,王磊,王丽娜,等. 阿德福韦酯治疗慢性乙型肝炎过程中发生病毒突破患者的(HBV)P基因变异分析[J]. 山东大学学报(医学版),2008,46(4):407-410.
[8] 姬粉芝,王磊,杨保华,等.rtA181位点突变乙型肝炎病毒感染患者的临床特点及个体化再治疗效果[J]. 中华肝脏病杂志,2012,20(4):280-284.
[9] 邵幼林,张锁才,柳龙根,等.ADV初治耐药与LAM耐药者再耐药时HBV-RT区的变异特征[J].世界华人消化杂志,2012,20(20):1879-1883.
[10] Yeh CT. Development of HBV S gene mutants in chronic hepatitis B patients receiving nucleotide/nucleoside analogue therapy[J]. Antivir Ther, 2010,15(3):471-475.
[11] Torresi J, Earnest-Silveira L, Deliyannis G, et al. Reduced antigenicity of the hepatitis B virus HBsAg protein arising as a consequence of sequence changes in the overlapping polymerase gene that are selected by lamivudine therapy[J]. Virology, 2002,293(2):305-313.
[12] Warner N, Locarnini S. The antiviral drug selected hepatitis B virus rtA181T/sW172 mutant has a dominant negative secretion defect and alters the typical profile of viral rebound[J]. Hepatology, 2008,48(1):88-98.
[13] Perales C, Iranzo J, Manrubia SC, et al. The impact of quasispecies dynamics on the use of therapeutics[J]. Trends Microbiol, 2012,20(12):595-603.
[14] European Association for the Study of the Liver. EASL clinical practice guidelines:management of chronic hepatitis B[J]. J Hepatol, 2009,51(1):226-227.
[15] Cho HC, Kim YJ, Gwar GY, et al. One-year study of entecavir and adefovir combination therapy for rtAl81V/T mutants in prior lamivudine-resistant hepatitis B virus[J]. Hepatology, 2011,54(Suppl):1065-1066.
[16] Patterson SJ, George J, Strasser SI, et al. Tenofovir disoproxil fumarate rescue therapy following failure of both lamivudine and adefovir dipivoxil in chronic hepatitis B[J]. Gut, 2011,60(2):247-254.
Antiviraltherapyhistory,serologicalcharacteristics,andentecavirsalvagetherapeuticeffectinHBVrtA181T/VmutantpatientswithchronichepatitisB
XUEYan,WANGLei,ZHANGLixin,LIUFeng,QUYundong,YANGBaohua,LITao,WANGYan,YEQian,GAOLin
(TheSecondHospitalofShandongUniversity,Jinan250033,China)
ObjectiveTo observe the history of antiviral therapy, serological characteristics, and entecavir salvage therapeutic effect in the hepatitis B virus (HBV) reverse transcriptase (RT) 181 site T/V mutant patients with chronic hepatitis B.MethodsSeventy-one patients with virological breakthrough of nucleoside (acid) analogues (NAs)-resistant hepatitis B were continuously enrolled. Using direct sequencing for HBV sequencing, and we confirmed the presence of HBV reverse transcriptase region 181 site mutation of T/V, including 41 cases of HBV reverse transcriptase region 181 site mutation of T (rtA181T), and 30 cases of HBV reverse transcriptase region 181 site mutation of V (rtA181V). The medication history of NAs in 71 patients was reviewed. The levels of serum ALT, HBsAg, and HBV-DNA were detected and compared in rtA181T and rtA181V patients during virological breakthrough. All patients were treated with entecavir-based antiviral therapy, and then we compared the virological response of rtA181T and rtA181V patients at 24 and 52 weeks.ResultsOf the 71 patients, 25 patients were treated with a single antiviral drug (adefovir dipivoxil), and 46 patients with sequential or combined use of multiple NA. When the HBV rtA181T and rtA181V patients had virological breakthrough, the levels of serum ALT were 55 (15, 474) and 49 (16,183) U/mL, respectively,P>0.05; the log10 of HBV-DNA were 5.71±1.02 and 6.04±0.97, respectively,P<0.05; the log10 of serum HBsAg were 3.36±0.50 and 3.64±0.60,P<0.05. Salvage therapy with entecavir was mainly for 24 weeks. The complete virologic response was found in 55 cases (77.5%), including 33 cases (80.5%) of HBV rtA181T patients and 22 cases (73.3%) of HBV rtA181V patients; incomplete virologic response was found in 16 cases (22.5%). After 52 weeks of treatment, the complete virologic response was found in 62 cases (87.3%), including 37 cases (90.2%) of HBV rtA181T patients and 25 cases (83.3%) of HBV rtA181V patients; incomplete virologic response was found in 9 cases (12.7%), and no significant difference was found in the virologic response between the HBV rtA181T and rtA181V patients (P>0.05).ConclusionsPatients with HBV rtA181T/V mutation are mostly treated with sequential or combined with adefovir dipivoxil, lamivudine and other NAs. Serum HBsAg is higher in HBV rtA181V patients than in patients with HBV rtA181T. The treatment effect of HBV rtA181T/V patients treated with entecavir salvage is satisfactory, but the treatment effect is not different between HBV rtA181T and HBV rtA181V patients.
chronic hepatitis B; hepatitis B virus; gene mutation; reverse transcriptase; lamivudine; adefovir dipivoxil; entecavir; telbivudine; virological response
山东省自然科学基金资助项目(ZR2014HL088);济南市临床医学科技创新计划(201506004);山东大学第二医院青年基金资助项目(Y2014010014)。
薛艳(1982-),女,医学硕士,主治医师,主要研究方向:各种类型病毒性肝炎,脂肪性肝病,药物性肝病,自身免疫性肝病等。E-mail: yoyoxue820308@126.com
王磊(1962-),男,医学博士,主任医师,主要研究方向:各种类型病毒性肝炎,脂肪性肝病,药物性肝病,自身免疫性肝病等。E-mail: wlcrb@sdu.edu.cn
10.3969/j.issn.1002-266X.2017.40.001
R512.6
A
1002-266X(2017)40-0001-04
2017-04-09)
