自然微生物挂膜处理水产养殖废水的效果及微生物群落分析
2017-11-29蔺凌云尹文林潘晓艺袁雪梅姚嘉赟沈锦玉
蔺凌云 尹文林 潘晓艺 袁雪梅 姚嘉赟 徐 洋 王 超 沈锦玉
(浙江省淡水水产研究所, 湖州 313001)
自然微生物挂膜处理水产养殖废水的效果及微生物群落分析
蔺凌云 尹文林 潘晓艺 袁雪梅 姚嘉赟 徐 洋 王 超 沈锦玉
(浙江省淡水水产研究所, 湖州 313001)
以弹性填料和流化床填料为硝化反应的生物挂膜材料, 聚羟基丁酸/戊酸共聚酯(PHBV)为反硝化反应的碳源和生物膜载体, 通过微生物自然挂膜处理低C/N比水产养殖废水, 去除水体中的氨氮、亚硝酸盐氮及总氮。应用Miseq高通量测序技术对生物膜的微生物群落组成和结构进行分析。结果表明: 温度25—30℃, 该处理系统首次挂膜成功需要4周, 启动后运行稳定, 对2种不同来源和氮污染程度的养殖废水均有较好的脱氮效果, 氨氮、亚硝酸盐氮及总氮的去除率均在90%以上。硝化生物膜(a)的优势菌分别归属变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。反硝化生物膜(b)微生物群落的多样性指数和丰度指数均远大于前者, 主要为变形菌门、厚壁菌门、拟杆菌门、螺旋体门(Spirochaetae)及绿菌门(Chlorobi)。其中, 归属于变形菌门β-变形菌纲(Betaproteobacteria)的丛毛单胞菌科(Comamonadaceae)和红环菌科(Rhodocyclaceae)在2种生物膜中占比均较高。由于所处环境(载体, 碳源、溶氧等)不同, 在属分类水平上,2种生物膜的细菌群落结构表现出明显差异。生物膜a中属的种类仅为b的三分之二, 相对丰度>0.5%的优势菌属, a为8个, b为18个。其中, 隶属丛毛单胞菌科和红环菌科未知属的优势种群分别占到a、b总序列数的56.67%和45.51%。磁螺菌属(Magnetospirillum)和硝化螺菌属(Nitrospira)是a中特有的优势功能菌群, 梭菌属(Clostridium)、动胶菌属(Zoogloea)、管道杆菌属(Cloacibacterium)、脱硫弧菌属(Desulfovibrio)等具有反硝化功能的菌群为b的优势菌属。
生物填料; PHBV; 养殖废水; 生物膜; 微生物群落
随着集约化水产养殖业的发展, 氮污染物的大量排放对人体健康及周围的水域环境都产生了较大的危害。因此, 养殖废水的脱氮处理受到广泛关注。生物脱氮法相比物理化学法, 具有费用低、不易产生二次污染、不破坏养殖生态平衡等优点, 是养殖废水处理及循环养殖中去除氮素污染最有效的方法之一。目前, 以传统硝化/反硝化为核心的生物脱氮工艺已经在水处理工程中广泛应用[1,2]。然而, 水产养殖废水中碳氮比(C/N, C以COD计)普遍较低, 特别是温室甲鱼养殖废水, 70%以上的水样C/N比小于2[3]。实现完全反硝化脱氮的理论C/N比值为2.86 kg COD/kg N, 结合微生物的生长, 实际所需值通常为4.2 kg COD/kg N[4]。有研究表明, 当COD/TN小于5时, 氮素的去除效率将明显降低[5]。因此, 针对低C/N比的废水, 一般需要外加碳源以保证其高效的脱氮效果。甲醇、乙醇、乙酸、葡萄糖是最常用的碳源[6—9], 不仅需要经常添加, 而且容易出现投加不足或者过量, 为系统的稳定运行及维护带来不小的麻烦。因此人们倾向于使用固相碳源, 尽管天然固相碳源物质, 如秸秆、树皮、芦苇、棉纤维、贝壳等价格低廉, 但这些物质降解产生大量的氨, 且容易导致出水颜色加深[10—14]。与此同时, 可生物降解的高分子固相碳源, 如聚羟基脂肪酸酯(PHAs)、聚乳酸(PLA)、聚己内酯(PCL)、聚β-羟基丁酸/戊酸酯共聚物(PHBV)等以其操作方便易于维护、效果稳定, 无二次污染等优势备受青睐[15—18]。
有研究证明, 增加硝化细菌的数量或延长水力停留时间是加快硝化反应的重要措施之一。目前主要通过添加填料的方法, 使硝化细菌附着于填料表面, 以促进其富集生长。沸石颗粒、活性炭、弹性填料、聚乙烯小球等都成功用作硝化细菌的挂膜材料[20], 填料的添加不仅加快了系统的启动, 同时极大地提高了脱氮性能。
生物脱氮是通过生物膜中微生物的代谢活动来实现的, 微生物群落的结构及多样性与脱氮效果有直接关系[20]。研究发现, 不同处理系统和不同的运行参数都会造成微生物群落结构的显著差异。金浩等[21]对污水处理活性污泥的细菌群落进行了分析, 变形菌门占细菌总数的91.9%, 其他优势菌门为厚壁菌门、拟杆菌门、硝化螺菌门(Nitrospirae)和绿弯菌门(Chloroflexi), 其中明显的优势菌群为产碱菌属(Alcaligenes)、假单胞菌属(Pseudomonas)和寡养单胞菌属(Stenotrophomonas)。Ma等[22]利用高通量测序技术考察了9个焦化废水处理厂的微生物群落特征, 结果表明, 硫杆菌属(Thiobacillus)、丛毛单胞菌属(Comamonas)、索氏菌属(Thauera)、固氮弯曲菌属(Azoarcus)及红游动菌属(Rhodoplanes)是至少6个处理厂的优势菌属。而其他出现在城市生活污水处理厂的核心菌属, 如动胶菌属(Zoogloea), 突柄杆菌属(Prosthecobacter)等在焦化废水处理反应器中占比很低。徐影等[23]的研究发现, 固体碳源表面生物膜中的主要微生物均为革兰氏阴性, 包括有益杆菌属(Diaphorobacter)、食酸菌属(Acidovorax)、红长命菌属(Rubrivivax)、固氮螺形菌属(Azospira)、热单胞菌属(Thermomonas)和德沃斯氏菌属(Devosia), 它们分别属于变形菌门的α-, β-和γ-变形菌纲, 其中有益杆菌属为反应器稳定运行期生物膜中丰度最高的菌群。
目前, 国内外已有很多关于生物膜微生物群落的研究, 特别是利用固相碳源为载体的反硝化处理中。研究的方法既有纯培养技术[24], 又有分子生态学技术, 如16S rRNA文库序列分析[21,25]、荧光原位杂交技术(FISH)[26]、变性梯度凝胶电泳(PCRDGGE)[23], 高通量测序等[27]。其中高通量测序技术以其高分辨率、高速、分析结果准确等特点, 被广泛应用于污水处理、土壤及人类肠道等各种环境样本中微生物群落结构和多样性研究[27—30]。
本试验采用生物膜法, 以弹性填料及流化床填料为硝化挂膜材料, 以PHBV同时作为反硝化碳源和生物膜载体, 对养殖废水的脱氮效果进行了研究。试验装置分为硝化和反硝化两个功能区, 使养殖废水的硝化及反硝化在同一系统中得以高效进行。硝化功能区持续曝气, 为硝化细菌的富集和代谢提供充足的氧气; 反硝化功能区保持微溶氧环境以利于反硝化细菌的生长及脱氮。并利用Miseq高通量测序技术对挂膜成熟阶段生物膜微生物的组成和群落结构及多样性进行分析, 以期为脱氮机理的研究、微生态制剂的研发及挂膜材料的优选等提供理论依据。
1 材料与方法
1.1 试验材料
硝化挂膜材料: 弹性填料(单元直径15 cm, 中心一根尼龙绳, 周围呈毛刷状, 图1a1)和流化床填料(为聚丙烯空心填料, 内外共有三层空心圆, 外径2.5 cm, 图1a2)。反硝化碳源及挂膜材料: PHBV颗粒(圆柱形, 平均高度0.32 cm, 平均截面直径为0.31 cm, 图1b)。
1.2 试验装置及运行

图1 本试验中使用的挂膜材料(a1-弹性填料, a2-流化床填料, b-PHBV)Fig. 1 The biofilm carriers used in this experiment (a1-elastic filler, a2-fluidized bed packing materials, b-PHBV)
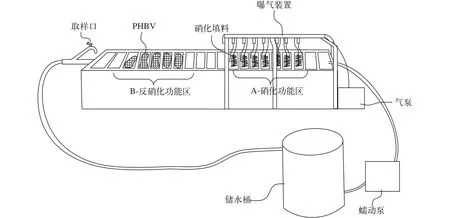
图2 养殖废水处理装置Fig. 2 The experimental set-up for aquaculture wastewater treatment
养殖废水处理试验装置如图2, 分为A、B两段。A段, 又称为硝化功能区。安装有通气设施,24h曝气, 每格悬挂弹性填料1根, 流化床填料30个。B段, 又称反硝化功能区。本区针对淡水集约化养殖废水中C/N普遍较低, 不利于反硝化脱氮的情况, 特别添加了固相碳源-有机高分子聚合物PHBV 3.0 kg。PHBV分装于小网袋投放至反硝化功能区。废水经储水桶首先进入A段, 经栅格上端的缺口进入下一格, 再由此格底部的开口流出, 如此流入流出, 大大增加了水流长度和水处理的作用时间。最后, 由B末端出水口的管道排到储水桶, 再经水泵将其抽至A段进行循环处理。设备总载水量75 L, 挂膜阶段水泵调节为24h循环1次, 系统正启动后为每8h循环1次。
首先, 在废水处理装置中注入温室甲鱼养殖废水, 室温(25—30℃)条件下进行自然微生物挂膜, 每3d更换一半的养殖废水, 隔天取水样检测NH3-N、NO2-N、TN及pH。待出水水质稳定后, 标志着挂膜基本完成。此后, 系统正式启动, 分别以甲鱼和南美白对虾养殖废水为处理对象进行试验。甲鱼废水处理结束, 将水排空, 自来水在系统内循环一次后排出, 然后在储水桶内加入南美白对虾养殖废水。甲鱼及南美白对虾养殖废水在系统内的循环时间(HRT)分别为4d和2d。
1.3 样品采集及水质指标分析方法
试验运行期间, 定期(挂膜阶段隔天取样, 正式运行阶段每12h取样)从取样口采集水样, 水样经0.45 μm滤膜过滤后分别对NH4-N、NO2-N、TN、pH进行测定。NH4-N和NO2-N分别采用纳氏分光光度法和N-(1-萘基)-乙二胺分光光度法, 参照《水和废水监测分析方法》[31], 分光光度计采用VARIAN cary 50 Bio。TN采用HACH公司的总氮测定试剂盒, 样品消解器HACH DRB200, 吸光度及浓度测定HACH DR2800。pH采用哈希便携式pH/溶氧计测定。水质数据分析及作图采用Excel软件。
1.4 微生物群落结构分析
在挂膜完成后, 分别取硝化及反硝化挂膜材料,超声波(15min, 2 kw/h, 40 kHz)分离载体表面的生物膜, 悬液离心(13000 r/min, 20min)取沉淀, 即为生物膜样品。生物膜DNA的提取采用水样基因组DNA快速提取试剂盒(离心柱形, BioTeke)。提取的DNA采用1%琼脂糖凝胶电泳进行检测, 并用核酸蛋白测定仪(NanoDrop 2000)测定DNA的质量和浓度。PCR扩增16S rRNA的V4+V5区[32], 引物序列515F: 5′-GTGCCAGCMGCCGCGG-3′; 907R: 5′-CCGTCAATTCMTTTRAGTTT-3′。PCR采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase。反应体系: 5×FastPfu Buffer 4 μL, 2.5 mmol/L dNTPs 2 μL, Forward Primer (5 μmol/L) 0.8 μL, Reverse Primer(5 μmol/L) 0.8 μL, FastPfu Polymerase 0.4 μL, Template DNA 10 ng, 补充ddH2O至20 μL。PCR仪: ABI GeneAmp® 9700型。反应程序: 95℃预变性3min, 95℃变性30s, 55℃退火30s, 72℃延伸45s, 27个循环, 最后72℃延伸10min。用AXYGEN凝胶回收试剂盒切胶回收PCR产物, 2%琼脂糖电泳检测, 将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司, 美国)检测定量, 之后按照每个样本的测序量要求, 进行相应比例的混合,构建基因文库。高通量测序平台为Illumina Miseq PE250, 测序得到的PE reads首先根据overlap关系进行拼接, 同时对序列质量进行质控和过滤, 区分样本后进行OUT聚类分析和物种分类学分析。OUT聚类利用MOTHUR软件(版本1.30.1), 聚类相似性为97%, 计算样本Chao丰度指数、Shannon多样性指数及测序深度指数。根据SILVA106库中的参考序列对OUT进行分类学分析。分别在各个分类水平: domain(域)、phylum(门)、class(纲)、order(目)、family(科)、genus(属)、species(种)统计各样本的群落组成, 并应用Excel软件作图对样品的群落结构进行分析。
2 结果
2.1 自然微生物膜的形成及水质指标变化
温室甲鱼养殖废水在系统内循环运行约4周之后, 水体的NH4-N、NO2-N、TN及pH分别稳定在1.0—1.4、0.05—0.07和12—15 mg/L, pH为7.4—7.6。观察装置内硝化及反硝化挂膜材料的表面均有一层薄膜覆盖。如图3所示, 为生物膜形成阶段, 养殖废水NH4-N、NO2-N、TN及pH的变化。TN在第20天出现明显的下降, 30d后出水TN小于15.0 mg/L。NH4-N在1—6d呈明显下降趋势, 7d后略有上升, 总体平稳直至挂膜最后阶段(第26天)又迅速降至1.4 mg/L以下, 前期NH4-N去除率高于后期。NO2-N则先升高后降低, 在第6天达到最大(54.2 mg/L), 并有一段时间的积累, 随后逐渐降低,22d后降至0.7 mg/L, 并最终维持在0.05 mg/L左右。脱氮过程中, pH先降低后升高, pH最低为5.6,大约在16d后趋于稳定, 出水pH约为7.5, 略高于进水(pH=7.2)。
2.2 自然微生物挂膜法对养殖废水的脱氮效果
在挂膜完成后, 分别对甲鱼和南美白对虾养殖废水进行处理, 废水中NH4-N、NO2-N、TN及pH等指标的变化趋势与挂膜阶段相似, NH4-N和TN逐渐降低, NO2-N先增加后降低, 最终均获得了良好的氮素去除效果。pH则先降后升, 维持在6—8。如图4所示, 甲鱼养殖废水在96h后, 其NH4-N、NO2-N、TN分别由初始的48.04、1.68、128.0 mg/L将至1.20、0.05和2.0 mg/L。氨氮、亚硝氮及总氮的去除率分别为97.58%、97.02%和98.43%。如图5所示,南美白对虾养殖废水经过48h的净化处理, 其NH4-N、NO2-N、TN分别有初始的2.46、1.43、12.5 mg/L将至0.36、0.02和1.20 mg/L。氨氮、亚硝氮及总氮的去除率分别为90.24%、98.60%和90.40%。
2.3 微生物多样性和分类学分析

图3 自然微生物挂膜阶段养殖废水NH4-N、NO2-N、TN及pH变化Fig. 3 Changes of aquaculture wastewater NH4-N, NO2-N, TN and pH during cultivation of biofilm
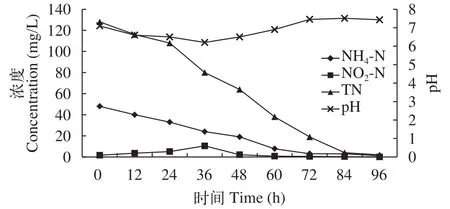
图4 甲鱼养殖废水NH4-N、NO2-N、TN及pH变化Fig. 4 Changes of Chinese turtle aquaculture effluent NH4-N,NO2-N, TN and pH
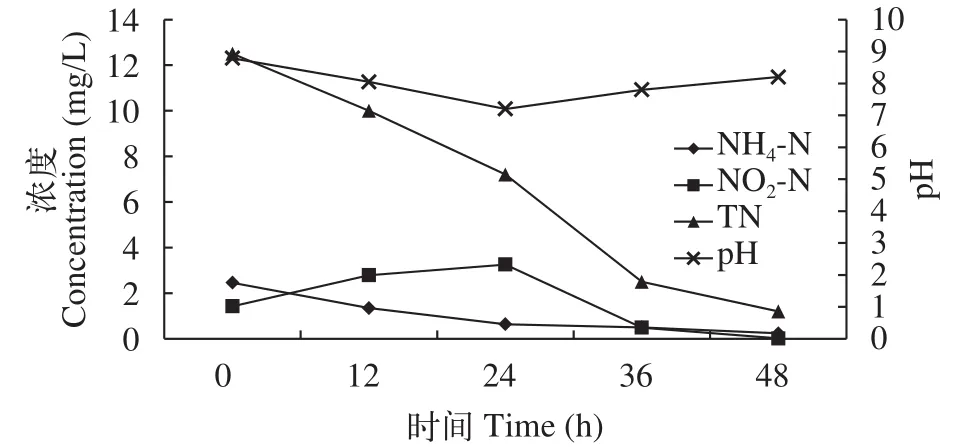
图5 南美白对虾养殖废水NH4-N、NO2-N、TN及pH变化Fig. 5 Changes of Penaeus vannmei aquaculture wastewater NH4-N, NO2-N, TN and pH
通过对两组样品-弹性填料及流化床填料生物膜样品a和PHBV生物膜样品b 16S rRNA基因文库进行Miseq高通量测序, 经修剪、去杂后, a与b各获得28150和25373条优化序列, 序列平均长度为400 bp。将优化序列提取非重序列、去除没有重复的序列, 抽平后, 与SILVA106库比对进行聚类, a与b在 97%相似性下分别获得了121和198个OTUs, 样品的稀释曲线如图6所示, 可知测序数据量在20000条以上时, 曲线趋于平坦, 说明本研究测序数据量合理, 足以覆盖样本中绝大多数细菌。2个样本的测序深度都大于0.99, 即样本OTU可以有效表征样本中细菌种群。由图6和表1均可以看出, b样本的细菌丰度指数及多样性指数均高于样本a。
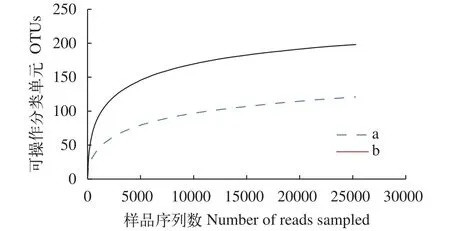
图6 样品的稀释曲线Fig. 6 Dilution curve of samples

表1 生物膜样品中细菌的丰度及多样性指数Tab. 1 Richness and diversity indexes of bio-film samples(α=0.03)
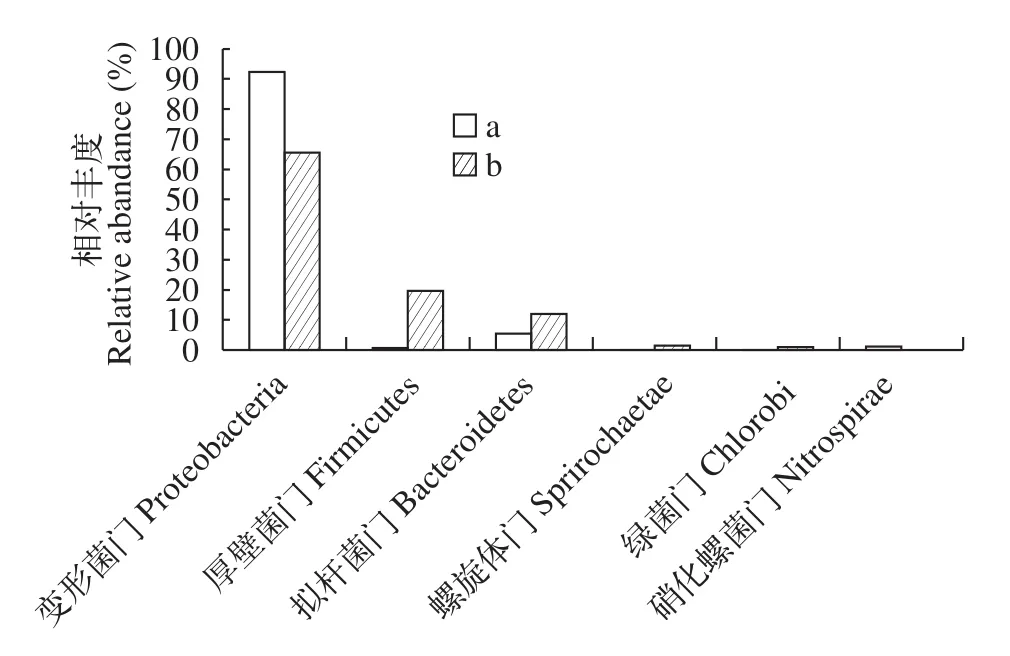
图7 细菌群落结构分布(分类到门)Fig. 7 Bacterial communities at phylum level
经过物种注释, 在门分类水平上, 生物膜样品a、b共划分为15个已知菌门, 占全部测序序列数的99.21%。图7为a、b样品在门分类水平上(>1%)的细菌群落结构。变形菌门是a和b中最主要的菌门,在a样品中为93.26%, b中为65.68%。变形菌门中,β-变形菌纲是最大的优势菌纲, a、b中的比例分别为69.05%和57.99%。其次是α-变形菌纲(a=23.60%,b=2.59%)、γ-变形菌纲(a=0.40%, b=2.95%)、δ-变形菌纲(a=0.20%, b=2.14%)。其他优势菌门依次为:厚壁菌门、拟杆菌门、螺旋体门和绿菌门。虽然这些门在2种生物膜样品中均有鉴定, 但在b中的占比远高于a。仅硝化螺菌门是a中特有的优势种群。
在科分类水平上, 2个样品总共有88个分类单元被鉴定, 样品a分属63科, 其中有36个已知菌科,占全部序列数的96.32%。其优势菌科为丛毛单胞菌科(50.98%), 红螺菌科(Rhodospirillaceae, 23.37%)、红环菌科(16.26%)、黄杆菌科(Flavobacteriaceae,2.50%)、硝化螺菌科(Nitrospiraceae, 0.96%)、亚硝化单胞菌科(Nitrosomonadaceae, 0.50%); 样品b分属83科, 其中有 43个已知菌科, 占全部序列数的92.10%。其优势菌科为丛毛单胞菌科(36.56%)、红环菌科(20.92%)、梭菌科(Clostridiaceae_1,15.06%)、黄杆菌科(3.64%)、黄单胞菌科(Xanthomonadaceae, 2.67%)、瘤胃菌科(Ruminococcaceae,2.24%)、脱硫弧菌科(Desulfovibrionaceae,1.86%)、红螺菌科(1.56%)、螺旋体科(Spirochaetaceae, 1.39%)、韦荣氏球菌科(Veillonellaceae,0.98%)、冷形菌科(Cryomorphaceae, 0.96%)。丛毛单胞菌科、红螺菌科、红环菌科及黄杆菌科为a、b的共同优势菌科, 这些细菌绝大多数为好氧或兼性厌氧的异养菌, 具有较强的适应性。梭菌科、黄单胞菌科、瘤胃球菌科、脱硫弧菌科、螺旋体科、韦荣氏球菌科、冷形菌科则为生物膜b中特有的优势菌群。
在属分类水平上, a样品中共有84个分类单元被注释, 已知属35个, 仅占全部序列数的32.25%, 大量的序列不能归入已知属(数据库分别以科的名称加_uncultured、_ norank、_unclassified来表示)。如图8所示, 8个优势菌群(相对丰度>0.5%)约占总序列的86.87%, 依次为Comamonadaceae_unclassified(50.36%)、磁螺菌属(23.35%)、Rhodocyclaceae_unclassified(6.31%)、黄杆菌属(Flavobacterium, 2.16%)、动胶菌属(1.72%)、嗜氢菌属(Hydrogenophaga, 1.09%)、水杆状菌属(Aquabacterium, 0.96)、硝化螺菌属(0.92%)。b样品中有126个分类单元被鉴定, 已知属56个, 仅占全部序列数的35.34%。图9为属分类水平b样品的优势菌群(相对丰度>0.5%), 18个优势菌属群约占总序列的84.74%。b中与反硝化有关的属包括:Comamonadaceae_unclassified(36.04%)、Rhodocyclaceae_unclassified(12.47%)、梭菌属(14.37%)、动胶菌属(8.05%)、管道杆菌属(2.82%)、脱硫弧菌属(1.86%)、热单胞菌属(1.15%)、黄杆菌属(0.81%)、嗜氢菌属(0.25%)、丛毛单胞菌属(0.24%)、脱氯单胞菌属(Dechloromonas, 0.14%), 这类细菌占样品总序列数的78.2%。
3 讨论
通过养殖废水中的土著微生物自然挂膜形成稳定而多样的微生物群落, 同时利用PHBV作为可释性碳源为反硝化脱氮提供电子, 可实现低C/N比水产养殖废水中氮素污染物的高效去除。本试验不同于之前直接以人工配置废水进行的脱氮处理,

图8 生物膜样品a中主要细菌分类组成(属水平)Fig. 8 Bacterial communities of biofilm sample a at genus level
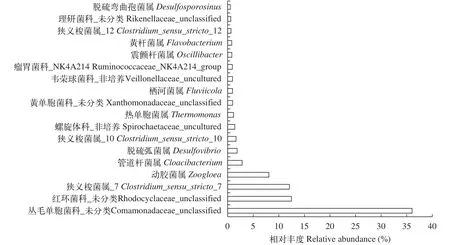
图9 生物膜样品b中主要细菌分类组成(属水平)Fig. 9 Bacterial communities of biofilm sample b at genus level
人工配置废水添加成分简单, 且往往只添加一种氮素污染物如硝酸盐[17,23,27,33]。本试验直接以氮素污染较严重的甲鱼养殖废水和相对较轻的南美白对虾养殖废水为脱氮处理的试验用水, 在同一反应器中实现了硝化与反硝化的同步进行, 其氨氮、亚硝酸盐氮及总氮的去除率均在90%以上。反应器的前端为硝化功能区, 添加弹性填料、流化床填料等为营附着性生长的硝化功能菌群提供有利生长条件, 通过这些细菌的转化作用, 氨氮在此首先被氧化为亚硝酸盐氮, 再进一步被氧化为硝酸盐氮。反硝化功能区与硝化功能区之间有多个小格, 其目的在于降低水中的溶氧, 水中的溶氧越低, PHBV上的生物膜越容易接近厌氧的微环境, 从而使得反硝化脱氮更彻底更高效, 期间观测到大量气泡产生, 进一步检测证实为N2。PHBV本质上是微生物的能源储备物质, 它具有较好的生物降解性, 在微生物酶的作用下而降解、释放碳源, 其降解速率可随环境的变化做出相应的调节, 不会因释放过量的有机碳而使水质恶化。使用时将其置于网袋中投入水体即可, 操作方便, 持久耐用。最大的不足是该材料价格昂贵, 在一定程度上限制了其推广应用。硝化反应产生酸, 而反硝化过程通常会产生碱度, 2个过程在一个反应系统内进行, 通过内部的循环维持酸碱度的平衡, 无需投加药剂调节pH。反应器中的功能微生物皆来自水产养殖废水, 并在添加了PHBV后, 形成了新的稳定微生物群落结构。因此,对不同氮负荷的养殖废水均有较好的去除效果。
微生物群落是生物填料及固相反硝化工艺实现氮素转化及去除的决定性因素。本研究借助Miseq高通量测序分析了弹性填料及流化床填料生物膜样品a和PHBV生物膜样品b的细菌群落结构。生物膜a的优势菌为变形菌门的β-、α-、γ-变形菌纲; 拟杆菌门的黄杆菌纲(Flavobacteria)和鞘氨醇杆菌纲(Sphingobacteria), 这与李秋芬等[34]的研究相似。根据已有的研究报道[35,36], 参与硝化过程的细菌, 如氨氧化细菌(Ammonia-oxidizing bacteria,AOB)及硝化细菌(Nitrite-oxidizing bacteria, NOB),以及将有机氮转化为氨态氮的氨化细菌等, 大部分种类也都属于变形菌门。另外, a中还鉴定出了硝化螺菌属, 它与β变形菌纲的亚硝化单胞菌属是废水处理中最常见的硝化功能菌群, 共同完成氨态氮到亚硝态氮及硝态氮的转化。然而, 在生物膜样品a中, 功能菌群亚硝化单胞菌及硝化螺菌的丰度远低于其他优势菌, 其原因可能是, 绝大部分种类的硝化细菌皆为专性化能自养菌, 好氧性强, 底物要求专一性高, 且对环境因子极为敏感, 平均世代周期一般都在10h以上, 生长缓慢。
由表1及图6—10均可以看出, 生物膜b上的细菌群落, 无论是其丰度指数, 还是多样性指数均显著高于生物膜a。b中细菌主要归属于变形菌门、厚壁菌门、拟杆菌门、螺旋体门和绿菌门, 其菌群结构组成与其他生物反硝化脱氮的研究结果[17,21,22,27,33,37]基本一致。变形菌门是反硝化过程中最主要的优势菌群[16, 17, 21—23, 27, 33, 37, 38], 大部分能够利用PHBV的反硝化菌都是β-变形菌纲的成员, 其中以丛毛单胞菌科丰度最高[15—18]。这均与本试验生物膜样品b的微生物群落结构基本符合, b中变形菌门的比例为65.65%, 变形菌门里88.61%为β-变形菌纲, 丛毛单胞菌科又占到了β-变形菌纲63.24%。有研究表明[17,23,24,33,38,39], 生物膜中与反硝化有关的主要菌属包括有益杆菌属、食酸菌属、丛毛单胞菌属、嗜氢菌属、脱硫弧菌属、脱氯单胞菌属、假单胞菌属、黄杆菌属、梭菌属、热单胞菌属、产碱菌属及动胶菌属等。这些种类的细菌在b中多有发现, 占样品总序列数的78.2%, 是水体中氮素污染物去除的主力军。
此外, 在属的分类水平上, 2种生物膜样品均有大量序列不能归入已知的属, a中有67.75%, b中有64.66%, 以丛毛单胞菌科和红环菌科的种类最多。这些序列与数据库中的参考序列进行比对后, 根据置信度阈值的筛选, 在属的分类级别分值较低, 统计时以Unclassified标记, 例如Comamonadaceae_unclassified、Rhodocyclaceae_unclassified, 在a、b总序列数中分别占50.36%、36.04%和6.31%、12.47%。推测可能是尚未鉴定的新属, 有研究指出[22], 细菌群落组成中一些不能鉴别或未培养的细菌, 可能在污染物去除过程中发挥重要的作用。这些未知细菌和水质净化能力的关联, 有待进一步研究。
[1]Ravnjak M, Vrtovšek J, Pintar A. Denitrification of drinking water in a two-stage biofilm membrane bioreactor [J].Desalination and Water Treatment, 2013, 51(28-30):5402—5408
[2]Sun S P, Nacher N P I, Merkey B,et al. Effective biological nitrogen removal treatment processes for domestic wastewaters with low C/N ratios: a review [J].Environmental Engineering Science, 2010, 27(2): 111—126
[3]Chen C J. Study on anammox treatment of turtle aquaculture wastewater and its microbial mechanism [D]. PhD dissertation. Zhejiang University, Hangzhou. 2012 [陈重军. 甲鱼养殖废水厌氧氨氧化处理及其微生物机理研究. 博士学位论文, 浙江大学, 杭州. 2012]
[4]Henze M. Capabilities of biological nitrogen removal processes from wastewater [J].Water Science and Technology, 1991(4—6): 669—679
[5]Wu C Y, Peng Y Z, Peng Y. Biological nutrient removal in A2O process when treating low C/N ratio domestic wastewater [J].Journal of Chemical Industry and Engineering (China), 2008, 59(12): 3126—3131 [吴昌永, 彭永臻, 彭轶. A2O工艺处理低C/N比生活污水的试验研究. 化工学报, 2008, 59(12): 3126—3131]
[6]Wang S Y, Yin F F, Hou H X,et al. Biological denitrification with methanol as external carbon source [J].Journal of Beijing University of Technology, 2009, 35(11):1521—1526 [王淑莹, 殷芳芳, 侯红勋, 等. 以甲醇作为外碳源的生物反硝化. 北京工业大学学报, 2009,35(11): 1521—1526]
[7]Delanghe B, Nakamura F, Myoga H,et al. Drinking water denitrification in a membrane bioreactor [J].Water Science and Technology, 1994, 30(6): 157—160
[8]Li H J, Chen Y G, Gu G W. Effect of propionic to acetic acid ratio on biological nitrogen and phosphorus removal with low energy consumption [J].China Environmental Science, 2008, 28(8): 673—678 [李洪静, 陈银广, 顾国维. 丙酸/乙酸对低能耗生物除磷脱氮系统的影响. 中国环境科学, 2008, 28(8): 673—678]
[9]Bill K A, Bott C B, Murthy S N. Evaluation of alternative electron donors for denitrifying moving bed biofilm reactors (MBBRs) [J].Water Science amp; Technology,2009, 60(10): 2647—2657
[10]Aslan S, Türkman A. Combined biological removal of nitrate and pesticides using wheat straw as substrates [J].Process Biochemistry, 2005, 40(2): 935—943
[11]Trois C, Pisano G, Oxarango L. Alternative solutions for the biodenitrification of landfill leachates using pine bark and compost [J].Journal of Hazardous Materials, 2010,178(1—3): 1100—1105
[12]Ovez B. Batch biological denitrification usingArundo donax,Glycyrrhiza glabra, andGracilaria verrucosaascarbon source [J].Process Biochemistry, 2006, 41(6):1289—1295
[13]Fang J Z, Xu C Y, Norio O. Denitrification of groundwater using cotton as energy source [J].Water Science amp;Technology, 1996, 34(1—2): 379—385
[14]Robinson-Lora M A, Brennan R A. The use of crab-shell chitin for biological denitrification: batch and column tests [J].Bioresource Technology, 2009, 100(2):534—541
[15]Hiraishi A, Khan S T. Application of polyhydroxyalkanoates for denitrification in water and wastewater treatment [J].Applied Microbiology and Biotechnology, 2003, 61(2): 103—109
[16]Takahashi M, Yamada T, Tanno M,et al. Nitrate removal efficiency and bacterial community dynamics in denitrification processes using poly (L-lactic acid) as the solid substrate [J].Microbes and Environments, 2010,26(3): 212—219
[17]Chu L B, Wang J L. Denitrification performance and biofilm characteristics using biodegradable polymers PCL as carriers and carbon source [J].Chemosphere, 2013,91(9): 1310—1316
[18]Khan S T, Horiba Y, Takahashi N,et al. Activity and community composition of denitrifying bacteria in poly(3-hydroxybutyrate-co-3-hydroxyvalerate)-using solidphage denitrification processes [J].Microbes and Environments, 2007, 22(1): 20—31
[19]Wang W, Qu K M, Wang H Z,et al. Preliminary study on the biofilm cultivation and the dissolved inorganic nitrogen-removing efficiency with three filtering stuff under different hydraulic loadings [J].Journal of Safety and Environment, 2012, 12(1): 66—71 [王威, 曲克明, 王海増,等. 水利负荷对3种滤料生物挂膜和溶解无机氮去除效果的初步研究. 安全与环境学报, 2012, 12(1): 66—71]
[20]Zhang L Y, Rao B Q, Xiong Y,et al. The micobial mechanism of horizonal constructed wetland used to treated Black-odor River [J].Acta Hydrobiologica Sinica, 2010,34(2): 256—261 [张列宇, 饶本强, 熊瑛, 等. 人工湿地黑臭水体处理系统微生物脱氮机理研究. 水生生物学报,2010, 34(2): 256—261]
[21]Jin H, Li B L, Ou J,et al. Microbial population diversity of activated sludge for wastewater treatment [J].Journal of Microbiology, 2012, 32(4): 1—5 [金浩, 李柏林, 欧杰,等. 污水处理活性污泥微生物群落多样性研究. 微生物学杂志, 2012, 32(4): 1—5]
[22]Ma Q, Qu Y Y, Shen W L,et al. Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing [J].Bioresource Technology, 2015, 179:436—443
[23]Xu Y, Qiu T L, Han M L,et al. Analysis on microbial community in biofilm coating onto solid carbon source using the PCR-DGGE technique [J].Environmental Sci-ence, 2013, 34(8): 3257—3263 [徐影, 仇天雷, 韩梅琳,等. PCR-DGGE技术解析固体碳源表面生物膜的微生物群落结构. 环境科学, 2013, 34(8): 3257—3263]
[24]Mergaert J, Boley A, Cnockaert M C,et al. Identity and potential functions of heterotrophic bacterial isolates from a continuous-upflow fixed-bed reactor for denitrification of drinking water with bacterial polyester as source of carbon and electron donor [J].Systematic and Applied Microbiology, 2001, 24(2): 303—310
[25]Wang C, Xie B, Han L, Xu X F. Study of anaerobic ammonium oxidation bacterial community in the aged refuse bioreactor with 16S rRNA gene library technique [J].Bioresource Technology, 2013, 145(4): 65—70
[26]Horiba Y, Khan S T, Hiraishi A. Characterization of the microbial community and culturable denitrifying bacteria in a solid-phase denitrification process using poly (εcaprolactone) as the carbon and energy source [J].Microbes and Environments, 2005, 20(1): 25—33
[27]Shen Z Q, Zhou Y X, Wang J L. Comparison of denitrification performance and microbial diversity using starch/polylactic acid blends and ethanol as electron donor for nitrate removal [J].Bioresource Technology,2013, 131(3): 33—39
[28]Mclellan S L, Huse S M, Mueller-Spitz S R,et al. Diversity and population structure of sewage derived microorganisms in wastewater treatment plant influent [J].Environmental Microbiology, 2010, 12(2): 378—392
[29]Roesch L F, Fulthorpe R R, Riva A,et al. Pyrosequencing enumerates and contrasts soil microbial diversity [J].The International Society for Microbial Ecology, 2007,1(4): 283—290
[30]Andersson A F, Lindberg M, Jakobsson H,et al. Comparative analysis of human gut microbiotaby barcoded pyrosequencing [J].PLoS One, 2008, 3(7): 2836—2843
[31]State Environmental Protection Administration. Water and Wastewater Monitoring Analysis Method (4th edition) [M]. Beijing: China Environmental Press. 2002,271—281 [国家环保总局. 水和废水监测分析方法 (第四版). 北京: 中国环境出版社. 2002, 271—281]
[32]Xiong J B, Liu Y Q, Lin X G,et al. Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau [J].Environmental Microbiology, 2012, 14(9): 2547—2466
[33]Shen Z Q, Zhou Y X, Hu J,et al. Denitrification performance and microbial diversity in a packed-bed bioreactor using biodegradable polymer as carbon source and biofilm support [J].Journal of Hazardous Materials,2013, 250—251: 431—438
[34]Li Q F, Fu X J, Zhang Y,et al. PCR-DGGE analysis of bacterial communities in bio-filtors of re-circulating mariculture system [J].Journal of Fisheries of China, 2011,35(4): 579—586 [李秋芬, 傅雪军, 张艳, 等. 循环水养殖系统生物滤池细菌群落PCR-DGGE分析. 水产学报,2011, 35(4): 579—586]
[35]Staley J T, Bryant M P, Pfennig N,et al. Bergey’s Manual of Systematic Bacteriology [M]. Baltimore: Williams amp;Wilkins, 2001, 1807—1835
[36]Ma Y, Qian L M, Wang Y S,et al. Progress in molecular ecology of nitrifying bacteria [J].Journal of Fishery Science of China, 2007, 14(5): 872—879 [马英, 钱鲁闽, 王永胜, 等. 硝化细菌分子生态学研究进展. 中国水产科学, 2007, 14(5): 872—879]
[37]Ye L, Shao M F, Zhang T,et al. Analysis of the bacterial community in a laboratory-scale nitrification reactor and a wastewater treatment plant by 454-pyrosequencing [J].Water Research, 2011, 45(45): 4390—4398
[38]Zhang L H, Liu L L, Qiu T L,et al. Nitrate removal from re-circulating aquaculture system using polyhydroxybutyrate-co-hydroxyvalerate as carbon source [J].Acta Microbiologica Sinica, 2014, 54(9): 1053—1062 [张兰河,刘丽丽, 仇天雷, 等. 以聚羟基丁酸戊酸共聚酯为碳源去除循环水养殖系统的硝酸盐及生物膜中微生物群落动态. 微生物学报, 2014, 54(9): 1053—1062]
[39]Shao Y Q, Chung B S, Lee S S,et al. Zoogloea caeni sp.nov., a floc-forming bacterium isolated from activated sludge [J].International Journal of Systematic and Evolutionary Microbiology, 2009, 59(3): 526—530
THE STUDY OF NATURAL BIOFILM FORMATION FOR NITROGEN REMOVAL FROM AQUACULTURE WASTEWATER AND ANALYSIS ON MICROBIAL COMMUNITY IN BIOFILM
LIN Ling-Yun, YIN Wen-Lin, PAN Xiao-Yi, YUAN Xue-Mei, YAO Jia-Yun, XU Yang,WANG Chao and SHEN Jin-Yu
(Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China)
This study was conducted to evaluate the applications of biological filter medias in low C/N ratio aquaculture wastewater. Elastic filler and fluidized bed packing materials were used as biofilm of nitration and PHBV (poly-3-hydroxybutyrate-co-3-hydroxyvalerate) were used as the carbon source and biofilm carrier of denitrification in this study. The water quality and the bacterial community compositions were determined by the method of Miseq highthroughput sequencing. The obtained results demonstrated that biofilm of the system formed after 4 weeks operation, at the temperature of 25—30℃. Our results also showed that the two kinds of media had great effects on removing total nitrogen (TN), ammonia nitrogen (NH3-N), nitrite (NO2-N). The removal rate of TN, NH3-N and NO2-N can reach up 90%. The sequencing results indicated that the predominant bacteria on the biofilm sample a coating onto elastic filler and fluidized bed packing materials were Proteobacteria, Bacteroidetes and Firmicutes. While the major microorganisms on the biofilm sample b attaching to the surface of PHBV granules were Proteobacteria, Firmicutes, Bacteroidetes, Spirochaetae and Chlorobi. The analysis revealed that both diversity index and abundance index of microbial community of biofilm sample b were far higher than the sample. Family of Comamonadaceae and Rhodocyclaceae belonging to Betaproteobacteria were highly enriched in both biofilms samples. However, there was a distinctive difference in phylotypes between the two biofilm samples at genus level, which was probably due to the diversities of biofilm carrier,carbon source and dissolved oxygen. The genera of biofilm sample a was only two thirds of b. A total of 8 and 18 genera with a relative abundance greater than 0.5% were identified from a and b, respectively. Among them, the unknown groups belonging to Comamonadaceae and Rhodocyclaceae accounted for 56.67% and 45.51% of the total sequence of a and b. Organisms from the genusMagnetospirillumandNitrospirawere only detected in a, while the genusClostridium,Zoogloea,Cloacibacterium,Desulfovibroetc were identified in b, which probably contributed to denitrification performance.
Biofilm carrier; PHBV; Aquaculture wastewater; Biofilm; Microbial community
Q938
A
1000-3207(2017)06-1327-09
2016-10-10;
2017-05-11
“十二五”农村领域国家科技计划课题(2015BAD13B04); 湖州市生态文明先行示范区科技专项重点项目(2014ZD2020)资助[Supported by National Science and Technology Project of the 12th Five-year Plan for Rural Areas (2015BAD13B04); Science and Technology Key Projects of Huzhou for Ecological Civilization Precede the Demonstration Area (2014ZD2020)]
蔺凌云(1984—), 女, 山东德州人; 硕士研究生; 主要研究方向为微生物学。E-mail: linly0531@163.com
沈锦玉, 研究员。E-mail: sjinyu@126.com
10.7541/2017.164
