PSMA6/PSMC6/PSMA3基因多态性与系统性红斑狼疮发病的相关性
2017-11-28刘兰婷宋继权欧运超
刘兰婷 王 玉 宋继权 裴 飒 欧运超
·论著·
PSMA6/PSMC6/PSMA3基因多态性与系统性红斑狼疮发病的相关性
刘兰婷1王 玉2宋继权1裴 飒1欧运超1
目的明确蛋白酶体(PSM)相关基因单核苷酸多态性与中国人群系统性红斑狼疮(SLE)的相关性。方法PCR扩增101例SLE患者和143名正常对照者外周血目的基因片段,通过二代测序对目的基因片段进行测序检测蛋白酶体20 s亚单位和相关ATP酶基因的4个目标位点PSMA6(rs2277460),PSMA3(rs2348071),PSMC6(rs2295826,rs2295827)的基因型及等位基因频率。结果SLE组及对照组中rs2277460(GG,GA、AA)基因型频率分别为97.22%,1.85%%,0.93%和96.5%,3.5%,0;rs2348071AA,AG,GG分别为30.56%、53.7%、15.74%和33.57%、50.35%、16.08%;rs2295826AA,AG,GG分别为75.93%、24.07%、0和69.23%、29.37%、1.4%;rs2295827CC、CT、TT分别为78.7%、19.45%、1.85%和76.22%、20.98%、2.8%,均无统计学差异(Pgt;0.05)。结论PSMA6/PSMC6/PSMA3 SNPs可能与SLE的发病无关。
系统性红斑狼疮; 蛋白酶体; ATP酶; 单核苷酸基因多态性
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种复杂的自身免疫性疾病,以产生非器官特异性的自身抗体,免疫复合物沉积及多系统损害为特征,具有多种临床表现[1]。其发病率约为(7.4~159.4)/10万人。该疾病常进行性加重,不能根治,预后不良,是危害健康的重要公共卫生问题,因此SLE发病机制的研究也是皮肤科疾病、代谢疾病、风湿疾病等领域研究的重点和难点。
SLE是一种高度遗传异质性疾病,其发病机制可以涉及细胞与体液免疫多个环节的异常。有证据表明泛素化在免疫应答的过程中发挥了重要作用[2]。在一些自身免疫性疾病及代谢性疾病中,均存在NF-kB通路的异常激活,以及前炎症因子的转录异常,已知泛素化NF-kB转录后调控的重要方式。其中,已证实编码泛素蛋白连接酶的基因UBC2L3在SLE中存在基因多态性[3]。有研究报道编码蛋白酶体的相关基因PSMA6/PSMA3/PSMC6与一些免疫性及代谢性疾病相关,例如多发性硬化(MS)、支气管哮喘(BA)、1型糖尿病等[4]。Alireza等证实在多发性硬化的患者中,可测得循环中蛋白酶体浓度显著升高[5]。但是目前尚没有研究表明蛋白酶体相关的基因多态性与SLE发病之间存在相关性。本文主要研究中国地区人群泛素-蛋白酶体系统(UPS)相关基因位点PSMA6(rs2277460),PSMA3(rs2348071),PSMC6(rs2295826,rs2295827)多态性与SLE的相关性,以探讨UPS在SLE发病过程中可能的作用机制。
1 材料与方法
1.1 研究对象 108例SLE女性患者资料均收集于2015年6月至2016年4月武汉大学中南医院和武汉大学人民医院门诊和住院患者,年龄中位数为38.5岁。所有患者均符合1997年美国风湿协会修订的SLE诊断标准[6]。对照组143名健康体检者来自武汉大学中南医院体检中心,年龄中位数为41岁,经实验室检查及问卷调查排除了SLE、干燥综合征、类风湿性关节炎、皮肌炎等自身免疫性疾病,且一,二,三级亲属中无SLE患者。所有受试者间均无血缘关系,且两组的年龄分布无统计学差异(Pgt;0.05)。本次实验通过了武汉大学中南医院伦理委员会的批准,所有实验受试者均签署了知情同意书。
1.2 仪器与试剂 5424台式离心机(Eppendorf公司);S1000 Thermal Cycler PCR仪(美国BIO-RAD公司);DYY-6C电泳仪(北京六一仪器厂);Tanon1600凝胶成像系统(上海天能科技有限公司);2xTsingKe Master Mix(北京擎科新业生物技术有限公司);血液基因组DNA提取试剂盒(天根生化科技有限公司,DP318;百泰克生物技术有限公司,DP6101)
1.3 实验方法 (1)采集受试者外周静脉血5 mL,保存于-4℃环境中。(2)采用血液DNA提取试剂盒提取DNA(苯酚-蛋白酶K法),采用紫外分光光度法测定DNA浓度,A260/A280gt;1.8,于-20℃保存。(3)PCR扩增目的基因,引物合成见表1。以下引物由武汉邦达生物科技有限公司合成。扩增条件为:94℃预变性3 min,94℃变性30 s,56℃退火30 s,72℃延伸30 s,循环35次,末次72℃延伸5 min。(4)琼脂糖凝胶电泳:将扩增的产物经2%的琼脂糖凝胶电泳,以验证扩增结果(图1)。(5)测序:由武汉邦达生物技术有限公司对PCR产物进行二代测序。(6)统计学方法:根据二代测序结果,利用直接计数法对基因型与等位基因频率进行统计,利用SPSS 17.0对实验组及对照组基因型频率及等位基因分布差异进行χ2检验,当Plt;0.05时,两组频数有统计学差异。
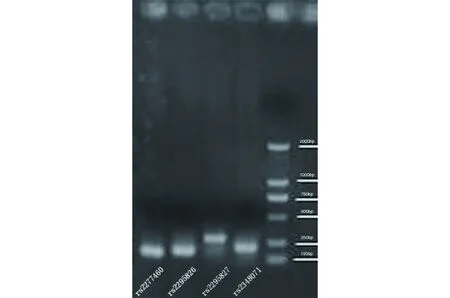
图1 rs2277460,rs2295826,rs2295827,rs2348071 (从左到右)PCR扩增产物的电泳图
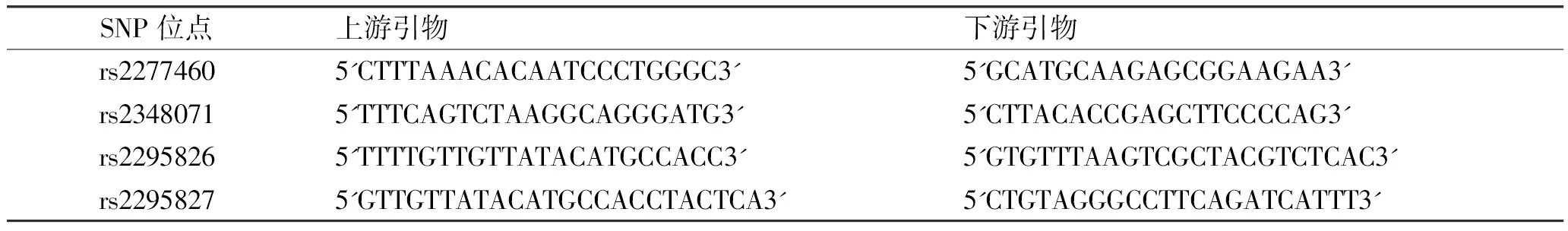
SNP位点上游引物下游引物rs22774605'CTTTAAACACAATCCCTGGGC3'5'GCATGCAAGAGCGGAAGAA3'rs23480715'TTTCAGTCTAAGGCAGGGATG3'5'CTTACACCGAGCTTCCCCAG3'rs22958265'TTTTGTTGTTATACATGCCACC3'5'GTGTTTAAGTCGCTACGTCTCAC3'rs22958275'GTTGTTATACATGCCACCTACTCA3'5'CTGTAGGGCCTTCAGATCATTT3'
2 结果
2.1 Hardy-Weinberg平衡检验 分别对实验组、对照组各基因型的频数及理论频数进行H-W平衡检验,四个位点在两组的分布均符合H-W平衡定律(Pgt;0.05),表明所选取的样品符合遗传平衡定律,可以代表总体人群。
2.2 基因型频率及等位基因频率(表2) PSMA6(rs2277460)GG,GA,AA基因型频率在SLE组与对照组中分别为97.22%,1.85%,0.93%和96.50%,3.50%,0,差异无统计学意义(Pgt;0.05),G,A等位基因频率在SLE组与对照组中分别为98.15%,1.85%和98.25%,1.75%,差异无统计学意义(Pgt;0.05);PSMA3(rs2348071)AA,AG,GG基因型频率在SLE组与对照组中分别为30.56%,53.70%,15.74%和33.57%,50.35%,16.08%,差异无统计学意义(Pgt;0.05),A,G等位基因频率在SLE组与对照组中分别为57.41%,42.59%和58.74%,41.26%,差异无统计学意义(Pgt;0.05);PSMC6(rs2295826)AA,AG,GG基因型频率在SLE组与对照组中分别为75.93%,24.07%,0和69.23%,29.37%,1.4%,差异无统计学意义(Pgt;0.05),A,G等位基因频率在SLE组与对照组中分别为87.96%,12.04%和83.92%,16.08%,差异无统计学意义(Pgt;0.05);PSMC6(rs2295827)CC,CT,TT基因型频率在SLE组与对照组中分别为78.70%,19.45%,1.85%和76.22%,20.98%,2.8%,差异无统计学意义(Pgt;0.05),C,T等位基因频率在SLE组与对照组中分别为88.43%,11.57%和86.71%,13.29%,差异无统计学意义(Pgt;0.05)
2.3 PSMA6(rs2277460),PSMA3(rs2348071),PSMC6(rs2295826,rs2295827)位点基因测序图 为进一步验证二代测序结果的准确性,随机选择SLE组4个位点的7各样本进行一代测序(图2~5)。
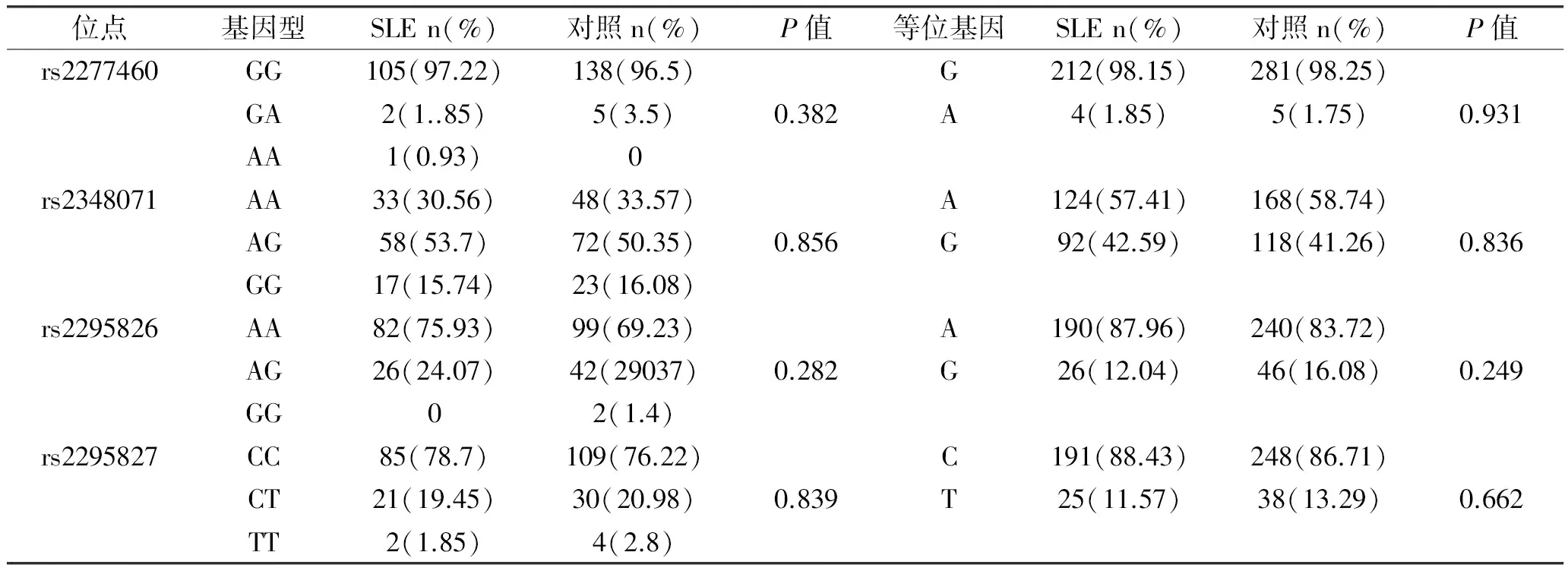
表2 PSMA6/PSMC6/PSMA3基因多态性在SLE患者和对照组的分布

图2 rs2277460位点,样品32(含G/A等位基因)的基因扩增产物测序图图3 rs2348071位点,样品46(含A/G等位基因)的基因扩增产物测序图
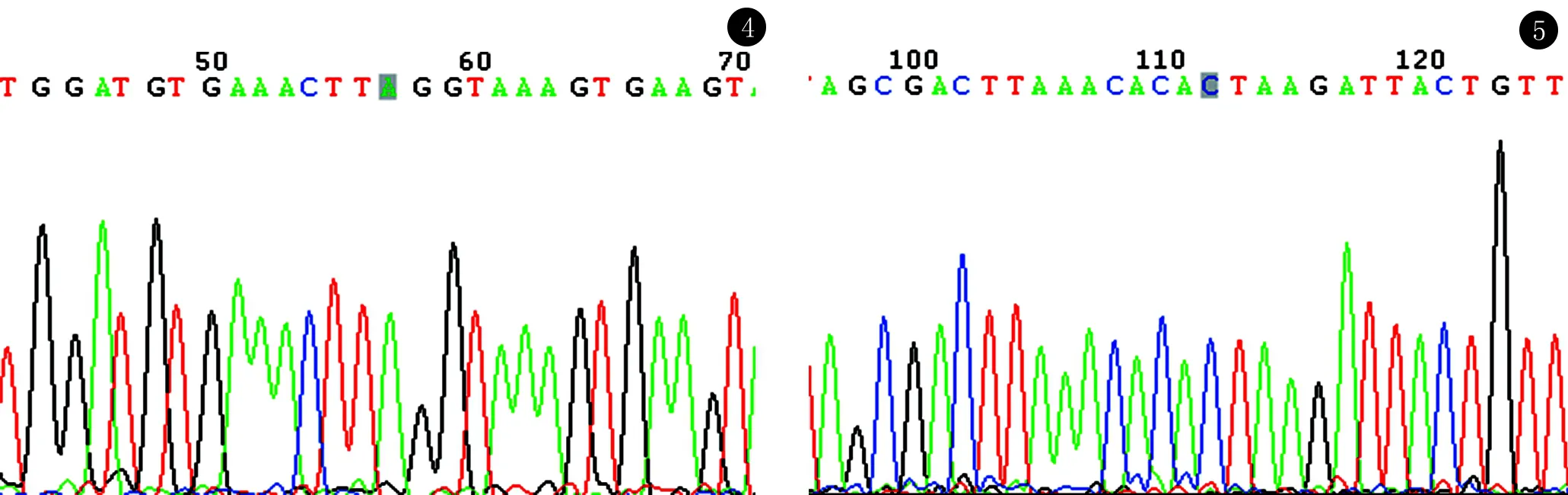
图4 rs2295826位点,样品48(含A/G等位基因)的基因扩增产物测序图图5 rs2295827位点,样品51(含C/T等位基因)的基因扩增产物测序
3 讨论
SLE的发病机制目前尚未完全明确,随着GWAS技术的发展,通过多个独立大数据的全基因扫描的病例对照研究,为研究SLE的发病机制提供了重要线索[7]。其中I型干扰素(IFN)活化异常是一个很重要的方面。在toll样受体介导下,激活NF-kB通路,进而影响前炎症因子的转录[8]。Lena等[9]在SLE血清引发的皮肤炎症反应组织中检测到升高的炎症因子TNFR1、NF-kB、MCP-1等。而在炎症反应的过程中,泛素-蛋白酶体系统是NF-kB通路主要的调节因子[10]。
UPS在免疫反应及自身免疫性疾病发病机制中的作用被人们作关注。UPS由泛素(Ub)、泛素活化酶(E1)、泛素结合酶(E2s)泛素-蛋白连接酶(E3s)、26S蛋白酶体和泛素解离酶(DUBs)等组成,是主要的非溶酶体依赖的蛋白降解途径,其对蛋白的降解受到基因与免疫信号的共同调控[11]。泛素化是NF-kB转录后调节的重要方式,有研究发现编码泛素连接酶UbcH7的基因UBC2L3在欧洲,亚洲及非洲裔的SLE患者与正常对照组中均存在基因多态性[3],并且高表达的T基因型与抗dsDNA抗体阳性可能存在相关性,进一步的研究表明在SLE患者群体中UbcH7在mRNA和蛋白质水平均有显著的高表达[12],在SLE患者体内,过度表达的UbcH7与其底物P105(NF-kB的前体蛋白)结合,增强了P105与蛋白酶体的结合与降解,使得其亚基P50二聚体增多并进入细胞核参与免疫调控。此外,有研究表明SLE的相关基因TNFAIP3编码的A20蛋白,为泛素酶的成分之一[13],与SLE发病及其系统损害密切相关。目前关于蛋白酶体在SLE发病机制的作用研究较少,已知在SLE患者体内同样可以检测到体内可以检测到针对泛素-蛋白酶体成分的抗体表达增强:PA28α抗体[14](PA28α为一种蛋白酶体激活蛋白),抗Ki抗体[15](Ki抗原是蛋白酶体11S调控因子的亚单位),且这种表达与IFN通路的异常活化相一致。Sjowall等[16]应用26s蛋白酶体抑制剂治疗两例活动期SLE患者,经治疗后患者的病情得到明显的缓解,其机制可能与NF-kB的抑制与基质细胞的相互作用使内质网的错误折叠蛋白累积凋亡有关。
编码蛋白酶体的基因主要位于14号染色体长臂,包括20s亚基的两个a链(PSMA3和PSMA6)和两个b链(PSMB5和PSMB11),ATP酶(PSMC1和PSMC6),11s非ATP酶催化剂(PSME1和PSME2)和PSMA3P假基因。有研究报道上述基因多态性与一些自身免疫性疾病及代谢性疾病相关,例如多发性硬化(MS),支气管哮喘(BA),幼年特发性关节炎(JIA)等[15]。Tatjana等[17]通过研究174例JIA患者与191名健康对照者,选择蛋白酶体相关的六个SNP位点(rs2277460,rs1048990,rs2348071,rs11543947,rs2295826,rs2295827)进行基因型及等位基因分析,发现位点rs2277460,rs234871,rs2295826,rs2295827可能与JIA发病和临床表现相关。
本次研究,为探究蛋白酶体相关基因SNPs与中国人群系统性红斑狼疮(SLE)的相关性,我们通过观察108例SLE患者和143名健康对照,选择4个SNP位点(rs2277460,rs234871,rs2295826,rs2295827),采用高通量基因分型对DNA样本SNP位点进行分析,结果示PSMA6(rs2277460)GG,GA,AA基因型频率和G,A等位基因在SLE实验组和对照组中无统计学差异(Pgt;0.05),PSMA3(rs2348071)AA,AG,GG基因型频率和A,G等位基因在SLE实验组和对照组中无统计学差异(Pgt;0.05),PSMC6(rs2295826)AA,AG,GG基因型频率和A,G等位基因在SLE实验组和对照组中无统计学差异(Pgt;0.05),PSMC6(rs2295827)CC,CT,TT基因型频率和C,T等位基因在SLE实验组和对照组中无统计学差异(Pgt;0.05)。上述四个SNP位点可能与SLE的发病机制无关。
本实验首次探究蛋白酶体相关基因SNPs与中国汉族人群SLE之间的关联,PSMA6/PSMC6/PSMA3 SNPs可能不是SLE的易感基因。一方面,本实验在编码蛋白酶体结构及相关酶蛋白的基因位点中仅选取了4个位点,不能排除其他SNPs在实验组和对照组中表达有差异的可能性,另一方面,患者循环中蛋白酶体浓度升高可能与转录及转录后调控有关,已知编码泛素连接酶(UbcH7)的基因UBC2L3为SLE的易感基因,UbcH7激活NF-kB通路可能参与了这一过程。同时本研究选取的样本量小,人种单一,选取的位点不能代表蛋白酶体的全部结构,因此,UPS在SLE中的作用还需要通过大样本,多基因点,多地区的研究,同时蛋白酶体转录后调控在SLE发病中的作用也有待进一步的研究。
[1] Tsokos GC. Systemic lupus erythematosus[J]. N Engl J Med,2011,365(22):2110-2121.
[2] Zinngrebe J, Montinaro A, Peltzer N, et al. Ubiquitin in the immune system[J]. Embo Reports,2014,15(1):28-45.
[3] Sandra A, Beverly SF, Akaash AK, et al. The autoimmune disease risk allele of UBE2L3 in african american patients with systemic lupus erythematosus: A recessive effect upon subphenotypes[J]. J Rheumatol,2012,39(1):73-78.
[4] Tatjana S, Natalia P, Kristine O, et al. Genetic variations in the PSMA3, PSMA6 and PSMC6 genes are associated with type 1 diabetes in Latvians and with expression level of number of UPS-related and T1DM-susceptible genes in HapMap individuals[J]. Mol Genet Genomics,2016,291(2):891-903.
[5] Alireza M, Wanlong M, Xi Z, et al. Plasma ubiquitin-proteasome system profile in patients with multiple sclerosis: correlation with clinical feature, neuroimaging, and treatment ith interferon-beta-1b[J]. Neurol Res,2012,64(6):49-58.
[6] Hochberg MC. Updating the american college of rheumatologyrevised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum,1997,40(9):1275.
[7] Han JW, Zheng HF, Cui Y, et al. Genome-wide association study in a Chinese han population identifies nine new susceptibility loci for systemic lupus erythematosus[J]. Nat Genet,2009,41(11):1234-1237.
[8] Gianchecchi E, Fierabracci A. Gene/environment interactions in the pathogenesis of autoimmunity:New insights on the role of Toll-like receptors[J]. Autoimmun Rev,2015,14(11):971-983.
[9] Liu L, Xu G, Dou H, et al. The feature of skin inflammation induced by lupus serum[J]. Clin Immun,2016,165:4-11.
[10] Skaug B, Jiang X, Chen ZJ. The role of ubiquitin in NF-kappaB regulayory pathways[J]. Annu Rev Biochem,2009,78(78):769-796.
[11] Eugen F, Gerd-Rudiger B, Elke K. The proteasome-victim or culprit in autoimmunity[J]. Clin Immun,2016,172:83-89.
[12] Shaofeng W, Indra A, Graham BW, et al. A functional haplotype of UBE2L3 confers risk for systemic lupus erythematosus[J]. Genes Immun,2012,13(5):380-387.
[13] Wang S, Wen F, Wiley GB, et al. An enhancer element harboring variants associated with systemic lupus erythematosus engages the TNFAIP3 promoter to influence A20 expression[J]. Plos Genetics,2013,9:e1003750.
[14] Matsushita M, Matsudaira R, Ikeda K, et al. Anti-proteasome activator 28alpha is a novel anti-cytoplasmic antibody in patients with systemic lupus erythematosus and sjogren's sydrome[J]. Mod Rheumatol,2009,19(6):622-628.
[15] Fredi M, Cavazzana I, Quinzanini M, et al. Rare autiantibodies to cellular antigens in systemic lupus erythematosus[J]. Lupius,2014,23(7):672-677.
[16] Sjowall C, Hjorth M, Eriksson P. Successful treatment of refractory systemic lupus erythematosus using proteasome inhibitor bortezomib followed by belimumab: description of two cases[J]. Lupus,2017,26(12):1333-1338.
[17] Tatjana S, Natalia P, Ingrida R, et al. Juvenile idiopathic arthritis subtype-and sex-specific associations with genetic variants in the PSMA6/PSMC6/PSMA3 gene cluster[J]. Pediatr Neunatol,2014,55(5):393-403.
(收稿:2017-06-18 修回:2017-07-31)
AssociationbetweenPSMA6/PSMA3/PSMC6genepolymorphismandsystemiclupuserythematosus
LIULanting1,WANGYu2,SONGJiquan1,PEISa1,OUYunchao1.
1.DepartmentofDermatologyZhongnanHospitalofWuhanUniversity,Wuhan430071,China; 2.DepartmentofDermatology,RenminHospitalHubeiUniversityofMedicine,Shiyan442000,China
SONGJiquan,E-mail:songjiq@126.com
Objective: To determine the association between the polymorphisms of proteasome (PSM) related genes and systemic lupus erythematosus (SLE).MethodsThe aim gene fragment extracted from the peripheral blood DNA of 101 SLE patients and 143 healthy controls was amplified by PCR. The single nucleotide polymorphisms of PSMA6 (rs2277460),PSMA3 (rs2348071),PSMC6 (rs2295826,rs2295827) alleles and the genotypes of proteasome 20 s subunit and related ATPase were detected by next generation sequencing technology.ResultsThe genotype frequencies of rs2277460 GG, GA, AA in the SLE patients and healthy controls were 30.56%, 53.7%, 15.74% and 33.57%, 50.35%, 16.08%, retrospectively. The genotype frequencies of rs2295826 AA, AG, GG were 75.93%, 24.07%, 0 and 69.23%, 29.37%, 1.4%. The genotype frequencies of rs2295827 CC, CT, TT were 78.7%, 19.45%, 1.85% and 76.22, 20.98%, 2.8%, with no significant differences between the two groups (Pgt;0.05).ConclusionThere may be no association between polymorphism of PSMA6/PSMC6/PSMA3 gene with SLE.
systemic lupus erythematosus (SLE); PSM; ATP ase; single nucleotide polymorphism
湖北省自然科学基金资助项目(编号:2015CKC902)
1武汉大学中南医院皮肤科,武汉,430071 2湖北医学院附属人民医院,十堰,442000
宋继权,E-mail: songjiq@126.com
