蛋白质泛素化修饰与肿瘤的研究进展
2020-02-11陈子琦
陈子琦
(扬州大学附属中学 江苏扬州 225001)
一、泛素化修饰的基本过程
泛素是一个含有76个氨基酸的小蛋白,泛素化通常发生在蛋白的赖氨酸(Lysine,K)残基上[1]。根据泛素化在目的蛋白上修饰位置以及泛素分子数目的不同,蛋白质泛素化修饰可以分为三类:单泛素化、多位点单泛素化和聚泛素化[1]。单泛素化和多位点单泛素化是指在蛋白一个或多个赖氨酸残基位点进行的单个泛素分子的修饰,主要参与胞吞作用、DNA修复、蛋白定位和运输过程。泛素本身含有7个赖氨酸。聚泛素化是指在蛋白赖氨酸残基上形成的多个泛素分子组成的链状修饰。蛋白经聚泛素化修饰后参与不同的生物学过程。其中,K48和K11位的泛素化链与蛋白酶体降解相关。
泛素化过程需要泛素活化酶E1、泛素结合酶E2和泛素连接酶E3的参与。
(一)泛素活化酶E1
研究表明,泛素活化酶有UBA1和UBA6两种,其功能有交叉,同时又相对独立:部分泛素结合酶,如UBE2D1-4/Ubch5a-d,既可通过UBA1也可通过UBA6接收泛素,而UBE2Z/USE1则是UBA6的特异性泛素结合酶[2]。 泛素经E1活化后,传递给E2(图1a)。
(二)泛素结合酶E2
泛素结合酶E2与活化的泛素结合后,会将泛素分子传递给泛素连接酶E3(图1b)或者直接对目的蛋白进行泛素化修饰(图1c)。目前人类基因组中已发现约50个编码泛素结合酶的基因[1]。

图1 泛素化修饰过程示意图。Ub代表泛素分子,Sub代表底物蛋白
(三)泛素连接酶E3
泛素连接酶能够特异性识别底物,人体细胞中约有600多个泛素连接酶。E3通常被分为两类:含有HECT结构的E3发挥活性需要通过半胱氨酸残基与泛素结合形成硫酯键再将泛素传递至底物;含有RING结构的E3作为支架蛋白,泛素分子被从E2转移到底物上[2]。
(四)蛋白酶体复合物
经48位赖氨酸聚泛素化链修饰的底物会被26S蛋白酶体降解。26S蛋白酶体是一种多亚基蛋白酶,由催化核心20S蛋白酶体和19S调节亚基组成(图2)。20S催化核心类似于桶状结构,由4个七聚体环组成。外侧为2个相同的无催化作用的α环,中间为两个相同的有催化作用的β环[3]。19S调节亚基为类似于盖子和底座的结构。
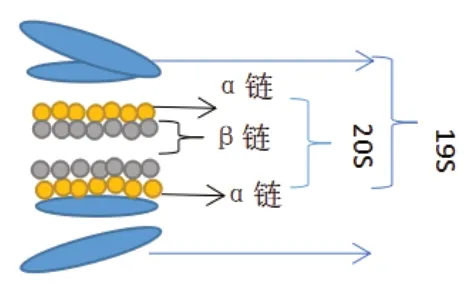
图2 26S蛋白酶体示意图
(五)去泛素化酶
为维持稳态,生物体内还存在与泛素化相对应的过程,即去泛素化,相应的酶被称为去泛素化酶。
二、异常的泛素化在肿瘤发生发展中的作用
泛素化作为一种蛋白质翻译后修饰,在细胞周期、细胞凋亡等多个胞内反应中发挥作用。泛素化的异常会改变胞内生理活动的正常调节,从而可能导致癌症的发生。
(一)泛素连接酶E3在肿瘤发生发展中的作用
通过泛素-蛋白酶体途径降解蛋白质是泛素化的重要功能之一。在不同的肿瘤中常常可以检测到泛素-蛋白酶体系统中关键的蛋白酶E3的突变或者表达的下调。例如,p53作为肿瘤抑制子,在正常细胞中参与细胞周期的表达和调控,以及DNA损伤修复等过程。在癌细胞中,p53会被E3酶MDM2泛素化从而被降解。MDM2在癌细胞中的过表达与p53的表达水平呈负相关,从而导致了癌症患者低的存活率和较差的预后。癌症和肿瘤基因图谱(Cancer Genome Atlas,TCGA)数据库揭示MDM基因的异常在一些肿瘤(如乳腺癌、脑癌)中,主要表现为突变和倍增[1]。最近有研究显示,在肿瘤细胞中,另一个E3酶RING也可以靶向p53使其降解[1]。临床结果也显示,RING1在肿瘤细胞表达中的上调与较差的预后相关[1]。
SCFSKP2是一种由F-box蛋白SKP2、CUL1、SKP1、RBX1组成的E3复合物,它在一些肿瘤中通过过量表达来调节关键的细胞周期抑制蛋白,如p27KIP1。SKP2的上调通过泛素化细胞周期蛋白抑制蛋白p27KIP1、p57、p130及FOXO1起着癌基因的作用。TCGA数据库分析显示,SKP2的突变和倍增存在于不同类型的癌症中,包括宫颈癌、子宫内膜癌、肾上腺皮质癌、卵巢癌、乳腺癌和非小细胞肺癌[1]。
pVHL是VCB-Cul2-VHL泛素连接酶复合物中的一部分,该复合物介导了HIF-1α的泛素化。当HIF-1α的脯氨酸被羟基化时,pVHL就会被泛素化并通过蛋白酶体降解。研究表明,VHL在视网膜癌、脑癌、胰腺癌和宫颈癌中深度缺失[1],这些突变导致了VHL在不同肿瘤中的低表达,因此,HIF-1α不再会被泛素化,从而不会被蛋白酶体降解,最终导致了快速化的血管形成及肿瘤增殖。
(二)泛素结合酶E2在肿瘤发生发展过程中的作用
泛素结合酶E2在肿瘤的发生发展中也起着非常重要的作用。例如,泛素结合酶E2 L3 (UBE2L3) 在非小细胞肺癌组织中的过表达与癌症交叉的预后相关。研究显示,UBE2L3与Skp2相互作用,促进了p27kip1的降解[1]。UBE2L3的缺失可以抑制非小细胞肺癌的进程,因此,UBE2L3被认为是一个新的预后诊断指标和一个潜在的治疗靶点。
(三)去泛素化酶在肿瘤发生发展过程中的作用
有研究显示,在骨肉瘤中,去泛素化酶UPS1和DUB3通过去泛素化DNA结合蛋白来保持间充质干细胞的特性。UPS1和DUB3也可以通过稳定CDC25来激活细胞周期增殖。USP1在范克尼白血病中去反泛素化DNA修复蛋白FANCD2及PCNA。USP4增强了癌基因转化生长因子TGF-β信号,并且在浸润性乳腺癌中过表达。UPS7主要调节抑癌基因p53和PTEN的定位和结构。UPS7对PTEN的去泛素化使得PTEN被排除到细胞核外从而不能起作用。USP7通常在前列腺癌、非小细胞肺癌及急性早幼粒细胞白血病中过表达。
三、以泛素化过程中的组分为靶点的肿瘤药物研究进展
(一)靶向E1的药物
研究结果显示,MLN7243和MLN4924可以作为UBA1和NAE1的抑制剂[4]。缺点在于,与靶向E2、E3相比,靶向E1的药物缺乏特异性。
(二)靶向E2的药物
LeucettamolA是一种从海洋生物中提取的药物,它可以抑制Ubc13-Uev1A的相互作用,
从而阻止E1和E2的相互作用。CC0651可以阻止E2 酶Cdc34的合成,导致抑癌基因p27的积累。目前,这两种药都仍处于科研阶段。
(三)靶向E3的药物
1.萨利多胺及其衍生物
萨利多胺可以靶向CRBN,调节其特异性接受底物,增强泛素化和底物的降解。目前,萨利多胺及其衍生物都被FDA批准,并应用于临床治疗[4]。
2.靶向MDM2/p53相互作用的药物
p53是一种肿瘤抑制因子,对细胞周期终止和细胞的凋亡中起重要作用。在E3酶中MDM2及与其功能相似的MDMX对p53的降解作用十分重要。因此,药物会选择靶向MDM2、MDMX,抑制其降解p53,从而达到抑制肿瘤发生的效果。然而,例如Nutlin-3a等抑制剂在作用时往往只对一种E3起作用,从而影响药物的效果[4]。为了解决这一问题,科学家研制可以同时抑制MDM2和MDMX的药物NSC207895[4]。
3.靶向F-box支架蛋白的药物
RING家族中的SCF(Skp1/cullin/F-box)占E3连接酶中的大部分,这种酶对调节细胞周期、基因转录、DNA复制起重要作用。其中F-box蛋白决定了SCF的特异性,因此,科研人员倾向于以此为靶点研制药物。靶向Cdc4这一F-box蛋白的SCF-12就是其中之一,但该药目前仍处于实验室阶段[4]。
4.靶向蛋白酶体的药物
26S蛋白酶体的20S催化核心是蛋白酶体抑制剂的重要研究靶点。现已有Bortezomib和Carfilzomib被美国FDA获批,并应用于临床治疗[4]。新一代的蛋白酶体抑制剂具有获得更好的治疗比例以及减少固有的或者获得的对药物抗性的潜力。
5.靶向去泛素化酶的药物
细胞需要维持蛋白质的稳态,因此,与泛素化相反的过程去泛素化也必不可少。去泛素化由去泛素化酶(UDB)调节,泛素特异性蛋白酶(USPs)就是去泛素化酶中的一种。其中USP14与胃肠癌以及肺癌的死亡率呈正相关。仍处于实验室阶段的药物IU1能够提高蛋白酶体的作用效率,加速了被氧化蛋白的降解,并且提供了对氧化应激的抗性[4]。
四、展望
通过研究肿瘤中异常的泛素化修饰,有助于寻找恰当的泛素化过程中组分作为肿瘤治疗的靶点,进而进行靶向药物的研制。另外,促进原癌基因表达生成的蛋白质的降解是蛋白质泛素化应用于肿瘤治疗的一个有效途径。例如,通过在靶蛋白上连接易被E3识别的异常蛋白,或是通过一些接头蛋白将靶蛋白强行与E3结合,从而促使其被泛素化降解。
