母细胞性浆细胞样树突细胞肿瘤一例并文献复习
2017-11-28朱奕锜王朵勤陈虎艳陈连军
朱奕锜 王朵勤 周 隽 黄 琼 陈虎艳 陈连军
·论著·
母细胞性浆细胞样树突细胞肿瘤一例并文献复习
朱奕锜 王朵勤 周 隽 黄 琼 陈虎艳 陈连军
本文报道一女性患者,72岁。全身泛发性红色丘疹半年,进行性加重1个月。皮损病理检查示:真皮浅层有一无细胞带,其下单一性弥漫性淋巴样细胞增生浸润,免疫组化检查示:CD56+、CD123+、CD4(弱+)。诊断为母细胞性浆细胞样树突细胞肿瘤。我们对相关文献进行了复习。
母细胞性浆细胞样树突细胞肿瘤; 血液肿瘤; 免疫组化
母细胞性浆细胞样树突细胞肿瘤(BPDCN)是一种罕见的造血系统恶性肿瘤,1994年首次被界定,又先后被命名为无颗粒型CD4+CD56+血液皮肤肿瘤、母细胞性NK细胞淋巴瘤或无颗粒型CD4+NK细胞白血病等[1,2]。2004年,Chaperot等[3]提出BPDCN可能来源于浆细胞样树突细胞的前体细胞(pDC),并得到后续研究的证实。2008年,WHO正式将此病归为急性髓系白血病相关的前体细胞恶性肿瘤[4]。BPDCN具有较强的侵袭性,预后很差,可同时累及多系统,但以皮肤病损首发为多见[5],易导致误诊。因此我们本次对临床上所见的一例BPDCN进行症状、诊断和治疗方面的分析研究,并结合相关文献复习,提高对这一罕见疾病的认识。
1 临床资料
患者,女,72岁。因全身泛发红色丘疹半年,进行性加重1个月于2016年11月24日入我院就诊。患者2016年6月起无明显诱因于右侧乳房处出现硬币大红色斑块,高出皮面并稍有瘙痒,后皮疹逐渐发展至双上肢(图1)。至当地医院就诊后予糠酸莫米松外用及氯雷他定分散片口服,无明显好转,且皮损蔓延至躯干,双上肢皮疹增多伴有渗液。2016年8月24日患者再次至当地医院就诊,诊断为“湿疹”,予以泼尼松每日1片口服(服用4天)、盐酸左西替利嗪片每日1片口服及糠酸莫米松乳膏外用,症状无明显好转。近1个月起皮疹渐发展至双下肢(图1),为进一步明确诊断而就诊于我科,初诊为“结节性红斑”。
皮肤科查体:右侧乳房处、背部、四肢可见多发大小不等紫红色斑块,有浸润感,边界清,稍高于皮面。遂于左前臂皮损处行病理穿刺活检。
组织病理检查:表皮萎缩,真皮浅层可见无细胞带,其下单一性弥漫性淋巴样细胞增生浸润,细胞体积中等偏小,胞质少,核不规则,核分裂相易见(图2)。甲苯胺蓝染色:真皮内少数染色阳性细胞;阿新蓝染色:阴性;病理诊断:疑为淋巴造血系统肿瘤,建议免疫组化。继续行免疫组化,示异型淋巴细胞Vim、LCA、CD56及CD123阳性(+)、CD4弱阳性(+),CD3、CD8、CD30、髓过氧化物酶(MPO)、CD20、CD79α、CD138、κ、λ、CD34、粒酶B(Gran-B)、溶菌酶、TIA-1、穿孔素及CD68均为阴性(-),Ki-67 10%(+)(图3),考虑母细胞性浆细胞样树突细胞肿瘤。
追问病史,患者2014年发现肾囊肿,予以微创治疗。否认体重下降,1992~1998年有长期接触机油史。2014年家中装修,装修后1个月即入住。患者有两个弟弟,一位患有胃癌,一位患有胰腺癌。
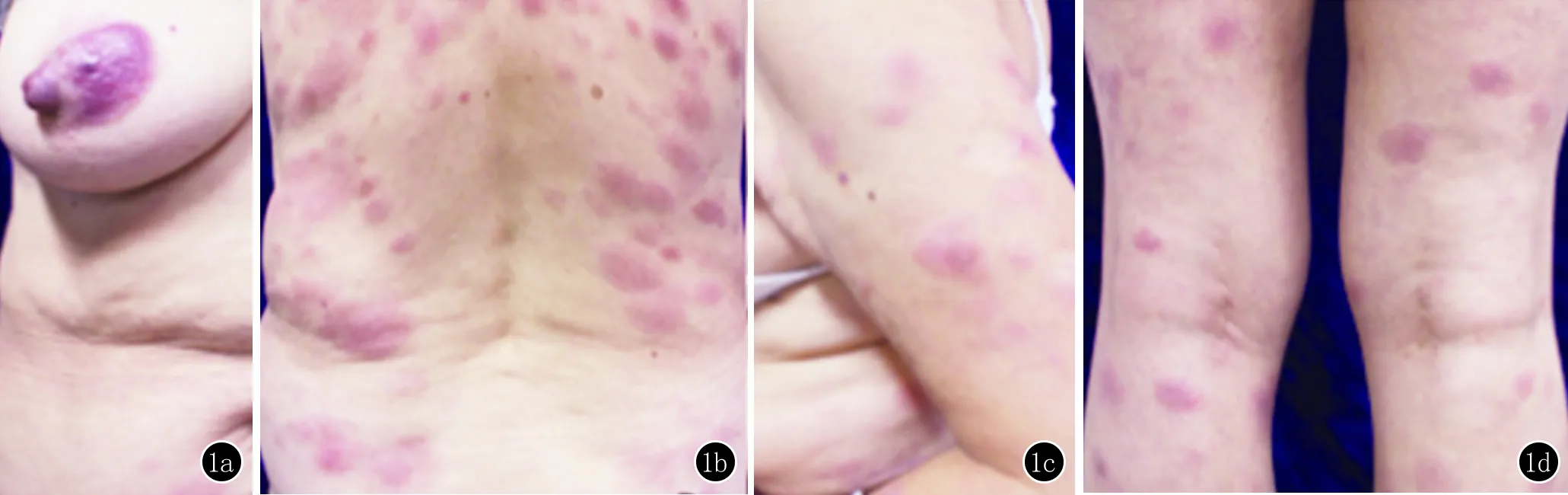
1a:右侧乳房;1b:背部;1c:上肢;1d:双下肢可见大小不等的紫红色斑块,边界清,稍高于皮面
图1 临床表现

2a:表皮萎缩,真皮浅层可见无细胞带(HE,×100);2b:真皮内单一性弥漫性淋巴样细胞增生浸润,侵犯皮肤附属器,细胞体积中等偏小,胞质少,核不规则,核分裂相易见(HE,×200)
图2 组织病理
随后我们建议患者转血液科就诊。现患者就诊于外院血液科,行CHOP方案化疗,目前继续随访中。
2 讨论
BPDCN是一种罕见的恶性血液疾病,好发于中老年患者,且男性更为多见(男女比例为3:1)[6]。现有研究认为,BPDCN的肿瘤细胞表达浆细胞样树突状细胞(pDC)标志物,可能来源于pDC的前体细胞。当机体处于肿瘤或自身免疫性疾病等状态时,pDC可聚集于淋巴结及黏膜等部位,分泌I型干扰素参与免疫反应的发生[7];或在抗原刺激下分化为树突状细胞,在抗原提呈过程中发挥作用[8]。
BPDCN主要累及皮肤、骨髓和淋巴结等器官组织。皮肤症状是患者最常见的主诉。皮肤损害表现为无症状的孤立或多发性结节状、斑块状等改变,并可伴发红斑、色素沉着、紫癜及溃疡等。Julia等[5]对法国90例BPDCN患者的皮肤症状进行统计,发现73%的患者表现为结节型皮损,12%表现为瘀伤样斑块,其余15%患者则为播散性混合斑块-结节样病变,此种类型被认为是最具诊断价值的皮损表现。随着病程进展,多数患者将很快出现淋巴结、软组织、骨髓及外周血甚至肝、肺等其他器官组织受累或侵犯症状[2,8]。
除临床表现外,目前对于BPDCN的确诊主要依靠组织病理和免疫组化学检查结果,最近也有利用FDG PET/CT对累及皮肤、体内淋巴结的病变进行病情评估的报道[9]。
典型的BPDCN病例皮肤组织病理表现为中等大小、形态均一的原始淋巴细胞样或原始粒细胞样细胞在真皮内弥漫浸润,早期可在血管或皮肤附属器周围呈结节样或斑片状分布[10]。肿瘤细胞主要侵及真皮,可有皮肤附属器破坏,一般不侵犯表皮,故在表皮与真皮间常可见一无细胞浸润带。瘤细胞较均一,中等大小,胞内可见细团块状染色质,不见核仁或核仁不明显,核分裂相常见[11]。
BPDCN常表达CD4、CD56、CD123及CD36、CD2AP、BDCA2、BDCA4与TCL1等标志物[6,8],而B细胞系、T细胞系、髓系与NK细胞系相关标志物多为阴性[12,13]。Garnache-Ottou等[14]认为,当CD4、CD123、BDCA4和/或BDCA2阳性,伴或不伴CD56阳性,且无CD11c、MPO、CD79α及CD3表达,则可临床诊断为BPDCN。而Julia等[5]则提出,若皮肤活检所见的肿瘤细胞表达CD4、CD56、CD123、BDCA2及TCL1共5项标志物中的4项,则高度提示BPDCN的诊断。

a1、a2:CD4染色,示弱阳性(弱+);b1、b2:CD56染色,示阳性(+);c1、c2:CD123染色,示阳性(+);d1、d2:LCA染色,示阳性(+);e1、e2:VIM染色,示阳性(+);f1、f2:Ki-67染色,示10%(+)
图3 免疫组化(a1、b1、c1、d1、e1、f1:×40;a2、b2、c2、d2、e2、f2:×100)
BPDCN患者常有复杂的分子生物学异常,但目前尚未发现特定的遗传学改变。此前,Wiesner等[15]发现,BPDCN患者常有9、12、13、15号染色体缺失,并以CDKN1B片段及CDKN2A/ARF/CDKN2B片段的缺失率最高;Pagano等[2]针对BPDCN的遗传学特点进行分析,则发现其存在5q21或5q34(72%)、12p13(64%)、13q13-q21(64%)、6q23-qter(50%)、15q(43%)和9q(28%)等基因片段的异常改变。最近报道的BPDCN病例中还发现存在KMT2A基因重排异常、PBRM1基因突变及NR3C1基因缺失[16-18],提示这类基因可能参与或影响BPDCN发病及预后。
BPDCN主要应与结外鼻型NK-T细胞淋巴瘤、皮肤T细胞淋巴瘤及髓样肉瘤等病进行鉴别。结外鼻型NK-T细胞淋巴瘤多累及鼻咽、上颚,肿瘤细胞呈血管中心性浸润,免疫表型可见CD4+及CD56+,且有CD3、TIA-1、粒酶B与穿孔素阳性表达,EB病毒原位杂交阳性[2,19],故本例可排除此诊断。皮肤T细胞淋巴瘤也可累及皮肤,组织病理表现为反应性小淋巴细胞、嗜酸粒细胞浸润性炎症表现,免疫表型表达CD4/CD56,且CD2、CD3、CD7等T细胞系免疫表型呈阳性,另有TCR单克隆性基因重排[6],与本例情况不符,故不考虑此诊断。髓样肉瘤常见髓过氧化物酶(MPO)、CD34、CD117及溶菌酶阳性,而在BPDCN中罕有阳性表达[20];与之相对,Petrella等[21]发现90%的BPDCN患者存在TCL-1阳性,而在髓样肉瘤中其阳性率仅为17%,提示TCL-1对鉴别这两类疾病具有较好的提示作用。本病例测得髓过氧化物酶、CD34及溶菌酶阴性,因此基本可以明确BPDCN的诊断。
BPDCN具有高侵袭性,预后很差,中位生存期仅为12~14个月[8]。BPDCN的治疗主要包括局部治疗、传统化疗及造血干细胞移植等,最近也有新型药物出现,但目前尚无公认的标准治疗方案。
对仅有孤立性皮肤症状的BPDCN患者,有报道[22-25]指出手术切除、局部放疗及全身糖皮质激素治疗可消除病灶,具有较好的短期疗效,常应用于晚期伴发全身皮肤、骨髓及外周血受累的老年患者或一般状况差、无法耐受化疗的患者。
此外,现有研究数据表明,非霍奇金淋巴瘤(NHL)、急性淋巴细胞白血病(ALL)和急性髓系白血病(AML)等恶性血液疾病的化疗方案对BPDCN普遍具有治疗作用,但总体而言,传统化疗治疗后BPDCN仍有较高复发率[26]。Reimer等[22]于2003年统计了既往报道中BPDCN患者接受化疗种类及其预后情况,发现CHOP方案具有70%的总体有效率,完全缓解率为55%。Falcone等[27]通过统计近年来以Hyper-CVAD方案为代表的ALL样化疗方案的疗效,发现其较AML样化疗方案具有更理想的完全缓解率,但后者的复发率则相对较低。
HSCT主要包括自体造血干细胞移植和异基因造血干细胞移植,常作为一种重要的巩固治疗方法。Aoki等[28]报道了11例化疗后处于第一次完全缓解期的患者,在接受HSCT治疗后,4年总生存率为84%,无进展生存率为73%。Dalle等[23]在临床统计中发现,移植组患者的中位生存期为31.3个月,明显大于非移植组(12个月)。
近年来,一些针对BPDCN相关基因、信息通路的靶向治疗药物也逐渐引起重视。比如SL-401可通过锚定IL-3受体产生细胞毒作用,从而对肿瘤细胞产生杀灭作用[26]。BMS-345541与MK-2206可分别阻断NF-kB及PI3K/AKT信号通路,诱导肿瘤细胞的死亡[27]。Montero等[29]证明Venetoclax作为一种抗凋亡蛋白BCL-2抑制剂,在动物实验中具有延长生存时间的作用。Bétrian等[30]报道了苯达莫司汀对处于进展期的BPDCN病例具有一定疗效。
综上,BPDCN是一种罕见的恶性疾病,因其发病率低、临床表现易与其它疾病混淆且形态学和免疫表型表现多样,故常会出现漏诊和误诊的情况。由于BPDCN进展很快,预后不佳,因此需要临床医生尽早识别这一侵袭性疾病,做出准确诊断。同时,我们也应认识到,BPDCN相关的诊断及治疗至今仍无统一标准,对于BPDCN是否存在具有诊断意义的临床表现、特征指标或连锁基因,以及如何制定最佳的诱导和巩固治疗方案等方面,亟待进一步深入探究。
[1] Adachi M, Maeda K, Takekawa M, et al. High expression of CD56 (N-CAM) in a patient with cutaneous CD4-positive lymphoma[J]. American Journal of Hematology,1994,47(4):278-282.
[2] Pagano L, Valentini CG, Grammatico S, et al. Blastic plasmacytoid dendritic cell neoplasm: diagnostic criteria and therapeuticalapproaches[J]. Br J Haematol,2016,174(2):188-202.
[3] Chaperot L, Perrot I, Jacob MC, et al. Leukemic plasmacytoid dendritic cells share phenotypic and functional features with their normal counterparts[J]. Eur J Immunol,2004,34(2):418-426.
[4] Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumors of heamatopioetics and lymphoid tissues[M].4th.Lyon: IARC Press,2008.145-147.
[5] Julia F, Petrella T, Beylot-Barry M, et al. Blastic plasmacytoid dendritic cell neoplasm: clinical features in 90 patients[J]. Br J Dermatol,2013,169(3):579-586.
[6] Zhang YW, Zhong JH, Chen XL, et al. Blastic plasmacytoid dendritic cell neoplasm: A case report and literature review[J]. Experimental amp; Therapeutic Medicine,2016,12(1):319-322.
[7] Cella M, Jarrossay D, Facchetti F, et al. Plasmacytoid monocytes migrate to inflamed lymph nodes and produce large amounts of type I interferon[J]. Nature Medicine,1999,5(8):919-923.
[8] 高娜,王学霞,孙建荣,等.母细胞性浆细胞样树突状细胞肿瘤2例并文献复习[J].临床血液学杂志,2014,6:962-965.
[9] Li ZG, Mu HY. Blastic plasmacytoid dendritic cell neoplasm evaluated by FDG PET/CT[J]. Clin Nucl Med,2017,42(7):551-552.
[10] 孙健,罗玉凤,曹金伶,等.母细胞性浆细胞样树突细胞肿瘤5例临床病理分析[J].临床与实验病理学杂志,2016,32(6):635-638.
[11] Dharmani PA, Mittal NM, Subramanian PG, et al. Blastic plasmacytoid dendritic cell neoplasm: report of two pediatric cases[J]. Indian Journal of Pathology amp; Microbiology,2015,58(1):72-76.
[12] Riaz W, Zhang L, Horna P, et al. Blastic plasmacytoid dendritic cell neoplasm: update on molecular biology, diagnosis, and therapy[J]. Cancer Control,2014,21(4):279-289.
[13] Yu H, Zhang P, Yin X, et al. Human BDCA2+ CD123+ CD56+ dendritic cells (DCs) related to blastic plasmacytoid dendritic cell neoplasm represent a unique myeloid DC subset[J]. Protein amp; Cell,2015,6(4):297-306.
[14] Garnache-Ottou F, Feuillard J, Ferrand C, et al. Extended diagnostic criteria for plasmacytoid dendritic cell leukaemia[J]. Br J Haematol,2009,145(5):624-636.
[15] Wiesner T, Obenauf AC, Cota C, et al. Alterations of the cell-cycle inhibitors p27(KIP1) and p16(INK4a) are frequent in blastic plasmacytoid dendritic cell neoplasms[J]. J Inves Dermatol,2010,130(4):1152-1157.
[16] Gehlbach D, Koduru P, John G, et al. Blastic plasmacytoid dendritic cell neoplasm with t(11;19)(q23;p13.3);KMT2A(MLL) rearranged: a diagnostic challenge[J]. Br J Haematol,2017,176(1):8.
[17] Yigit N, Suarez LF, Roth LG, et al. CD4-Negative variant of cutaneous blastic plasmacytoid dendritic cell neoplasm with a novel PBRM1 mutation in an 11-year-old girl[J]. Am J Clin Pathol,2017,147(5):453-460.
[18] Emadali A, Hoghoughi N, Duley S, et al. Haploinsufficiency for NR3C1, the gene encoding the glucocorticoid receptor, in blastic plasmacytoid dendritic cell neoplasms[J]. Blood,2016,127(24):3040-3053.
[19] 刘永霞,卢宪梅,陈声利,等.母细胞性浆细胞样树突细胞肿瘤二例[J].中国麻风皮肤病杂志,2017,33(5):281-283.
[20] Sangle NA, Schmidt RL, Patel JL, et al. Optimized immunohistochemical panel to differentiate myeloid sarcoma from blastic plasmacytoid dendritic cell neoplasm[J]. Mod Pathol,2014,27(8):1137-1143.
[21] Petrella T, Meijer C J, Dalac S, et al. TCL1 and CLA expression in agranular CD4/CD56 hematodermic neoplasms (blastic NK-cell lymphomas) and leukemia cutis[J]. Am J Clin Pathol,2004,122(2):307-313.
[22] Reimer P, Rüdiger T, Kraemer D, et al. What is CD4+ CD56+ malignancy and how should it be treated?[J]. Bone Marrow Transplant,2003,32(7):637-646.
[23] Dalle S, Beylot-Barry M, Bagot M, et al. Blastic plasmacytoid dendritic cell neoplasm: is transplantation the treatment of choice?[J]. Br J Dermatol,2010,162(1):74-79.
[24] Li Y, Li Z, Lin H, et al. Primary cutaneous blastic plasmacytoid dendritic cell neoplasm without extracutaneous manifestation: case report and review of the literature[J]. Pathol Res Pract,2011,207(1):55-59.
[25] Pileri A, Delfino C, Grandi V, et al. Blastic plasmacytoid dendritic cell neoplasm (BPDCN): the cutaneous sanctuary[J]. G Ital Dermatol Venereol,2012,147(6):603-608.
[26] Sullivan JM, Rizzieri DA. Treatment of blastic plasmacytoid dendritic cell neoplasm[J]. Hematology Am Soc Hematol Educ Program,2016,2016(1):16-23.
[27] Falcone U, Sibai H, Deotare U. A critical review of treatment modalities for blastic plasmacytoid dendritic cell neoplasm[J]. Crit Rev Oncol Hematol,2016,107:156-162.
[28] Aoki T, Suzuki R, Kuwatsuka Y, et al. Long-term survival following autologous and allogeneic stem cell transplantation for blasticplasmacytoid dendritic cell neoplasm[J]. Blood,2015,125(23):3559-3562.
[29] Montero J, Stephansky J, Cai T, et al. Blastic plasmacytoid dendritic cell neoplasm (BPDCN) is highly BCL-2 dependent and sensitive to venetoclax[J]. Cancer Discovery,2016,7(2):156-178.
[30] Bétrian S, Guenounou S, Luquet I, et al. Bendamustine for relapsed blastic plasmacytoid dendritic cell leukaemia[J]. Hematol Oncol,2017,35(2):252-255.
(收稿:2017-07-03 修回:2017-08-17)
Blasticplasmacytoiddendriticcellneoplasm:acasereportandliteraturereview
ZHUYiqi,WANGDuoqin,ZHOUJun,HUANGQiong,CHENHuyan,CHENLianjun.
DepartmentofDermatology,HuashanHospital,FudanUniversity,Shanghai200040,China
CHENLianjun,E-mail:hschenlianjun@163.com.
A 72-year-old female presented with erythematous papules all over body for 6 months and aggravated for one month. Biopsy of the papules was characterized by a diffuse infiltration of lymphoid cells in the lower dermis with an uninvolved zone in the upper dermis and immunohistochemistry revealed that CD56 and CD123 were positive and CD4 was weak positive. The diagnosis of blastic plasmacytoid dendritic cell neoplasm Relevant literature review was made.
blastic plasmacytoid dendritic cell neoplasm; hematological neoplasm; immunohistochemistry
复旦大学附属华山医院皮肤科,上海,200040
陈连军,E-mail:hschenlianjun@163.com
