鸡痘鹌鹑化弱毒株种子批的建立及鉴定
2017-11-27毛娅卿孔冬妮李慧姣
毛娅卿,王 嘉,吴 涛,王 哲,孔冬妮,李 岭,李慧姣
(中国兽医药品监察所,北京100081)
鸡痘鹌鹑化弱毒株种子批的建立及鉴定
毛娅卿,王 嘉,吴 涛,王 哲,孔冬妮,李 岭,李慧姣*
(中国兽医药品监察所,北京100081)
为保证制苗所用毒种质量和稳定性,在对鸡痘鹌鹑化弱毒株病毒含量、病毒纯净性、特异性、免疫原性及安全性等研究的基础上,建立了鸡痘鹌鹑化弱毒株种子批。将鸡痘鹌鹑化弱毒F278 E1(1966年6月3日冻干)通过鹌鹑连续传至4代(F282 E1)后,再经鸡胚传至14代(F282 E14)。传代毒种的鉴定结果表明:抽检的各代次的毒种均无细菌、支原体、外源病毒污染,且病毒含量检测稳定,均≥106.2EID50/0.2mL。将抽检的各代次的毒种制成活疫苗,免疫适龄鸡只后均能产生完全保护。因此,确定鸡痘鹌鹑化弱毒株基础种子代数为F282 E2-E6代,生产用毒种继代应不超过3代。种子批的建立,为鸡痘鹌鹑化弱毒株疫苗的生产奠定了基础。
鸡痘鹌鹑化弱毒株;种子批;建立及鉴定
鸡痘(Avian Pox)是鸡的一种急性、接触性传染病,是危害养鸡业发展的一种重要传染病之一[1]。成鸡发病后不造成死亡,但可使病禽生长迟缓,产蛋下降,种禽发病时孵化率降低等,若并发其他传染病、寄生虫病和卫生条件、营养状况不良时也可引起大批死亡,死亡率甚至高达40%~50%。雏鸡发病死亡率较高,一般5%~30%不等。
鸡痘鹌鹑化弱毒株是中国兽医药品监察所于20世纪50-60年代开发的具有自主知识产权的产品,经过50多年来的大量实验室试验和田间实践证明,该毒种毒力稳定、安全、免疫原性好,是一株优良的疫苗毒株[2]。为确保疫苗的有效性、纯净性和稳定性,建立了鸡痘鹌鹑化弱毒株毒种的种子批,为生产出合格的鸡痘鹌鹑化弱毒株疫苗奠定基础。
1 材料与方法
1.1 毒种 分别取CVCC AV1003 F282 E2、E5、E9和E14代冻干毒种各2支,由中国兽医药品监察所冻干、保存。
1.2 SPF鸡及鸡胚 11~12日龄鸡胚、SPF鸡由北京梅里亚维通实验动物技术有限公司提供。
1.3 诊断用抗原及抗体
1.3.1 琼脂扩散(AGP)抗原和阳性血清 包括马立克氏病病毒(MDV)、鸡痘病毒(APV)、鸡传染性法氏囊病病毒(IBDV)、禽呼肠孤病毒(REOV)等AGP抗原和阳性血清,均由中国兽医药品监察所制备。
1.3.2 血凝抑制(HI)抗原及标准阳性血清 H5、H7、H9亚型禽流感病毒(AIV)HI抗原及标准阳性血清,购自哈尔滨维科生物技术开发公司。新城疫病毒(NDV)和减蛋综合征病毒(EDSV)HI抗原及标准阳性血清由中国兽医药品监察所制备。
1.3.3 ELISA检测试剂盒 包括禽白血病病毒(ALV)、禽脑脊髓炎病毒(AEV)、网状内皮组织增生症病毒(REV)、鸡传染性法氏囊病病毒(IBDV)、鸡传染性支气管炎病毒(IBV)、禽呼肠孤病毒(REOV)和鸡传染性贫血病毒(CAV)等ELISA检测试剂盒,均购自IDEXX公司。
1.3.4 阴性血清 SPF鸡血清,由中国兽医药品监察所制备。
1.4 检验用培养基 硫乙醇酸盐(T.G)、酪胨琼脂(G.A)、葡萄糖蛋白胨汤(G.P)、改良Frey氏液体培养基、改良Frey氏固体培养基,均由中国兽医药品监察所制备。
1.5 毒种繁殖、冻干 将毒种用灭菌生理盐水稀释至10-2~10-3,经鸡胚绒毛尿囊膜上接种11~12日龄SPF鸡胚,每胚0.2 mL,37 ℃继续孵育至120 h。选接种后96~120 h死胚和120 h活胚,无菌采集有水肿或痘斑的绒毛尿囊膜,混合研磨后过滤,加入蔗糖脱脂奶保护剂后,进行冷冻真空干燥。
1.6 病毒含量及对鸡胚的最小感染量测定 将E2、E5、E9和E14代毒种分别用生理盐水进行10倍系列稀释,取10-5、10-6、10-7三个稀释度,经绒毛尿囊膜接种12日龄SPF鸡胚,每个稀释度接种鸡胚5个,每胚0.2 mL,置37 ℃继续孵育至120 h,鸡胚绒毛尿囊膜水肿增厚或出现痘斑判为感染,计算EID50和对鸡胚的最小感染量[3-4]。
1.7 纯净性 对E2、E5、E9和E14代种毒进行了纯净性检验,按照现行的 《中华人民共和国兽药典》有关规定[5],对种毒进行细菌、霉菌、支原体和外源病毒污染检验,其中外源病毒污染检验采用鸡胚法。
1.8 免疫原性试验 将E2、E5、E9和E14代毒种分别用灭菌生理盐水稀释至103.0EID50/0.1mL(含1羽份)。将50只14日龄的SPF鸡分为5组,每组10只。第1、2、3、4组,翅内侧皮下分别注射E2、E5、E9和E14代病毒液0.1 mL/只(含1羽份);第5组,不注射疫苗,作为对照组。免疫接种3周后,将所有鸡用APV 102株强毒攻击(含100个最小发痘量),记录鸡群每日的发病与死亡情况。
1.9 最小发痘量 将E2、E5、E9和E14代毒种分别用生理盐水按装量复原后,稀释至10-4,每代次用3月龄SPF鸡3只,将鸡大腿部毛拔掉约3 cm2,取0.2 mL毒液涂抹毛囊,观察3周,记录发痘情况。
1.10 对鸡的安全性 将E2、E5、E9和E14代毒种用灭菌生理盐水稀释至104.0EID50/0.1mL(10羽份),经肌肉接种10只7日龄SPF鸡,每只10羽份,同时加5只对照鸡。观察14 d的临床症状,并记录结果。
1.11 最小免疫剂量测定 将50只21日龄的SPF鸡分为5组,第1组-第4组为接种组,第5组为对照组。接种组每只翅内侧皮下注射0.1 mL稀释的E5代病毒液。其中第1组,接种剂量为每只鸡40 EID50;第2组,接种剂量为每只鸡20 EID50;第3组,接种剂量为每只鸡10 EID50;第4组,接种剂量为每只鸡5 EID50;第5组,不注射疫苗,作为对照组。免疫接种3周后,将所有鸡用APV 102株攻击(含100个最小发痘量),记录鸡群每日的发病与死亡情况。
1.12 毒种保存期试验 抽检 1990年7月(E2代)、1993年1月(E5代)、1996年4月(E9代)三个代次的毒种,测定病毒含量测定和对鸡胚的最小感染量。
1.13 剩余水分测定 按照现行的《中国兽药典》附录进行。
1.14 真空度测定 按照现行的《中国兽药典》附录进行。
2 结 果
2.1 病毒含量及对鸡胚的最小感染量 E2、E5、E9和E14代冻干毒种的病毒含量及对鸡胚最小感染量测定结果见表1,病毒含量在106.4~106.5EID50/0.2mL,对鸡胚的最小感染量在10-5/0.2mL~10-6/0.2mL。试验结果见表1。
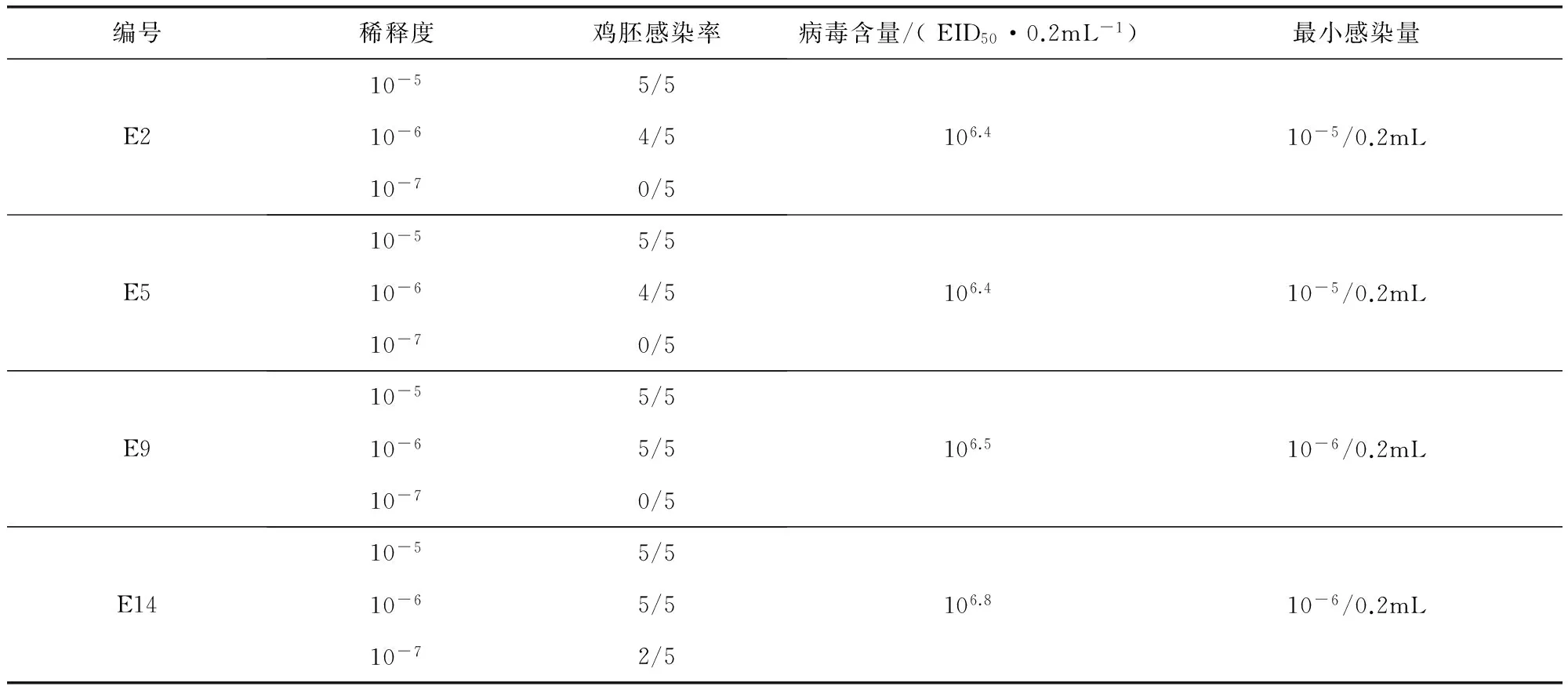
表1 毒种病毒含量及对鸡胚的最小感染量Tab 1 The virus content and the minimum infective dose of chick embryo
2.2 纯净性 鸡痘鹌鹑化弱毒株毒种E2、E5、E9和E14代纯净,未受细菌、霉菌、支原体及外源病毒污染。试验结果见表2。
2.3 免疫原性 第1、2、3、4组鸡接种后14 d,对鸡痘强毒攻击均能产生完全保护作用,而第5组未免疫对照鸡攻毒后,10/10发病。鸡痘鹌鹑化弱毒株毒种E2、E5、E9和E14代免疫原性没有明显差异,均具有良好的免疫原性,免疫后攻毒均获得保护。2.4 最小发痘量 鸡痘鹌鹑化弱毒株E2、E5、E9和E14代涂沫毛囊后,试验鸡均出现局部毛囊红肿、结痂,涂沫皮肤有轻微水肿,10 d左右结痂开始脱落,2~3周时康复,不引起全身痘及其他反应。最小发痘量均为≤10-4/0.2mL。
2.5 对鸡的安全性 所有接种鸡均健活,除接种局部出现红肿、结痂,均无其他全身不良反应,精神食欲不受影响。由此证明鸡痘鹌鹑化弱毒株对1周龄以上雏鸡是安全的,可用于1周龄以上雏鸡的免疫。试验结果见表3。
2.6 最小免疫剂量测定 以含40 EID50、20 EID50、10 EID50的E5代种毒接种的21日龄SPF鸡,攻毒保护率均为10/10,而以含5 EID50的E5代种毒接种的21日龄SPF鸡,攻毒保护率为6/10,即最小免疫量为10 EID50。试验结果见表3。
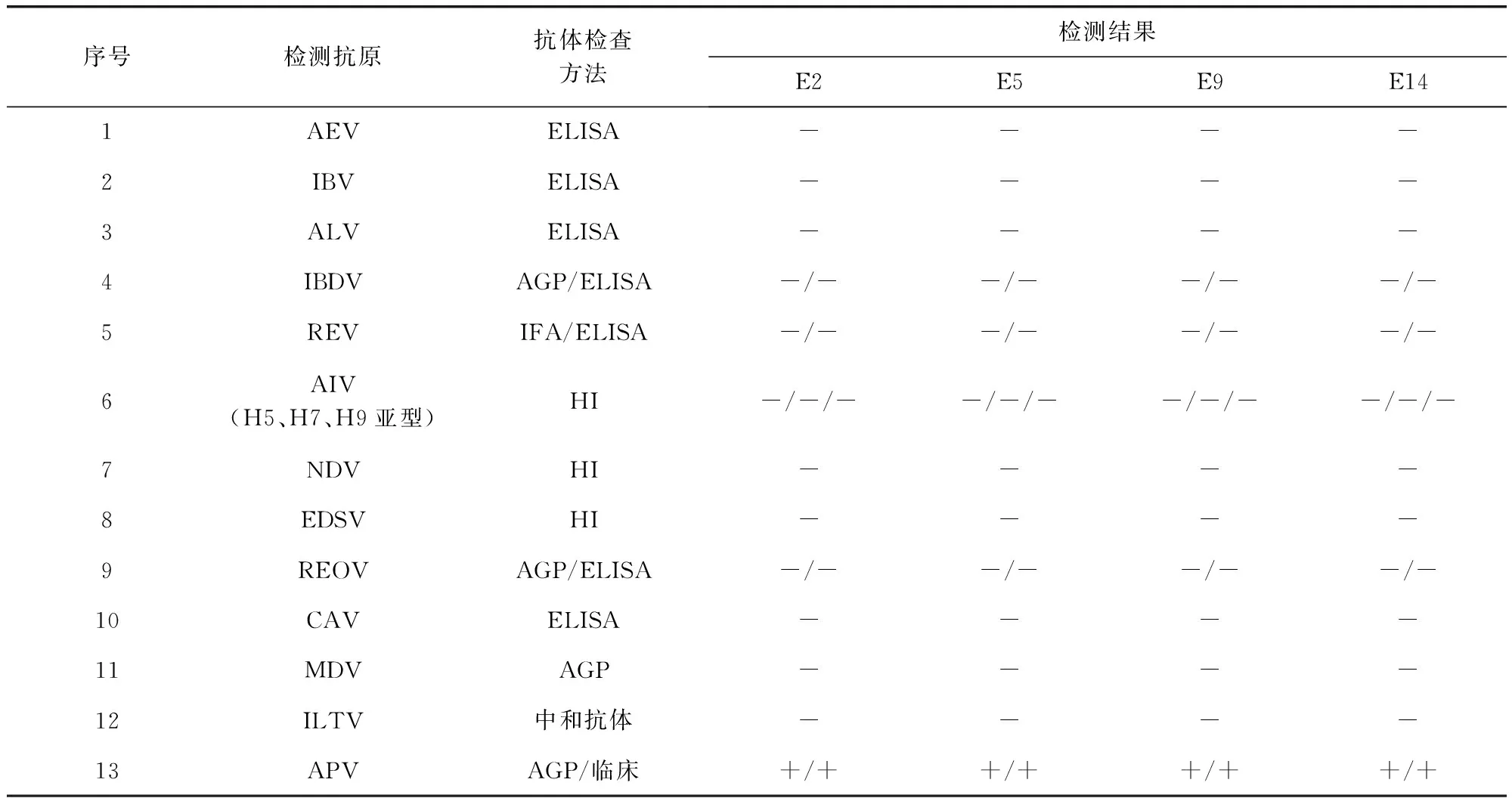
表2 毒种外源病毒血清学检测结果Tab 2 Serological test of exogenous virus
“-”表示阴性,“+”表示阳性
"-"means negative, "+" means positive
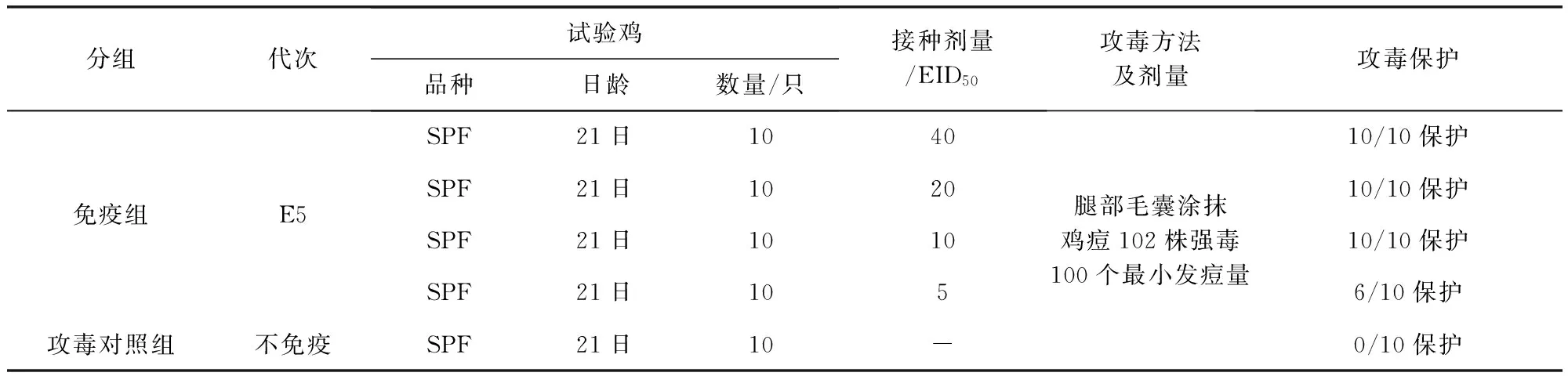
表3 不同接种剂量免疫攻毒保护结果Tab 3 Results of attack protection against different doses of vaccination
2.7 保存期试验 鸡痘鹌鹑化弱毒株分别在-70 ℃以下保存22年、20年和17年进行病毒含量测定,结果病毒含量几乎没有变化,对鸡胚最小感染量≤10-5/0.2mL,均符合《中华人民共和国兽用生物制品规程》(二〇〇〇年版)规定。试验结果见表4。

表4 保存前后病毒含量测定结果和对鸡胚最小感染量Tab 4 The virus content before and after preservation and the minimum infective dose of chick embryo
2.8 剩余水分测定和真空度测定 四个代次的鸡痘鹌鹑化弱毒冻干毒种剩余水分测定均小于3%,真空度测定均发出紫色辉光,检验结果符合规定。试验结果见表5。

表5 毒种剩余水分与真空度测定结果Tab 5 Determination of residual water and vacuum of virus
3 小 结
本研究通过选用中国兽医药品监察所鸡痘鹌鹑化弱毒株CVCC AV1003 F282冻干毒种制备活疫苗,通过本动物免疫攻毒试验表明,毒种E2、E5、E9和E14代免疫原性没有明显差异,均具有良好的免疫原性,免疫后攻毒均能够产生完全的攻毒保护,以此为依据,建立了毒种的种子批,可以确定鸡痘鹌鹑化弱毒株基础种子代数为F282 E2~E6代,生产用毒种继代应不超过3代[6-11]。
为保证各代次毒种质量,本研究对E2、E5、E9和E14代次毒种分别进行安全性试验。所有接种鸡均健活,除接种局部出现红肿、结痂,均无其他全身不良反应,精神食欲不受影响。由此证明鸡痘鹌鹑化弱毒株对1周龄以上雏鸡是安全的,可用于1周龄以上雏鸡的免疫。
通过对鸡痘鹌鹑化弱毒株各代次冻干种毒抽检病毒含量测定、纯净性、特异性、免疫原性和安全性等,证明各代次病毒传代稳定;纯净性检验均无细菌、霉菌、支原体和外源病毒污染;鸡痘鹌鹑化弱毒株冻干毒种在-70 ℃及以下保存,至少可达17年。本试验种子批的建立可为鸡痘鹌鹑化弱毒株疫苗的研制,以及将来的规模化生产提供稳定、可靠的生产用种毒。
[1] Y M Saif,A M Fadly.禽病学[M].苏敬良,高 褔,索 勋,主译.第 12 版.北京:中国农业出版社,2012.
Y M Saif,A M Fadly.Diseases of poultryM].Su J L, Gao F, Suo X, main translation. Twelfth Edition. Beijing: China Agricultural Press, 2012.
[2] 中国兽医药品监察所,中国兽医微生物菌种保藏管理中心.中国兽医菌种目录[M].2008年版. 北京:中国科学技术出版社,2008.
China Institute of Veterinary Drug Control, China Veterinary Culture Collection Center. Chinese veterinary species list[M]. 2008 Edition, Beijing: China Science and Technology Press, 2008.
[3] 农业部兽药审评中心.兽用生物制品试验研究技术指导原则[M].北京. 2006年版.
Center for Veterinary Drug Ealuation, MOA. Technical guidelines for veterinary biological products test and research[M]. Beijing, 2006 Edition.
[4] 马兴树. 禽传染病实验诊断技术[M]. 北京:化学工业出版社, 2006:170-176.
Ma X S. Avian infectious diseases laboratory diagnosis technology[M]. Beijing: Chemical Industry Press, 2006:170-176.
[5] 中国兽药典委员会.中国人民共和国兽药典[M].2010 年版.三部.北京:中国农业出版社,2010.
Chinese Pharmacopoeia Committee. People's Republic of China Veterinary Pharmacopoeia [M]. 2010 edition. Third Volume. Beijing: China Agriculture Press, 2010.
[6] 范书才,李 虹,朱良全,等.鸭瘟灭活疫苗种毒筛选及生产用种毒种子批的建立[J].中国预防兽医学报,2009,31(6):458-461.
Fan S C, Li H, Zhu L Q,etal. Establishment of master stocks for preparation of inactivated vaccine against duck plague [J]. Chinese Journal of Preventive Veterinary Medicine, 2009, 31 (6): 458-461.
[7] 王新卫,贾文科,王泽霖,等.传染性支气管炎病毒M41株种子批的建立[J].安徽农业科学,2008,36(9):3663-3664,3729.
Wang X V, Jia WK, Wang Z L,etal. Establishment of seed batches of strain M41 of infectious bronchitis virus [J]. Anhui Agricultural Sciences, 2008, 36 (9):3663-3664, 3729.
[8] 黄宇翔,刘力威,王志强,等.鹅细小病毒灭活疫苗种子批建立[J].中国兽药杂志,2016,50( 4) :11-15.
Huang Y X, Liu LW, Wang Z Q,etal. The seed lots built of goose parvovirus inactivated vaccine candidate [J]. Chinese Journal of Veterinary Drug, 2016, 50 (4):11-15.
[9] 王永录,张永光,方玉珍,等. 口蹄疫A型灭活疫苗毒种和种子批的研究[J]. 中国兽医科学, 2006, 36(5): 371-375.
Wang Y L, Zhang Y G, Fang Y Z,etal. Studies on the virus seeds and seed batches of inactivated vaccine against foot-and-mouth disease virus type A[J]. Veterinary Science in China, 2006, 36 (5): 371-375.
[10] 公殿力, 李开军, 王舰兵, 等. 长47株麻疹减毒活疫苗纯化毒种三级种子批的建立及疫苗的临床观察[J]. 吉林医学, 2005, 26(4): 407.
Gong D L, Li K J, Wang X B,etal. Establishment of three-tier virus seed library of 47 species of purified measles vaccine live and clinical observation of vaccine[J]. Jilin Medical University, 2005, 26 (4): 407.
[11] 李萍萍, 杨晓明, 张爱华, 等. SARS病毒NS-1株三级毒种库的建立[J]. 中国生物制品学杂志, 2005, 18(3): 227-228.
Li P P, Yang X M, Zhang A H,etal. Construction of three-tier virus seed library of SARS virus NS-1 strain [J]. Chinese Journal of Biologicals, 2005, 18 (3): 227-228.
(编辑:李文平)
TheSeedLotsEstablishmentandIdentificationofAvianPoxVirus(QuailAdaptedStrain)
MAO Ya-qing,WANG Jia,WU Tao,WANG Zhe,KONG Dong-ni,LI Ling,LI HUI-Jiao*
(ChinainstituteofVeterinaryDrugControl,Beijing100081,China)
LIHUI-Jiao,E-mail:lihuijiao@ivdc.org.cn
In order to ensure the vaccine virus seed quality and stability, avian pox virus quail adapted strain vaccine virus seed lots were established on the research basis of virus seed content, purity, specific, immunogenicity, safety and expanding propagation generations.The avian pox virus quail adapted strain attenuated F278 E1 (June 3, 1966 gelsiccation) by quail 4 passages (F282 E1), followed by chicken embryo passaged for 14 generations (F282 E14). The passaged identification results showed that the each generation of the virus had no bacteria, mycoplasma and exogenous virus pollution. The virus content was stable, no less than 106.2EID50/0.2 mL. The various generations of the virus was made live vaccine, the chickens after immunization can produce complete protection. Therefore, we ultimately determined that the master seed was F282 E2-E6 generation, the production virus following the generation should not exceed 3 generations. The establishment of the seed lot laid the foundation for avian pox virus quail adapted strain vaccine production.
avian pox virus quail adapted strain; seed lots; establishment and identification
10.11751/ISSN.1002-1280.2017.11.02
2016-12-13
A
1002-1280 (2017) 11-0009-06
S852.65
毛娅卿,博士,从事兽用生物制品检测工作。
李慧姣。E-mail:lihuijiao@ivdc.org.cn
