犬细小病毒灭活疫苗的制备及免疫效果观察
2017-11-27朱盛和畅翊然胡敏华莫梅君吴玉婷张博越刘运忠谭业平郭霄峰
李 敏,朱盛和,畅翊然,胡敏华,莫梅君,吴玉婷,张博越,刘运忠,谭业平,郭霄峰*
(1. 广州市华南农大生物药品有限公司,广州 511300;2. 华南农业大学 兽医学院,广州 510642;3. 广州医药研究总院有限公司(国家犬类实验动物种子中心),广州 510240;4江苏省农业科学院兽医研究所, 南京210014)
犬细小病毒灭活疫苗的制备及免疫效果观察
李 敏1,朱盛和2,畅翊然2,胡敏华3,莫梅君2,吴玉婷2,张博越2,刘运忠3,谭业平4,郭霄峰2*
(1. 广州市华南农大生物药品有限公司,广州 511300;2. 华南农业大学 兽医学院,广州 510642;3. 广州医药研究总院有限公司(国家犬类实验动物种子中心),广州 510240;4江苏省农业科学院兽医研究所, 南京210014)
以新分离的两种不同亚型CPV为毒种制备浓缩灭活苗和未浓缩灭活苗,通过与商品化弱毒苗的比较评价灭活疫苗的免疫效果。将CPV-S5(New CPV-2a)与CPV-1401(New CPV-2b)毒株扩大培养后浓缩灭活,制备了两种浓缩与两种未浓缩水溶剂灭活疫苗;将灭活疫苗和商品化二联弱毒苗分别接种5周龄HI阴性幼犬,分别在免疫后7 d、14 d、21 d、28 d测定HI抗体效价;首免36 d后取其中4只犬二免,其他犬进行攻毒。结果显示,各免疫组在第7天HI均高于1∶80,浓缩组显著高于未浓缩组,初步表明CPV灭活苗效果与抗原的浓度有直接的关系;灭活疫苗组与商品化弱毒苗组均差异显著;免疫组的犬均存活,而HI阴性犬死亡,经检测死亡犬CPV为阳性,表明制备的CPV灭活苗产生的特异性免疫应答均能抵抗强毒的攻击,对犬起到良好的免疫保护;二免后其HI抗体效价极显著提高,有效抗体能维持5个月,更有效的对免疫犬群进行保护。
犬细小病毒;灭活疫苗;免疫效果;血球凝集抑制试验
犬细小病毒性肠炎是由犬细小病毒(Canine Parvovirus, CPV)感染导致的呈世界分布的高度接触性传染病,主要引起犬急性出血性肠炎或新生犬急性心肌炎,呈现较高的发病率和死亡率,对养犬业和经济动物的养殖造成了巨大的损失[1-2],而且对野生动物的生存构成极大的威胁。目前,尚未发现非常有效的防治方法,平时主要依靠同源性疫苗,发病后以高免血清紧急治疗[3]。CPV只有一个抗原型,即CPV-2,但是CPV存在抗原漂移,其后出现了在宿主范围、血凝性和抗原性上都发生了变化的不同亚型CPV-2a、CPV-2b、CPV-2c(a)和CPV-2c(b)[4-6]。我国的主要流行毒株为CPV-2a亚型 ,而在南方地区也出现了CPV-2b毒株的流行[7]。
CPV疫苗预防该病起了积极的作用,由于基因工程疫苗研制周期较长且不能较强的针对正在流行的毒株,弱毒苗存在毒株突变与毒力返强风险,而灭活疫苗安全性高且不存在散毒的风险。目前市场主要还是以CPV-2为基础来制作CPV疫苗,这导致国内流行毒株与疫苗毒株不匹配。本研究所使用的病毒为新分离的CPV-S5和CPV-1401分别属于New CPV-2a、New CPV-2b,代表国内最新的进化趋势,以其为毒种制备的浓缩灭活疫苗对控制目前国内CPV的流行有较大的针对性作用,通过浓缩灭活苗、未浓缩灭活苗及商品化弱毒苗之间的比较,望得到一种较低成本、持久、安全有效的疫苗来针对性的防控当前国内CPV的感染。
1 材料与方法
1.1 材料
1.1.1 细胞、毒株、商品化疫苗和实验动物 F81 cell由本实验室保存;CPV-S5[7]、CPV-1401[8]由本实验室分离、鉴定和保藏;宠必威商品化二联疫苗(犬细小弱毒和犬瘟热弱毒二联苗,批号A122B01)购买于宠物医院;5周龄CPV HI 抗体阴性健康幼土犬,购自广州郊区。
1.1.2 主要试剂 胎牛血清为gibco产品;β-丙内酯购于北京百灵威科技有限公司;佐剂MONTANIDE GEL 01为广州市华南农大生物药品有限公司研发部实验室馈赠。
1.2 方法
1.2.1 病毒的浓缩 将在F81细胞上培养的CPV病毒液与20%PEG 8000/2.5 mol/L NaCl的比例为2∶1混合,4 ℃过夜(浓缩效果更好),接着冰浴1 h。4 ℃ 11000 r/min离心30 min,去掉上清液,接着以原病毒液量的1/10的PBS缓冲液洗脱离心管底部的白色沉淀,对病毒液进行10倍浓缩,将浓缩液收集于新的50 mL无菌离心管中,并用直径为0.45 μm的滤膜过滤。测定浓缩病毒的HA效价,-80 ℃冰箱保存备用。
1.2.2 病毒滴度的测定 在V型血凝板中参照《兽医微生物学实验指导》进行[9],实验过程中使用新鲜配备的1%猪红细胞悬液。
1.2.3 疫苗的制备及检验 参照叶苹苹的方法[8]和文献报道[10]的同类疫苗的制备方法进行病毒的灭活和疫苗的制备。按照β-丙内脂∶病毒液 =1∶2000 的比例混合均匀,4 ℃灭活24 h,37 ℃水解2 h。取灭活后的病毒液,以终浓度为5%同步接种于 F81 细胞上,参照培养病毒方法进行检测,并连续盲传代三次,于显微镜下观察,以细胞是否发生病变为病毒灭活的标准,同时设接种病毒液的阳性对照组和不加病毒液的空白对照组。参考Liu Xiaohui[11]的方法将佐剂MONTANIDE GEL 01和灭活病毒按 1∶9 比例混合,搅拌均匀,制成疫苗。然后进行无菌检验。
1.2.4 CPV灭活苗免疫 将幼犬分为七组,其免疫程序见表1。按免疫程序皮下接种疫苗。免疫后第0、7、14、21、28天采血检测HI抗体效价,观察犬产生抗体水平及抗体消长规律。首免36 d后选取C组的4只犬进行二免,免疫浓缩CPV-S5灭活苗+浓缩CPV-1401灭活苗,各1 mL。二免后第7天采血测HI抗体效价,以后每隔一个月采血测HI抗体效价,观察犬抗体水平及抗体消长规律。

表1 免疫程序Tab 1 Immunization program
1.2.5 血清的处理和HI试验 将血清56 ℃ 30 min灭活,然后取60 μL灭活血清、60 μL 0.2 mol/L pH 7.3 PBS与 120 μL 25%的高岭土混匀(4倍稀释),置室温20 min,其间振动摇匀2~3次使血清充分吸附,4 ℃ 3500 r/min离心10 min,取上清再加入猪红细胞泥20 μL,充分摇匀但要避免发生溶血,置于37 ℃水浴30 min,其间摇动数次,4 ℃ 2400 r/min离心10 min,取上清待检。根据 HA结果配制4单位抗原,再参照《兽医微生物学实验指导》[9]测定血清中的HI效价。
1.2.6 攻毒 参照1.2.5结果,挑选上述1只HI阴性犬和免疫36 d后的19只犬,编号为1-20,其中1号犬为HI阴性犬,2-4号犬为免疫浓缩CPV-S5疫苗组,5号犬为免疫浓缩CPV-1401疫苗组,6号犬为免疫浓缩CPV-S5组+浓缩CPV-1401疫苗组,7、8、14、15号犬为免疫未浓缩CPV-1401疫苗组,9-13号犬为免疫未浓缩CPV-S5疫苗组,16-18号犬为免疫未浓缩CPV-S5组+未浓缩CPV-1401疫苗组,19、20号犬为免疫商品化疫苗组。以CPV-S5(2a)细胞培养液为攻毒液,其血凝效价为28,攻毒剂量为每只犬口腔2 mL/kg[12],攻毒前断水1 d。
2 结果与分析
2.1 病毒的浓缩 结果见表2。

表2 浓缩病毒与未浓缩病毒的HATab 2 HA of concentrated virus andnon concentrated virus
培养的CPV-S5、CPV-1401通过PEG和高浓度盐进行10倍离心浓缩,其HA效价并没有呈现10倍,而是约8倍。因为在离心浓缩过程中容易造成病毒损失,所以不能达到理论值。
2.2 疫苗检验 灭活检验中阳性对照细胞发生明显的CPE,样品及阴性细胞未见CPE,且盲传三代后还是均无CPE,表明CPV灭活疫苗均灭活成功。样品经需氧及厌氧性、霉菌、腐生菌和真菌培养基的培养均无细菌生长,表明灭活疫苗无菌检验合格。
2.3 抗体消长规律 免疫前对31只幼犬采血检测HI,结果均为1∶20,表明所有幼犬免疫前抗CPV的HI抗体均为阴性。疫苗免疫犬7 d后,浓缩CPV-S5灭活苗组的HI抗体效价极显著大于浓缩CPV-1401灭活疫苗组、未浓缩CPV-S5灭活苗组和未浓缩CPV-1401灭活疫苗组(Plt;0.01);显著大于未浓缩CPV-S5+未浓缩CPV-1401灭活苗组(Plt;0.05);极显著小于商品化弱毒疫苗(Plt;0.01);与浓缩CPV-S5+浓缩CPV-1401灭活苗组无显著性差异。浓缩CPV-1401灭活苗组显著小于浓缩CPV-S5+浓缩CPV-1401灭活苗组(Plt;0.05);极显著小于商品化弱毒疫苗(Plt;0.01);与其他组无显著性差异。浓缩CPV-S5+浓缩CPV-1401灭活苗组显著大于未浓缩CPV-S5灭活苗组和未浓缩CPV-1401灭活苗组(Plt;0.05);显著小于商品化弱毒苗(Plt;0.05)。未浓缩CPV-S5灭活苗组、未浓缩CPV-1401灭活苗组与未浓缩CPV-S5+未浓缩CPV-1401灭活苗组之间均无显著性差异;未浓缩CPV-S5灭活苗组与未浓缩CPV-1401灭活苗组都极显著小于商品化弱毒苗(Plt;0.01);未浓缩CPV-S5+未浓缩CPV-1401灭活苗组显著小于商品化弱毒苗(Plt;0.05)。见图1。
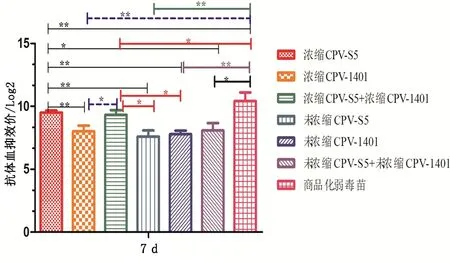
图1 免疫犬7 d HI抗体效价Fig 1 Antibody titer of HI 7 d in immunized dogs
疫苗免疫犬14 d HI抗体效价为浓缩CPV-S5灭活苗组、浓缩CPV-1401灭活苗组、浓缩CPV-S5+浓缩CPV-1401灭活苗组、未浓缩CPV-S5灭活苗组、未浓缩CPV-1401灭活苗组和未浓缩CPV-S5+未浓缩CPV-1401灭活苗组之间均无显著性差异;但都极显著小于商品化弱毒苗(Plt;0.01)。见图2。
疫苗免疫犬21 d HI抗体效价为浓缩CPV-S5+浓缩CPV-1401灭活苗组极显著大于未浓缩CPV-S5+未浓缩CPV-1401灭活苗组(Plt;0.01);显著大于浓缩CPV-1401灭活苗组、未浓缩CPV-S5灭活苗组和未浓缩CPV-1401灭活苗组(Plt;0.05);显著小于商品化弱毒苗(Plt;0.05);与浓缩CPV-S5灭活苗组无显著性差异。其他组之间均无显著性差异,但均极显著小于商品化弱毒苗(Plt;0.01)。见图3。

图2 免疫犬14 d HI抗体效价Fig 2 Antibody titer of HI 14 d in immunized dogs
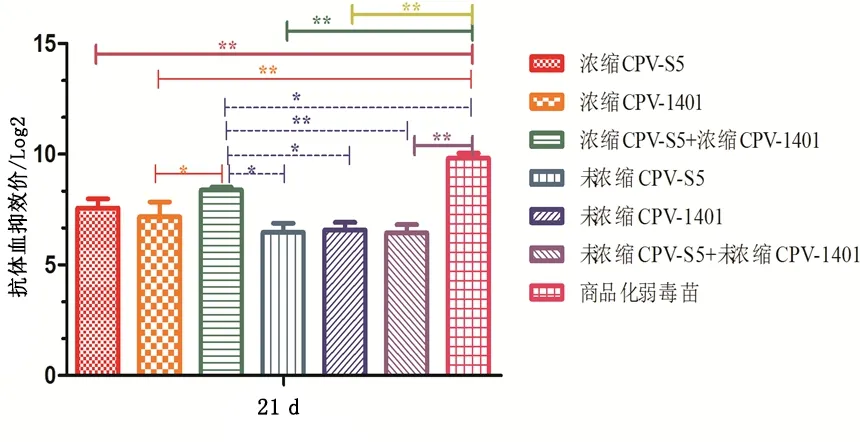
图3 免疫犬21 d HI抗体效价Fig 3 Antibody titer of HI 21 d in immunized dogs
疫苗免疫犬28 d HI抗体效价为浓缩CPV-S5灭活苗组、浓缩CPV-1401灭活苗组、浓缩CPV-S5+浓缩CPV-1401灭活苗组、未浓缩CPV-S5灭活苗组、未浓缩CPV-1401灭活苗组和未浓缩CPV-S5+未浓缩CPV-1401灭活苗组之间均无显著性差异;但都极显著小于商品化弱毒苗(Plt;0.01)。见图4。
免疫犬HI抗体效价总情况为免疫组在第7天达到最高,而其HI抗体效价随着时间的推移各组均呈现下降的趋势,但是浓缩组灭活苗组HI抗体效价下降的趋势要比未浓缩的灭活疫苗组要缓。在浓缩组中,浓缩CPV-S5+浓缩CPV-1401灭活苗组下降趋势比浓缩CPV-S5灭活苗组和浓缩CPV-1401灭活苗组均要缓慢。见图5。
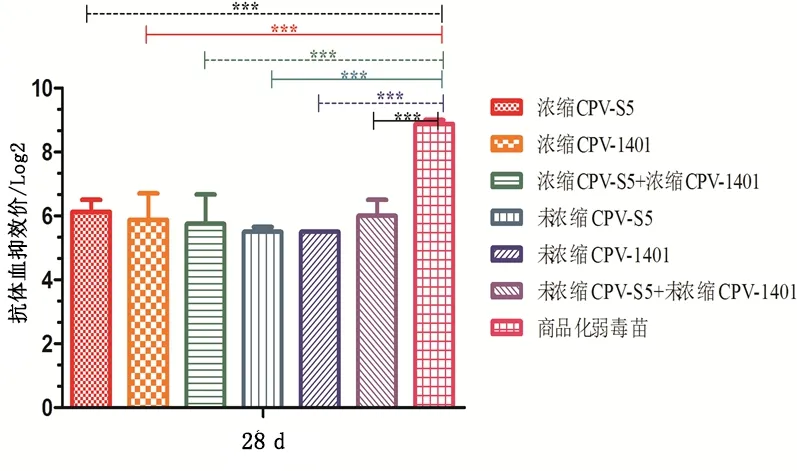
图4 免疫犬28 d HI抗体效价Fig 4 Antibody titer of HI 28 d in immunized dogs
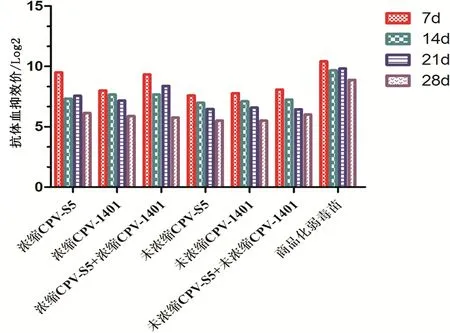
图5 免疫犬HI抗体效价Fig 5 Antibody titer of HI in immunized dogs
二免后7 d 的HI抗体效价迅速增长,HI平均值达到1∶2304;28 d的HI抗体效价有所下降,HI平均值为1∶768;56 d HI平均值为1∶469;84 d HI平均值为1∶448;120 d HI平均值为1∶104;二免后第2、3个月HI抗体效价基本上维持平稳;第4个月HI抗体水平又下降,抗体水平能维持5个月。如图6。
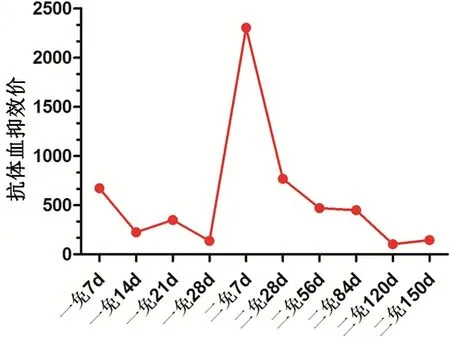
图6 二免HI抗体效价Fig 6 Antibody titer of HI in second immunized dogs
2.4 CPV疫苗免疫效果 攻病毒后,其中5号、10号犬3 d左右出现厌食呕吐现象,眼睛凹陷,精神较萎靡并伴有轻度腹泻等临床症状,但7 d左右犬渐渐恢复,最终耐过;而1号HI阴性犬第4d开始出现发烧、呕吐、精神沉郁、厌食、拉黄色稀便等症状,第6天精神高度沉郁、站立不安、喜伏卧、排具有腥臭味番茄汁样稀粪,第8天犬死亡,其他幼犬未见明显临床症状且全部存活。对病死犬进行解剖,发现肠系膜被染黄、腹股沟淋巴结肿大、肝脏肿大出血;小肠一小段溃烂、肠壁出血。对病死犬肠内容物进行病毒的DNA提取及PCR的检测,结果显示CPV为阳性。根据临床症状和病理解剖及实验室PCR检测结果可知,HI阴性犬为攻CPV强毒致死。表明灭活疫苗诱导的特异性免疫应答能够抵抗CPV强毒的攻击。
3 讨 论
CPV能引起犬较高的致病率和死亡率,且存在抗原漂浮性,导致防御难度加大了,因此根据CPV的流行和抗原特异性来制备相应的灭活苗,针对性的预防目前国内CPV的流行。本实验室分离的CPV-S5与CPV-1401毒株分别属于New CPV-2a、New CPV-2b,代表了国内最新的进化趋势,以其为毒种研制的浓缩灭活苗对于当前国内CPV病的防控会有较大的针对性。疫苗接种犬后,结果显示浓缩CPV-S5灭活苗与浓缩CPV-1401灭活苗以及未浓缩的两种CPV灭活苗在相同的时间都能产生高于1∶80的抗体水平。据文献报道,犬血清中HI抗体效价低于1∶80 时则可能会发生CPV的感染[13]。浓缩组的HI抗体水平要明显高于未浓缩组的HI抗体水平,表明CPV灭活苗的免疫效果跟抗原的浓度有直接的关系。 CPV-S5灭活苗组与CPV-1401灭活苗疫苗组的免疫效果的总体趋势一样,可能与CPV只有一种血清型有关[6]。本研究试制的CPV灭活苗诱导的抗体水平均比商品化弱毒苗低,这也许由于商品化弱毒苗的活病毒在犬中大量繁殖,同一时间内产生了更多的病毒抗原。免疫后攻毒试验,HI阴性犬发病死亡,而免疫犬获得很好的保护,与其他研究者的结果一致[12, 14]。因此,CPV灭活疫苗也能保护犬只免受强毒的攻击。至于攻毒后部分犬出现随粪便排毒现象,主要由于灭活苗不能有效的刺激犬的胃肠道产生足够局部的抗体来清除病毒[15]。
一次免疫灭活苗的犬所产生的有效抗体(HI≥80)可持续一个月,如作加强免疫,短时间内可达1∶2304,并且持续时间能够维持约五个月。有学者研究发现,幼犬出生后约60日龄以灭活疫苗首免,半个月后进行二免,之后每隔半年免疫一次,则其保护率为100%[16]。因此,好的疫苗也需要有合理的免疫程序。
[1] 赵忠鹏,谢之景,夏咸柱,等. 果子狸细小病毒的分离与鉴定[J]. 特产研究, 2003(04): 5-11.
Zhao Z P, Xie Z J, Xia X Z,etal. Isolation and identification of canine parvovirus from Paguma larvata[J]. Special Wild Economic Animal and Plant Research, 2003(04): 5-11.
[2] 谢之景,夏咸柱,扈荣良,等. 犬细小病毒分离鉴定及其基因型调查的基础研究[J]. 中国动物保健, 2003(12): 19-21.
Xie Z J, Xia X Z, Hu R L,etal. Basic research on isolation and identification of CPV and investigation of its genotype[J]. China Animal Health, 2003(12): 19-21.
[3] 孙 梅,吴建华,白文军. 犬细小病毒研究进展[J]. 北京农业, 2013(36): 175-179.
Sun M, Wu J H, Bai W J. Advance in canine parvovirus[J]. Beijing Agriculture, 2013(36): 175-179.
[4] Decaro N, Martella V, Desario C,etal. First detection of canine parvovirus type 2c in pups with haemorrhagic enteritis in Spain[J]. J Vet Med B Infect Dis Vet Public Health, 2006, 53(10): 468-472.
[5] Chinchkar S R, Mohana S B, Hanumantha R N,etal. Analysis of VP2 gene sequences of canine parvovirus isolates in India[J]. Arch Virol, 2006, 151(9): 1881-1887.
[6] 邱 薇,范泉水,李作生,等. 犬细小病毒VP2基因的比较及分型研究[J]. 动物医学进展, 2005(05): 69-72.
Qiu W, Fan Q S, Li Z S,etal. Comparation and Typing of VP2 Genes of Canine Parvovirus[J], Progress in Veterinart Medicine, 2005(05): 69-72.
[7] 黄永亮,施赫赫,冯顺意,等. 广东珠三角地区犬细小病毒分离与鉴定[J]. 中国预防兽医学报, 2012(10): 778-781.
Huang Y L, Si H H, Feng S Y,etal. Isolation and identification of canine parvovirus in pearl river delta region of Guangdon[J]. Chinese Journal of Preventive Veterinary Medicine, 2012(10): 778-781.
[8] 叶苹苹. 犬细小病毒灭活疫苗的研制[D]. 广州: 华南农业大学, 2015.
Ye P P, Preparation of canine parvovirus inactivated vaccine[D]. Guangzhou: South China Agricultural University, 2015.
[9] 姚火春. 兽医微生物学实验指导[M]. 北京: 中国农业出版社,2001.
Yao H C. The experimental guidance of veterinary microbiology[M]. Beijing: China Agricultural Press, 2001.
[10] 丁 毅. 猫细小病毒灭活疫苗的制备及保护性研究[D]. 长春: 吉林大学, 2010.
Din Y. Study on preparation and protection of feline parvovirus inactivated vaccine[D]. Chang Chun: Jilin University, 2010.
[11] Liu X H, Yang Y, Sun Z,etal. A recombinant rabies virus encoding two copies of the glycoprotein gene confers protection in dogs against a virulent challenge[J]. PLoS One, 2014, 9(2):1-10.
[12] Jun Luo, Hehe Shi, Yeping Tan,etal. Two potential recombinant rabies vaccines expressing canine parvovirus virion protein 2 induce immunogenicity to canine parvovirus and rabies virus[J].Vaccine, 2016, 34(37): 4392-4398.
[13] 秦海斌,温 海,贺星亮,等. 犬细小病毒抗体效价监测与疫苗免疫效果分析[J]. 中国工作犬业, 2014(06): 19-21.
Qin H B, Wen H, He X L,etal. The monitoring of the antibody efficay and analysis of immunological effects induced by canine parvovirus[J], Zhongguo Gongzuo Quanye, 2014(06): 19-21.
[14] 黄永亮. 广东地区犬细小病毒流行病学调查及VP2蛋白单克隆抗体的制备[D]. 广州: 华南农业大学, 2012.
Huang Y L. Epidemiological investigation of canine parvovirus in guangdon and preparation of monoclonal antibody of VP2 protein[D], Guangzhou, South China Agricultural University, 2012.
[15] 李河林,焦铁军,刘淑红,等. 犬细小病毒病研究进展[J]. 动物医学进展. 2008(05): 73-77.
Li H L, Jiao T J, Liu S H,etal. Progress on canine parvovirus disease[J]. Progress in Veterinary Medicine, 2008(05): 73-77.
[16] 张加正,董清平,张亚华,等. 犬细小病毒肠炎最佳免疫程序的探讨[J]. 特产研究, 2000(02): 50-51.
Zhang J Z, Dong Q P, Zhang Y H,etal. Discussion of optimum immune procedure of canine parvovirus enteritis[J]. Special Wild Economic Animal and Plant Research, 2000(02): 50-51.
(编辑:李文平)
ImmuneEffectofCanineParvovirusInactivatedVaccine
LI Min1, ZHU Sheng-he2, CHANG Yi-ran2, HU Min-hua3, MO Mei-jun2, WU Yu-ting2, ZHANG Bo-yue2, LIU Yun-zhong3, TAN Ye-ping4,GUO Xiao-feng2*
(1.GuangzhouSouthChinaAgriculturalUniversityBiologicalPharmaceuticalCo.,Ltd.,Guangzhou511300,China;2.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China;3.GuangzhouGeneralPharmaceuticalResearchInstituteCo.,Ltd.,(NationalSeedCenterofExperimentalDog),Guangzhou510240,China;4.InstituteofVeterinaryMedicine,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
GUOXiao-feng,E-mail:xfguo@scau.edu.cn
To evaluate the immune effect of inactivated vaccine prepared with two different subtypes canine parvovirus strains, and to observe the relationship between the CPV concentration and non-concentrated inactivated vaccine and commercial two attenuated vaccine. The CPV-S5(New cpv-2a)and CPV-1401(New cpv-2b)strains were cultured in cells, and then was concentrated and inactivated. Two kinds of inactivated vaccine were prepared, one with concentrated virus and another non-concentrated virus. The aqueous solvent inactivated vaccines and two commercial attenuated vaccine were inoculated to 5 weeks old hemagglutination inhibition (HI) negative puppies respectively. At 7 d, 14 d, 21 d and 28 d the blood was collected and HI antibody titer were determined post-immunization. At 36d after the first immune, another four dogs were boosted one time. The other dogs were challenged with the virulent CPV. The result showed the HI antibody of the immuned groups was higher than 1∶80 at 7 d, and concentrated virus group was significantly higher than non-concentrated virus group. The HI titers were significantly different during the groups with inactivated vaccine and commercial attenuated vaccine. The immuned dogs still lived until the end, but HI negative dogs died. CPV can be isolated from the dead dogs, which suggested that the specific immune response induced by the CPV inactivated vaccine could resist the virulent attack, and it had a good immune protection to the canines. After second immunization the HI antibody titer significantly increased and the effective antibody can last five months.
canine parvovirus; inactivated vaccine; immune effect; hemagglutination inhibition test
10.11751/ISSN.1002-1280.2017.11.01
2017-05-02
A
1002-1280 (2017) 11-0001-08
S852.65
广州市海珠区产学研重大专项(2014-CG-10);江苏省自然科学基金(BK20130705)
李 敏,兽医师,从事动物用生物制品的生产和研发;朱盛和,硕士研究生,从事动物用生物制品的研发, 为共同第一作者。
郭霄峰。E-mail: xfguo@scau.edu.cn
