外周血SEPT9基因甲基化检测在结直肠癌筛查中的应用进展
2017-11-11陈卫昌
冷 霞 陈卫昌
苏州大学附属第一医院消化内科(215006)
·综 述·
外周血SEPT9基因甲基化检测在结直肠癌筛查中的应用进展
冷 霞1*陈卫昌#
苏州大学附属第一医院消化内科(215006)
结直肠癌(CRC)的早期诊断具有重要临床意义。外周血SEPT9基因甲基化在大量研究中被证实是CRC的特异性生物学标记物,敏感性和特异性均较高,较之目前常用的粪便隐血试验、血清肿瘤标记物和结肠镜筛查具有一定优势,但在筛查腺瘤、息肉等癌前病变中的应用价值有限,用于评估CRC术后复发和放化疗效果的潜力则尚需进一步临床验证。本文就外周血SEPT9基因甲基化检测在CRC筛查中的应用进展作一综述。
结直肠肿瘤; 筛查; 早期诊断; DNA甲基化; SEPT9基因
结直肠癌(colorectal cancer,CRC)是临床常见的消化道恶性肿瘤之一,我国每年CRC新发病例数超过25万,死亡病例数约14万,新发和死亡病例均占全世界同期CRC病例的20%[1],给社会和个人造成沉重的医疗负担。CRC的转归和预后与疾病分期密切相关,但60%~70%的患者在确诊时已进展至中晚期[2]。因此,CRC的早期诊断具有重要临床意义,而普及CRC筛查和推广内镜下早诊、早治是提高CRC早期诊断率、降低CRC相关死亡率的有效途径。
结肠镜检查是诊断CRC的金标准,但肠道准备、侵入性操作、隐私暴露以及患者的恐惧心理等因素,限制了其在结直肠肿瘤筛查中的应用。我国人口众多,医疗资源分布极不均衡,直接采用结肠镜检查进行人群筛查亦不符合国情。采用无创技术进行初筛,再针对高危人群进行结肠镜精查则是行之有效的方法。目前常用的无创筛查方法主要有粪便检测和血清肿瘤标记物检测,前者包括粪便隐血试验(fecal occult blood test,FOBT)、粪便microRNAs(miRNAs)、粪便DNA检测等,但筛查普及率仍偏低。FOBT简便易行,是最常用的CRC粪便筛查方法,目前免疫化学法(fecal immuno-chemical test,FIT)已逐渐取代传统愈创木脂法(guaiac-based FOBT,gFOBT),在CRC筛查中表现出较高的敏感性和特异性[3]。但粪便检测取样困难,可能需多次检测,且结果易受多种因素影响。临床常用的血清消化道肿瘤标记物包括CEA、CA19-9、CA125、CA724等,但敏感性和特异性均不高,单一指标对CRC的诊断价值有限。
近年来,国内外多项临床试验证实,甲基化SEPT9基因是CRC的特异性生物学标记物,应用荧光探针PCR技术检测外周血SEPT9基因甲基化水平,可评估CRC患病风险。该项检查无需禁食,血液标本易采集,受检者依从性好,对于CRC的诊断有较高的敏感性和特异性,且检出率与患者性别、肿瘤部位无关[4-5]。本文就外周血SEPT9基因甲基化检测在CRC筛查中的应用进展作一综述。
一、SEPT9基因结构及其转录产物的生理作用
迄今为止,在哺乳动物中共发现13个septin基因,分别命名为SEPT1至SEPT12和SEPT14,其蛋白产物隔膜蛋白(septins)是一组具有GTP结合蛋白活性的保守骨架蛋白家族,参与细胞骨架形成、细胞极化、胞质分裂、细胞膜重构等多个细胞生物学过程,特别是与细胞分裂密切相关[6-7]。SEPT9基因位于染色体17q25.3,普遍存在于人类细胞中,共有18种转录产物。Septins家族成员相互之间具有高亲和力,可形成含有多个septin多肽的三、六、八聚体复合物。SEPT9编码蛋白在septins八聚体复合物中位于末端位置,具有稳定多聚体结构以及促进各亚基聚合的作用,并在细胞分裂时子细胞的最终分离中起关键作用[8-9]。因此,SEPT9基因表达异常或缺失时,细胞分裂可能受到严重影响。
二、SEPT9基因与肿瘤的关系
SEPT9基因在多种恶性肿瘤中存在异常表达。Tóth等[10]的研究表明,从结直肠腺瘤、异型增生至CRC,SEPT9 mRNA表达呈下降趋势,CRC组织和细胞中的SEPT9蛋白表达较正常组织和细胞显著降低。SEPT9不同转录本在不同组织来源肿瘤中的表达亦存在差异,如在乳腺癌形成过程中可观察到SEPT9_v1、v2、v3转录本高表达[11];卵巢肿瘤上皮中为v1、v4*转录本高表达[12];CRC上皮中v1转录本则呈低表达,v2、v4、v4*、v5转录本呈高表达[10]。上述发现提示在不同组织来源肿瘤的形成过程中,SEPT9基因可能发挥不同作用,而DNA甲基化可能是调节SEPT9不同转录本差异表达的机制之一。
DNA甲基化包括高甲基化和低甲基化,通常认为高甲基化导致基因沉默、蛋白表达减少,低甲基化则引起基因激活、蛋白表达增多。Wasserkort等[13]对不同性质结肠病变的SEPT9基因及其临近部位共8个区域的甲基化状态进行检测,发现在CRC和腺瘤组织上皮细胞中,SEPT9基因高甲基化集中发生于v2转录本的CpG岛3(CGI3),这也是Epi proColon试剂盒(德国Epigenomics AG)SEPT9基因甲基化检测的靶片段。在CRC组织中,高甲基化从CGI3的核心区域扩展至5’末端,而在腺瘤组织中,5’末端无高甲基化表现,表明高甲基化区域的扩展可能是腺瘤进展至CRC过程中的晚期事件,这可能是SEPT9基因甲基化检测在腺瘤中的敏感性明显低于CRC的原因。
鉴于SEPT9基因异常甲基化不仅发生在CRC中,Grützmann等[14]对多种恶性肿瘤患者的血浆SEPT9基因甲基化情况进行了比较,发现CRC患者甲基化阳性率为72%(90/125),而非CRC恶性肿瘤患者阳性率仅为11.5%(11/96),为SEPT9基因甲基化作为CRC的特异性诊断指标提供了依据。
三、SEPT9基因甲基化检测筛查结直肠肿瘤的临床研究
2008年至今,国内外不同研究小组发表了一系列通过检测SEPT9基因甲基化筛查早期CRC的临床研究,尤其是第二代检测试剂盒Epi proColon 2.0应用以来,其敏感性进一步提高至79.3%(2/3算法)~95.6%(1/3算法),特异性达到84.8%(1/3算法)~98.9%(2/3算法)[4]。1/3算法即3次PCR反应中有1次阳性即判定为SEPT9基因甲基化阳性,2/3算法则为3次反应中有2次或以上阳性判定为阳性。1/3算法虽能保证高敏感性,但导致特异性降低[4-5]。在CRC筛查过程中,筛查手段的高特异性有利于排除非癌样本以避免不必要的结肠镜检查,可能漏诊的高危人群则可通过定期复查FOBT得到补偿[1]。因此,Epi proColon 2.0试剂盒使用手册推荐使用2/3算法,一系列采用该算法的国内外研究[4,15-18]显示其敏感性为 71.1%~79.3%,特异性为 87.4%~98.9%(表1)。目前该试剂盒已完成国产化,降低了检测成本,并对检测过程作了简化,将原有的2~3次PCR反应简化至1次,避免了算法对检测结果的影响。北京协和医院吴东等[19]的研究显示,采用简化算法的国产化试剂盒在中国人群中的诊断敏感性和特异性分别达到80.0%和95.3%。最新关于外周血SEPT9基因甲基化检测诊断CRC准确性的系统综述显示,其总体敏感性为71%(95% CI:67%~75%),特异性为92%(95% CI:89%~94%),在不同检测方法和技术中,Epi proColon 2.0和2/3算法检出CRC最为有效;对于癌前病变的筛查,腺瘤敏感性为11%~19%,特异性为85%~94%,息肉敏感性为3%~8%,特异性为90%~97%,敏感性均较低,提示SEPT9基因甲基化检测对CRC癌前病变的诊断价值有限[20]。
外周血SEPT9基因甲基化在不同临床分期CRC中的阳性率见表2。相关meta分析表明,该项检测在Ⅰ、Ⅱ、Ⅲ、Ⅳ期CRC中的阳性率分别为45%、70%、76%和79%[20],表明对于早期CRC,SEPT9基因甲基化检测仍有一定的检出率,可为诊断提供依据。甲基化阳性率总体上随CRC临床分期的进展而升高,可能与原发病灶肿瘤细胞坏死和凋亡随疾病进展而增多,释放至外周血中的甲基化SEPT9基因DNA量增加有关。
表1外周血SEPT9基因甲基化检测筛查CRC的临床研究(Epi proColon 2.0试剂盒,2/3算法)
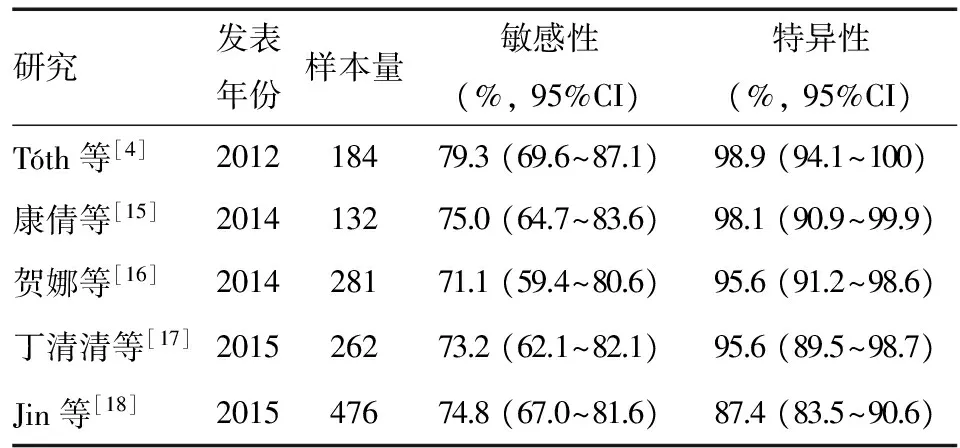
研究发表年份样本量敏感性(%,95%CI)特异性(%,95%CI)Tóth等[4]201218479.3(69.6~87.1)98.9(94.1~100)康倩等[15]201413275.0(64.7~83.6)98.1(90.9~99.9)贺娜等[16]201428171.1(59.4~80.6)95.6(91.2~98.6)丁清清等[17]201526273.2(62.1~82.1)95.6(89.5~98.7)Jin等[18]201547674.8(67.0~81.6)87.4(83.5~90.6)
表2不同临床分期CRC外周血SEPT9基因甲基化检测阳性率(%)
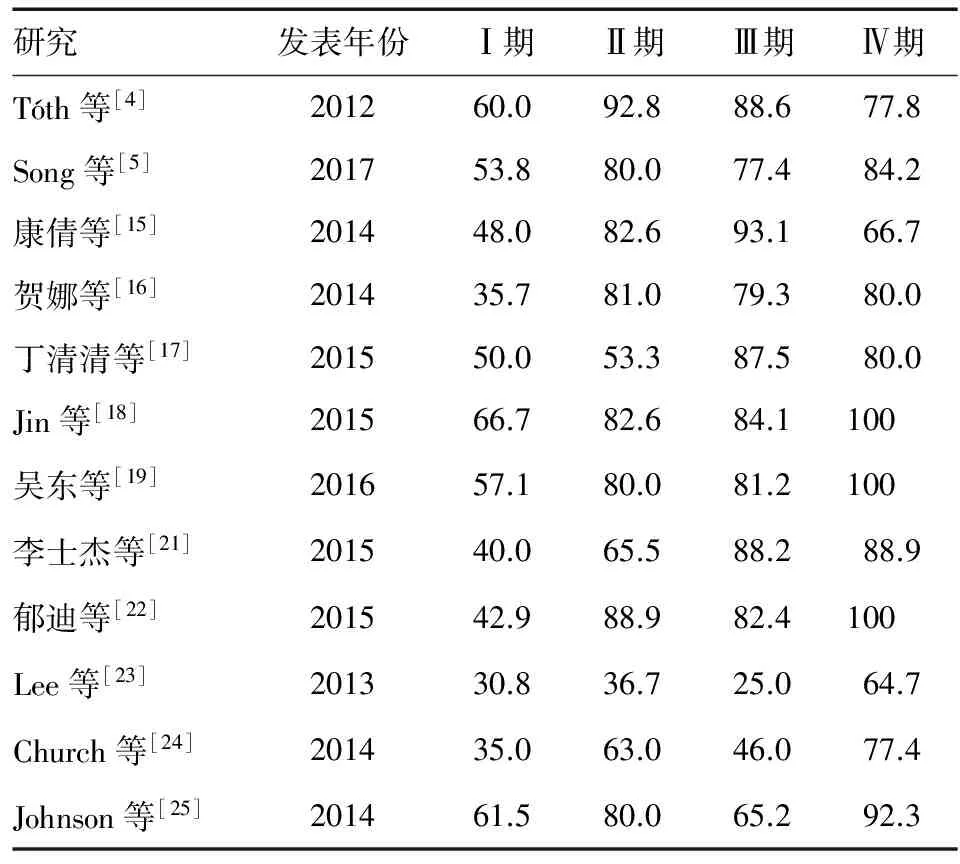
研究发表年份Ⅰ期Ⅱ期Ⅲ期Ⅳ期Tóth等[4]201260.092.888.677.8Song等[5]201753.880.077.484.2康倩等[15]201448.082.693.166.7贺娜等[16]201435.781.079.380.0丁清清等[17]201550.053.387.580.0Jin等[18]201566.782.684.1100吴东等[19]201657.180.081.2100李士杰等[21]201540.065.588.288.9郁迪等[22]201542.988.982.4100Lee等[23]201330.836.725.064.7Church等[24]201435.063.046.077.4Johnson等[25]201461.580.065.292.3
2013年结束的一项纳入来自美国和德国32个医疗机构的7 941例50岁及以上无症状人群的大样本CRC筛查研究[24]结果显示,血浆SEPT9基因甲基化筛查CRC的敏感性为48.2%(95% CI:32.4%~63.6%),明显低于上文中多项回顾性验证研究得出的敏感性。该研究的筛查对象为无症状人群,代表了外周血SEPT9基因甲基化检测应用于一般风险人群CRC筛查的实际操作情况,其结果有更好的指导意义。
Lee等[23]的研究观察了CRC患者根治性手术前后血浆SEPT9基因甲基化水平的变化,发现在近4个月的随访期内,9例术前甲基化阳性者中有8例转阴(88.9%),且生存分析显示SEPT9甲基化水平与CRC术后无病生存期呈显著负相关。尽管该研究样本量较小,但提供了外周血SEPT9基因甲基化作为CRC术后复发监测指标的研究思路,该指标能否作为CRC放化疗效果的评估指标有待进一步研究。
四、SEPT9基因甲基化检测与目前常用CRC筛查方法的比较
目前CRC筛查方法主要有粪便检测(FOBT、粪便miRNAs、粪便DNA等)、血清糖蛋白类肿瘤标记物和结肠镜检查。FOBT包括FIT和gFOBT两种检测方式,前者敏感性和特异性更高,分别达到79%~89%和92%~94%[3]。意大利一项研究[26]显示,以FIT为基础的筛查方案能显著降低CRC死亡率并提高早期手术治疗率。但FIT的应用存在一定局限性,如易受其他出血性疾病影响,且有证据显示,由于血红蛋白的降解,粪便在肠道内积存时间过长或检测与取样时间间隔过久可致假阴性率明显升高[27]。多项研究比较了外周血SEPT9基因甲基化检测和FIT单独或联合应用于CRC筛查的诊断效能,结果显示单独应用SEPT9、FIT的敏感性分别为73.3%~81.5%和53.8%~88.9%,特异性分别为81.5%~95.3%和54.1%~97.4%[15,18-19,22,25],两者联合 诊断的敏感性和特异性则分别为88.7%~97.8%和 52.9%~78.8%[19,25],SEPT9甲基化在特异性方面优于FIT,而联合检测有助于进一步提高敏感性。近年来粪便miRNAs和DNA检测成为研究热点。在CRC的发生、发展过程中,患者粪便中可观察到miRNAs和DNA的持续改变。相关meta分析显示粪便miRNAs在亚洲人群CRC筛查中的敏感性和特异性分别为79.5%(95% CI:76.8%~84.4%)和81.9%(95% CI:79.1%~84.4%)[28],而粪便DNA的敏感性和特异性分别为85%~92%和90%~95%[29]。但粪便miRNAs和DNA检测方法复杂,价格较高,结果受粪便样本质量影响较大,可能需多次检测,难以在人群筛查中推广应用。
临床上用于CRC筛查的糖蛋白类肿瘤标记物主要包括CEA、CA19-9、CA125、CA724和CA242。余捷凯等[30]筛选出的由CEA、CA19-9、CA242、CA211和CA724五个肿瘤标记物组成的诊断模型筛查CRC的敏感性和特异性分别为83%和95%,与外周血SEPT9基因甲基化检测相近,而最常用的单项血清肿瘤标记物CEA的敏感性和特异性均低于SEPT9基因甲基化检测[4,16,21-22]。
结肠镜联合活检病理检查是诊断CRC的金标准。近年来,结直肠肿瘤的内镜下治疗技术日渐成熟,内镜黏膜切除术(EMR)、内镜黏膜下剥离术(ESD)等内镜手术治疗在结直肠癌前病变中的应用逐渐增多。但采用结肠镜进行大规模人群筛查需消耗大量医疗资源,加之结肠镜检查要求彻底的肠道准备以保证观察视野清晰,并存在禁忌证和并发症风险,患者依从性差。因此,目前我国共识推荐的早期CRC筛查流程是先对筛查人群进行危险分层,低危人群先选择FIT和(或)SEPT9基因甲基化检测,高危人群直接进行结肠镜精查[1]。
五、结语
大量临床数据证实外周血SEPT9基因甲基化检测对于诊断CRC有较高的敏感性和特异性,可用于早期CRC筛查,其结果不受性别和肿瘤部位影响,并能指导后续筛查方法的选择,提高人群对结肠镜检查的依从性。但对于结直肠腺瘤、息肉等癌前病变的筛查,其应用价值有限。SEPT9基因甲基化检测在CRC术后复发和放化疗效果评估中的应用潜力,尚需大量临床数据加以验证。
1 中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜学专业委员会.中国早期结直肠癌筛查及内镜诊治指南(2014,北京)[J].中华医学杂志,2015,95 (28):2235-2252.
2 American Cancer Society.Colorectal Cancer Facts & Figures 2011-2013[R].Atlanta,GA:American Cancer Society,2011:7-8.
3 姜岩松,刘国祥,黄慧瑶,等.免疫法粪便隐血试验检测大肠癌准确度的Meta分析[J].中华预防医学杂志,2015,49 (5):392-398.
4 Tóth K,Sipos F,Kalmár A,et al.Detection of methylated SEPT9 in plasma is a reliable screening method for both left- and right-sided colon cancers[J].PLoS One,2012,7 (9):e46000.
5 Song L,Jia J,Yu H,et al.The performance of the mSEPT9 assay is influenced by algorithm,cancer stage and age,but not sex and cancer location[J].J Cancer Res Clin Oncol,2017,143 (6):1093-1101.
6 Neubauer K,Zieger B.The Mammalian Septin Interactome[J].Front Cell Dev Biol,2017,5:3.
7 Longtine MS,DeMarini DJ,Valencik ML,et al.The septins:roles in cytokinesis and other processes[J].Curr Opin Cell Biol,1996,8 (1):106-119.
8 Kim MS,Froese CD,Estey MP,et al.SEPT9 occupies the terminal positions in septin octamers and mediates polymerization-dependent functions in abscission[J].J Cell Biol,2011,195 (5):815-826.
9 Estey MP,Di Ciano-Oliveira C,Froese CD,et al.Distinct roles of septins in cytokinesis:SEPT9 mediates midbody abscission[J].J Cell Biol,2010,191 (4):741-749.
10 Tóth K,Galamb O,Spisák S,et al.The influence of methylated septin 9 gene on RNA and protein level in colorectal cancer[J].Pathol Oncol Res,2011,17 (3):503-509.
11 Connolly D,Yang Z,Castaldi M,et al.Septin 9 isoform expression,localization and epigenetic changes during human and mouse breast cancer progression[J].Breast Cancer Res,2011,13 (4):R76.
12 Scott M,McCluggage WG,Hillan KJ,et al.Altered patterns of transcription of the septin gene,SEPT9,in ovarian tumorigenesis[J].Int J Cancer,2006,118 (5):1325-1329.
13 Wasserkort R,Kalmar A,Valcz G,et al.Aberrant septin 9 DNA methylation in colorectal cancer is restricted to a single CpG island[J].BMC Cancer,2013,13:398.
14 Grützmann R,Molnar B,Pilarsky C,et al.Sensitive detection of colorectal cancer in peripheral blood by septin 9 DNA methylation assay[J].PLoS One,2008,3 (11):e3759.
15 康倩,金鹏,杨浪,等.外周血游离DNA中Septin9基因甲基化在结直肠癌筛查中的意义[J].中华医学杂志,2014,94 (48):3839-3841.
16 贺娜,褚文慧,李永奇,等.血浆甲基化Sept9基因检测在结直肠癌诊断中的临床意义[J].中华消化杂志,2014,34 (11):726-731.
17 丁清清,张皓,许海尘,等.胞裂蛋白9基因甲基化在老年人群结直肠癌筛查中的意义[J].中华老年医学杂志,2015,34 (12):1348-1350.
18 Jin P,Kang Q,Wang X,et al.Performance of a second-generation methylated SEPT9 test in detecting colorectal neoplasm[J].J Gastroenterol Hepatol,2015,30 (5):830-833.
19 吴东,杨红,李玥,等.外周血甲基化Septin9基因联合粪便免疫化学试验对专科门诊患者结直肠癌和腺瘤的筛查[J].中华消化杂志,2016,36 (2):107-112.
20 Nian J,Sun X,Ming S,et al.Diagnostic Accuracy of Methylated SEPT9 for Blood-based Colorectal Cancer Detection:A Systematic Review and Meta-Analysis[J].Clin Transl Gastroenterol,2017,8 (1):e216.
21 李士杰,刘艳刚,王警,等.外周血Septin9基因甲基化检测在结直肠癌筛查中的应用[J].中国普通外科杂志,2015,24 (12):1756-1760.
22 郁迪,张小虎,鲁辛辛.血清SEPT9基因甲基化检测在结直肠癌诊断中的应用[J].临床检验杂志,2015,33 (9):687-689.
23 Lee HS,Hwang SM,Kim TS,et al.Circulating methylated septin 9 nucleic Acid in the plasma of patients with gastrointestinal cancer in the stomach and colon[J].Transl Oncol,2013,6 (3):290-296.
24 Church TR,Wandell M,Lofton-Day C,et al; PRESEPT Clinical Study Steering Committee,Investigators and Study Team.Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer[J].Gut,2014,63 (2):317-325.
25 Johnson DA,Barclay RL,Mergener K,et al.Plasma Septin9 versus fecal immunochemical testing for colorectal cancer screening:a prospective multicenter study[J].PLoS One,2014,9 (6):e98238.
26 Zorzi M,Fedeli U,Schievano E,et al.Impact on colorectal cancer mortality of screening programmes based on the faecal immunochemical test[J].Gut,2015,64 (5):784-790.
27 van Rossum LG,van Rijn AF,van Oijen MG,et al.False negative fecal occult blood tests due to delayed sample return in colorectal cancer screening[J].Int J Cancer,2009,125 (4):746-750.
28 Yan L,Zhao W,Yu H,et al.A Comprehensive Meta-Analysis of MicroRNAs for Predicting Colorectal Cancer[J].Medicine (Baltimore),2016,95 (9):e2738.
29 Iannone A,Losurdo G,Pricci M,et al.Stool Investi-gations for Colorectal Cancer Screening:From Occult Blood Test to DNA Analysis[J].J Gastrointest Cancer,2016,47 (2):143-151.
30 余捷凯,杨美琴,姜铁军,等.血清肿瘤标志物优化组合人工神经网络模型在大肠癌诊断中的应用[J].浙江大学学报(医学版),2004,33 (5):407-410.
(2017-05-05收稿;2017-05-19修回)
ProgressinApplicationofPeripheralBloodMethylatedSEPT9GeneAssayforColorectalCancerScreening
LENGXia,CHENWeichang.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,JiangsuProvince(215006)
CHEN Weichang,Email:weichangchen@126.com
The early detection and diagnosis of colorectal cancer (CRC) is of great clinical importance.Peripheral blood methylated SEPT9 gene was found to be a sensitive and specific biomarker for CRC and was superior to other commonly used screening methods such as fecal occult blood test,serum tumor markers and colonoscopy in a variety of studies.But it is of limited value in screening of adenomas,polyps and other precursors of CRC,and its capacities for assessment of cancer recurrence and therapeutic effects of radiotherapy and chemotherapy need further clinical validation.This article reviewed the progress in application of peripheral blood methylated SEPT9 gene assay for CRC screening.
Colorectal Neoplasms; Screening; Early Diagnosis; DNA Methylation; SEPT9 Gene
10.3969/j.issn.1008-7125.2017.10.009
*Email:20155232024@stu.suda.edu.cn
#本文通信作者,Email:weichangchen@126.com
