英夫利西单抗在HBV感染炎症性肠病患者中使用的安全性
2017-11-11戴张晗王天蓉冉志华
戴张晗 王天蓉 郑 青 冉志华
上海交通大学医学院附属仁济医院消化内科(200127)
·论 著·
英夫利西单抗在HBV感染炎症性肠病患者中使用的安全性
戴张晗*王天蓉 郑 青 冉志华#
上海交通大学医学院附属仁济医院消化内科(200127)
乙型肝炎病毒; 炎症性肠病; 英夫利西单抗; 免疫抑制剂; 抗病毒治疗; 安全
流行病学资料显示全世界超过20亿的人口感染乙型肝炎病毒(hepatitis B virus,HBV),亚洲(主要是中国)、非洲和中东地区的感染率明显高于西方国家[1-2]。2009年中国调查资料显示,1~59岁中国人群的HBsAg阳性率为7.2%,人群中34.1%存在HBV现症或既往感染(HBcAb阳性)[3]。HBV复燃亦称HBV再激活,定义为既往HBV-DNA水平稳定或检测不到的患者病毒复制突然升高10倍及以上,伴或不伴肝脏炎症坏死。HBV复燃现象主要发生于免疫抑制治疗过程中,包括化疗、器官移植后治疗和自身免疫性疾病的治疗。免疫抑制治疗过程中发生HBV复燃可能是致命的,给需接受免疫抑制治疗的HBV感染患者的用药带来极大的安全隐患。研究发现部分细胞毒药物、大剂量激素和生物制剂,特别是CD20单克隆抗体如利妥昔单抗(rituximab)、奥法木单抗(ofatumumab)引起HBV复燃的风险较高,而部分免疫抑制剂如甲氨蝶呤(methotrexate,MTX)、硫唑嘌呤(azathioprine,AZA)等引起HBV复燃的风险较低[4]。
炎症性肠病(inflammatory bowel disease,IBD)是一组病因不明的自身免疫性疾病,其发生、发展与机体免疫功能紊乱有直接联系,目前主要内科治疗药物包括美沙拉嗪、激素、免疫抑制剂和生物制剂。近年对IBD的治疗倾向于“降阶梯”策略,即对部分被评估为高复发和疾病活动风险的患者优先考虑采用生物制剂治疗[5],此种治疗思路使得生物制剂在IBD的治疗中得以推广和广泛应用。目前中国国家食品药品监督管理局批准用于治疗IBD的生物制剂是肿瘤坏死因子-α(TNF-α)单克隆抗体英夫利西单抗(infliximab,IFX)。既往国外文献报道克罗恩病(Crohn’s disease,CD)患者在IFX治疗过程中出现HBV复燃,可导致严重肝功能损害,甚至因肝功能衰竭致死[6]。因此,研究IFX在合并HBV感染IBD患者中使用的安全性具有重要意义。本研究对合并HBV感染IBD患者使用IFX治疗时的HBV复燃情况进行单中心回顾性分析。
对象与方法
一、研究对象
回顾性连续选取2014年3月—2017年3月上海交通大学医学院附属仁济医院消化内科入院诊断为IBD的住院患者1 388例,出院诊断包括CD、溃疡性结肠炎(ulcerative colitis,UC)和未定型IBD。排除未使用IFX者1 194例和HBcAb阴性患者166例,最终共28例HBcAb阳性、接受IFX治疗的IBD患者纳入研究。
二、方法
采集入组患者相关临床资料,包括疾病诊断、疾病分型、治疗前肝功能、HBV复制情况、IFX使用疗程和联合用药情况等,以及出院后每2~6个月随访复查的病毒复制和肝功能情况。
肝功能指标包括ALT、AST、总胆红素和白蛋白,采用罗氏Cobas8000 c701全自动生化分析仪进行 检测。HBV相关指标包括HBsAg、HBsAb、HBcAb、HBeAg、HBeAb五项和HBV-DNA,分别采用雅培ARCHITECT i2000SR免疫发光检测系统和ABI PRISM®7700 PCR仪进行检测。
HBV感染状态包括现症感染和既往感染,现症感染包括慢性乙型肝炎和非活动性HBsAg阳性携带状态;既往感染定义为HBcAb阳性同时HBsAg阴性。HBV复燃定义为在原有HBV现症感染或既往感染状态下,HBV-DNA升高10倍以上或HBsAg由阴转阳。
根据治疗前HBV血清学将患者分为3组,对其IFX使用中和使用后的HBV复燃情况进行回顾性分析。
三、统计学分析
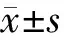
结 果
一、一般资料
194例采用IFX进行诱导缓解和维持缓解治疗的IBD患者中28例合并HBV现症或既往感染,总体感染率为14.4%,现症感染率为4.6%(9/194)。28例患者中男性22例,女性6例,平均年龄(36.36±7.35)岁,CD 27例,UC 1例。21例患者经1次诱导治疗,6例经2次诱导治疗,1例仅单次输注IFX。IFX剂量为5 mg/kg,平均疗程(6.96±3.47)次,中位疗程6.5次,平均随访时间(15.32±10.47)个月,中位随访时间13.5个月。15例(53.6%)患者接受预防性抗病毒治疗,其中1例使用拉米夫定(lamivudine,LAM),14例使用恩替卡韦(entecavir,ETV)。
CD蒙特利尔分型:确诊年龄≤16岁(A1)0例;17~40岁(A2)21例(77.8%);>40岁(A3)6例(22.2%)。病变部位:回肠末段(L1)9例(33.3%);结肠(L2)4例(14.8%);小肠结肠(L3)14例(51.9%);上消化道累及(L4)0例。疾病行为:炎症(B1)7例(25.9%),B1p(肛周病变)10例(37.0%);狭窄(B2)4例(14.8%),B2p 3例(11.1%);穿透(B3)3例(11.1%),B3p 0例。1例UC患者蒙特利尔分型为广泛结肠炎(E3)。
二、根据HBV血清学的分组分析
1.HBsAg阳性、HBV-DNA阳性:5例患者IFX治疗前HBsAg阳性,同时能检测到不同程度的HBV-DNA,其中1例患者为HBeAg阳性,4例为HBeAb阳性。患者具体临床情况见表1。5例患者均采用ETV预防性抗病毒治疗,中位随访时间10个月(7~16个月),均未观察到HBV复燃现象。
2.HBsAg阳性、HBV-DNA阴性:4例患者IFX治疗前HBsAg阳性,但检测不到HBV-DNA,HBeAg均为阴性。患者具体临床情况见表2。4例患者均采用预防性抗病毒治疗,其中1例使用LAM,3例使用ETV,中位随访时间29.5个月(22~36个月)。1例患者(编号2)经6次IFX和4个月的AZA协同治疗后出现HBV复燃,表现为病毒复制数升高100倍,但肝功能保持正常。检测到HBV-DNA升高后即暂停IFX治疗,停用原有抗病毒药物LAM并更换为ETV,1个月后复查HBV-DNA降至检测下限。
3.HBsAg阴性、HBV-DNA阴性:19例患者IFX治疗前HBsAg阴性,且检测不到HBV-DNA。患者具体临床情况见表3。6例患者采用ETV预防性抗病毒治疗,13例未采用抗病毒治疗,平均IFX疗程(6.26±3.42)次,平均随访时间(13.63±10.22)个月,中位随访时间10个月,均未观察到HBV复燃。
三、IFX与免疫抑制剂协同治疗患者分析
3组患者中共10例(35.7%)在IFX治疗过程中加用免疫抑制剂,其中9例使用AZA,1例使用MTX,平均IFX与免疫抑制剂协同作用时间为(8.00±14.20)个月(2~24个月),中位时间为5个月。10例协同治疗者中1例在协同治疗4个月后发生HBV复燃,复燃率为10.0%,28例入组患者总体复燃率为3.6%(1/28)。
讨 论
中国位于HBV感染率较高的东亚地区,2009年的大型流行病学调查显示34.1%的中国人存在HBV现症感染或既往感染。虽然目前尚缺乏最新全国数据,但2016年发表的一项针对华南地区、有超过16万社区人群参与的大型流行病学调查显示HBV现症感染 (HBsAg阳性)率为8.76%[7]。笔者所在研究中心开展的一项回顾性研究[8]发现,中国IBD患者中HBV现症/既往感染率高达40.62%,明显高于非IBD人群的27.58%。目前IBD的主要治疗药物包括美沙拉嗪、激素、免疫抑制剂和生物制剂,其中生物制剂系通过作用于某种特定的生物因子发挥免疫抑制作用,对控制疾病活动有良好的疗效。但生物制剂的主要不良反应之一即为增加机会感染的风险和使之前机体中的隐匿/稳定感染再次活动或复燃,包括引起HBV复燃。IFX治疗时发生HBV复燃最早的病例报道是在2003年,系1例同时使用IFX和MTX的HBsAg阳性类风湿关节炎患者出现HBV复燃[9]。随后2004年《Gut》杂志发表了3例接受IFX治疗的合并慢性HBV感染CD患者病毒复燃情况的报道,2例IFX撤药后HBV复燃者中1例死亡[6]。Urata等[10]的前瞻性研究纳入422例类风湿关节炎患者,发现135例合并HBV既往感染者中有7例在12个月内出现HBV复燃, HBV复燃者的生物制剂使用率显著高于未复燃者(85.7%对36.0%,P=0.008),使用生物制剂者的病毒复燃风险比(HR)高达10.9(P=0.008)。近年一项系统分析共纳入257例接受TNF-α单抗治疗的HBV感染患者(HBsAg阳性89例,HBcAb阳性168例),其中现症和既往感染者分别有35例(39%)和9例(5%)发生HBV复燃,现症感染者复燃率更高;共6例患者出现急性肝功能衰竭,其中5例为现症感染者[11]。该研究中HBV总体复燃率为16%,高于本研究的3.6%,推测可能与本组半数以上患者(15例)接受预防性抗病毒治疗,而该研究纳入分析的患者仅18.3%(47例)接受预防性抗病毒治疗有关。HBV复燃率的降低得益于更广泛的预防性抗病毒治疗。

表1 使用IFX治疗的HBV现症感染、HBV-DNA阳性IBD患者的临床资料(n=5)

表2 使用IFX治疗的HBV现症感染、HBV-DNA阴性IBD患者的临床资料(n=4)

表3 使用IFX治疗的HBV既往感染IBD患者的临床资料(n=19)
我国部分IBD患者因经济原因而不能长期使用IFX进行维持治疗,在初始使用IFX诱导缓解后,之后的维持缓解阶段转为采用免疫抑制剂,如AZA、MTX、沙利度安等[12]。在免疫抑制剂的HBV复燃风险等级分层中,AZA和MTX均被列为低风险[4]。美国胃肠病学会相关指南并不推荐使用HBV复燃低风险免疫抑制剂的患者采用预防性抗病毒治疗[13]。由于部分免疫抑制剂起效较慢,临床上会在IFX撤药前加用免疫抑制剂,因此治疗过程中存在生物制剂与免疫抑制剂协同作用的时期。目前对协同治疗是否会增加HBV复燃风险尚无定论,但临床观察显示大部分既往感染病例的复燃都是在TNF-α单抗与免疫抑制剂联合使用的情况下发生的[14]。对相关文献的系统分析亦发现,在使用TNF-α单抗的患者中,HBV复燃大多发生在免疫抑制剂协同治疗过程中,特别是在联合使用激素、钙调磷酸酶抑制剂(calcineurin inhibitors,CNIs)等免疫抑制剂的情况下[11]。Loras等[15]发表于《Gut》的研究指出,使用≥2种免疫抑制剂是合并HBV现症感 染IBD患者病毒复燃的独立危险因素(OR=8.75,95% CI: 1.16~65.66)。本组28例患者中,惟一1例HBV复燃者就是在IFX与AZA协同治疗4个月后发生的。尽管本研究仅在单一个体中观察到HBV复燃现象,但对多种免疫抑制剂协同治疗引起HBV复燃的可能性仍应加以关注。建议在联合使用生物制剂与免疫抑制剂时,HBV现症感染患者加用抗病毒治疗;HBV既往感染患者如联合使用HBV复燃中高风险免疫抑制剂(如激素、CNIs),亦需采用预防性抗病毒治疗,如联合使用HBV复燃低风险免疫抑制剂(如AZA、MTX),则需密切监测肝功能和HBV-DNA,以便早期发现HBV复燃迹象,及时加用抗病毒治疗。
HBV复燃的机制尚未完全明确,目前认为主要与机体自身免疫对病毒复制的监管缺失有关。在HBV感染过程中,TNF-α表现出一定的抗病毒作用,与干扰素-γ(IFN-γ)协同作用可抑制HBV复制,对将HBV从肝细胞中清除亦非常关键[16]。因此在活动性乙型肝炎患者中,使用TNF-α单抗可增加病毒复制,导致肝功能损害甚至肝功能衰竭。而在HBV既往感染患者中,病毒可在肝细胞内长期存活,因此HBsAg阴性患者亦可出现HBV复燃。本组19例HBcAb阳性、HBsAg阴性的既往感染患者无一例出现HBV复燃,1例HBV复燃患者为HBV现症感染,尽管已采用预防性抗病毒治疗,但仍在IFX与AZA协同治疗过程中出现病毒复燃。分析复燃原因为原有抗病毒药物LAM耐药。在更换抗病毒药物后,患者HBV-DNA再次降至检测下限。2014年《JAMA》杂志发表的一项多中心非盲随机对照Ⅲ期临床试验对比了ETV与LAM在HBsAg阳性生物制剂联合化疗淋巴瘤患者中预防HBV复燃的效果,结果发现ETV组患者复燃率显著低于LAM组(6.6%对30%,P=0.001),ETV较之LAM对预防延迟发生的HBV复燃效果亦更好(0%对8.3%,P=0.03)[17]。美国胃肠病学会相关指南指出,对于免疫抑制剂治疗中的预防性抗病毒治疗,建议使用耐药率较低的核苷类抗病毒药物[13]。结合本研究结果,笔者建议合并HBV感染的IBD患者在使用IFX治疗时,预防性抗病毒药物首选低耐药率的ETV或替诺福韦(tenofovir);已采用预防性抗病毒治疗的患者需定期检测肝功能和HBV-DNA,以及时发现抗病毒药物耐药引起的HBV复燃。至今已有多篇专家述评或共识建议对使用TNF-α单抗治疗的患者进行HBV筛查,并予合并HBV现症感染者预防性抗病毒治疗,而既往感染患者则需对复燃进行密切监测[4,13,18-19]。欧洲肝脏研究学会2017年最新发布的HBV感染处理临床实践指南对采用免疫抑制治疗的乙型肝炎患者亦提出类似建议[20]。该指南同时提出在高HBV复燃风险的HBsAg阴性、HBcAb阳性既往感染患者中采用预防性抗病毒治疗。最新欧洲克罗恩病和结肠炎组织(ECCO)发布的IBD诊治共识同样对预防性抗病毒治疗作了说明[21]。关于预防性抗病毒治疗的药物选择、停药时间和应用范围,目前尚无统一意见,需进一步开展基础和临床研究加以明确。
综上所述,本研究通过对28例合并HBV现症/既往感染并接受IFX治疗的IBD患者的回顾性分析,发现1例HBV现症感染IBD患者在采用LAM预防性抗病毒治疗的情况下,经6次IFX和4个月的AZA协同治疗后出现HBV-DNA升高。结合本研究发现以及既往研究和共识中的观点和意见,建议使用IFX治疗的IBD患者应筛查HBV感染状态;合并HBV感染的IBD患者在IFX与免疫抑制剂协同治疗的情况下可选用低耐药率的抗病毒药物(如ETV)行预防性抗病毒治疗,更广泛的预防性抗病毒治疗有助于降低HBV复燃率。
1 Goldstein ST,Zhou F,Hadler SC,et al.A mathematical model to estimate global hepatitis B disease burden and vaccination impact[J].Int J Epidemiol,2005,34 (6):1329-1339.
2 André F.Hepatitis B epidemiology in Asia,the Middle East and Africa[J].Vaccine,2000,18 Suppl 1:S20-S22.
3 Liang X,Bi S,Yang W,et al.Reprint of:Epidemiological serosurvey of Hepatitis B in China -- declining HBV prevalence due to Hepatitis B vaccination[J].Vaccine,2013,31 Suppl 9:J21-J28.
4 Di Bisceglie AM,Lok AS,Martin P,et al.Recent US Food and Drug Administration warnings on hepatitis B reactivation with immune-suppressing and anticancer drugs:just the tip of the iceberg?[J].Hepatology,2015,61 (2):703-711.
5 Gomollón F,Dignass A,Annese V,et al; ECCO.3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016:Part 1:Diagnosis and Medical Management[J].J Crohns Colitis,2017,11 (1):3-25.
6 Esteve M,Saro C,González-Huix F,et al.Chronic hepatitis B reactivation following infliximab therapy in Crohn’s disease patients:need for primary prophylaxis[J].Gut,2004,53 (9):1363-1365.
7 Zeng F,Guo P,Huang Y,et al.Epidemiology of hepatitis B virus infection:results from a community-based study of 0.15 million residents in South China[J].Sci Rep,2016,6:36186.
8 Huang ML,Xu XT,Shen J,et al.Prevalence and factors related to hepatitis B and C infection in inflammatory bowel disease patients in China:a retrospective study[J].J Crohns Colitis,2014,8 (4):282-287.
9 Ostuni P,Botsios C,Punzi L,et al.Hepatitis B reactivation in a chronic hepatitis B surface antigen carrier with rheumatoid arthritis treated with infliximab and low dose methotrexate[J].Ann Rheum Dis,2003,62 (7):686-687.
10 Urata Y,Uesato R,Tanaka D,et al.Prevalence of reactivation of hepatitis B virus replication in rheumatoid arthritis patients[J].Mod Rheumatol,2011,21 (1):16-23.
11 Pérez-Alvarez R,Díaz-Lagares C,García-Hernández F,et al; BIOGEAS Study Group.Hepatitis B virus (HBV) reactivation in patients receiving tumor necrosis factor (TNF)-targeted therapy:analysis of 257 cases[J].Medicine (Baltimore),2011,90 (6):359-371.
12 中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].胃肠病学,2012,17 (12):763-781.
13 Reddy KR,Beavers KL,Hammond SP,et al; American Gastroenterological Association Institute.American Gastro-enterological Association Institute guideline on the prevention and treatment of hepatitis B virus reactivation during immunosuppressive drug therapy[J].Gastroen-terology,2015,148 (1):215-219; quiz e16-e17.
14 Gonzalez SA,Perrillo RP.Hepatitis B Virus Reactivation in the Setting of Cancer Chemotherapy and Other Immuno-suppressive Drug Therapy[J].Clin Infect Dis,2016,62 Suppl 4:S306-S313.
15 Loras C,Gisbert JP,Mínguez M,et al; REPENTINA study; GETECCU (GrupoEspaol de Enfermedades de Crohn y Colitis Ulcerosa) Group.Liver dysfunction related to hepatitis B and C in patients with inflammatory bowel disease treated with immunosuppressive therapy[J].Gut,2010,59 (10):1340-1346.
16 Herbein G,O’Brien WA.Tumor necrosis factor (TNF)-alpha and TNF receptors in viral pathogenesis[J].Proc Soc Exp Biol Med,2000,223 (3):241-257.
17 Huang H,Li X,Zhu J,et al.Entecavirvslamivudine for prevention of hepatitis B virus reactivation among patients with untreated diffuse large B-cell lymphoma receiving R-CHOP chemotherapy:a randomized clinical trial[J].JAMA,2014,312 (23):2521-2530.
18 Weinbaum CM,Mast EE,Ward JW.Recommendations for identification and public health management of persons with chronic hepatitis B virus infection[J].Hepatology,2009,49 (5 Suppl):S35-S44.
19 Perrillo RP.Tumor necrosis factor inhibitor therapy for hepatitis B virus-infected individuals:How loud is the alarm bell?[J].Hepatology,2015,62 (1):16-18.
20 European Association for the Study of the Liver.EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection[J].J Hepatol,2017,67 (2):370-398.
21 Magro F,Gionchetti P,Eliakim R,et al; European Crohn’s and Colitis Organisation [ECCO].Third European Evidence-based Consensus on Diagnosis and Management of Ulcerative Colitis.Part 1:Definitions,Diagnosis,Extra-intestinal Manifestations,Pregnancy,Cancer Surveillance,Surgery,and Ileo-anal Pouch Disorders[J].J Crohns Colitis,2017,11 (6):649-670.
(2017-07-11收稿;2017-07-26修回)
SafetyofInfliximabinInflammatoryBowelDiseasePatientsWithHBVInfection
DAIZhanghan,WANGTianrong,ZHENGQing,RANZhihua.
DivisionofGastroenterologyandHepatology,RenjiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai(200127)
RAN Zhihua,Email:zhihuaran@vip.163.com
Hepatitis B Virus; Inflammatory Bowel Disease; Infliximab; Immunosuppressive Agents; Antiviral Therapy; Safety
10.3969/j.issn.1008-7125.2017.10.002
*Email:daizhanghan@163.com
#本文通信作者,Email:zhihuaran@vip.163.com
背景:免疫抑制治疗过程中发生乙型肝炎病毒(HBV)复燃危害重大。合并HVB感染的炎症性肠病(IBD)患者在生物制剂治疗过程中可能发生HBV复燃。目的研究我国合并HBV感染IBD患者在使用英夫利西单抗(IFX)治疗时的HBV复燃情况。方法回顾性连续纳入2014年3月—2017年3月在上海仁济医院诊断为IBD、HBcAb阳性并接受IFX治疗的住院患者,采集相关临床资料和随访信息,观察病毒复制和肝功能变化。结果194例接受IFX治疗的IBD患者中28例合并HBV现症或既往感染,总体感染率为14.4%,现症感染率为4.6%。28例患者平均IFX疗程(6.96±3.47)次,平均随访时间(15.32±10.47)个月。15例(53.6%)患者接受预防性抗病毒治疗,1例使用拉米夫定,14例使用恩替卡韦。10例(35.7%)患者采用IFX与免疫抑制剂协同治疗,其中1例(10.0%)HBV现症感染患者(HBsAg阳性,HBV-DNA阴性)治疗过程中出现HBV复燃。该例患者采用拉米夫定预防性抗病毒治疗,将抗病毒药物更换为恩替卡韦后HBV-DNA降至检测下限。结论使用IFX治疗的IBD患者应筛查HBV感染状态。合并HBV感染者在IFX与免疫抑制剂协同治疗的情况下可选用低耐药率的抗病毒药物行预防性抗病毒治疗,从而降低病毒复燃率。
Background:Reactivation of hepatitis B virus (HBV) in the context of immunosuppressive therapy is serious.Biological agents are known having the effect to increase the risk of HBV reactivation in patients with inflammatory bowel disease (IBD) who are seropositive for HBsAg and/or HBcAb.AimsTo study the HBV reactivation in IBD patients with HBV infection who are treated with infliximab (IFX) in China.MethodsA retrospective study was conducted between March 2014 and March 2017 in Shanghai Renji Hospital.Consecutive IBD patients who were seropositive for HBcAb and treated with IFX were enrolled.The clinical and follow-up data were analyzed and the changes in viral replication and liver function were recorded.ResultsOf the 194 IBD patients treated with IFX,28 had active or prior HBV infection.The overall prevalence of HBV infection was 14.4%,and that of active infection was 4.6%.The mean number of IFX treatment course was 6.96±3.47,and the mean follow-up period was (15.32±10.47) months.Fifteen patients (53.6%)
prophylactic antiviral treatment,one with lamivudine and 14 with entecavir.Ten patients (35.7%) received synergistic treatment with immunosuppressants,of which,one (10.0%) with active HVB infection (HBsAg positive and HBV-DNA negative) suffered HBV reactivation.In this reactivation case,lamivudine antiviral prophylaxis was used initially and the reactivation was resolved when entecavir was used instead of lamivudine.ConclusionsIBD patients receiving IFX treatment should be screened for HBV infection.In patients who are seropositive for HBsAg and/or HBcAb,prophylactic antiviral agents with low resistance rate is recommended for preventing HBV reactivation when IFX and immunosuppressants are synergistically used.
