人羊膜上皮细胞复合去表皮的真皮构建组织工程皮肤修复裸鼠皮肤缺损的实验研究
2017-11-03江蕾微刘志卢彬周文明李远英陆洪光
江蕾微 刘志 卢彬 周文明 李远英 陆洪光
550004贵阳,贵州医科大学附属医院皮肤科
·论著·
人羊膜上皮细胞复合去表皮的真皮构建组织工程皮肤修复裸鼠皮肤缺损的实验研究
江蕾微 刘志 卢彬 周文明 李远英 陆洪光
550004贵阳,贵州医科大学附属医院皮肤科
目的探索由人羊膜上皮细胞(hAEC)、成纤维细胞与去表皮的真皮(DED)构建组织工程皮肤修复裸鼠全层皮肤缺损的可行性。方法采用低浓度胰蛋白酶多步消化分离法提取hAEC,并用两步酶消化法处理健康小儿包皮,获得成纤维细胞悬液,传代培养。将体外扩增培养至第3~5代的成纤维细胞和第2代hAEC分别接种在DED真皮面和基底膜面,体外器官培养构建组织工程皮肤。取3~4周龄健康雄性裸鼠20只,抽签法随机分为2组,在所有小鼠背部正中制备全层皮肤缺损模型。组织工程组用构建的组织工程全层皮肤覆盖创面;对照组创面仅覆盖凡士林油纱。分别于术后第7、14、21、28天对裸鼠全身及移植部位大体观察,比较两组间创面愈合时间及创面愈合率,并对移植部位行组织学观察。结果hAEC具有干细胞特征,免疫荧光显示其表达结合转录因子4(OCT⁃4)、阶段特异性胚胎抗原4(SSEA⁃4)。器官培养2周后,体外构建的组织工程皮肤形成4~9层复层表皮,且表皮的组织结构形态与正常皮肤类似。移植组织工程皮肤至裸鼠创面后肉眼观察显示,在移植后第7、14、21天,组织工程组创面愈合率分别为57.49%±6.11%、92.80%±3.10%、98.83%±0.25%,均明显高于对照组(22.93%±4.26%、54.57%±7.94%、91.16%±4.79%),差异均有统计学意义(n=10,t值分别为27.36、32.23、11.80,均P< 0.001),组织工程组创面愈合时间[(21.51± 1.51)d]明显短于对照组[(28.80± 1.14)d](n=10,t=42.23,P< 0.001),且在移植后第28天移植物颜色与自体皮肤颜色接近。组织学观察显示,组织工程组上皮层次清晰,角化明显,真皮层细胞生长良好;对照组移植区上皮较薄且有部分缺损,真皮层次欠佳,且可见炎症细胞浸润。结论用hAEC、成纤维细胞复合DED构建的组织工程皮肤移植后能在裸鼠体内存活,且创面愈合更佳,可望成为一种较理想的组织工程皮肤。
组织工程;上皮细胞;真皮;皮肤移植;伤口愈合;去表皮真皮;人羊膜上皮细胞
应用组织工程技术构建人工皮肤是解决大面积皮肤缺损患者自体皮肤移植时供皮肤不足问题的最有效的途径之一。因干细胞来源的组织工程皮肤可以不断自我更新和增殖,取得不错的修复效果,很多学者已应用干细胞作为种子细胞来构建组织工程皮肤[1]。但这些干细胞的应用都存在一定限制,如来源、数量、取材创伤等都制约着它的发展。人羊膜上皮细胞(hAEC)是在受精后第8天从外胚叶发育而来,使其可能维持原肠胚形成前期胚胎干细胞的可塑性。故具有一定的三胚层分化潜能。在一定条件下,hAEC不表达 HLA⁃A、B、C或DR抗原,一般认为无免疫原性,移植后几乎不引起排斥反应。hAEC易于分离培养,可在体外大量扩增,且具有干细胞的特性,是一种较为理想的组织工程皮肤种子细胞。我们曾报道用人去表皮的真皮(de⁃epidermized dermis,DED)体外构建组织工程皮肤[2]。DED为富含胶原的三维结构,保留Ⅳ型胶原、板层素等基底膜成分,可诱导种子细胞的发育和分化,在体外皮肤重建中具有较高的应用价值[3]。我们构建hAEC⁃DED全层组织工程皮肤,并把构建好的组织工程皮肤移植于裸鼠创面,从创面愈合率、创面愈合时间、组织病理学等方面评估组织工程皮肤的效果,为临床应用提供实验依据。
材料与方法
一、主要试剂与仪器
低糖型DMEM培养基(美国Gibco生物公司),胎牛血清(美国Hyclone生物公司),表皮生长因子(EGF,美国PeproTech生物公司),波形蛋白抗体(Denmark生物公司),结合转录因子3/4抗体(Oct⁃3/4抗体)、阶段特异性胚胎抗原-4抗体(SSEA⁃4抗体)(美国SantaCruz生物公司)。
二、实验方法
1.hAEC分离培养及生物学特征检测:羊膜组织来自贵州医科大学产科健康孕妇剖宫产足月胎儿的新鲜胎盘(患者知情同意),机械剥离胎盘羊膜组织,尽量使羊膜完整。采用低浓度胰蛋白酶多步消化分离法提取hAEC。将羊膜组织用磷酸盐缓冲液(PBS)反复冲洗后剪成细碎小块,加入0.05%胰蛋白酶-0.02%乙二胺四乙酸(EDTA)溶液,37℃消化10 min,弃消化液以去除杂细胞和细胞碎片。重复上述方法消化上皮细胞,37℃消化30~40 min,200目不锈钢网过滤。收集单细胞悬液,加含10%胎牛血清的培养基终止消化。过滤后组织碎片用同样方法重复消化1次。离心收集的细胞用添加10 μg/L EGF的L⁃DMEM完全培养基在37℃、5%CO2孵箱内培养。24 h后首次换液,此后每3天全量换液1次,约10 d后按常规方法传代培养细胞。第2代hAEC爬片后用4%多聚甲醛固定,分别行Oct⁃3/4、SSEA⁃4免疫荧光检测。
2.成纤维细胞(FB)的分离培养及鉴定:取贵州医科大学附属医院泌尿外科3~15岁健康男性包皮环切术后的正常包皮(患者家属知情同意)组织,分离FB。FB培养方法同文献[4]。取第5代FB进行细胞爬片,4%多聚甲醛固定后行波形蛋白染色。
3.DED的制备及预处理:实验方法同文献[5]。
4.组织工程皮肤构建及组织学特征分析:将经预处理的DED置于6孔板中,DED基底膜面向下,加入hAEC完全培养基(1 ml/孔),用移液器将备好的FB悬液150 μl接种于第1~5孔的DED上,第6孔中DED上加150 μl PBS作为空白对照。置于5%CO2、37℃环境中孵育过夜。然后,把DED翻转,使DED的基底膜面朝上,将备好的hAEC细胞悬液150 μl接种于第1~5孔的DED基底膜面上,第6孔中加入150 μl PBS作为空白对照,每孔再加入hAEC完全培养基浸没DED,置于5%CO2、37℃环境中培养。液下培养3 d,使hAEC达到融合,再将DED置于支撑架上,调整培养基的量,使hAEC在气液界面上生长,5%CO2、37℃环境中继续培养2周。将构建的组织工程皮肤行常规苏木精-伊红(HE)染色。
5.实验动物选择及分组:20只健康雄性BALB/C裸鼠(上海斯莱克实验动物有限责任公司)作为受体,动物合格证号 SCXK(沪)2006⁃0007,3~ 4周龄,体重17~25 g。所有实验用裸鼠均在贵州医科大学动物实验中心SPF条件下饲养。使用前检查有无皮肤疾患。用抽签法随机分为2组,即组织工程组和空白对照组,每组10只。
6.实验动物皮肤缺损模型的建立及植皮:以5%水合氯醛0.01 ml/g腹腔注射,3~5 min后裸鼠进入麻醉状态。待裸鼠麻醉后将其固定,常规用乙醇及聚维酮碘消毒裸鼠背部皮肤,铺洞巾。以裸鼠背部正中为中心点,用眼科剪剪成直径约1 cm的圆形缺损,去除该处全层皮肤后,用青链霉素混合液清洗伤口,立即用构建的组织工程皮肤覆盖组织工程组裸鼠缺损处创面,空白对照组先不覆盖,后均立即用凡士林油纱布覆盖创面,打包缝合创面并稍加压包扎。每只分笼饲养。术后1周拆除纱布包并揭去油纱,常规换药,连续观察4周。
7.术后创面愈合情况观察及组织学检测:术后分别于第1、2、3、4周肉眼观察记录两组创面愈合时间。用透明薄膜法[6]计算两组的创面愈合率,创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%。于术后4周在裸鼠背部术区取材,4%甲醛固定,常规脱水,石蜡包埋,切片,HE染色。
8.统计学分析:采用SPSS19.0统计软件分析,计量资料以x±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
一、细胞培养及鉴定
1.原代培养的hAEC形态及特征:原代hAEC呈扁平多角形,核/质比例小,胞核呈圆形、卵圆形,约6~8 d形成单层,细胞融合成片呈铺路石样(图1A)。免疫荧光示Oct⁃4、SSEA⁃4阳性,且主要表达在高细胞密度区、小克隆区或球体结构区,在hAEC比较稀疏的区域几乎无表达(图1)。
2.原代培养的FB形态及特征:原代培养的FB细胞呈长梭形,多角形或不规则形,2~3 d即呈汇合状态,密度低时细胞之间排列疏松,有较大细胞间隙,细胞密度高时,细胞相互平行排列或呈放射状和漩涡状排列(图2)。FB特异性标志蛋白波形蛋白染色阳性,胞质内见大量棕褐色颗粒,核为蓝色。

图1 人羊膜上皮细胞(hAEC)鉴定1A:hAEC呈铺路石样生长(倒置显微镜×100);1B:免疫荧光示第2代hAEC细胞核表达Oct⁃4蛋白(绿色荧光),且主要在高细胞密度区表达(×40);1C:DAPI染色对图1B进行细胞核定位(×40);1D:免疫荧光示第2代hAEC在细胞表面表达SSEA⁃4蛋白(绿色荧光),且主要在细胞克隆区或球体结构区表达(×40);1E:DAPI染色对图1D进行细胞核定位(× 40)
二、体外重建组织工程皮肤肉眼及组织学观察
组织工程皮肤体外气-液面培养2周后观察,DED表面光滑,上有膜状物形成(图3A)。组织学观察可见DED上有4~9层完整的新生表皮结构。新生表皮结构清晰,层次分明,角质层角化完全,细胞排列整齐。表皮与DED交错,表皮突呈高低不平的乳头状伸入真皮(图3B)。
表1 两组小鼠创面愈合率和愈合时间比较(±s)

表1 两组小鼠创面愈合率和愈合时间比较(±s)
组别n 创面愈合率(%)组织工程组对照组t值P值10 10移植后7 d 57.49±6.11 22.93±4.26 27.36<0.001移植后21 d 98.83±0.25 91.16±4.79 11.80<0.001移植后14 d 92.80±3.10 54.57±7.94 32.23<0.001创面愈合时间(d)21.51±1.51 28.80±1.14 42.23<0.001
三、移植术后动物伤口及存活情况
所有的裸鼠术后均存活,且未出现感染、化脓、体液渗出等不良反应。
四、动物创面愈合情况
见表1。移植后7 d肉眼观察到组织工程皮肤组移植的hAEC⁃DED全层皮肤与自体皮肤能较好地融合,没有观察到组织排异现象,且创面较前明显收缩。移植后第14天肉眼观察,组织工程组创面愈合明显优于对照组,移植物颜色与自体皮肤颜色接近。移植后第21天后,组织工程组创面基本愈合,对照组有部分未愈合的伤口。见图4。移植4周后,肉眼观两组创面均达到完全愈合。移植后第28天组织工程组上皮层次清晰,角化明显,真皮层细胞生长良好(图5A)。空白对照组移植区上皮较薄且有部分缺损,真皮层次欠佳,且可见炎症细胞浸润(图5B)。移植后第7天、14天、21天组织工程组创面愈合率明显高于对照组,且差异具有统计学意义;组织工程组创面愈合时间明显短于对照组,且两者差异有统计学意义。

图2 原代培养的成纤维细胞(FB)形态及特征(倒置显微镜×100) FB呈长梭形,多角形或不规则形
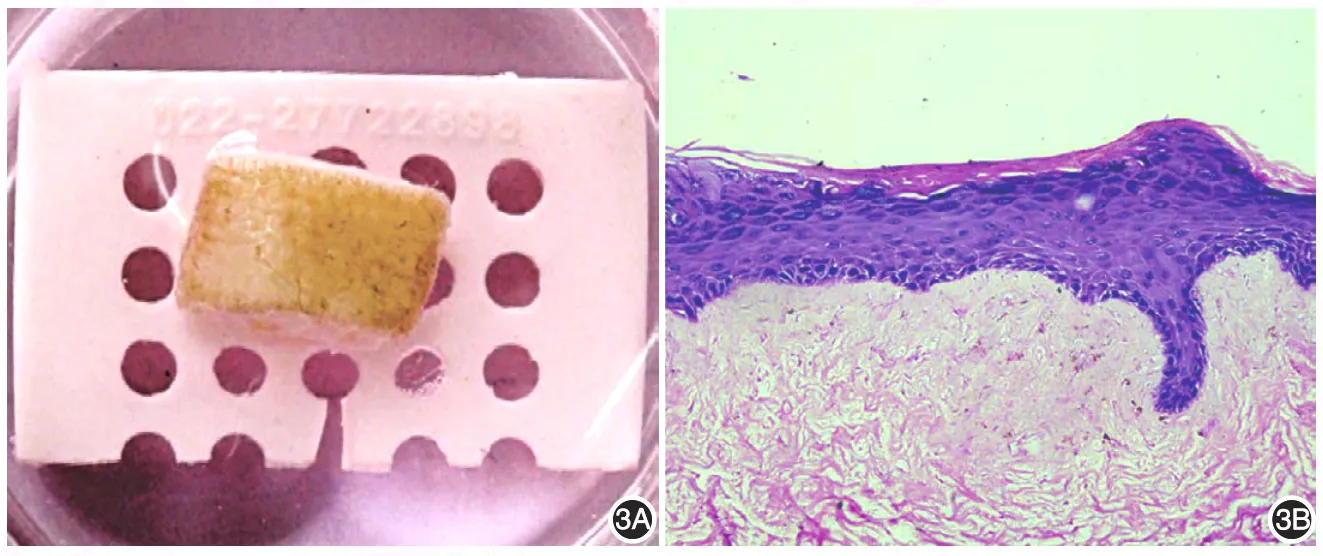
图3 体外重建组织工程皮肤肉眼观及组织学特征 3A:肉眼观去表皮真皮(DED)表面光滑,上有膜状物形成;3B:培养2周后组织学观察示DED上有4~9层完整的新生表皮,结构清晰,层次分明,角质层角化完全,细胞排列整齐。表皮与DED犬牙交错,表皮突呈高低不平的乳头状伸入真皮(HE×100)

图4 裸鼠创面愈合情况 移植后第14天,组织工程组移植的组织工程皮肤与自体皮肤能较好地融合,移植物颜色与自体皮肤颜色接近,且其创面愈合明显优于对照组;移植后第21天,组织工程组创面基本愈合,对照组有部分未愈合伤口
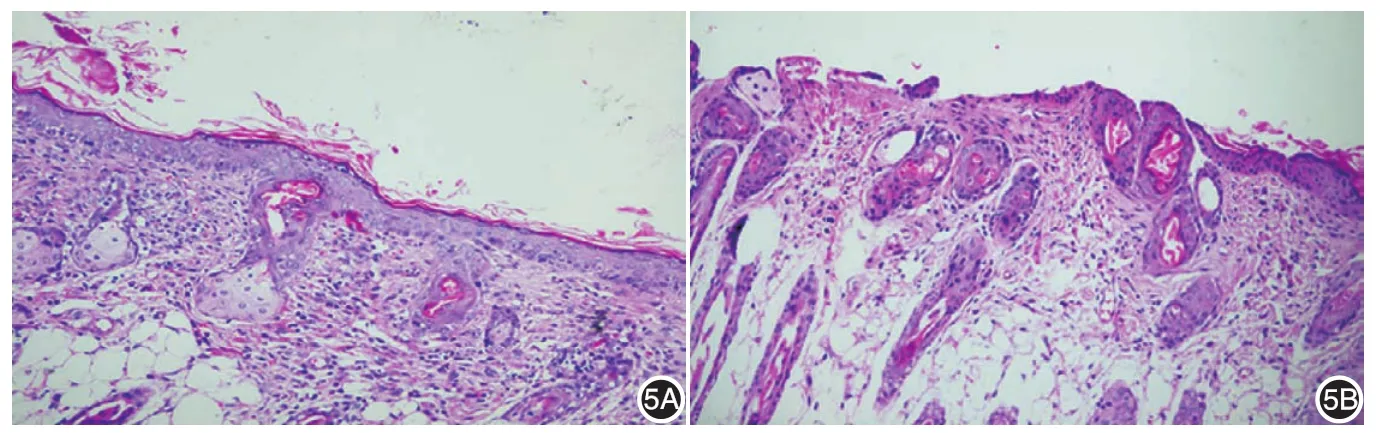
图5 裸鼠背部皮肤移植28 d后组织学观察(HE×40) 5A:组织工程组移植后上皮层次清晰,角化明显,真皮层细胞生长良好;5B:对照组移植区上皮较薄且有部分缺损,真皮层结构紊乱,有炎症细胞浸润
讨 论
组织工程皮肤移植是在体外将种子细胞与合适的细胞外基质进行器官培养后获得人工皮肤,并将其移植到皮肤缺损部位,在细胞外基质逐步降解的过程中,种植的细胞通过增殖分化形成具有固有功能的活性组织。它在临床上主要用于大面积烧伤、难治性溃疡等皮肤缺损性疾病的皮肤移植。目前组织工程皮肤种类繁多,但很多产品仍不成熟,主要存在以下问题:①种子细胞来源缺乏,培养耗时长;②异体种子细胞诱发免疫排斥反应;③耐磨性差;④治疗费用昂贵。理想的组织工程皮肤应同时修复表皮和真皮组织,因为这两种组织结构不仅决定皮肤的功能和外形,且相互影响,能够促进彼此分化。因此,探索构建组织工程全层皮肤的新方法是今后皮肤组织工程研究的主要方向。现国内外很多学者都在进行组织工程全层皮肤移植的基础及临床应用研究,Pellegrini等[7]通过筛选全克隆干细胞集落作为构建人工皮肤的表皮种子细胞,在纤维蛋白制备的支架中接种FB来构建真皮层,并用构建的全层组织工程皮肤来治疗大面积烧伤患者。目前组织工程皮肤的细胞基质主要选用胶原凝胶,其后期易收缩,不耐磨。因大部分组织工程皮肤基底膜结构不完整或缺乏,故易起泡,且创面愈合后仍会出现瘢痕增生。另外还存在弹性欠佳、柔软度不足、抗感染力差等问题,故在临床应用中受到很大限制[8]。我们在皮肤重建中应用DED组织可减少瘢痕增生,并增加创面愈合后的皮肤弹性、柔软性及机械耐磨性,另在DED组织中接种FB可促进新生表皮增殖分化,并诱导基底膜形成[9]。
由于裸鼠无胸腺,T细胞生成障碍,是免疫缺陷动物,故容易植入异种细胞和组织,已有多个实验采用裸鼠为载体研究移植免疫取得良好效果[10⁃11]。Berthod等[12]以表皮干细胞为种子细胞,将其种植在胶原海绵支架上,体外器官培养后将获得的人工皮肤移植到裸鼠背部,观察发现裸鼠自身的血管逐渐向胶原海绵支架下延伸到表皮下,并在细胞支架内形成完整的血管网。故我们选择裸鼠来制备皮肤缺损的动物模型,用于观察组织工程皮肤移植后种子细胞在体内增殖分化的情况及人工皮肤成活后的结构特征。本实验中新鲜的组织工程全层皮肤hAEC⁃DED移植于裸鼠14 d后即与周围组织基本融合生长,21 d后与周围皮肤外观上无明显差别,约28 d后即能转化为组织结构合理的皮肤组织。组织学显示,移植的组织工程皮肤表皮和真皮结构层次清晰,且与正常皮肤结构相似,表皮结构清晰,角质层明显,真皮富含纤维,且真表皮分界清晰。由此可见,我们构建的组织工程皮肤具有与正常皮肤相似的功能和生物活性,用于修复实验动物皮肤缺损效果良好,为后期的临床应用打下基础。
[1]ShenY,DaiL,LiX,etal.Epidermalstem cells cultured on collagen⁃modified chitin membrane inducein situtissue regeneration of full⁃thickness skin defects in mice[J/OL].PLoS One,2014,9(2):e87557[2016⁃04⁃09].https://doi.org/10.1371/journal.pone.0087557.DOI:10.1371/journal.pone.0087557.
[2]江蕾薇,陆洪光,蔡灵龙.角质形成细胞与黑素细胞体外构建含黑素的组织工程皮肤[J].中华皮肤科杂志,2011,44(2):110⁃113.DOI:10.3760/cma.j.issn.0412⁃4030.2011.02.014.
[3]Jiang LW,Chen H,Lu H.Using human epithelial amnion cells in human de ⁃epidermized dermis for skin regeneration[J].J Dermatol Sci,2016,81(1):26⁃34.DOI:10.1016/j.jdermsci.2015.10.018.
[4]林建红,汪宇,卢彬,等.角质形成细胞无血清培养基条件下构建组织工程皮肤[J].中华皮肤科杂志,2016,49(2):103⁃107.DOI:10.3760/cma.j.issn.0412⁃4030.2016.02.006.
[5]Lu H,Rollman O.Fluorescence imaging of reepithelialization from skin explant cultures on acellular dermis[J].Wound Repair Regen,2004,12(5):575⁃586.DOI:10.1111/j.1067⁃1927.2004.012510.x.
[6]Nagelschmidt M,Becker D,Bönninghoff N,et al.Effect of fibronectin therapy and fibronectin deficiency on wound healing:a study in rats[J].J Trauma,1987,27(11):1267⁃1271.
[7]Pellegrini G,Ranno R,Stracuzzi G,et al.The control of epidermal stem cells(holoclones)in the treatment of massive full⁃thickness burns with autologous keratinocytes cultured on fibrin[J].Transplantation,1999,68(6):868⁃879.
[8]Herndon DN,Rutan RL.Comparison of cultured epidermal autograft and massive excision with serial autografting plus homograft overlay[J].J Burn Care Rehabil,1992,13(1):154⁃157.
[9]El GA,Lamme E,Ponec M.Crucial role of fibroblasts in regula⁃ting epidermal morphogenesis[J].Cell Tissue Res,2002,310(2):189⁃199.DOI:10.1007/s00441⁃002⁃0621⁃0.
[10]Liu X,Lee PY,Ho CM,et al.Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing[J].Chem Med Chem,2010,5(3):468⁃475.DOI:10.1002/cmdc.200900502.
[11]Sander EA,Lynch KA,Boyce ST.Development of the mechanical properties of engineered skin substitutes after grafting to full⁃thickness wounds[J].J Biomech Eng,2014,136(5):051008.DOI:10.1115/1.4026290.
[12]Berthod F,Germain L,Li H,et al.Collagen fibril network and elastic system remodeling in a reconstructed skin transplanted on nude mice[J].Matrix Biol,2001,20(7):463⁃473.
Construction of tissue⁃engineered skin by culture of human amniotic epithelial cells on human de⁃epidermized dermis for the repair of skin defects in nude mice:an experimental study
Jiang Leiwei,Liu Zhi,Lu Bin,Zhou Wenming,Li Yuanying,Lu Hongguang
Department of Dermatology,The Affiliated Hospital of Guizhou Medical University,Guiyang 550004,China
Lu Hongguang,Email:hongguanglu@hotmail.com
ObjectiveTo evaluate the feasibility of repair of full⁃thickness skin defects in nude mice with tissue⁃engineered skin which was constructed by culture of human amniotic epithelial cells(hAECs)and fibroblasts on human de⁃epidermized dermis(DED).MethodsHealthy human amniotic tissues were treated with trypsin at a low concentration in multi⁃steps to prepare hAECs,and a two⁃step collagenase digestion was used to treat healthy children′s prepuce tissues to prepare fibroblast suspensions.When fibroblasts were culturedin vitroup to passage 3-5 and hAECs up to passage 2,they were seeded on the reticular dermal surface and basement membrane surface of the DED respectively to construct the tissue⁃engineered skin.A total of 20 healthy male nude mice aged 3-4 weeks were enrolled into this experiment,and full⁃thickness skin defects were made on the middle of the back of mice.Then,these mice were randomly divided into 2 groups by using a lottery method,and reconstructed full⁃thickness tissue⁃engineered skin grafts and vaseline oil gauze were used to cover the wounds in the tissue⁃engineered skin group and control group respectively.The whole body and transplantation sites of the nude mice were observed on day 7,14,21 and 28 after transplantation,the wound healing time and rate were compared between the above two groups,and skin tissues at the transplantation site were harvested at 4 weeks after transplantation and subjected to histological examination.ResultsHAECs had stem⁃cell characteristics and expressed octamer⁃binding protein⁃4(OCT⁃4)and embryonic marker stage⁃specific embryonic antigen⁃4(SSEA⁃4).After 2⁃week organ culture,thein vitroreconstructed tissue⁃engineered skin showed 4-9 continuous layers of strati fi ed epithelium,and the histological structure of the epidermis was similar to that of the normal human skin.Compared with the control group,the tissue⁃engineered skin group showed significantly higher wound healing rates on day 7,14 and 21 after transplantation(57.49% ±6.11%vs.22.93%±4.26%,92.80%±3.10%vs.54.57%±7.94%,98.83%±0.25%vs.91.16%±4.79%,respectively;n=10,t=27.36,32.23,11.80,respectively,allP< 0.001),shorter wound healing time[(21.51 ± 1.51)dvs.(28.80±1.14)d,n=10,t=42.23,P<0.001],with the color of skin grafts closer to that of autologous skin on day 28 after transplantation.Histological examination revealed distinct stratification of the epithelium,obvious keratinization and favorable growth of cells in the dermis in the tissue⁃engineered skin group,but thin epithelium with some defects,indistinct stratification of the dermis,and inflammatory cell infiltration in the control group.ConclusionTissue⁃engineered skin constructed by the culture of hAECs and fibroblasts on human DED can survive in nude mice after transplantation,resulting in a more favorable healing of wounds,and is expected to serve as a kind of ideal tissue⁃engineered skin.
Tissue engineering;Epithelial cells;Dermis;Skin transplantation;Wound healing;De⁃epidermized dermis;Human amniotic epithelial cells
陆洪光,Email:hongguanglu@hotmail.com
10.3760/cma.j.issn.0412⁃4030.2017.07.007
国家自然科学基金(81673069);贵州省科学技术基金(黔科合J字[2014]2024号);贵州省人民医院博士基金(GZSYBS[2016]05号)
Fund programs:National Natural Science Foundation of China (81673069);Science and Technology Foundation of Guizhou Province(Guizhou Provincal Department of Science and Technology[2014]2024);Doctoral Fund of Guizhou Provincial People′s Hospital(GZSYBS[2016]05)
2016⁃08⁃31)
(本文编辑:尚淑贤)
