UV-B照射对采后葡萄果实品质和黄酮醇积累的影响
2017-10-19,
,
(中国农业科学院农产品加工研究所,北京 100193)
UV-B照射对采后葡萄果实品质和黄酮醇积累的影响
方芳,王凤忠*
(中国农业科学院农产品加工研究所,北京 100193)
本实验以赤霞珠葡萄果实为试材,研究了UV-B照射对采后葡萄果实品质和黄酮醇积累的影响。结果表明,采后适当剂量UV-B照射葡萄果实可在不影响果实硬度及果梗褐变指数等外在品质的情况下显著提高果实可滴定酸、总酚、总黄酮及总黄酮醇含量,减缓可溶性固形物及VC降解,可较好改善酿酒葡萄采后品质。UV-B对葡萄果实采后品质的改善作用呈现明显的照射剂量依赖性和孵育时间依赖性。150 μW/cm2的照射剂量和2 h的孵育时间的调控作用最佳。
UV-B,葡萄,果实品质,黄酮醇
黄酮醇是自然界中一类重要的次生代谢产物和多酚类化合物,广泛存在于葡萄、葡萄酒、洋葱、苹果及茶叶等多种植物源食品中[1-3]。因其具有抗氧化、抗炎、抗菌等多种重要的生物活性[4-6],同时对癌症、心脑血管疾病及肥胖等多种慢性疾病具有重要的预防和治疗作用而成为人类饮食中重要的功能因子[7-9]。同时,因其与葡萄及葡萄酒的色泽和口感的形成密切相关,而成为决定葡萄和葡萄酒品质的重要因素[10-11]。
UV-B,即光谱范围介于280~320 nm间的中波紫外线,是日光光谱的重要组成部分[12]。大量研究表明,其与植物的生长发育、细胞骨架建成、植物形态生成、代谢产物积累及氧化防御体系激活等多种生理活动密切相关[13-15]。而近年来人类活动加剧导致大气臭氧层破坏严重,地表UV-B辐射进一步增强,则引发有关UV-B对食品中主要生物活性物质积累的影响研究备受关注[16-17]。
UV-B照射对果实的品质形成和次生代谢产物的积累具有重要的调控作用。孙莹等在研究UV-B照射对葡萄果实发育和果实品质的影响时发现UV-B不仅会延缓葡萄生长,导致果粒变小,产量降低,同时导致糖含量、酸含量及糖酸比等品质指标明显降低[18]。Liu等在研究UV-B照射剂量对绿熟期番茄果实的影响时发现适当剂量的UV-B照射可有效保持果实硬度,促进总酚及总黄酮积累,但果实VC含量明显降低。UV-B照射剂量过高会对果实的颜色、质地及抗氧化性等产生负面影响[19]。Du等在筛查UV-B照射对不同果蔬营养品质的影响时发现,UV-B对葡萄、蓝莓、樱桃番茄中的可溶性总多酚含量无显著影响,但草莓的总多酚含量在高剂量UV-B照射下显著提升[20]。李昌亨等发现,采后UV-B照射可显著促进葡萄果实多酚,尤其是黄烷醇类物质积累,但随着辐照剂量增强,酚类及黄烷醇类物质的积累受到明显抑制[21]。杨乐等发现UV-B照射可有效促进蓝莓果实可溶性糖在幼果期和白果期的积累,显著促进不同发育阶段蓝莓果实中总酚和花青苷的积累,对蓝莓果实整体品质提升具有积极作用[22]。由此可见,UV-B照射对果实的品质形成及酚类物质积累均具有重要影响,但这种影响与果实的种类、品种、发育阶段、照射剂量及营养或生物活性物质的种类和性质等密切相关[20,22-23]。
本文以赤霞珠葡萄果实为试材,以UV-B照射为处理手段,研究采后UV-B照射对葡萄果实品质(外在、内在)和黄酮醇类物质积累的影响,旨在为采后葡萄果实品质提升和黄酮醇类物质的定向调控提供理论依据。
1 材料与方法
1.1材料与仪器
实验所需酿酒葡萄原料由河北怀涞酿酒葡萄基地提供。实验所需黄酮醇标准品及福林酚试剂等如无特殊说明均购于Sigma公司。实验所需检测试剂均为色谱级,购于Fisher公司。
CT3型质构仪 美国Brookfield公司;手持式阿贝折光仪 上海勃基仪器仪表有限公司;中波紫外灯 天津特种光源有限公司;BSP-250型生化培养箱 上海博讯实业有限公司;高效液相色谱仪 Waters中国有限公司。
1.2材料处理
UV-B照射实验均在密封避光容器中进行,参考zhang等的方法[24]略加修改。根据实验要求,采后葡萄果实样品被随机分为3组,辐照强度分别为0 μW/cm2(CK组),150 μW/cm2(低剂量组)和450 μW/cm2(高剂量组)。实验过程中UV-B紫外灯管(20 W,311 nm)被水平置于平铺的葡萄果实上方50 cm处,辐照时间为10 min,辐照结束后,对照组与处理组葡萄果实样品被同时转移至生化培养箱中进行避光孵育处理,孵育温度25 ℃,湿度75%,孵育时间分别为0.5、1、2、4、8 h。孵育结束后,液氮速冻葡萄果实样品,并置于-80 ℃超低温冰箱中备用。
1.3检测方法
1.3.1 果实硬度的测定 采用质构仪测定[25]。TPA分析法(质地剖面分析测定),探头直径8 mm。
1.3.2 果梗褐变指数的测定 参考田金强等的方法测定[26]。褐变程度分为4级,果梗无褐变为0级,果梗1/4内发生褐变的为1级,果梗1/2内发生褐变的为2级,果梗3/4内发生褐变的为3级,果梗3/4以上发生褐变的为4级。褐变指数计算公式为:褐变指数(%)=[Σ(果梗数×褐变级值)/(总果梗数×褐变最高级值]×100。
1.3.3 可滴定酸含量的测定 采用酸碱滴定法测定[27]。
1.3.4 可溶性固形物含量的测定 采用阿贝折光仪测定[28]。
1.3.5 VC含量的测定 采用碘量法测定[29]。准确称取葡萄果实样品20 g,置于20 mL 2%的HCl中研磨并离心,上清液用2%的HCl定容至100 mL制得提取液。取3 mL 0.5%的淀粉溶液,加入20 mL果实提取液,充分混匀,以已标定好的I2标准溶液滴定至混合溶液呈现蓝紫色后30 s内不变色即为实验终点。VC含量计算公式如下:
VC含量(mg·100 g-1)=[(CI×VI)×176.12×A/W]×100
其中,CI为I2标准溶液浓度,VI为消耗I2标准溶液的体积,A为提取液定容体积与吸取体积比值,W为葡萄样品重量。
1.3.6 总酚含量的测定 采用福林酚法测定[30],酚类物质提取参照Wen等的方法[31]。将25 μL葡萄果实多酚提取物与125 μL经适当稀释的福林酚试剂混匀,室温下反应10 min,加入125 μL 7.5%的Na2CO3溶液,37 ℃反应30 min,于765 nm处测定吸光值,实验结果以没食子酸当量表示为mg·100 g-1FW。
1.3.7 总黄酮含量的测定 采用氯化铝比色法测定[32]。以芦丁为标准品配制浓度为0~500 mg/L的芦丁标准溶液,制定标准曲线。取20 μL 0.5 mol/L NaNO2与50 μL芦丁标准品溶液或样品提取液混匀,室温下反应5 min,加入20 μL 0.3 mol/L AlCl3溶液,反应一定时间后,加入200 μL 0.5 mol/L NaOH溶液,反应结束后于510 nm处测定吸光值,实验结果以芦丁当量表示为mg·100 g-1FW。
1.3.8 总黄酮醇的测定 总黄酮醇的提取参照Hertog等的方法[33],总黄酮醇的测定参照Fang等的方法[34]。检测体系采用Waters Sunfire TM C18柱(250 mm×4.6 mm,5 μm),Waters 2695分离模块和Waters 2489紫外检测器,检测波长360 nm,流速1.0 mL/min。流动相A为19%乙腈、5%甲醇和1%四氢呋喃的混合溶液,流动相B为55%乙腈和15%甲醇的混合溶液。流动相B的洗脱程序为:0~15 min,2% B;15~28 min,2~28% B;28~40 min,28~36% B;40~44 min,36% B;44~45 min,36~80% B;45~48 min,80~75% B;48~50 min,75% B;50~51 min,75~80% B;51~55 min,80% B and 55~65 min,80~2% B。
1.4数据处理方法
实验中所有处理均重复3次,每个样品做3个平行。实验结果以平均值±标准偏差表示。方差分析结果表示各平均值间是否存在显著差异(p>0.05,无显著差异;p<0.05,显著差异)。
2 结果与讨论
2.1UV-B对采后葡萄果实外在品质的影响
2.1.1 UV-B对采后葡萄果实硬度的影响 硬度不仅对葡萄果实的食用品质有着重要影响,还对其加工品质和采后抗病能力具有重要影响,因此其是衡量葡萄果实外在品质的重要指标之一[35]。研究显示,果实在采后贮藏期间其生理代谢活动仍十分旺盛,这些代谢活动可能对果实硬度产生重要影响[35],且多种外源激素及环境条件也会对果实硬度产生影响[36-37]。本实验在研究UV-B对采后葡萄果实硬度的影响时发现(见图1),对照组葡萄果实样品随孵育时间延长,果实硬度逐渐降低,但果实外观形态保持良好。经低剂量UV-B照射后的果实硬度也表现出逐渐降低的趋势,但与对照组果实硬度差异不显著。经高剂量UV-B照射后,果实硬度较之对照组显著降低,且随孵育时间延长,下降趋势更加明显。由此可见,采后葡萄果实硬度会逐渐降低,UV-B照射对葡萄果实硬度的影响呈现照射剂量依赖性。在一定剂量范围内,UV-B照射对果实硬度无显著影响,但超过极限剂量后,UV-B照射会导致采后果实迅速软化。分析其原因,可能是高剂量UV-B照射可促进采后葡萄果实的呼吸代谢和相关酶活性发生变化所致[38]。
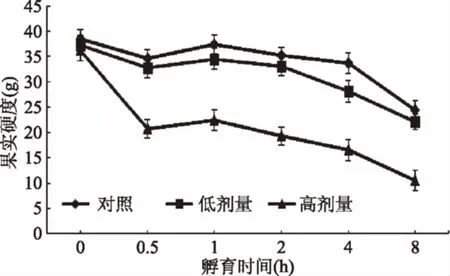
图1 UV-B照射对采后葡萄果实硬度的影响Fig.1 Effect of UV-B irradiationon the firmness of postharvest grape berry
2.1.2 UV-B对采后葡萄果实果梗褐变指数的影响 葡萄果实在离开葡萄植株后,除果实自身品质发生相应变化外,其果梗也会逐渐褐变、干枯[39],因此果梗褐变指数可作为衡量葡萄果实外观品质优劣的重要指标之一。由图2可以看出,对照组葡萄果实样品随孵育时间延长,果梗褐变指数逐渐升高。经低剂量UV-B照射后的葡萄果实样品其果梗褐变指数随孵育时间延长逐渐升高,但孵育时间不足2 h时与对照组差异不显著(p>0.05)。经高剂量UV-B照射后,果梗褐变指数较之对照组显著升高(p<0.05),且随孵育时间延长,升高趋势愈发明显。可见UV-B对采后葡萄果实果梗褐变指数的影响不仅呈现照射剂量依赖性,而且与孵育时间密切相关。分析其原因,可能是由于UV-B照射会导致葡萄果实和果梗发生复杂的生理生化反应,但这些反应需要一定的孵育时间才能直观的表现出来所致[40]。

图2 UV-B照射对采后葡萄果实果梗褐变指数的影响Fig.2 Effect of UV-B irradiation on the browningindex of grape stems of postharvest grape berry
2.2UV-B对采后葡萄果实内在品质的影响
2.2.1 UV-B对采后葡萄果实可滴定酸含量的影响 可滴定酸含量是衡量果实内在品质的重要性状之一,是影响果实风味的重要因素[41]。一般说来,高糖高酸特性更适于酿酒等加工用葡萄品种。由图3可知,对照组葡萄果实样品的可滴定酸含量随孵育时间延长无显著变化,低剂量UV-B照射后的葡萄果实样品在孵育2 h时可滴定酸含量较之对照组显著升高(p<0.05),之后逐渐下降。经高剂量UV-B照射的葡萄果实样品在孵育1 h前可滴定酸含量与对照组间无显著差异,之后显著降低(p<0.05)。前人在研究贮藏过程(0~45 d)对采后玫瑰香葡萄可滴定酸含量影响时发现,葡萄可滴定酸含量随着贮藏时间的延长而逐渐降低[39],本实验对照组的研究结果与其存在差异,一方面可能是由于本实验的孵育时间仅为8 h,远低于45 d的贮藏时间,导致可滴定酸含量变化不明显。另一方面,不同葡萄品种间可滴丁酸含量变化可能存在差异。此外,本研究证明,UV-B对采后葡萄果实可滴定酸含量的影响存在明显的照射剂量依赖性和孵育时间依赖性,当UV-B照射剂量超出果实可承受阈值后,可滴定酸含量迅速降低,可能由于高剂量UV-B照射可提高葡萄果实的呼吸代谢强度,并可促进可滴定酸通过生理代谢转化为其它物质的进程[39]。
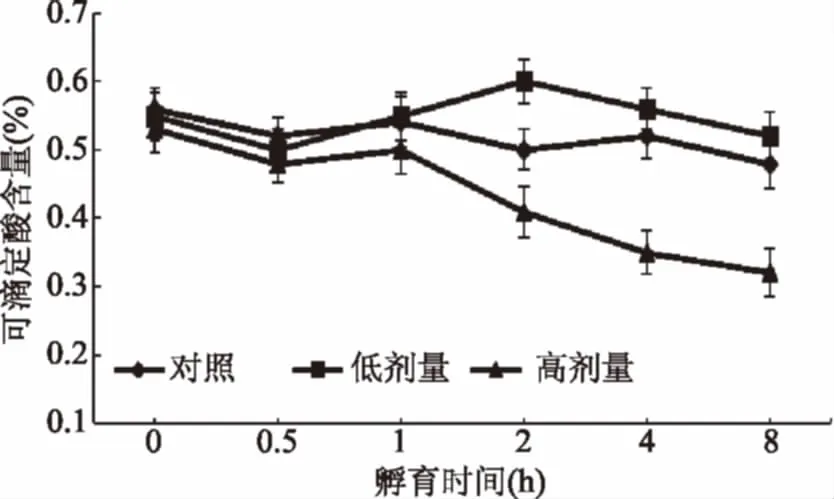
图3 UV-B对采后葡萄果实可滴定酸含量的影响Fig.3 Effect of UV-B irradiationon the titra Table acid content of postharvest grape berry
2.2.2 UV-B对采后葡萄果实可溶性固形物含量的影响 可溶性固形物是指胞内所含的多种可溶性糖类、矿物质、氨基酸和维生素等的总称,是衡量果实内在品质的重要指标之一。葡萄果实中的可溶性固形物多以糖类为主,其与可滴定酸一样,是决定果实风味的重要因素[42]。由图4可见,对照组的可溶性固形物含量在孵育初期无显著变化,随着孵育时间的延长,可溶性固形物含量逐渐降低。这与冯叙桥等有关采后贮藏会导致与果实品质密切相关的营养物质含量明显降低[39]的结论相符。低剂量组在孵育过程中,可溶性固形物含量逐渐降低,但与对照组无显著差异(p>0.05)。高剂量组在孵育过程中可溶性固形物含量迅速降低,与对照组存在显著差异(p<0.05)。由此可见,UV-B对采后葡萄果实可溶性固形物含量的影响呈现明显的照射剂量依赖性。这与前人研究UV-B照射剂量对设施桃中可溶性固形物含量的影响结论相符[43]。分析其原因,UV-B不仅可作为代谢调控手段,也可作为逆境胁迫因子,高剂量UV-B照射可能导致果实中营养物质的正常代谢被破坏所致[43]。

图4 UV-B对采后葡萄果实可溶性固形物含量的影响Fig.4 Effect of UV-B irradiationon the soluble solids content of postharvest grape berry
2.2.3 UV-B对采后葡萄果实VC含量的影响 VC是人体必需的一类营养物质及水溶性抗氧化剂[44],其对组织发育、损伤修复、神经系统调节等多种生理功能具有重要作用[44]。由于人体自身无法合成VC,因此采后果实的VC含量对于判断果实内在品质优劣至关重要。由图5可知,对照组葡萄果实的VC含量随孵育时间延长逐渐下降,孵育8 h后,VC含量较之孵育初期下降46.45%。低剂量组在孵育过程中,其VC含量较之对照组的下降趋势明显减缓,孵育8 h后,VC含量较之孵育初期仅下降28.09%。高剂量组样品在孵育过程中其VC含量急剧降低,至孵育结束,VC含量较之孵育初期下降了63.78%。由此可见,适量UV-B处理可明显减缓采后葡萄果实VC降解,但过量UV-B处理则会导致VC迅速降解。这与UV处理对桃采后抗氧化物含量提升具有促进作用的结论一致[45]。其原因可能是高剂量UV-B照射会对采后果实造成氧化胁迫,植物体需要消耗更多的抗氧化剂来维持机体平衡,而适量的UV-B处理则对采后果实中抗氧化物的生物合成具有调控作用所致。

图5 UV-B对采后葡萄果实VC含量的影响Fig.5 Effect of UV-B irradiationon the VC content of postharvest grape berry
2.2.4 UV-B对采后葡萄果实总酚含量的影响 多酚是葡萄果实中一类重要的生物活性物质和次生代谢产物[46],其不仅对葡萄和葡萄酒的风味、色泽和口感具有决定作用[47],同时具有抗氧化、抗癌及预防心脑血管疾病等多种生理功能[1],因此总酚含量是衡量采后葡萄果实内在品质的重要指标之一,根据总酚含量可对葡萄果实抗氧化程度及品质优劣进行判断。由图6可知,对照组葡萄样品的总酚含量在孵育过程中无显著变化(p>0.05)。低剂量组葡萄样品的总酚含量在孵育过程中呈现先升高后降低趋势,且显著高于对照组(p<0.05)。高剂量组样品在孵育过程中其总酚含量迅速降低,并与对照组呈现显著差异(p<0.05)。由此可见,适量UV-B处理可促进采后葡萄果实总酚积累,但过量UV-B照射则会导致总酚含量迅速降低,这与UV-B可诱导蓝莓中酚类物质积累[48]的研究结果相符。分析其原因,UV-B照射会对植物体造成氧化胁迫,植物需要提高自身抗氧化物质含量来应对氧化损伤,但高剂量UV-B照射会对细胞结构造成损伤,影响植物次生代谢产物的正常生物合成所致[48]。

图6 UV-B对采后葡萄果实总酚含量的影响Fig.6 Effect of UV-B irradiationon the total phenol content of postharvest grape berry
2.2.5 UV-B对采后葡萄果实总黄酮含量的影响 类黄酮是一种重要的多酚类化合物,因其具有抗氧化、可清除自由基等多种与人体健康密切相关的生理功能而成为判断葡萄果实内在品质优劣的重要依据[49]。由图7可见,对照组葡萄果实的总黄酮含量在孵育前期无明显变化,孵育4 h后迅速降低。低剂量组的总黄酮含量在孵育过程中先升高后降低,孵育2 h时总黄酮含量达到最高,较之对照组提高41.62%。高剂量组在孵育过程中总黄酮含量迅速下降,并显著低于对照组(p<0.05)。本实验结果与UV对黑加仑[50]中总黄酮含量影响的研究结果一致。表明UV-B可作为提高采后葡萄果实总黄酮含量的有效手段,但该作用与UV-B的照射剂量和孵育时间密切相关。分析其原因,由于类黄酮是植物多酚中一类重要的紫外吸收化合物,接受UV照射后植物体需迅速启动类黄酮生物合成以抵御紫外损伤所致[51]。
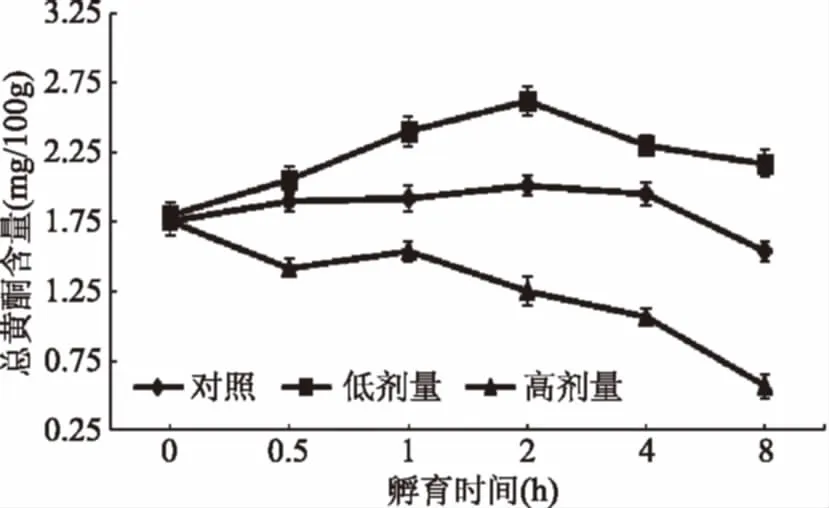
图7 UV-B对采后葡萄果实总黄酮含量的影响Fig.7 Effect of UV-B irradiationon the total flavonold content of postharvest grape berry
2.2.6 UV-B对采后葡萄果实总黄酮醇含量的影响 黄酮醇是葡萄和葡萄酒中一类重要的多酚类化合物[1-2],其对葡萄和葡萄酒的色泽、口感和营养品质的形成具有重要辅助作用[10-11]。研究酿酒葡萄采后品质变化,可将黄酮醇含量作为重要的评价指标。本研究结果显示(图8),对照组葡萄样品的总黄酮醇含量在孵育过程中无显著变化(p>0.05)。低剂量组样品的总黄酮醇含量先升高后降低,孵育2 h时总黄酮醇含量达到最大值,较之孵育初期提高13.51%。高剂量组的总黄酮醇含量随孵育时间延长迅速降低,并显著低于对照组(p<0.05)。可见适量UV-B照射有利于采后葡萄果实中黄酮醇类物质积累,这与UV照射可显著提高贮藏期洋葱中黄酮醇含量[52]的研究结果一致。分析其原因,这与UV照射可促进黄酮醇类物质的生物合成密切相关。

图8 UV-B对采后葡萄果实总黄酮醇含量的影响Fig.8 Effect of UV-B irradiationon the total flavonol content of postharvest grape berry
3 结论
低剂量UV-B处理的采后葡萄果实在孵育过程中,其可滴定酸含量、总酚、总黄酮及总黄酮醇含量较之对照组均明显提高,可溶性固形物和VC的降解较之对照组明显减缓,而果实硬度和果梗褐变指数未受显著影响。高剂量UV-B处理会导致采后葡萄果实的外在品质及内在品质急剧下降。说明UV-B照射对采后葡萄果实品质的提升具有调控作用,且这种作用呈现照射剂量依赖性和孵育时间依赖性,UV-B可作为提升葡萄果实采后品质的重要手段之一。
[1]Hertog M G L,Hollman P C H,Van de Putte B. Content of potentially anticarcinogenic flavonoids of tea infusions,wines and fruit juices[J]. Journal of Agricultural and Food Chemistry,1993,41:1242-1246.
[2]Fang F,Tang K,Huang W D. Changes of flavonol synthase and flavonol contents during grape berry development[J]. European Food Research and Technology,2013,237(4):529-540.
[3]Jiang H,Engelhardt U H,Maiwald B,et al. Determination of flavonol glycosides in green tea,oolong tea and black tea by UHPLC compared to HPLC[J]. Food Chemistry,2015,183:30-35.
[4]Kimura H,Ogawa S,Ishihara T,et al. Antioxidant activities and structural characterization of flavonol O-gkycosides from seeds of Japanese horse chestnut(Aesculus turbinate BLUME)[J]. Food Chemistry,2017,228:348-355.
[5]Boudouda H B,Zeghib A,Karioti A,et al. Antibacterial,antioxidant,anti-cholinesterase potential and flavonol glycosides of Biscutella raphanifolia(Brassicaceae)[J].Pakistan Journal of Pharmaceutical Sciences,2015,28(1):153-158.
[6]Cassidy A,Rogers G,Peterson J J,et al. Higher dietary anthocyanin and flavonol intakes are associated with anti-inflammatory effects in a population of US adults[J].American Journal of Clinical Nutrition,2015,102(1):172-181.
[7]Kim H,Seo E M,Sharma A R,et al. Regulation of Wnt signaling activity of growth suppression induced by quercetin in 4T1 murine mammary cancer cells[J]. International Journal of Oncology,2013,43:1319-1325.
[8]Serban M C,Sahebkar A,Muntner P,et al. The effect of quercetin on blood pressure:a systematic review and meta-analysis of randomized controlled trials[J].Journal of the American Heart Association,2016. doi:10.1161/JAHA. 115.002713.
[9]Nabavi S E,Russo G L,Daglia M,et al. Role of quercetin as an alternative for obesity treatment:You are what you eat[J]. Food Chemistry,2015,179:305-310.
[10]Escribano-Bailón M T,Santos-Buelga C. Anthocyanin copigmentation-Evaluation,mechanisms and implication for the colour of red wines[J]. Current Organic Chemistry,2012,16:715-723.
[11]Ferrer-Gallego R,Brás N F,García-Estévez I,et al. Effect of flavonols on wine astringency and their interaction with human saliva[J]. Food Chemistry,2016,209:358-364.
[12]Mackerness S A H. Plant responses to ultraviolet-B(UV-B:280-320 nm)stress:what are the key regulators[J]. Plant Growth Regulation,2000,32(1):27-39.
[13]Orodan M,TurcuV,Osser G,et al. Influence of type UV-B radiations of different wavelengths regarding the photosynthetic activity during plant development of Zea Mays L[J].Studia Universitatis Vasile Goldis Arad,Seria Stiintele Vietii,2013,23(1):85-89.
[14]Torre S,Roro A G,Bengtsson S,et al. Control of plant morphology by UV-B and UV-B-temperature interactions[J]. Acta Horticulturae,2012,956(1):207-214.
[15]Inostroza-Blancheteau C,Reyes-Díaz M,Arellano A,et al. Effects of UV-B radiation on anatomical characteristics,phenolic compounds and gene expression of the phenylpropanoid pathway in highbush blueberry leaves[J]. Plant Physiology and Biochemistry,2014,85:85-95.
[16]Butler J H,Battle M,Bender M L,et al. A record of atmospheric halocarbons during the 20thcentury from polar firn air[J]. Nature,1999,399:749-755.
[17]Kakani V G,Reddy K R,Zhao D,et al. Field crop responses to ultraviolet-B radiation:a review[J]. Agricultural and Forest Meteorology,2003,120:191-218.
[18]孙莹,张振文,张景昱,等.紫外线-B辐射增强对葡萄浆果的影响[J].干旱地区农业研究,2010,28(1):164-167.
[19]Liu C H,Han X X,Cai L Y,et al. Postharvest UV-B irradiation mantains sensory qualities and enhances antioxidant capacity in tomato fruit during storage[J].Postharvest Biology and Technology,2011,59:232-237.
[20]Du W X,Avena-Bustillos R J,Breksa Ⅲ A P,et al. UV-B light as a factor affecting total soluble phenolic contents of various whole and fresh-cut specialty crops[J].Postharvest Biology and Technology,2014,93:72-82.
[21]李昌亨,贾杨超,张伟,等.采后UV-B对葡萄果实中多酚及PAL活性的影响[J].中国园艺文摘,2014(5):10-12.
[22]杨乐,杨俊枫,候智霞,等.UV-B对不同发育时期离体蓝莓主要果实品质及相关酶活性的影响[J].西北植物学报,2015,35(12):2477-2482.
[23]Choudhary K K,Agrawal S B. Ultraviolet-B induced changes in morphological,physiological and biochemical parameters of two cultivars of pea(PisumsativumL.)[J].Ecotoxicology Environmental Safety,2014,100:178-187.
[24]Zhang Z Z,Li X X,Chu Y N,et al. Three types of ultraviolet irradiation differentially promote expression of shikimate pathway genes and production of anthocyanins in grape berries[J]. Plant Physiology and Biochemistry,2012,57:74-83.
[25]纪淑娟,周倩,马超,等.1-MCP处理对蓝莓常温货架品质变化的影响[J].食品科学,2014,35(2):322-327.
[26]田金强,张子德,陈志周.红提葡萄贮藏保鲜过程中SO2伤害的防止技术研究[J].食品科学,2006,27(1):250-252.
[27]Santiago P A,Carmen P,Jose M G,et al. Biochemical changes and quality loss during chilled storage of farmed turbot(Psettamaxima)[J]. Food Chemistry,2005,90(3):445-452.
[28]罗茂,李蓉,张春.芦荟提取物对葡萄保鲜及贮藏品质的影响[J].食品工业科技,2013,34(3):328-331.
[29]杜鹏飞,杨国慧.树莓果实维生素C含量测定方法的研究[J].东北农业大学学报,2009,40(2):31-33.
[30]Singleton V L,Orthofer R,Lamuela-Raventos R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J].Methods Enzymology,1999,299:152-178.
[31]Wen C F,Dong A W,Li G Z,et al. Determination of total sugar and reducing sugar in viola philippicassp munda W. Becker by anthrone colorimetry[J]. Guangzhou Food Science and Technology,2005,21(3):122-123.
[32]Herald T J,Gadgil P,Tilley M. High-throughput micro plate assays for screening flavonoid content and DPPH-scavenging activity in sorghum bran and flour[J]. Journal of the Science of Food and Agriculture,2012,92:2326-233.
[33]Hertog M G L,Hollman P C H,Katan M B. Content of potentially anticarcinogenic flavonoids of 28 vegetables and 9 fruits commonly consumed in the Netherlands[J]. Journal of Agricultural and Food Chemistry,1992,40:2379-2383.
[34]Fang F,Li J M,Pan Q H,et al. Determination of red wine flavonoids by HPLC and effect of aging[J]. Food Chemistry,2007,101:428-433.
[35]彭永彬,李玉,徐鹏程,等.葡萄果实硬度及影响硬度的主要因素[J].浙江农业学报,2014,26(5):1227-1234.
[36]Osorio S,Scossa F,Fernie A R. Modecular regulation of fruit ripening[J]. Frontiers in Plant Science,2013,4(9):198.
[37]李琛,刘颖,翁桢,等.贮运环境对葡萄品质的影响[J].现代视食品科技,2013,2:230-235.
[38]吴有梅,任建川,华雪增,等.葡萄采后果粒脱落及保鲜贮藏[J].植物生理学报,1992,18(3):267-272.
[39]冯叙桥,关筱歆,张鹏,等.1-MCP结合ClO2处理对冰温贮藏玫瑰香葡萄生理和品质的影响[J].食品工业科技,2012,33(17):333-338.
[40]Du W X,Avena-Bustillos R J,Breksa Ⅲ A P,et al. UV-B light as a factor affecting total soluble phenolic contents of various whole and fresh-cut specialty crops[J]. Postharvest Biology and Technology,2014,93:72-82.
[41]葛枝,丁甜,刘东红.基于自动滴定仪测定水果可滴定酸含量样品前处理的简化[J].中国食物与营养,2013,19(6):32-34.
[42]Baxter C J,Carrari F,Bauke A,et al. Fruit carbohydrate metabolism in an introgression line of tomato with increased fruit soluble solids[J]. Plant and Cell Physiology,2005,46(3):425-437.
[43]于妮娜,李冬梅,谭秋平,等.UV-B辐射对设施桃结果枝同化物转运和分配的影响[J].应用与环境生物学报,2013,19(1):157-163.
[44]Iqbal K,Khan A,Khattak M M A K. Biological significance of ascorbic acid(Vitamin C)in human health-a review[J]. Pakistan Journal of Nutrition,2004,3(1):5-13.
[45]梁敏华,雷建敏,邵佳蓉,等.UV-C处理对桃果实酚类物质代谢和贮藏品质的影响[J].核农学报,2015,29(6):1088-1093.
[46]蒋宝,罗美娟,张小转,等.不同地区酿酒葡萄果实中酚类物质含量及抗氧化能力的分析[J].食品与发酵工业,2014,40(10):146-150.
[47]Mushtaq M,Wani S M. Polyphenols and human health. A review[J]. International Journal of Pharma and Bio Sciences,2013,4(2):338-360.
[48]Eichholz I,Huyskens-Keil S,Keller A,et al. UV-B-induced changes of volatile metabolites and phenolic compounds in blueberries(VacciniumcorymbosumL.)[J].Food Chemistry,2011,126:60-64.
[49]Kamboh A A,Arain M A,Mughal M J,et al. Flavonoids:health promoting phytochemicals for animal production-a review[J]. Journal of Animal Health and Production,2015,3(1):6-13.
[50]Huyskens-Keil S,Eichholz I,Kroh LW,et al. UV-B induced changes of phenol composition and antioxidant activity in black currant fruit(RibesnigrumL.)[J]. Journal of Applied Botany and Food Quality,2007,81(2):140-144.
[51]Jansen M A K,Gaba V,Greenberg B M. Higher plants and UV-B radiation:Balancing damage,repair and acclimation[J]. Trends in Plant Science,1998,3(4):131-135.
[52]Yoo K S,Lee E J,Patil B S. Changes in quercetin glucoside concentrations of onion bulbs by scales,during storage,and in sprouting leaves exposed to UV[J].Postharvest Biology and Technology,2013,83:65-71.
EffectofUV-Birradiationonfruitqualityandflavonolaccumulationofpostharvestgrapeberry
FANGFang,WANGFeng-zhong*
(Institute of Food Science and Technology,Chinese Academy of Agricultural Sciences,Beijing 100193,China)
The effect of UV-B irradiation on fruit quality and flavonol accumulation of postharvest grape berry(VitisViniferaL. Cabernet Saubignon)was studied. The results showed that the content of titra
Table acid,total phenol,total flavonoid and total flavonol was significantly enhanced by proper UV-B irradiation without affecting the firmness and the browning index of grape stems,and the degradation of soluble solids and vitamin C was significantly slowed down,which indicated that UV-B irradiation improved fruit quality of postharvest grape berry,but the effect of UV-B irradiation was irradiation-dose-dependent and incubation-time-dependent. The optimum condition of UV-B irradiation in terms of improved fruit quality and increased flavonol content was determined to be 150 μW/cm2and 2 h.
UV-B;grape;fruit quality;flavonol
TS255
A
1002-0306(2017)19-0272-07
10.13386/j.issn1002-0306.2017.19.050
2017-04-14
方芳(1980-),女,博士,副研究员,研究方向:植物源食品功能活性物质挖掘与代谢调控研究,E-mail:fangfang9992@126.com。
*通讯作者:王凤忠(1972-),男,博士,研究员,研究方向:农产品功能因子研究与利用,E-mail:wangfengzhong@sina.com。
国家自然科学基金项目(31401823)。
