不同杀菌方式对软质胶原蛋白冻品质及抗氧化活性的影响
2017-10-19炜亮
, ,, ,炜亮,,*,,
(1.华南农业大学食品学院,广东广州 510642;2.广东农工商职业技术学院,广东广州 510507;3.广东省疾病预防控制中心,广东广州 511430)
不同杀菌方式对软质胶原蛋白冻品质及抗氧化活性的影响
吴红1,周佺1,郭善广1,万俊2,吴炜亮3,蒋爱民1,*,罗碧琳1,祁焰晶1
(1.华南农业大学食品学院,广东广州 510642;2.广东农工商职业技术学院,广东广州 510507;3.广东省疾病预防控制中心,广东广州 511430)
以猪皮胶原蛋白酶解液为主要原料,经热诱导凝胶制成软质胶原蛋白冻,系统研究不同的杀菌方式(巴氏杀菌、常压沸水杀菌、高压蒸汽杀菌)对其品质及抗氧化特性的影响。研究结果表明,高压蒸汽杀菌后软质胶原蛋白冻的色泽变黄,硬度、弹性和咀嚼性都明显下降(p<0.05)。不同杀菌方式处理后,经超滤分离的四个组分(>50、10~50、5~10、<5 kDa)中,分子量>50 kDa的蛋白质组分所占比例最大,常压沸水杀菌组中分子量为5~10 kDa和<5 kDa的组分比例最大,分别为25.71%和9.48%。常压沸水杀菌后软质胶原蛋白冻的DPPH自由基和羟基自由基的清除能力最强,其IC50分别为0.042 g/mL和 0.093 g/mL,且色泽明亮且弹性较好。常压沸水杀菌不仅有良好的杀菌效果,还能较好的保持软质胶原蛋白冻的质构特性和抗氧化活性,这为新型软质胶原蛋白的冻加工技术奠定基础。
胶原蛋白,抗氧化,巴氏杀菌,常压沸水杀菌
胶原蛋白中含有人体所必需的各类氨基酸[1],具有抑制细胞老化和增强细胞存活能力等抗氧化生物活性作用[2-4]。然而,胶原蛋白是一种热敏性蛋白,在一定温度下因化学键被打破而降解为分子量更小的多肽,从而影响其抗氧化活性[1]。软质胶原蛋白冻是以猪皮为主要原料制成的胶原蛋白食品,研究表明,杀菌温度的差异不仅会对凝胶类产品的理化性质,如色泽、质构特性和贮藏性造成影响[5-7],还会造成蛋白质分子量分布的改变[8]。
凝冻食品的杀菌方法较常用的是常压杀菌,杀菌温度低于100 ℃,但该杀菌条件无法达到商业无菌的要求[9]。升温升压处理凝冻可提高凝冻的食用安全品质[10]。杀菌温度和压力对胶原蛋白冻的凝胶流变学特性及抗氧化活性仍未有深入研究。
本文以猪皮为主要原料,经酶解调配后制备软质胶原蛋白冻为研究对象,对比分析巴氏杀菌、常压沸水杀菌和高压蒸汽杀菌对其质构特性、流变学特性和抗氧化活性的影响,为制备高品质及具有抗氧化能力的软质胶原蛋白冻食品提供理论依据。
1 材料与方法
1.1材料与试剂
新鲜猪皮 购于华南农业大学三角市;胰蛋白酶(1∶250);无水乙醇、铁氰化钾、三氯乙酸、三氯化铁、过氧化氢、硫酸亚铁、水杨酸、抗坏血酸等 均为分析纯;二苯基苦肼基(DPPH) 美国Sigma公司;其他为实验室常用试剂。
1.2仪器与设备
UV-1800紫外可见分光光度计 日本岛津有限公司;TA-XT Plus 12320质构仪 英国SMS公司;MCR301流变仪 奥地利安东帕有限公司;29751型超滤仪 美国Millipore公司;X-Rite SP62型色差仪 美国爱色丽公司;Kjeltec TM8100型凯氏定氮仪 福斯特卡公司;HH-4型数显恒温水浴锅 国华电器有限公司;JM-FB80型胶体磨 宁波骏丰伟业机械有限公司;其他均为实验室常用设备。
1.3实验方法
1.3.1 胶原蛋白冻制备流程 软质胶原蛋白冻的制备流程[11],如图1所示。制备要点如下:
酶解:称取一定重量的匀浆液,调节pH至8.5后,添加0.04%的胰蛋白酶(按匀浆液中猪皮重量计),在37 ℃下水解3 h后,95 ℃水浴灭酶5 min[12]。
溶胶:称取一定量的胶原蛋白酶解液,将卡拉胶和魔芋粉干混后加入,在室温搅拌15 min,使胶粉充分溶胀,然后在75 ℃下煮胶15 min,并不停搅拌。
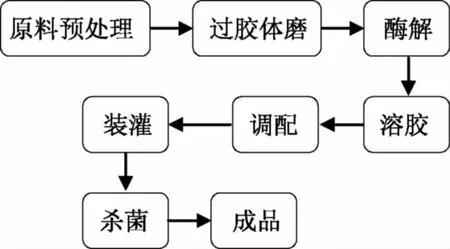
图1 软质胶原蛋白冻的制备流程Fig.1 Preparation of soft collagen jelly
1.3.2 杀菌方法 巴氏杀菌:85 ℃/15 min;常压沸水杀菌[13]:100 ℃/10 min;高压蒸汽杀菌:121 ℃/15 min[10];对照组:未经任何杀菌处理的软质胶原蛋白冻。
1.3.3 色泽测定 在色差测定结果中,L*值为黑/白值、a*为红/绿值、b*为蓝/黄值[13]。将制备好的软质胶原蛋白冻常温下放置16 h后切成大小一致的,放在洗净的培养皿中,测试光源为D65,测试口直径10 mm。样品重复测定3次,计算平均值。
1.3.4 质构的测定 将制备好的软质胶原蛋白冻常温下放置16 h后切成1.5 cm×1.5 cm×1.5 cm的正方体,测试结果取硬度、弹性、胶黏性和咀嚼性进行主要分析。测试条件:探头P50;测前下压速度5.0 mm/s、测时速度1.0 mm/s、测试后回程速度5.0 mm/s;触发力5.0 N,两次压缩间隔时间2.0 s,压缩变形50%[14]。
1.3.5 流变学特性的测定 取一定量不同杀菌工艺下的软质胶原蛋白冻进行流变学特性测定。
1.3.5.1 剪切扫描 按照Murillo-Maetinez等[15]的方法进行测定。选用PP50锥板(直径为50 mm2),平行板间距为1 mm,剪切速率为0.01~100 s-1,进行测定。
1.3.5.2 温度扫描 参考王元兰[16]的方法,稍作修改。选用PP50锥板(直径为50 mm2),平行板间距为1 mm,温度扫描范围为30~120 ℃,升温速率为3 ℃/min,固定剪切速率为10 rad/s,应变为5%。测样时用石蜡油将锥板四周密封,防止加热过程中水分蒸发。
1.3.6 不同肽段蛋白质的分离 软质胶原蛋白冻用一定量蒸馏水混匀后均质,离心(10000 r/min,10 min)后用双层滤纸抽滤,收集滤液进行超滤。在室温条件下,入口压力30 Psi,循环口压力10 Psi,选用截留分子量为50、10、5 kDa的超滤膜对滤液中的蛋白质进行分离[17]。
1.3.7 蛋白质含量测定 参照国家标准GB/T 5009.5-2010 《食品中蛋白质的测定》,进行测定[18]。
1.3.8 微生物检测 菌落总数的测定参照国家标准GB 4789.2-2016《食品卫生微生物学检验菌落总数测定》,进行测定[19]。
1.3.9 不同分子量多肽的抗氧化活性测定 取不同杀菌工艺下的软质胶原蛋白冻,配制成不同的浓度梯度(0.025、0.05、0.10、0.25 g/mL)进行抗氧化活性测定。
1.3.9.1 DPPH·清除能力测定 参考Rodrigo等[20]的方法测定。实验时精确称取0.0025 g DPPH,用无水乙醇溶解并定容至100 mL的棕色容量瓶中,配制成浓度为6.5×10-5mol/L DPPH·乙醇溶液。分三组进行,第一组分别吸取2 mL样液和2 mL DPPH·乙醇溶液,摇匀,室温下反应30 min后用分光光度计517 nm处测定吸光度值A1;第二组分别吸取2 mL无水乙醇和2 mL DPPH·乙醇溶液,其余步骤同第一组,吸光度值记为A2;第三组试管中分别吸取2 mL样液和2 mL无水乙醇,其余步骤同第一组,吸光度值记为A3。以抗坏血酸为阳性对照,每组做三个平行。DPPH·清除率计算公式如下:
式(1)
1.3.9.2 ·OH清除率 参考Smirnoff 等[21]的方法测定。H2O2和Fe2+混合发生Fenton反应,生成具有很高反应活性的·OH,能被水杨酸有效捕捉并生成有色物质;样液中具有清除作用的物质能与水杨酸竞争而使有色物质生成量减少。取不同浓度样品溶液2 mL,依次加入 6 mmol/L的FeSO4溶液、6 mmol/L的H2O2溶液和6 mmol/L的水杨酸溶液2 mL,混匀后静置30 min,用分光光度计在510 nm处测其吸光值,以抗坏血酸为对照,进行三次平行测定。
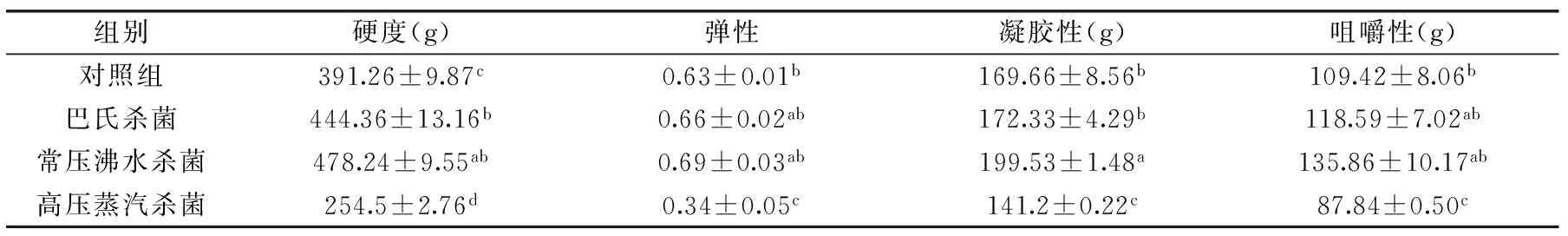
表2 杀菌方式对软质胶原蛋白冻质构特性的影响Table 2 The effects of different sterilization methods on soft collagen jelly’s texture
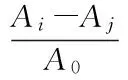
式(2)
其中A0为空白对照;Ai为某质量浓度样品溶液的吸光值;Aj为无过氧化氢时样品溶液的吸光值。
1.3.9.3 还原力测定 参考任俊凤[22]的方法,并稍作修改。取0.5 mL的样品,分别加入2.5 mL的磷酸缓冲液(0.2 mol/L,pH6.6)和1%的铁氰化钾溶液,50 ℃水浴20 min后再加入10%的三氯乙酸溶液2.5 mL,静置10 min后取上述反应液2.5 mL,加入2.5 mL蒸馏水和0.1%的氯化铁溶液0.5 mL,反应10 min后用分光光度计在700 nm处测定吸光值,以抗坏血酸为对照,进行三次平行测定。
1.3.10 数据处理 实验数据的统计使用Microsoft Office 2010和Origin 8.5软件(美国Origin Lab公司);数据的显著性差异分析使用SPSS 20.0软件(美国SPSS公司),差异显著性水平为p<0.05。
2 结果与分析
2.1不同杀菌方式对软质胶原蛋白冻色泽的影响
杀菌方式对软质胶原蛋白冻色泽的影响如表1所示。研究结果表明,杀菌方式对软质胶原蛋白冻的色泽具有一定影响,其中对L*值和b*值影响显著,而对a*值无显著影响。对于L*值,高压蒸汽杀菌组的L*值最大,显著高于其他三组(p<0.05),且巴氏杀菌与常压沸水杀菌组之间的L*值无显著差异(p>0.05)。对于b*值,处理组中,高压蒸汽杀菌组的b*值最大,显著高于另外两种杀菌方法(p<0.05),颜色偏黄。原因可能是,软质胶原蛋白冻中蛋白质含量为5.28%,加工过程中有添加调味剂(白砂糖),在杀菌过程中温度越高、反应时间越长,羰基化合物(糖类)和氨基化合物(氨基酸和蛋白质)间发生美拉德反应而使产品的颜色加深[23],但高压蒸汽杀菌处理会加速反应的进行,使软质胶原蛋白冻颜色偏黄。
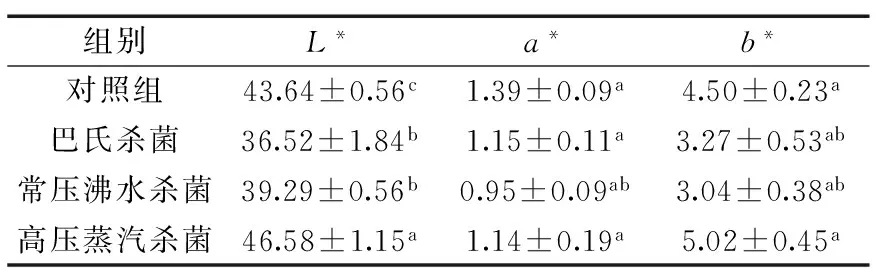
表1 杀菌方式对软质胶原蛋白冻色泽的影响Table 1 The effects of different sterilization methodson the color changes of soft collagen jelly
注:同列不同字母代表差异显著(p<0.05)。2.2杀菌方式对软质胶原蛋白冻质构特性的影响
杀菌方式对软质胶原蛋白冻质构的影响如表2所示。对于硬度,巴氏杀菌和常压沸水杀菌后的软质胶原蛋白冻硬度显著高于对照组(p<0.05),且常压沸水杀菌组的软质胶原蛋白冻硬度最大,而高压蒸汽杀菌后的软质胶原蛋白冻硬度明显下降(p<0.05)。对于凝胶性,经过不同杀菌方式后,软质胶原蛋白冻的凝胶性大小依次为:高压蒸汽杀菌<对照<巴氏杀菌<常压沸水杀菌,且常压沸水杀菌组的软质胶原蛋白冻凝胶性最显著大于其他三组(p<0.05)。杀菌过程中,温度在75~100 ℃内,软质胶原蛋白冻的弹性和咀嚼性等质构特性随着温度的上升而增大,在杀菌温度高于110 ℃时,凝胶性果冻的硬度、咀嚼性和弹性等质构特性下降[13],当温度达到高压蒸汽杀菌所需温度(121 ℃)后,软质胶原蛋白冻的质构特性显著下降(p<0.05),因此可得常压沸水杀菌能较好的提升并减少温度对软质胶原蛋白冻质构特性的影响。
2.3杀菌方式对流变学特性的影响
粘性能够反映破坏凝胶内部结构的难易程度[24]。图2所示为30 ℃时不同杀菌组的表观粘度随剪切速率的变化。由图可知,剪切速率在0.01~80 s-1内,随着剪切速率的增加,表观粘度逐渐下降,呈现假塑性,具有剪切稀化的特点。剪切速率达到80 s-1时,出现曲线平台。在0.01~100 s-1内,表观粘度大小依次为:巴氏杀菌<常压沸水杀菌<高压蒸汽杀菌。随着剪切速率的增加,蛋白质分子在流动方向上逐渐定向,摩擦阻力下降,蛋白质中的氢键和其他弱的作用键断裂导致蛋白质的聚集或网络结构的解体,使其粘性下降[25]。随着杀菌温度的越高,软质胶原蛋白冻的粘度下降越慢,粘度越大。这可能是由于高温处理导致凝胶体系遭到破坏,网络结构稳定性降低而导致粘度下降[9]。
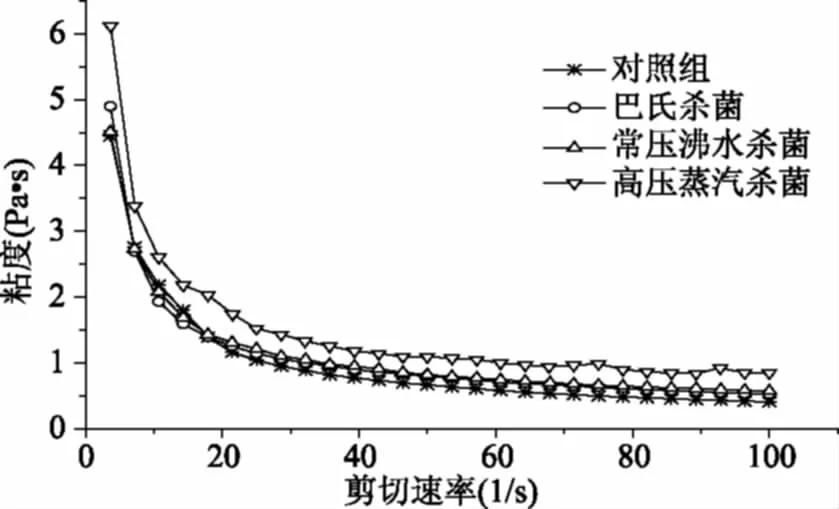
图2 剪切速率对软质胶原蛋白冻表观粘度的影响Fig.2 The effect of different sterilization methodson the apparent viscosity of soft collagen jelly
在流变学中,储能模量(G′)和损失模量(G″)分别表示被测样品的弹性行为和粘性行为。软质胶原蛋白冻温度扫描结果如图3所示。经不同杀菌方式处理后,软质胶原蛋白冻体系中的G′和G″具有相似的变化趋势,在30~65 ℃范围内,随着温度的升高,G′和G″快速下降,65 ℃后,G′和G″达到平台区,基本保持稳定。在温度扫描范围内,G′与G″大小顺序为:对照组>巴氏杀菌>常压沸水杀菌>高压蒸汽杀菌,其中高压蒸汽杀菌组弹性模量和粘性模量都显著降低(p<0.05)。在30~65 ℃内,各处理组G′大于G″,即弹性行为高于粘性行为。经高温处理后胶体大分子解离,分子间缠绕减少,由有序状态变成无序状态,粘性下降[26,28],高压蒸汽杀菌会降低软质胶原蛋白冻的弹性模量和粘性模量。
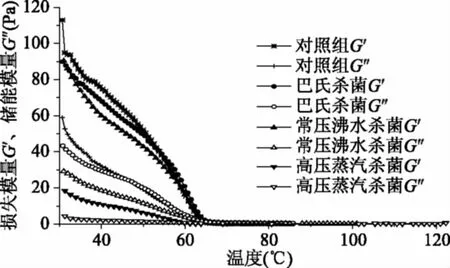
图3 温度对软质胶原蛋白冻储能模量和损失模量的影响Fig.3 The effect of different sterilization methodson the G′ and G″ of soft collagen jelly
2.4杀菌方式对蛋白质分子量分布的影响
杀菌后软质胶原蛋白冻中蛋白质分子量分布变化如图4所示。从图4中可知,经三种杀菌方式处理后,各蛋白质分子量仍以大于50 kDa为主,分别占(62.23%±0.21%)、(51.87%±0.47%)和(56.25%±0.11%),但10~50 kDa之间的蛋白质占比在高压蒸汽杀菌和巴氏杀菌后有所增大,处理组间存在显著性差异(p<0.05)。常压沸水杀菌后软质胶原蛋白冻中的小分子蛋白(10~5 kDa之间和小于5 kDa)占比最大,分别为(25.71%±0.24%)和(9.48%±0.24%),显著高于其他两个灭菌组(p<0.05)。在升温过程中(15~100 ℃)胶原蛋白三股肽链间的氢键减少,伸展的肽链结构增加[13,26],大分子水解成小分子;随着温度的继续升高,胶原蛋白肽链进一步水解,使游离氨基酸和可溶性氮含量增加[27],而高温会促使蛋白质和白砂糖发生非酶促褐变,随着时间的延长,氨基酸含量的减少呈指数变化[29-31],因此高压蒸汽杀菌可能会加速氨基酸的损失,导致小分子蛋白含量降低。
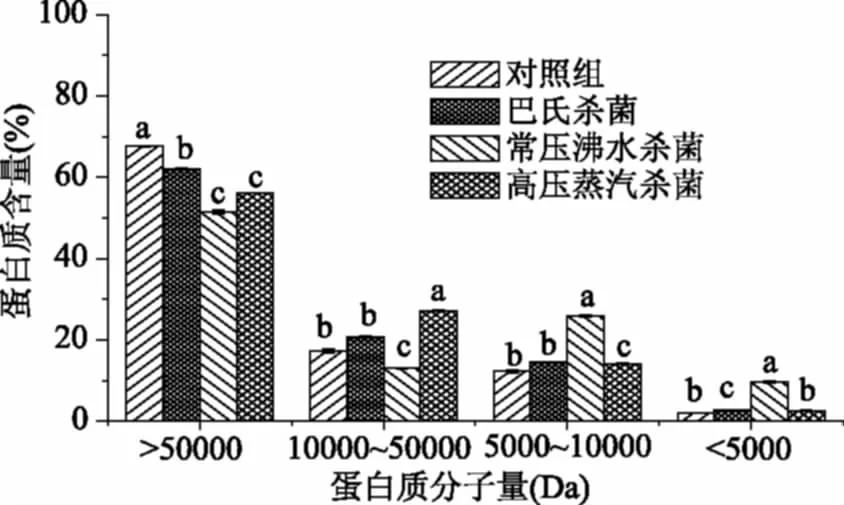
图4 不同杀菌方式蛋白质分子量的分布Fig.4 The molecular weight distribution ofdifferent sterilization methods
2.5菌落总数测定结果
菌落总数检测结果如图5所示,高压蒸汽杀菌灭菌率可达97.33%,灭菌最彻底;常压沸水杀菌和巴氏杀菌的灭菌率分别为74.08%、80.00%;三种杀菌效果均存在显著性差异(p<0.05)。

图5 不同杀菌方式对软质胶原蛋白冻菌落总数的影响Fig.5 The effect of different sterilization methodson the main facilities of soft collagen jelly
2.6杀菌方式对抗氧化活性的影响
2.6.1 DPPH·清除能力 由图6可知,杀菌后的软质胶原蛋白冻对DPPH·清除能力呈现一定的量效关系。随着测试样液中胶原蛋白浓度的增大,DPPH·清除能力增强,DPPH·清除能力大小依次为常压沸水杀菌为0.042 g/mL)>巴氏杀菌(IC50为0.048 g/mL)>高压蒸汽杀菌(IC50为0.049 g/mL)>对照组(IC50=0.051 g/mL),巴氏杀菌后软质胶原蛋白冻对DPPH·的清除能力最高。在80 ℃下加热胶原蛋白,会使胶原肽链收缩、聚集,温度超过100 ℃时,胶原蛋白的一级结构被严重破坏[8],促使胶原蛋白热水解成小分子多肽[28],高压蒸汽杀菌处理会破坏维持胶原蛋白活性肽空间结构的化学键,导致活性下降或丧失[30]。任娇艳[31]研究发现,高压蒸汽杀菌会使草鱼胶原蛋白肽的活性显著低于巴氏杀菌,会破坏维持活性肽空间结构的化学键,导致活性丧失,因此高温处理会降低猪皮胶原蛋白的DPPH·清除能力。
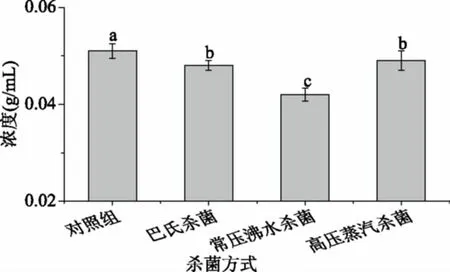
图6 不同杀菌方式DPPH·清除能力的比较Fig.6 The scavenging DPPH· activity ofdifferent sterilization methods
2.6.2 ·OH清除能力 从图7可知,不同杀菌方式处理后,软质胶原蛋白冻仍具有一定的·OH清除能力,随着样品浓度的增加,清除能力增强,呈现一定的量效关系。常压沸水杀菌后软质胶原蛋白冻对·OH清除能力最强,IC50为0.09 g/mL,其次是高压蒸汽杀菌组(0.10 g/mL)、巴氏杀菌组(0.11 g/mL)和对照组(0.12 g/mL)。常压沸水杀菌处理后,软质胶原蛋白冻中小分子量蛋白(5~10 kDa之间和<5 kDa)含量最高,小分子胶原蛋白多肽对·OH有较好的清除能力[32]。
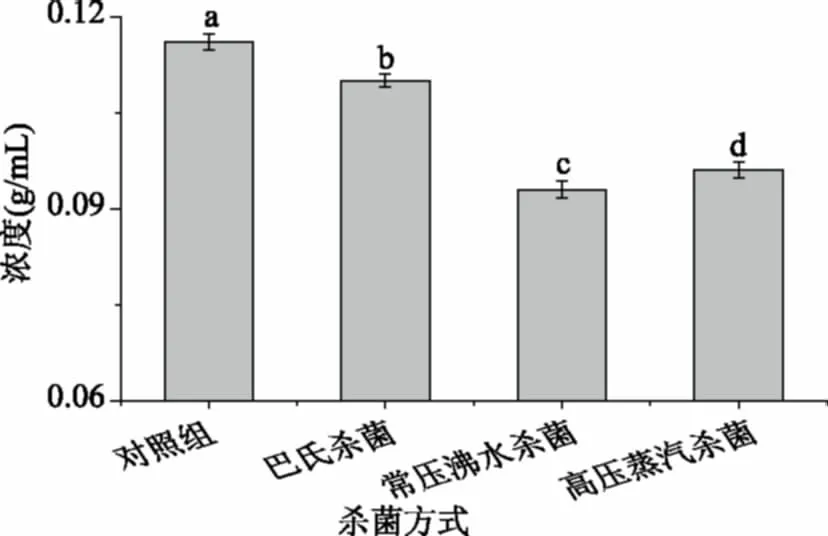
图7 不同杀菌方式·OH清除能力比较Fig.7 The scavenging ·OH activity ofdifferent sterilization methods
2.6.3 Fe3+还原力 抗氧化剂能在一定的条件下将Fe3+还原成Fe2+,使体系颜色发生变化,用分光光度计在700 nm处测定体系的吸光度值,即可反映待测物质还原能力的强弱,吸光度值越大,还原能力越强。不同杀菌方式处理软质胶原蛋白冻后其Fe3+还原力结果如图8所示。由图中可以看出,杀菌后软质胶原蛋白冻具有一定的Fe3+还原能力;各处理组还原力大小依次为:高压蒸汽杀菌(0.369±0.004)>常压沸水杀菌(0.368±0.012)>巴氏杀菌(0.292±0.002)>对照组(0.287±0.006),常压沸水杀菌和高压蒸汽杀菌处理组间无明显差异(p>0.05)。
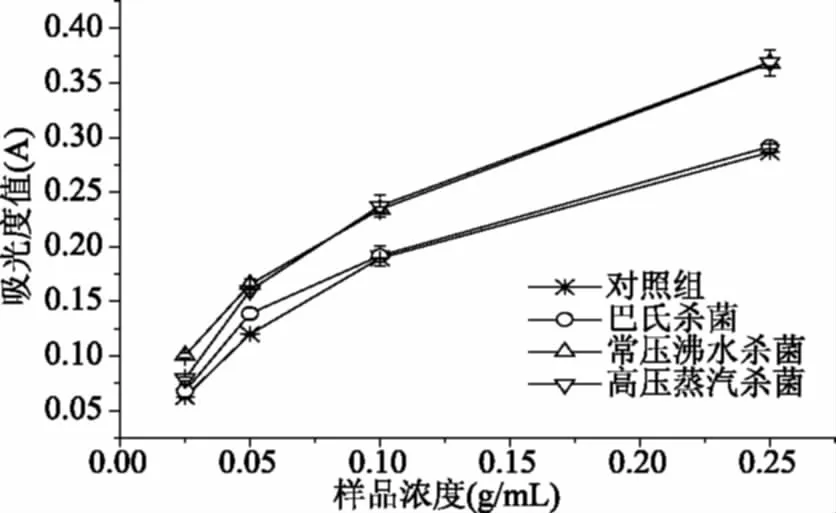
图8 不同杀菌方式的还原能力比较Fig.8 The reducing ability of different sterilization methods
3 结论
通过对比软质胶原蛋白冻的品质及抗氧化能力变化得出:不同杀菌方式对软质胶原蛋白冻的质构及色泽影响较大,常压沸水杀菌后软质胶原蛋白冻色泽明亮,咀嚼性和弹性等质构特性与市售果冻最接近,高压蒸汽杀菌后硬度、弹性和咀嚼性都显著下降;常压沸水杀菌组的·OH清除能力最强,Fe3+还原力较好,其中小分子蛋白(5000~10000 Da和<5000 Da)占比为35.19%。常压沸水杀菌不仅有良好的杀菌效果,还能在维持软质胶原蛋白冻质构特性的同时提高其抗氧化活性,是较适合软质胶原蛋白冻的一种杀菌方式,值得在软质胶原蛋白冻领域推广应用。
[1]蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社.2006.
[2]Akinori Haratake,Daisuke Watase,Takuya Fujita,et al.Effects of oral administration of collagen peptides on skin collagen content and its underlying mechanism using a newly developed low collagen skin mice model[J]. Journal of Functional Foods,2015,16:174-182.
[3]Takashi Fujii,Takahiro Okuda,Naomi Yasui,et al. Effects of amla extract and collagen peptide on UVB-induced photoaging in hairless mice[J].Journal of Functional Foods,2013,5:451-459.
[4]S Morimura,H Nagata,Y Uemura,A Fahmi,T Shigematsu,K Kida. Development of an effective process for utilization ofcollagenfrom livestock and fish waste[J]. Process Biochemistry,2002,37:1403-1412.
[5]魏玉,王元兰.κ-卡拉胶与魔芋胶复配凝胶结构探讨[J]. 食品科学,2012,09:47-49.
[6]Moritaka H,Natio S,Nishinari K,et al. Effects of gellan gum,citric acid and sweetener on the texture of lemon gel[J]. Journal of Texture Studies,1999,30(1):29-44.
[7]Funami T. Next target for food hydrocolloid studies:Texture design of foods using hydrocolloid technology[J]. Food Hydrocolloids,2011,25(8):1904-1914.
[8]王哲平,刘淇,曹荣,等.温度对刺参胶原蛋白结构和分子量变化的影响[J].渔业科学进展,2011(6):80-84.
[9]曾庆孝,苪汉明,李汴生. 食品加工与保藏原理[M]. 北京:化学工业出版社,2008:66-96.
[10]张晓银,李汴生.常压沸水杀菌对低酸性大米果冻质构特性的影响[J].食品与发酵工业,2012(7):98-102.
[11]程雨晴,解万脆,杨锡洪,等.鱼鳞胶原蛋白冻休闲食品的制备及其优化[J].农产品加工,2014(3):12-14.
[12]胥彩云,童军茂,周晓宏.胰酶水解猪皮胶原蛋白及其产物氨基酸分析[J].食品研究与开发,2010(9):34-36.
[13]韦志刚.黑木耳质量检测及黑木耳果冻产品的开发[D]. 福建农林大学,2012.
[14]程伟伟,夏列,蒋爱民,等.不同冷冻方式对调理猪肉贮藏期品质影响的对比研究[J].食品工业科技,2015(8):333-339.
[15]顾杨娟.草鱼鱼鳞冻的制备及其性质研究[D].上海:上海海洋大学,2013.
[16]Murilo M M,Pedroza I R,Lobato C C,et al. Designing W1/O/W2double emulsions stabilized by protein-polysaccharidecomplexes for producing edible films:Rheological,mechanical and water vapour properties[J]. Food Hydrocolloids,2011,25(4):577-585.
[17]王元兰,魏玉. κ-卡拉胶与魔芋胶复配胶体系的流变特性[J]. 食品科学,2011,05:92-95.
[18]GB/T 5009.5-2010,食品中蛋白质的测定[S].
[19]GB 4789.2-2016,食品卫生微生物学检验菌落总数测定[S].
[20]Hui Yang,Xiao long Wen,Shan guang Guo,et al.Physical,antioxidant and structural characterization of blend films based onhsian-tsaogum(HG)andcasein(CAS)[J]. Carbohydrate Polymers,2015,134,(10):222-229.
[21]Scherer R,Godoy H T. Antioxidant activity index(AAI)by the 2,2-diphenyl-1-picrylhydrazy Method[J].Food Chemistry,2009,112(3):654-658.
[22]Smirnoff N,Cumbes Q J. Hydroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry,1989,28(4):1057-1060.
[23]任俊凤,任婷婷,朱蓓薇.河豚鱼皮胶原蛋白多肽提取及其抗氧化活性的研究[J].中国食品学报.2009(1):77-82.
[24]阚建全.食品化学.北京:中国农业大学出版社,2002.
[25]王晓园,杨晓泉,朱建华.大豆蛋白组分与κ-卡拉胶混合凝胶的流变学研究[J].现代食品科技,2008,06:501-505.
[26]徐志丽,吴晖.卡拉胶的流变性能[J].广州食品工业科技,2004,03:153-155,152.
[27]肖和兰,孙素琴,周群,等.温度对胶原蛋白结构影响的二维红外相关光谱的研究[J].原子与分子物理学报,2003,02:211-218.
[28]Buedo A P,Elustondo M P,Urbicain M J. Amino acid loss in peach juice concentrate during storage[J]. Innovative Food Science & Emerging Technologies,2001(1):281-288).
[29]Babsky N E,Toribio J L,Lozano J E. Influence of storage on the composition of clarified apple juice concentrate[J]. Journal of Food Science,1986,51:564-567.
[30]张雪,陈复生.高压对食品基本成分影响的研究进展[J].食品工业科技,2006,27(1):210-213.
[31]任娇艳.草鱼蛋白源抗疲劳生物活性肽的制备分离及鉴定技术研究[D].广州:华南理工大学,2008.
[32]林琳.鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学,2006.
Effectsofdifferentsterilizationmethodsonthequalityandantioxidantactivityofsoftcollagenjelly
WUHong1,ZHOUQuan1,GUOShan-guang1,WANJun2,WUWei-liang3,JIANGAi-min1,*,LUOBi-lin1,QIYan-jing1
(1.College of Food Science,South China Agricultural University,Guangzhou 510642,China;2.Guangdong Agr Ind Business Polytechnic College,Guangzhou 510507,China;3.Guangdong Provincial Center for Disease Control and Prevention,Guangzhou 511430,China)
In this research,pigskin collagen enzyme solution was used as main raw material to make a soft collagen jelly,on the basis of this,the effects of different sterilization methods(pasteurization,atmospheric pressure boiling water sterilization,high pressure steam sterilization)on the quality and antioxidant activity of soft collagen gel were investigated. Results showed that the color of soft collagen jelly with high pressure steam sterilization was yellow,the hardness,flexibility and chewiness were decreased significantly(p<0.05). After different sterilization process,there were four protein components separated by ultrafiltration(>50,10~50,5~10,<5 kDa),and macromolecular protein(>50 kDa)accounted for the biggest percentage,the content of protein which were 5~10 kDa and<5 kDa of atmospheric pressure boiling water sterilization were highest,accounted for 25.71% and 9.48%,the scavenging activity of DPPH· and ·OH was strongest in atmospheric pressure boiling water sterilization group,IC50were 0.042 g/mL and 0.093 g/mL,and the soft collagen jelly showed a bright colour and good elasticity. In conclusion,atmospheric pressure boiling water sterilization not only has good sterilization effect,also can keep soft collagen jelly’s texture and antioxidant activity better,which lay the foundation for the new soft collagen jelly’s processing technology.
collagen;antioxidant;pasteurization;atmospheric pressure boiling water sterilization
TS251
A
1002-0306(2017)19-0052-06
10.13386/j.issn1002-0306.2017.19.010
2017-04-11
吴红(1993-),女,硕士研究生,研究方向:食品工程,E-mail:m13422056632@163.com。
*通讯作者:蒋爱民(1957-),男,博士,教授,研究方向:畜产品加工, E-mail:amjiang@scau.edu.cn。
广东省畜禽产品加工工程技术研究开发中心建设项目/畜禽产品精准加工与安全国家地方联合工程研究中心建设项目。
