草珊瑚属药用植物的生物活性物质基础△
2017-09-21杨秀伟
杨秀伟
(北京大学 天然药物及仿生药物国家重点实验室,北京大学 药学院 天然药物学系,北京 100191)
·专论·
草珊瑚属药用植物的生物活性物质基础△
杨秀伟*
(北京大学 天然药物及仿生药物国家重点实验室,北京大学 药学院 天然药物学系,北京 100191)
评述金粟兰科草珊瑚属药用植物草珊瑚和海南草珊瑚的化学成分和分析方法、生物学活性和药理学作用、安全性、临床应用。尽管已从草珊瑚属药用植物中分离鉴定出三萜、苯丙素、香豆素、木脂素、黄酮、酚、酚酸等类型化合物,但倍半萜类化合物无论是在含量上,还是在化学结构多样性上,占绝对优势地位,它们可能是草珊瑚属药用植物的重要生物活性物质基础之一。
草珊瑚;海南草珊瑚;生物活性物质基础;倍半萜
金粟兰科(Chloranthaceae)植物有5属,约70种,分布于热带和亚热带,药用3属13种1亚种2变种。草珊瑚属(SarcandraGardn.)是其中的一属,有3种,分布于亚洲东部至印度;我国有1种1亚种,分别为草珊瑚Sarcandraglabra(Thunb.)Nakai subsp.Glabra(Glabrous Sarcandra)、海南草珊瑚Sarcandraglabra(Thunb.)Nakai subsp.brachystachys(Blume)Verdc.[=Sarcandrahainanensis(C.Pei)Swamy et I.W.Bailey(Hainan Sarcandra)],产于西南部至东南部,药用全草。其中的草珊瑚不良反应低,在临床上正被广泛使用,有很好的应用前景,是研制现代中药的天然资源。迄今,已从草珊瑚属药用植物中分离鉴定了三萜、苯丙素、香豆素、木脂素、黄酮、酚、酚酸、倍半萜等类型化合物。本文评述这些化学成分的研究,重点突出其中的倍半萜类化合物,并给出了它们的化学结构。
1 草珊瑚
1.1 产地和功效
产于江西、安徽、浙江、福建、湖北、湖南、台湾、海南、广东、广西、贵州、四川和云南;亦分布于柬埔寨、印度、日本、朝鲜、马来西亚、菲律宾、斯里兰卡、越南。《中华人民共和国药典》1977、2000、2005、2010、2015年版收载在“肿节风”项下,《云南药品标准》1974和1996年版收载为“鱼子兰”的基原植物,药用其干燥全草。江西称肿节风,浙江称九节茶,广西称节骨茶,云南称珍珠兰、九节草、鱼子兰。具有祛风除湿、活血散瘀、清热解毒的功能;用于肢体麻木、跌打损伤、骨折、妇女痛经、产后瘀滞腹痛、肺炎、急性阑尾炎、急性胃肠炎、菌痢、胆囊炎、脓肿、口腔炎、风湿痹痛等症。
1.2 化学成分
地上部分或全草含特征性成分倍半萜类,包括单量体和二聚体倍半萜。1996年,鉴定出金粟兰内酯(chloranthalactone)A(1)、G(2)[1],其后相继鉴定出金粟兰内酯B(3)[2]和E(4)[3],肿节风苷(sarcaglaboside)A(5)、B(6)[4]、C(7)[2,4]、D(8)、E(9)[4]、F(10)、G(11)、H(12)[2],金栗兰诺苷A(chloranoside A,13)[2,4-5],9-羟基异质柳珊瑚内酯(9-hydroxyheterogorgiolide,14)[2],8β,9α-二羟基桉叶-4(15),7(11)-二烯-8α,12-内酯[8β,9α-dihydroxyeudesman-4(15),7(11)-dien-8α,12-olide,15],8β,9α-二羟基林丹-4(5),7(11)-二烯-8α,12-内酯[8β,9α-dihydroxylindan-4(5),7(11)-dien-8α,12-olide,16],(-)-伊斯坦布尔马芹素A[(-)-istanbulin A,17][3],白术内酯(atractylenolide)III(18)[3,6]、IV(19)[7],伊斯坦布尔马芹素A(istanbulin A,20)[6],金粟兰内酯E-8-O-β-D-吡喃葡萄糖苷(chloranthalactone E-8-O-β-D-glucopyranoside,21)[4],草珊瑚醇(glabranol)A(22)、B(23)[8],8β,9α-二羟基林丹-4(5),7(11)-二烯-8α,12-内酯[8β,9α-dihydroxylindan-4(5),7(11)-dien-8α,12-olide,24][7],银线草内酯(shizukanolide)E(25)、F(26)[7]、H(27)[9],草珊瑚内酯(sarcandralactone)A(28)[10]、B(29)[9-10]、C(30)、D(31)、E(32)[9],尖叶木新姜子酮B(neolitacumone B,33)[9-10],3-桉叶烯-1β,7,11-三醇(3-eudesmene-1β,7,11-triol,34)[10],1α,8α,9α-三羟基桉叶-3(4),7(11)-二烯-8β,12-内酯[1α,8α,9α-trihydroxyeudesman-3(4),7(11)-dien-8β,12-olide,35][11],4α-羟基-5αH-林丹-8(9)-烯-8,12-内酯(4α-hydroxy-5αH-lindan-8(9)-en-8,12-olide,36)[12],莪术呋喃二烯酮(furanodienone,37),银线草内酯(shizukanolide,38)[13],日本金粟兰内酯C(chlorajapolide C,39),伊斯坦布尔马芹素B(istanbulin B,40)[14],4α,7α-环氧愈创木烷-10α,11-二醇(4α,7α-epoxyguaiane-10α,11-diol,41),匙叶桉油烯醇(spathulenol,42)[1,10],橙花叔醇(nerolidol,43)[1],草珊瑚宝酯(sarcaboside)A(39)、B(40)[15]。化学结构见图1。
二聚体倍半萜类化合物包括:草珊瑚萜内酯(sarcandrolide)A(46)、B(47)、C(48)[10]、D(49)、E(50)[9-10]、F(51)、G(52)、H(53)、I(54)、J(55)[9],银线草醇(shizukaol)B(56)[10]、C(57)[9-10]、D(58)[9]、E(59)、G(60)[10]、H(61)[9],环银线草醇A(cycloshizukaol A,62),全缘金粟兰内酯F(chlorahololide F,63)[9-10],金粟兰素F(spicachlorantin F,64),宽叶金粟兰醇D(henriol D,65)[9],日本金粟兰尼内酯E(chlorajaponilide E,66)[9]。化学结构见图2。
还含有其他类型化学成分。降倍半萜或大柱香波龙烷类:二氢催吐萝芙木醇-O-β-D-吡喃葡萄糖苷(dihydrovomifoliol-O-β-D-glucopyranoside)[2],(6R,9S)-长春花苷[(6R,9S)-roseoside],二氢催吐萝芙木醇(dihydrovomifoliol)[7,16],催吐萝芙木醇-O-β-D-吡喃葡萄糖苷(vomifoliol-O-β-D-glucopyranoside),淫羊藿次苷(icariside)B1、B5,顺式-脱落酸(cis-abscisic acid),β-D-吡喃葡萄糖基脱落酸酯苷(β-D-glucopyranosylabscisate)[16];三萜类:白桦脂酸(betulinic acid)[1],1β-羟基羽扇豆醇(1β-hydroxy-lupeol)[5],羽扇豆醇(lupeol),24-羟基羽扇豆醇(24-hydroxylupeol)[13],草珊瑚三萜苷(sarcandroside)A、B[17];苯丙素类:草珊瑚酚苷(glabraoside)C、D[11],5-O-咖啡酰奎宁酸甲酯(methyl 5-O-caffeoylquinilic acid)[18],绿原酸(chlorogenic acid;3-O-caffeoylquinic acid),隐绿原酸(cryptochlorogenic acid;4-O-caffeoylquinic acid),新绿原酸(neochlorogenic acid;5-O-caffeoylquinic acid),迷迭香酸-4-O-β-D-吡喃葡萄糖苷(rosmarinic acid-4-O-β-D-glucopyranoside)[19],迷迭香酸(rosmarinic acid)[19-20],迷迭香酸甲酯(rosmarinic acid methyl ester)[19,21],迷迭香酸乙酯(ethyl rosmarinate)[22],咖啡酸(caffeic acid)[19,21],咖啡酸乙酯(caffeic acid ethyl ester),乙烯醇咖啡酸酯(vinyl caffeate)[19],3-O-咖啡酰莽草酸(3-O-caffeoylshikimic acid),4-O-咖啡酰莽草酸(4-O-caffeoylshikimic acid)[19-20],5-O-咖啡酰莽草酸(5-O-caffeoylshikimic acid)[20],丁香酸(caryophyllic acid)[19],N-反式-阿魏酰酪胺(N-trans-feruloyltyramine)[22],ω-羟基丙基愈创木酮(ω-hydroxypropioguaiacone)[16],(2S)-3,3-二-(4-羟基-3-甲氧基苯基)-1,2-丙二醇[(2S)-3,3-di-(4-hydroxy-3-methoxyphenyl)-propane-1,2-diol][23];香豆素类:草珊瑚香豆素(sarcandracoumarin)[20],东莨菪内酯(scopoletin)[1,24],东莨菪苷(scopolin)[16],秦皮苷(fraxin)[16,24],4,4′-双异嗪皮啶(4,4′-biisofraxidin),七叶树内酯(esculetin),秦皮素(fraxetin),滨蒿内酯(scoparone)[24],异嗪皮啶(isofraxidin)[1,24-25],秦皮啶(fraxidin),异嗪皮啶-7-O-β-D-吡喃葡萄糖苷(isofraxidin-7-O-β-D-glucopyranoside)[25],3,3′-双异嗪皮啶(3,3′-biisofraxidin)[6],3,5-二羟基香豆素-7-O-α-L-吡喃鼠李糖苷(3,5-dihydroxycoumarin-7-O-α-L-rhamnopyranoside)[26];木脂素类:印度杠柳素1(hemidesmin 1)[22],(-)-(7S,8R)-二氢去氢二松柏醇[(-)-(7S,8R)-dihydrodehydrodiconiferyl alcohol][22,27],(-)-(7S,8R)-二氢去氢二松柏醇-9-O-α-D-吡喃葡萄糖苷[(-)-(7S,8R)-dihydrodehydrodiconiferyl alcohol-9-O-α-D-glucopyranoside],(-)-(7S,8R)-二氢去氢二松柏醇-9′-O-α-D-吡喃葡萄糖苷[(-)-(7S,8R)-dihydrodehydrodiconiferyl alcohol-9′-O-α-D-glucopyranoside],(-)-(7S,8R)-二氢去氢二松柏醇-4-O-α-D-吡喃葡萄糖苷[(-)-(7S,8R)-dihydrodehydrodiconiferyl alcohol-4-O-α-D-glucopyranoside],(-)-(7S,8R)-5-甲氧基二氢去氢二松柏醇-4-O-β-D-吡喃葡萄糖苷[(-)-(7S,8R)-5-methoxydihydrodehydrodiconiferyl alcohol-4-O-β-D-glucopyranoside][27];黄酮类:2′,4′-二羟基-6′-甲氧基-二氢査耳酮(2′,4′-dihydroxy-6′-methoxy-dihydrochalcone),2′,4′-二羟基-4,6′-二甲氧基-二氢査耳酮(2′,4′-dihydroxy-4,6′-dimethoxy-dihydrochalcone),2′,6′-二羟基-4,4′-二甲氧基-二氢査耳酮(2′,6′-dihydroxy-4,4′-dimethoxy-dihydrochalcone;calomelanen),2′-羟基-4′,6′-二甲氧基-二氢査耳酮(2′-hydroxy-4′,6′-dimethoxy-dihydrochalcone;dihydroflavokawain B;dihydroflavoka-win B;lapathone),6′-羟基-2′,4,4′-三甲氧基-二氢査耳酮(6′-hydroxy-2′,4,4′-trimethoxy-dihydrochalcone)[1],鸢尾苷(tectoridin)[5],5-羟基-7,4′-二甲氧基二氢黄酮(5-hydroxy-7,4′-dimethoxyflavanone;naringenin 4′,7-dimethyl ether)[1,6],安哥拉紫玉盘素(uvangoletin)[6],2′,6′-二羟基-4′-甲氧基二氢査耳酮(2′,6′-dihydroxy-4′-methoxydihydrochalcone)[1,13],7-甲基柚皮苷元(7-methylnaringenin)[13],槲皮素-3-O-α-D-吡喃葡萄糖醛酸苷(quercetin-3-O-α-D-glucuronide),槲皮素-3-O-β-D-吡喃葡萄糖醛酸苷甲酯(quercetin-3-O-β-D-glucuronopyranoside methyl ester),5,7,4′-三羟基-8-C-β-D-吡喃葡萄糖基二氢黄酮苷(5,7,4′-trihydroxy-8-C-β-D-glucopyranosylflavanone),新落新妇苷(neoastilbin)[18],山柰酚-3-O-β-D-吡喃葡萄糖醛酸苷(kaempferol-3-O-β-D-glucuronide)[18,25],(+)-3,3′,5,5′,7-五羟基二氢黄酮[(+)-3,3′,5,5′,7-pentahydroxyflavanone][22],5,7,3′,4′-四羟基-6-C-β-D-吡喃葡萄糖基二氢黄酮苷(5,7,3′,4′-tetrahydroxy-6-C-β-D-glucopyranosylflavanone),山柰酚(kaempferol),球松素(pinostrobin)[1,6,13,25],草珊瑚酚苷A(glabraoside A),3′-(7"-烯丙基苯基)-2′,4′,4′-三羟基-6′-甲氧基二氢查尔酮[3′-(7"-allylphenyl)-2′,4′,4′-trihydroxy-6′-methoxydihydrochalcone][28];酚、酚酸类:刺五加苷B1(eleutheroside B1)[13,27],3,5-二甲氧基-4-羟基-苯甲醇-4-O-β-D-吡喃葡萄糖苷(3,5-dimethoxyl-4-hydroxybenzyl alcohol-4-O-β-D-glucopy-ranoside),葡萄糖丁香酸(glucosyringic acid)[16],香荚兰酚苷(vanilloloside)[16,20],丁香酸(syringic acid),1,2-苯二酚(1,2-benzenediol),香草酸(vanillic acid),3,4-二羟基苯甲酸(3,4-dihydroxybenzoic acid),酪醇(tyrosol)[20],3,4-二羟基苯乳酸甲酯(methyl-3,4-dihydroxyphenyllactate),邻苯二甲酸二丁酯(dibutyl phthalate)[21],苄基-2-β-吡喃葡萄糖氧基苯甲酸酯(benzyl-2-β-glucopyranosyloxybenzoate)[27],3-甲氧基-4-羟基苯甲酸(3-methoxy-4-hydroxybenzoic acid),原儿茶酸(protocatechuic acid)[19];其他类:β-谷甾醇,胡萝卜苷[6],3β-羟基豆甾-5-烯-7-酮(3β-hydroxystigmast-5-en-7-one),3β-羟基豆甾-5,22-二烯-7-酮(3β-hydroxystigmast-5,22-dien-7-one),4-羟基-4,7-二甲基-l-四氢萘酮(4-hydroxy-4,7-dimethyl-l-tetralone),(+)-羟基二氢新库鲁醇[(+)-hydroxydihydroneocurucol][14],十六酸[6],十五酸[13],酸性多糖SGP-2[29]。
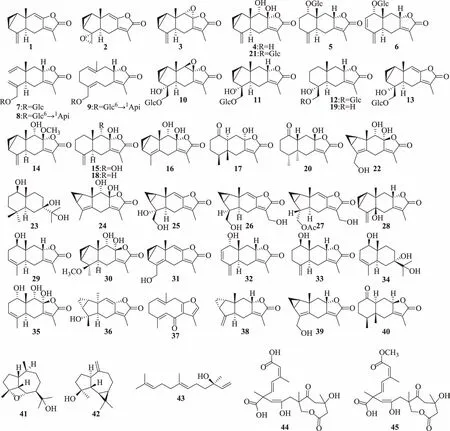
图1 草珊瑚中的单倍体倍半萜类化合物结构
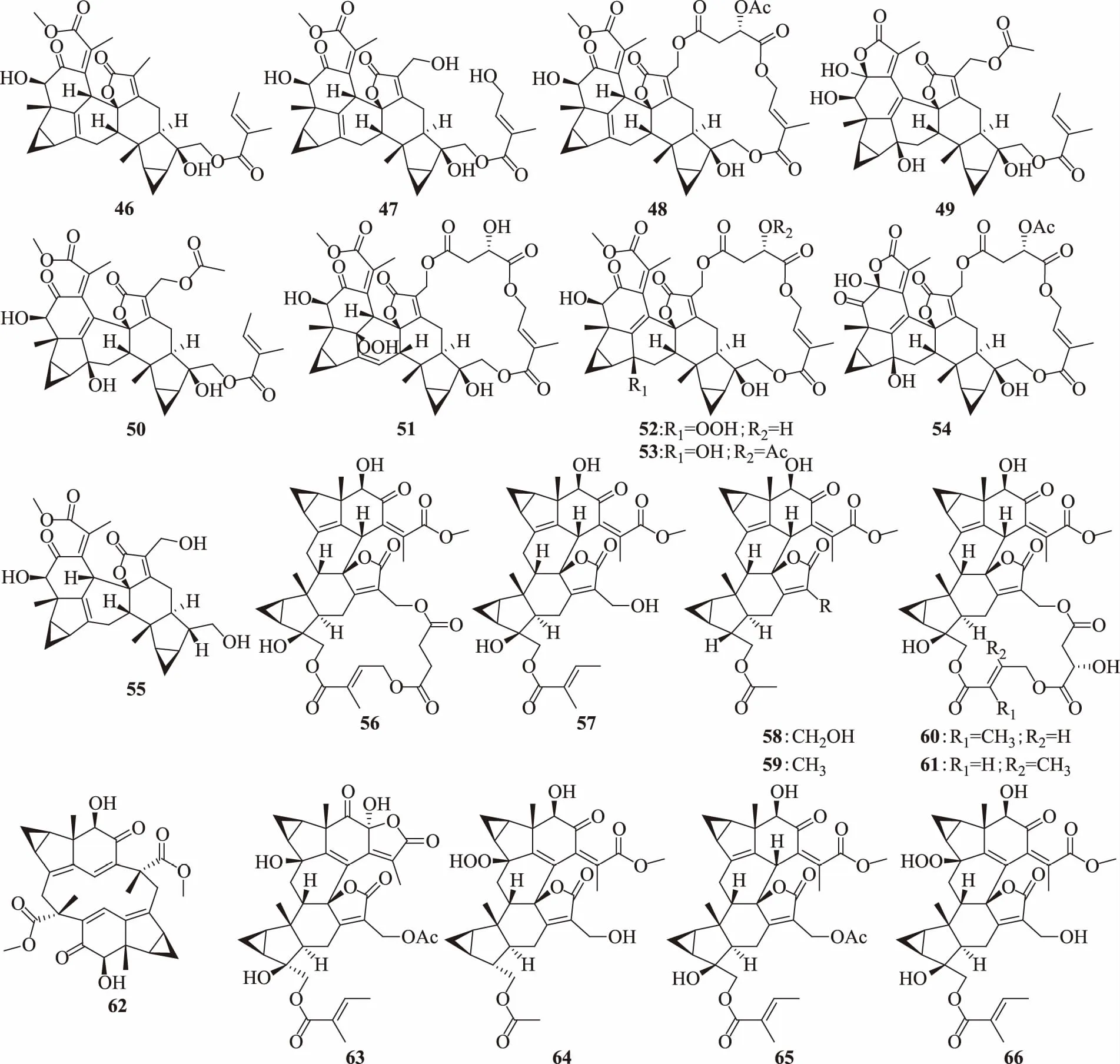
图2 草珊瑚中的二聚体倍半萜类化合物结构
种子含特征性成分倍半萜类化合物,包括草珊瑚酯B(sarcandrolide B,47),银线草醇(shizukaol)B(56)、C(57)、G(60)、N(67),草珊瑚新酯(sarglabolide)A(68)、B(69)、C(70)、D(71)、E(72)、F(73)、G(74)、H(75)、I(76)、J(77)、K(78)[30],草珊瑚过氧化物(sarglaperoxide)A(79)、B(80)[31]。化学结构见图3。
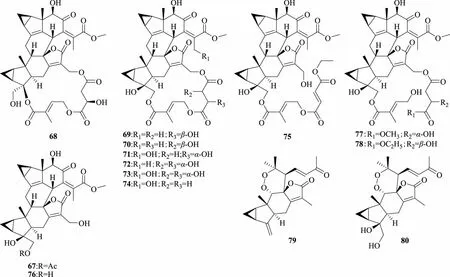
图3 草珊瑚种子中的倍半萜类化合物结构
1.3 化学成分分析方法
《中华人民共和国药典》2015年版“肿节风”项下规定照反相高效液相色谱(HPLC)法测定,按干燥品计算,含异嗪皮啶不得少于0.02%,含迷迭香酸不得少于0.02%[32]223-224;“肿节风浸膏”项下规定照反相HPLC法测定,特征图谱中应检出绿原酸、异嗪皮啶、迷迭香酸、新绿原酸、隐绿原酸等6个特征峰[32]409-410。Li等[33]开发了超高效液相色谱(UPLC)法测定草珊瑚全草及清热消炎宁胶囊、肿节风片、金粟兰搽剂、肿节风注射液、血康胶囊等相关制剂中的绿原酸、隐绿原酸、新绿原酸、咖啡酸、异嗪皮啶-7-O-β-D-吡喃葡萄糖苷、秦皮啶、迷迭香酸、迷迭香酸-4-O-β-D-吡喃葡萄糖苷、落新妇苷和新落新妇苷等10个化学成分。嗣后,将液质联用技术用于测定草珊瑚全草中的17个成分,除上述10个化学成分外,还包括原儿茶酸、异嗪皮啶、新异落新妇苷、异落新妇苷、槲皮素-3-O-β-D-吡喃葡萄糖醛酸苷、槲皮苷(quercitrin)、金粟兰内酯E,并进行了定量分析[34],只有金粟兰内酯E是比较有特征性的成分。
1.4 生物活性和药理学作用
1.4.1 抗肿瘤作用 草珊瑚挥发油对EAC、S180、W256、L615等瘤株增殖均有抑制作用[35-36]。草珊瑚挥发油和浸膏对癌细胞株白血病615、瓦克癌256、TM755、肺腺癌615、自发乳腺癌615、自发腹水型AL771、艾氏腹水癌、肉瘤180、肉瘤37等增殖均有抑制作用[37]。肿节风注射液对Bcl-7408、HCT-8肿瘤细胞增殖具有一定的抑制作用,与阿霉素并用对HC-T8细胞可产生相加或增强的协同抑制效果,尤以高浓度与阿霉素的协同作用更显著[38];草珊瑚注射液体外可灭活L615细胞,且能减少其对自发乳腺癌615敏感小鼠的感染率;腹腔注射草珊瑚粗提物,对移植性小鼠固体肿瘤S180和大鼠W256增殖均有较强的抑制作用;草珊瑚浸膏和注射液中的黄酮类成分对艾氏腹水癌、S180、RS615、TM755均有抑制作用;草珊瑚乙酸乙酯提取物通过干预人白血病HL-60细胞DNA复制,将细胞阻滞于S期,通过上调Bax/Bcl-2比率,促进肿瘤细胞凋亡[39]。
单体化合物41、42、43[10]、46和48[9]对人白血病细胞株HL-60细胞增殖具有抑制作用,IC50分别为3.1、8.4、8.5、0.03、1.2 μmol·L-1;41和43[10]对人肺腺癌细胞株A-549细胞增殖亦具有抑制作用,IC50分别为7.2、4.7 μmol·L-1。从草珊瑚抗肿瘤活性部位分离出的某些化合物在低质量浓度(1 μg·mL-1)、中质量浓度(10 μg·mL-1)没有显示出对肿瘤细胞增殖有抑制作用,但在高质量浓度(100 μg·mL-1)具有一定程度的抑制活性,3,3′-双异嗪皮啶、伊斯坦布尔马芹素A、2′,4′-二羟基-6′-甲氧基二氢查耳酮和异嗪皮啶对HL60、A549、BGC-823和BEL-7402有抑制活性;球松素、滨蒿内酯对HL60、BGC-823和BEL-7402有抑制活性;白术内酯III对HL60和BGC-823有抑制活性;金粟兰内酯E对HL60、A549和BGC-823有抑制活性[6]。
1.4.2 抗炎镇痛作用 草珊瑚对脂多糖所致内皮细胞株表达白细胞介素-1(IL-1)有抑制作用,但对改善细胞存活率无明显作用,提示在细胞毒素性肺损伤过程中其可能是通过稳定内皮细胞的代谢活性来调节由于内毒素休克所致血管内皮细胞分泌功能的紊乱[40];同时能调节由于尿酸盐所致血管内皮细胞分泌功能的紊乱,抑制炎症因子IL-1的过度释放,阻断炎症级联反应,达到治疗效果[41];草珊瑚干浸膏灌胃能显著减轻巴豆油所致小鼠耳廓炎症和角叉莱胶所致大鼠足趾炎症、减少醋酸腹腔注射所致小鼠扭体次数[42]。单体化合物3,5-二羟基香豆素-7-O-α-L-吡喃鼠李糖苷对脂多糖所致RAW264.7巨噬细胞一氧化氮(NO)的产生具有抑制作用,其作用是通过抑制诱导性一氧化氮合酶(iNOS)mRNA表达实现的[26];56、60和68对脂多糖所致RAW264.7巨噬细胞NO的产生具有抑制作用,IC50分别为2.33、4.65和3.04 μmol·L-1[30];79对脂多糖所致RAW264.7巨噬细胞NO的产生亦具有抑制作用[31]。二聚体倍半萜类的56能抑制血管细胞黏附,特别是细胞内的细胞黏附分子-1(ICAM-1),提示其能用于动脉硬化和炎症性疾病(类风湿性关节炎、过敏性哮喘、骨质疏松症等)[43]。56和62在HL-60细胞能抑制佛波醇-12-肉豆蔻酸酯-13-乙酸酯(PMA)所致同型细胞聚集,最小抑制浓度(MIC)分别为34.1 nmol·L-1和 0.9 μmol·L-1,抑制HL-60细胞的ICAM-1表达呈现浓度依赖性[44]。
1.4.3 抗菌抗病毒作用 草珊瑚干浸膏(肿节风片)对白色念珠菌、链球菌[42]、绿脓杆菌、金黄色葡萄球菌(敏感株和耐药株)、大肠杆菌[42,45]和痢疾(志贺氏、宝石、弗氏3种)杆菌、伤寒和副伤寒杆菌皆有一定程度的抑制作用[45];在与双黄连、柴银口服液、祛痰灵口服液比较性试验中,发现肿节风片抑制金黄色葡萄球菌、肺炎链球菌、大肠埃希菌等有更好的抗菌效果,在抑制铜绿假单胞菌的效果上,肿节风片与双黄连口服液抑菌效果相当[45]。草珊瑚CO2超临界流体萃取物对金黄色葡萄球菌、大肠埃希菌、伤寒沙门菌、铜绿假单胞菌具有抑菌作用[46]。草珊瑚乙醇提取物对牙龈卟啉单胞菌生长具有抑制作用,其最小抑菌浓度(MIC)为0.313 mg·mL-1。活性导向分离发现其三氯甲烷萃取物对牙龈卟啉单胞菌和转糖链球菌生长的MIC分别为0.313、1.25 mg·mL-1;乙酸乙醋萃取物的MIC分别为0.156、1.25 mg·mL-1;进一步从抗菌活性部位分离得到的6个化合物,皆显示较好的抗菌活性。其中,异嗪皮啶对牙龈卟啉单胞菌生长的抗菌效果最好,MIC为0.078 mg·mL-1;4,4′-双异嗪皮啶对转糖链球菌的抗菌效果最好,MIC为0.125 mg·mL-1[24]。此外,草珊瑚中的山柰酚-3-O-β-D-吡喃葡萄糖醛酸苷、异嗪皮啶-7-O-β-D-吡喃葡萄糖苷、山柰酚对金黄色葡萄球菌具有抑制作用[25];79对金黃色葡萄球菌生长具有抑制作用,在25 μg·mL-1的抑制率为64.5%[31]。10%去鞣质的草珊瑚浸膏对流感病毒A/京科68-115(H3N2)的半数感染量有明显的灭活作用,其作用强于或等于金刚烷胺、病毒灵、吗啉双胍等3种对照药物[47]。
1.4.5 调节免疫作用 草珊瑚片能通过提高小鼠网状内皮系统的吞噬功能,增强非特异性免疫作用[48]。草珊瑚浸膏及其总黄酮能促进小鼠巨噬细胞吞噬功能,小剂量时可以使免疫状态亢进,但高剂量则使其下降[47]。肌内注射草珊瑚总黄酮,可显著促进小鼠腹腔巨噬细胞的吞噬功能[49]。草珊瑚中的3-O-咖啡酰奎宁酸、4-O-咖啡酰奎宁酸、5-O-咖啡酰奎宁酸、咖啡酸、5-O-咖啡酰奎宁酸、异嗪皮啶、迷迭香酸-4-O-β-D-吡喃葡萄糖苷、迷迭香酸能改善小鼠束缚应激导致的淋巴细胞减少,调整CD4+T/CD8+T平衡和提高NK细胞活性[50]。
1.4.6 促进骨折愈合作用 草珊瑚水提取物能使家兔实验性骨折的骨外膜、内膜的成骨细胞增生出现早且比较活跃,骨断端连接及骨髓腔再通较早[51]。其中的琥珀酸、延胡索酸可使骨痂含量最高的甘氨酸、精氨酸和赖氨酸较早出现且含量增高[52]。
1.4.7 抗血小板减少作用 草珊瑚总黄酮能改善小鼠免疫性血小板减少性紫癜[53],其作用机制可能与通过促进小鼠巨核系细胞增殖、增加外周血中血小板数量有关[54]。肿节风浸膏及其口服液具有对抗大剂量5-氟尿嘧啶所致血小板减少的作用,从而预防并治疗化疗后血小板减少症[55]。
1.4.8 抗氧化捕捉自由基作用 草珊瑚水溶性粗多糖和浸膏在体外实验中具有清除羟基自由基的能力[56-57];水提取物可清除AP-TEMED系统产生的超氧阴离子自由基[58]。
1.4.9 降血糖、降血脂作用 草珊瑚多糖(SGP-2)能降低2型糖尿病小鼠的血糖和血脂[59]。
1.5 毒性和不良反应
草珊瑚浸膏对大、小鼠急性毒性试验的半数最大致死剂量(LD50)均大于10g·kg-1[60];致小鼠精子畸形试验、小鼠骨髓细胞微核试验和Ames试验皆为阴性,未发现致突变作用[61]。小鼠和家兔对草珊瑚注射液的最大耐受量分别是猪用剂量的160、133倍[62]。
1.6 临床应用
1.6.1 治疗呼吸道感染 将患有急性上呼吸道感染的78例儿童随机分成两组,用肿节风注射液治疗组46例,用病毒唑治疗的对照组38例,结果显示肿节风注射液治疗组在退热时间、症状、体征消失与病毒唑治疗对照组相比有显著性差异[63]。对57例患有急性上呼吸道感染的患者进行肿节风注射液治疗,临床效果十分明显[64]。
投影面可以划分为一个中心圆和N-1个等间距的同心圆环,每个圆环处的相位初步设定为βi,且相位由内到外线性分布,则口径面内任意一点的相位可以表示为:
1.6.2 治疗肠炎 用肿节风注射液治疗小儿轮状病毒肠炎42例,对照组给予病毒唑,肿节风注射液治疗组总有效率为100%,显效率为95.2%,疗效确实、可靠[65]。
1.6.3 治疗肺炎 用肿节风注射液治疗小儿病毒性肺炎60例,与利巴韦林注射液治疗比较,肿节风注射液治疗组总有效率88.33%,利巴韦林注射液治疗组为67.27%,两组疗效差异有统计学意义[66]。
1.6.4 治疗肿瘤 用肿节风注射液配合化疗治疗晚期消化道恶性肿瘤有显著性效果[67];能在一定程度上降低顺铂+5-氟尿嘧啶联合化疗方案引起的毒副反应程度[68]。
2 海南草珊瑚
2.1 产地和功效
产于海南、广东、广西和云南;亦分布于老挝、泰国北部、越南。药用其干燥全草。海南、广东、广西、云南等地称山羊耳,作“接骨草”、“九节风”等药材使用;彝族亦药用。具有活血散瘀、祛风止痛的功能;用于跌打损伤、骨折、瘀阻肿痛、风湿痹痛、肢体麻木等症。
2.2 化学成分
全草含倍半萜类化合物:草珊瑚醇内酯(sarcanolide)A(81)、B(82)[69],化学结构见图4。未见其他倍半萜类化合物报道。
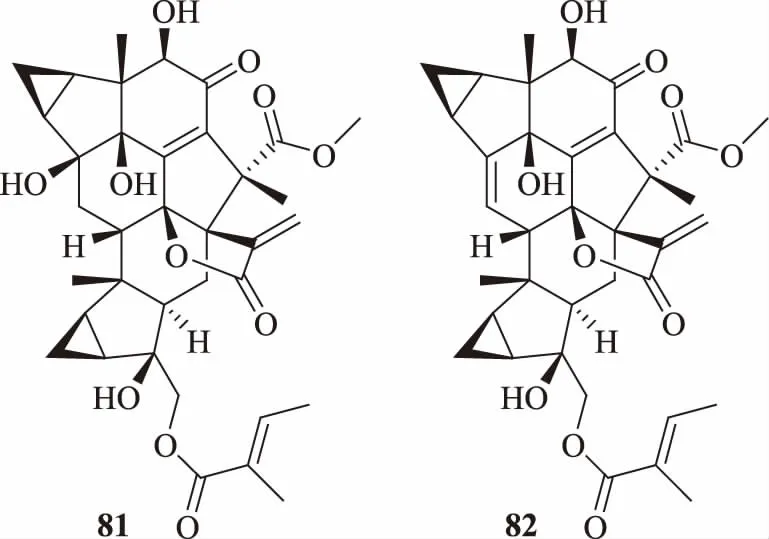
图4 海南草珊瑚中的倍半萜类化合物结构
全草还含黄酮类化合物:草珊瑚酮(sarcandrone)A、B[70]、C、D[71],球松素(pinostrobin),7-羟基-5,8-二甲氧基二氢黄酮(7-hydroxy-5,8-dimethoxyflavanone)[70],7-羟基-5,6-二甲氧基二氢黄酮(7-hydroxy-5,6-dimethoxyflavanone),山柰酚(kaempferol),7-羟基-5-甲氧基二氢黄酮(7-hydroxy-5-methoxyflavanone),柚皮苷元-4′,7-二甲醚(naringenin-4′,7-dimethyl ether),3,4′,5,7-四羟基二氢黄酮-3-O-吡喃葡萄糖苷(3,4′,5,7-tetrahydroxyflavanone-3-O-glucopyranoside),山柰酚-3-O-吡喃葡萄糖苷(kaempferol-3-O-glucopyranoside)[71],2′,3′-二羟基-4′,6′-二甲氧基查耳酮(2′,3′-dihydroxy-4′,6′-dimethoxychalcone),2′-羟基-4′,6′-二甲氧基查耳酮(2′-hydroxy-4′,6′-dimethoxychalcone),小豆蔻明(cardamonin)[72];香豆素类:异嗪皮啶(isofraxidin)[70];蒽醌类:大黄酚(chrysophanol),大黄素(emodin)[72];其他类:β-谷甾醇,花生酸(icosanoic acid),十六酸,十八酸[72]。
2.3 生物活性
二聚黄酮类的草珊瑚酮A、B对人类免疫缺陷病毒整合酶活性有抑制作用,IC50分别为18.05、25.27 μmol·L-1[70]。
3 评述
3.1 药材名称
该药材各地名称不一,比较混乱。清代何克谏撰写并于1711年出版的《生草药性备要》中称为“九节茶”[73];其后的《植物名实图考·卷三十八》中称为“接骨木”[74];《分类草药性·上卷·风类》中称为“九节风”[75]。根据《中国植物志》记载,该药材基原植物的中文正名为“草珊瑚”。为规范中药名称,该药材应按植物分类法统一称为“草珊瑚”,替代“肿节风”等,相关产品应冠以“草珊瑚”字样。
3.2 化学成分研究
本属药用植物只有草珊瑚和海南草珊瑚2个物种,前者的化学成分研究比较深入和系统,母核结构清晰,取代类型比较明确。但对后者的研究比较薄弱、极其不够深入,尤其是特征性成分倍半萜类化合物的研究更薄弱。今后应加强两者的比较性研究,阐明两者在化学成分上的异同,为化学分类提供科学依据,为深入开发利用提供化学资源。
3.3 物质基础与药学作用研究
针对草珊瑚功效开展了许多药效学研究和机制探讨,但缺乏物质基础与药学作用的相关研究。似乎缺乏倍半萜类化合物供筛或研究样品,今后应倡导学科交叉研究,以确定其特异的药效物质基础。
3.4 质量标准
任何一味中药都有其独特的疗效,取决于其特色的物质基础[76-77],要在3.3内容研究成果的基础上,建立合理的、切实可行的、科学的质量标准。
3.5 先导化学结构
草珊瑚多样性的倍半萜类化合物结构,构成了一个“精美”的袖珍型化合物库,为该类化合物优秀结构的筛选提供了极其宝贵的天然资源,为现代中药的创制提供了先导物质。
[1] Tsui W Y,Brown G D.Cycloeudesmanolides fromSarcandraglabra[J].Phytochemistry,1996,43(4):819-821.
[2] Hu X R,Yang J S,Xu X D.Three novel sesquiterpene glycosides ofSarcandraglabra[J].Chem Pharm Bull,2009,57(4):418-420.
[3] Zhu L P,Li Y,Yang J Z,et al.Two new sesquiterpene lactones fromSarcandraglabra[J].J Asian Nat Prod Res,2008,10(6):541-545.
[4] Li Y,Zhang D M,Li J B,et al.Hepatoprotective sesquiterpene glycosides fromSarcandraglabra[J].J Nat Prod,2006,69(4):616-620.
[5] Mai T H Y,Nguyen D T,Chau V M,et al.Isolation and structural determination of tectoridin and 1β,3β-dihydroxylup-20(29)-ene from the plantSarcandraglabraThunb[J].Tap Chi Duoc Hoc,2010,50(8):45-48,19.
[6] 王菲,袁胜涛,朱丹妮.肿节风抗肿瘤活性部位的化学成分[J].中国天然药物,2007,5(3):174-178.
[7] Hu X R,Wu H F,Zhang X P,et al.A new sesquiterpene lactone fromSarcandraglabra[J].Nat Prod Res,2013,27(13):1197-1201.
[8] Oanh D T K,Pham T,Hang T B,et al.Two new sesquiterpenes fromSarcandraglabra[J].Nat Prod Commun,2010,5(11):1717-1720.
[9] Ni G,Zhang H,Liu H C,et al.Cytotoxic sesquiterpenoids fromSarcandraglabra[J].Tetrahedron,2013,69(2):564-569.
[10] He X F,Yin S,Ji Y C,et al.Sesquiterpenes and dimeric sesquiterpenoids fromSarcandraglabra[J].J Nat Prod,2010,73(1):45-50.
[11] Wang C,Li Y,Li CJ,et al.Three new compounds fromSarcandraglabra[J].Chin Chem Lett,2012,23(7):823-826.
[12] 黎雄,张玉峰,杨柳,等.肿节风倍半萜类化学成分研究[J].药学学报,2011,46(11):1349-1351.
[13] 罗永明,刘爱华,余邦伟,等.中药草珊瑚的化学成分研究[J].中国药学杂志,2005,40(17):1296-1298.
[14] 郑学芳,刘海洋,钟惠民.草珊瑚化学成分的研究[J].天然产物研究与开发,2014,26(8):1221-1224,1284.
[15] Li X,Zhang Y F,Zeng X,et al.Two new-skeleton compounds fromSarcandraglabra[J].Helv Chim Acta,2012,95(6):998-1002.
[16] Wu H F,Hu X R,Zhang X P,et al.Isolation and chemotaxonomic significance of megastigmane-type sesquiterpenoids fromSarcandraglabra[J].J Med Plants Res,2012,6(28):4501-4504.
[17] Luo Y M,Liu A H,Zhang D M,et al.Two new triterpenoid saponins fromSarcandraglabra[J].J Asian Nat Prod Res,2005,7(6):829-834.
[18] 黄明菊,曾光尧,谭健兵,等.肿节风中黄酮苷类成分研究[J].中国中药杂志,2008,33(14):1700-1702.
[19] 黎雄,张玉峰,杨柳,等.肿节风酚酸类化学成分研究[J].中药新药与临床药理,2012,23(3):295-298.
[20] Feng S X,Xu L X,Wu M,et al.A new coumarin fromSarcandraglabra[J].Fitoterapia,2010,81(6):472-474.
[21] 黄明菊,李妍岚,曾光尧,等.肿节风化学成分研究[J].中南药学,2007,5(5):459-461.
[22] 朱丽萍,李媛,杨敬芝,等.草珊瑚的化学成分研究[J].中国中药杂志,2008,33(2):155-157.
[23] 段营辉,李畅,戴毅,等.草珊瑚中一个新的苯基丙二醇类化合物[J].植物分类与资源学报,2012,34(2):208-210.
[24] 许旭东,胡晓茹,袁经权,等.草珊瑚中香豆素化学成分研究[J].中国中药杂志,2008,33(8):900-902.
[25] 袁珂,朱建鑫,斯金平,等.草珊瑚正丁醇部位化学成分及抑菌活性研究[J] 中国中药杂志,2008,33(15):1843-1846.
[26] Wang M J,Zhao J,Zhao Y,et al.A new coumarin isolated fromSarcandraglabraas potential anti-inflammatory agent[J].Nat Prod Res,2016,30(16):1796-1801.
[27] Wu H F,Hu X R,Zhang X P,et al.Benzyl 2-β-glucopyranosyloxybenzoate,a new phenolic acid glycoside fromSarcandraglabra[J].Molecules,2012,17(5):5212-5218.
[28] Li Y,Zhang D M,Yu S S,et al.A novel phenylpropanoid-substituted catechin glycoside and a new dihydrochalcone fromSarcandraglabra[J].Chin Chem Lett,2006,17(2):207-210.
[29] Zhang Z H,Liu W,Zheng Y,et al.SGP-2,an acidic polysaccharide fromSarcandraglabra,inhibits proliferation and migration of human osteosarcoma cells[J].Food Funct,2014,5(1):167-175.
[30] Wang P,Luo J,Zhang Y M,et al.Sesquiterpene dimers esterified with diverse small organic acids from the seeds ofSarcandraglabra[J].Tetrahedron,2015,71(33):5362-5370.
[31] Wang P,Li R J,Liu R H,et al.sarglaperoxides A and B,sesquiterpene-normonoterpene conjugates with a peroxide bridge from the seeds ofSarcandraglabra[J].Org Lett,2016,18(4):832-835.
[32] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015.
[33] Li X,Yang L,Zeng X,et al.Simultaneous determination of ten active compounds in the whole plant ofSarcandraglabraand its related traditional chinese medicinal preparations by ultra high performance liquid chromatography[J].Asian J Chem,2012,24(1):37-41.
[34] Li X,Zhao Y,Huang R Y,et al.Simultaneous quantification of 17 bioactive constituents inSarcandraglabraby liquid chromatography-electrospray ionisation-mass spectrometry[J].Anal Methods,2014,6(19):7989-7995.
[35] 戴培兴,洪永副.肿节风抗肿瘤化学成分的初步研究[J].中草药,1981,12(3):9.
[36] 孙文娟,李晶,兰凤英,等.肿节风注射液抗小鼠前胃癌FC的作用及毒性[J].中药新药与临床药理,2003,14(3):168-171.
[37] 王劲,杨锋,沈翔,等.肿节风抗肿瘤的实验研究[J].浙江中医杂志,1999,34(10):450-451.
[38] 赵益,杨艳平,肖兵华,等.肿节风注射液抗肿瘤及与阿霉素联合用药的实验研究[J].中药新药与临床药理,2007,18(3):200-202.
[39] Li W Y,Chiu Lawrence C M,Lam W S,et al.Ethyl acetate extract of Chinese medicinal herbSarcandraglabrainduces growth inhibition on human leukemic HL-60 cells,associated with cell cycle arrest and up-regulation of pro-apoptotic Bax/Bcl-2 ratio[J].Oncol Rep,2007,17(2):425-431.
[40]朱黎红,洪华.肿节风对脂多糖诱导内皮细胞株IL-1表达的影响[J].浙江中西医结合杂志,2007,17(8):485-487.
[41] 洪华,徐红,朱黎红.肿节风对尿酸盐诱导的内皮细胞IL-1表达的影响[J].中国中医药科技,2006,13(6):397-398.
[42] 蒋伟哲,孔晓龙,黄仁彬,等.肿节风片的抗菌和抗炎作用研究[J].广西中医学院学报,2000,17(1):50-52.
[43] Choi S Y,Hyun J W,Kim K H,et al.Shizukaol B fromChloranthusjaponicusfor the treatment of arteriosclerosis and inflammatory diseases:KR 2005006406 A[P]. 2005-01-17.
[44] Kwon O E,Lee H S,Lee S W,et al.Dimeric sesquiterpenoids isolated fromChloranthusjaponicusinhibited the expression of cell adhesion molecules[J].J Ethnopharmacol,2006,104(1-2):270-277.
[45] 王靖,杜民.肿节风片与柴银、双黄连、袪痰口服液体外抑菌效果比较[J].上海医药,2008,29(2):80-82.
[46] 李先春,王敦清,赫荣安,等.草珊瑚超临界CO2流体萃取物抑菌效果和应用研究[J].日用化学工业,1999,(2):17-18.
[47] 龙维英,邹莉玲,伍学渊.草珊瑚浸膏液对流行性感冒病毒的抑制效果观察[J].江西中医药,1989(3):41-42.
[48] 蒋伟哲,孔晓龙,梁钢,等.肿节风片对恶性肿瘤和免疫功能的影响[J].广西医科大学学报,2001,18(1):39-41.
[49] 朱元昌,吴志勤,李翰芳.肿节风中微量元素在治疗中的作用[J].中成药,1991,13(12):47.
[50] He R R,Yao X S,Li H,et al.The anti-stress effects ofSarcandraglabraextract on restraint-evoked immunocompromise[J].Biol Pharm Bull,2009,32(2):247-252.
[51] 唐国杰,时光达.多核巨细胞在中草药促进骨折愈合过程中的作用[J].贵阳中医学院学报,1980(2):44-46.
[52] 熊辉.中药干预骨折愈合过程的实验研究概况[J].湖南中医学院学报,2002,22(1):69-71.
[53] 汤喜兰,黄立新,曾治君,等.肿节风总黄酮对巨核系细胞体外扩增的作用研究[J].中国实验方剂学杂志,2010,16(1):79-82.
[54] 徐国良,肖兵华,陈奇,等.肿节风及其分离部位对免疫性血小板减少性紫癜小鼠血小板的影响[J].中国实验方剂学杂志,2005,11(4):33-36.
[55] 钟立业,刘天浩,陈运贤,等.肿节风防治化疗后血小板减少症的研究[J].中药材,2005,28(1):35-37.
[56] 邵佳,郁建平,胡美忠.草珊瑚水溶性粗多糖提取及抗氧化性能研究[J].食品科学,2007,28(11):283-286.
[57] 秦俭,王仁生,滕家安,等.肿节风浸膏对氧自由基作用的研究[J].时珍国医国药,2007,18(12):2945-2946.
[58] 杜钢宁,龙奇军,蒋芸芸,等.肿节风、玄参对超氧阴离子自由基清除率影响的实验研究[J].当代医学,2009,15(19):153-154.
[59] Liu W,Zheng Y,Zhang Z Z,et al.Hypoglycemic,hypolipidemic and antioxidant effects ofSarcandraglabrapolysaccharide in type 2 diabetic mice[J].Food Funct,2014,5(11):2850-2860.
[60] 徐彩菊,吴慧岭,夏勇,等.草珊瑚浸膏的急性毒性和致突变性探讨[J].浙江中医学院学报,1996,20(5):36-37.
[61] 孙建琴,孙晓红,王惠群,等.草珊瑚的毒性研究[J].贵阳医学院学报,1998,23(1):43-44.
[62] 郁建生,杨冰,周芳英,等.草珊瑚制剂治疗禽霍乱等研究[J].中国畜禽传染病,1996(3):41-45.
[63] 王笑晴.肿节风治疗小儿急性上呼吸道感染临床观察[J].中国误诊学杂志,2008,8(12):2803-2804.
[64] 杨勇.肿节风注射液治疗急性上呼吸道感染的疗效观察[J].北方药学,2011,8(8):26.
[65] 黄国辉.肿节风治疗小儿轮状病毒肠炎42例临床观察[J].海南医学,2007,18(8):111.
[66] 姚圣祥,陆英,董艳.肿节风注射液治疗小儿病毒性肺炎60例[J].中国药业,2006,15(16):59.
[67] 於伟民,周丽红,徐益元,等.肿节风注射液合化疗治疗晚期消化道癌[J].浙江中西医结合杂志,2006,16(8):484-485.
[68] 覃玉桃,王仁生,马姗姗,等.肿节风结合PF方案治疗鼻咽癌的临床疗效观察[J].广西医学,2013(10):1317-1318.
[69] He X F,Zhang S,Zhu R X,et al.Sarcanolides A and B:Two sesquiterpenoid dimers with a nonacyclic scaffold fromSarcandrahainanensis[J].Tetrahedron,2011,67(18):3170-3174.
[70] Cao C M,Peng Y,Xu L J,et al.Two flavonoid dimers fromSarcandrahainanensis(Pei)Swamy et Bailey[J].Chem Pharm Bull,2009,57(7):743-746.
[71] Cao C M,Xu L J,Peng Y,et al.Two new flavan-flavanones fromSarcandrahainanensis[J].Chem Pharm Bull,2010,58(10):1395-1398.
[72] 曹聪梅,许利嘉,陈葵,等.海南草珊瑚石油醚部位化学成分研究[J].中国中药杂志,2009,34(8):1009-1010.
[73] 清·何克谏.生草药性备要//岭南本草古籍三种[M].北京:中国医药科技出版社,1999:39.
[74] 清·吴其浚.植物名实图考[M].北京:中华书局,1963:889.
[75] 清·佚名.分类草药性·上卷[M].民国二十八年新刻.
[76] 杨秀伟.中药新药有效成分研究及其标准制定的科学依据[J].中草药,2009,40(增刊):8-13,18.
[77] 杨秀伟.中药物质基础研究是中药继承、发展、创新的关键科学问题[J].中国中药杂志,2015,40(17):3429-3434.
BioactiveMaterialBasisofMedicinalPlantsinGenusSarcandra
YANGXiuwei*
(StateKeyLaboratoryofNaturalandBiomimeticDrugs,DepartmentofNaturalMedicines,SchoolofPharmaceuticalSciences,PekingUniversity,Beijing100191,China)
Sarcandraglabra(Thunb.)Nakai subsp.glabra andS.glabra(Thunb.)Nakai subsp.brachystachys(Blume)Verdc.[=S.hainanensis(C.Pei)Swamy et I.W.Bailey] are medicinal herbs in the Chloranthaceae family.In this article,the studies on chemical constituents and their analytical methods,biological and pharmacological activities,safety assessments,and clinical uses were reviewed.Even though triterpenoids,phenylpropanoids,coumarins,lignanoids,flavonoids,phenolics,phenolic acids and sesquiterpenoids were isolated and determinated,sesquiterpenoid compounds are predominantly dominant type not only in amount but also in structural varieties,which should be one of important bioactive material basis of medicinal plants in genusSarcandra.
Sarcandraglabra;Sarcandraglabrassp.brachystachys;bioactive material basis;sesquiterpene
“十二五”国家科技支撑项目(2011BAI07B08)
] 杨秀伟,教授,博士生导师,研究方向:天然产物化学与药物代谢;E-mail:xwyang@bjmu.edu.cn
10.13313/j.issn.1673-4890.2017.2.001
2016-04-11)
*[
