HPLC-Q-TOF/MS鉴定白屈菜中异喹啉类生物碱△
2017-09-21杨鹏卿志星左姿余坤曾建国
杨鹏,卿志星,左姿,余坤,曾建国,2*
(1.湖南中医药大学 药学院,湖南 长沙 410208;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128)
·基础研究·
HPLC-Q-TOF/MS鉴定白屈菜中异喹啉类生物碱△
杨鹏1,卿志星1,左姿1,余坤1,曾建国1,2*
(1.湖南中医药大学 药学院,湖南 长沙 410208;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128)
目的:利用HPLC-Q-TOF/MS分析技术快速、系统地鉴定白屈菜中异喹啉类生物碱。方法:采用XAqua C8色谱柱(150 mm×2.1 mm,5 μm);以乙腈-0.1%甲酸水溶液为流动相梯度洗脱;体积流量为0.3 mL·min-1;ESI源正离子模式检测。结合对照品的二级质谱及相关文献推测生物碱的结构。结果:从白屈菜的甲醇提取物中鉴定了18个生物碱,其中木兰箭毒碱(1)、北美黄连碱(4)、药根碱(12)、非洲防己碱(14)为首次在白屈菜中报道。结论:HPLC-Q-TOF/MS方法能快捷、准确地鉴定白屈菜中的化学成分,为白屈菜化学成分的进一步提取分离和药效物质基础的研究提供科学依据。
HPLC-Q-TOF/MS;白屈菜;异喹啉类生物碱
白屈菜ChelidoniummajusL.系罂粟科白屈菜属植物,别名地黄连、土黄连、牛金花、断肠草,分布于东北、华北等丘陵地带[1]。作为我国传统中药,主要用于止咳平喘、镇痛消炎、抗癌抑菌[2-4]。研究表明其主要有效成分是异喹啉类生物碱。目前发现的生物碱(如白屈菜碱、血根碱、白屈菜红碱、原阿片碱、别隐品碱、小檗碱、黄连碱、四氢黄连碱、白屈菜明碱等[5-8])主要属于苯并菲啶类、原小檗碱类、普罗托品类、四氢原小檗碱类、二聚苯并菲啶类等,而异喹啉类生物碱生源合成途径中的二氢苯并菲啶类、苄基异喹啉类却少见报道。因此,有必要对白屈菜中的化学成分进行进一步的研究。HPLC-Q-TOF/MS技术由于其高分辨率、高灵敏度的分析特点,已广泛运用到中药药效物质基础、中药化学成分分析、代谢组学等研究领域中。本研究采用HPLC-Q-TOF/MS的方法对白屈菜中的生物碱进行鉴定,为其化学成分的进一步研究和药效物质基础的阐明提供科学依据。
1 仪器与材料
1290 HPLC串联6530 Q-TOF/MS(美国Agilent公司);ML 204/02型精密天平[梅特勒-托利多仪器(上海)有限公司]。
乙腈、甲酸(色谱纯,Merck);甲醇(色谱纯,安徽时联特种溶剂股份有限公司);水为Milli-Q超纯水;血根碱、小檗碱、北美黄连碱、别隐品碱对照品由本实验室分离得到,白屈菜采自国家中药材生产(湖南)技术中心基地。
2 方法
2.1 样品的制备
取1.0 g白屈菜干燥粉末于150 mL锥形瓶中,加入50 mL甲醇超声提取60 min,过滤,滤液过0.22 μm微孔滤膜,待用。
2.2 色谱条件
Agilent 1290液相色谱仪,色谱柱:XAquaC8柱(150 mm×2.1 mm,5 μm);流动相A为0.1%甲酸-水,流动相B为乙腈;洗脱条件:0~5 min,5%~30% B;5~18 min,30%~45% B;18~25 min,45%~90% B;流速0.3 mL·min-1;检测波长:284 nm;进样量:1 μL;柱温:30 ℃。
2.3 质谱条件
ESI离子源,采用正离子检测模式,干燥器温度:300 ℃,干燥气体积流量:8 L·min-1,雾化器压力:3.8×106Pa,脱溶剂温度:350 ℃,脱溶剂气体积流量:12 L·min-1,毛细管电压:3500 V,锥孔电压:100 V,扫描范围m/z:120~1200,二级裂解电压:15~35 eV。
3 结果与讨论
本实验运用HPLC-Q-TOF/MS对白屈菜甲醇提取物进行分析鉴定(总离子流图见图1),选择40余个峰进行二级质谱分析,最终推断出18个生物碱结构,其特征性二级质谱数据如表1所示。
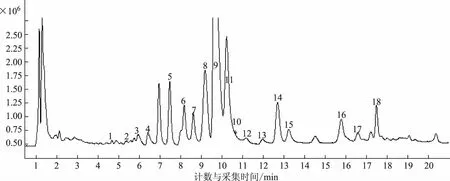
图1 白屈菜甲醇提取物的总离子流图
3.1 苯并菲啶类生物碱
苯并菲啶类生物碱结构较稳定,其母核一般不会发生裂解,二级质谱中碎片离子峰都在m/z200以上,只有部分取代基(CH3、CH2O、CH4)从母核上丢失[9],如对照品血根碱特征碎片离子峰m/z317、304、274、246均为取代基的丢失所形成(血根碱对照品二级质谱见图2)。据此推断化合物13、16、17、18为苯并菲啶类。
化合物13,离子化分子量为m/z332.092 1(C20H14NO4+),m/z317[M-CH3]+是分子离子失去氮甲基形成,m/z304[M-CO]+、274[M-CO-2H-CO]+和246[M-CO-2H-CO-CO]+推测分子中存在两个亚甲二氧基,综上所述,参考文献[10],推断化合物13为血根碱。化合物16,离子化分子量为m/z348.122 8(C21H18NO4+),m/z333[M-CH3]+、332[M-CH4]+、318[M-2CH3]+、304[M-CH4-CO]+和290[M-2CH3-CO]+推测分子中存在相邻的甲氧基,从离子峰m/z260[M-2CH3-CO-CO-2H]+推测分子中存在亚甲二氧基。综上所述,参考文献[11],推断化合物16为白屈菜红碱。化合物17,离子化分子量为m/z362.102 5(C21H16NO5),m/z332[M-CH3-CH3]+丢失的两个甲基一个为氮甲基,一个为12位甲氧基的甲基,因为该化合物的二级碎片中没有M-16的碎片,所以不存在邻二甲氧基,该化合物的其他裂解方式与血根碱相似,结合生源合成途径[12],参考文献[13],推断化合物17为白屈菜如宾碱。化合物18,离子化分子量为m/z378.134 1(C22H20NO5+),该化合物裂解方式与白屈菜红碱裂解方式相同,每个特征碎片离子分子量相差30,结合这类化合物的生源合成途径推测甲氧基位于12位,参考文献[13],推断化合物18为白屈菜黄碱。生物碱13、16、17、18的质谱裂解途径见图3。
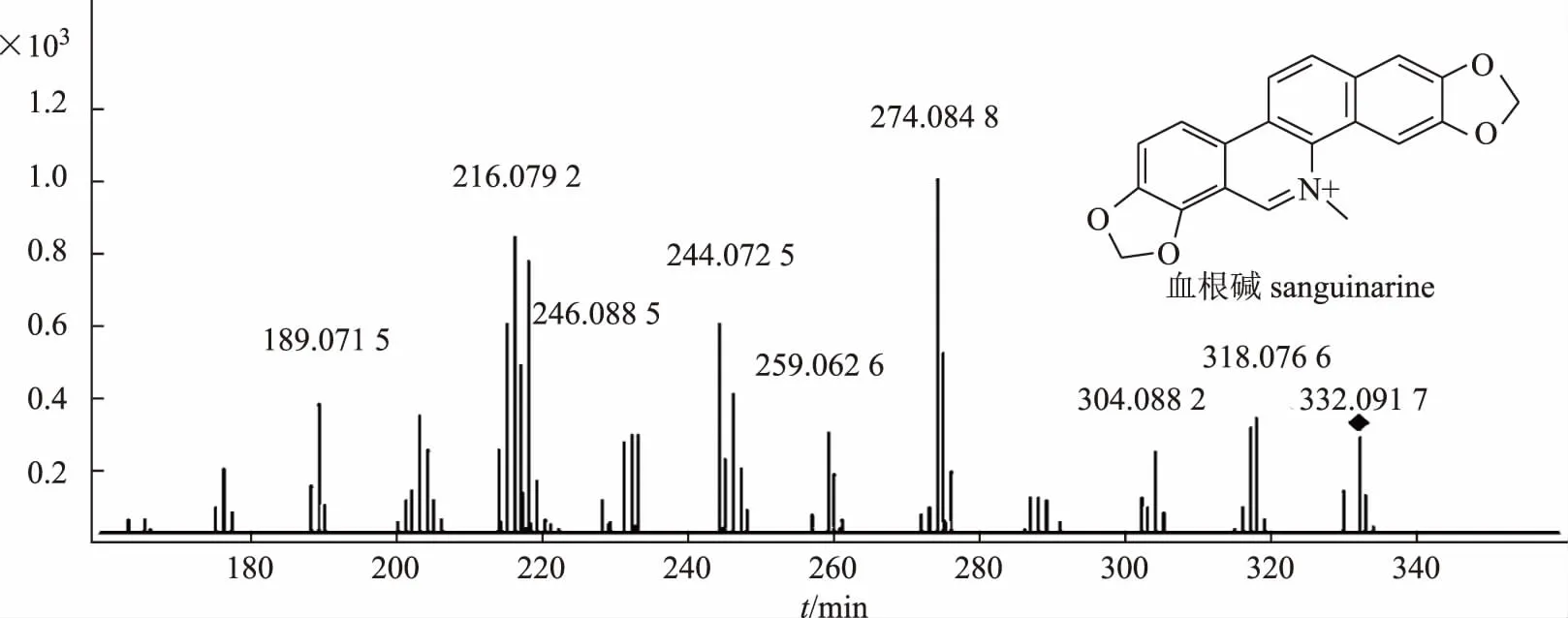
图2 血根碱质谱图
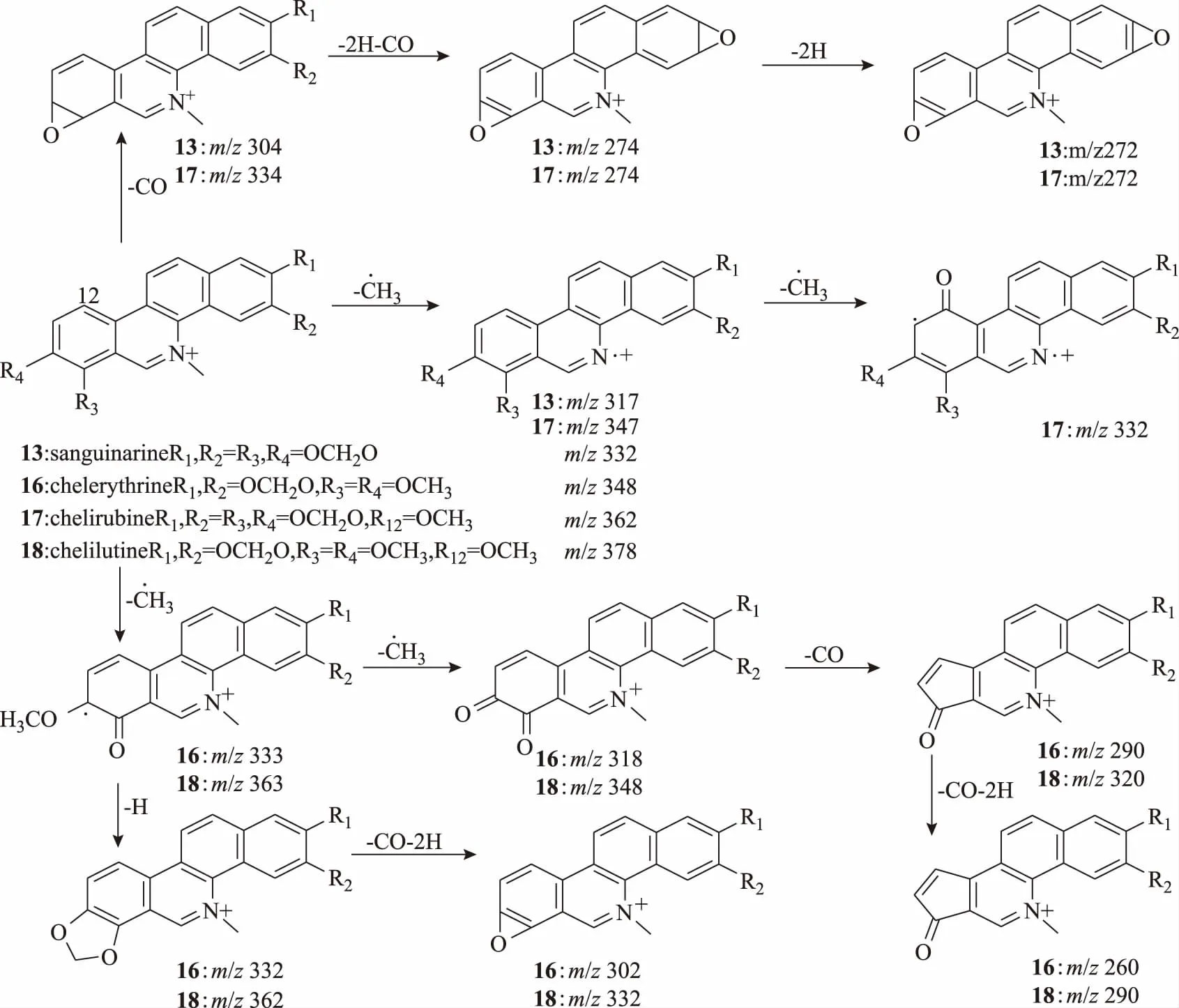
图3 苯并菲啶类生物碱质谱裂解途径
3.2 原小檗碱类生物碱
原小檗碱类生物碱母核一般不会发生裂解,仅有小分子取代基的裂解与丢失,由于C-5、6位碳碳单键的存在,容易使母核失去2个氢形成更稳定的大π共轭体系,小檗碱特征碎片离子峰m/z334、321、320、306、292、278为取代基的丢失所形成,小檗碱特征碎片离子峰m/z318、304、290、276均为失去5,6 位的氢而形成(小檗碱对照品二级质谱见图4)。据以上特征性的裂解规律推断化合物9、10、12、14、15为原小檗碱类。
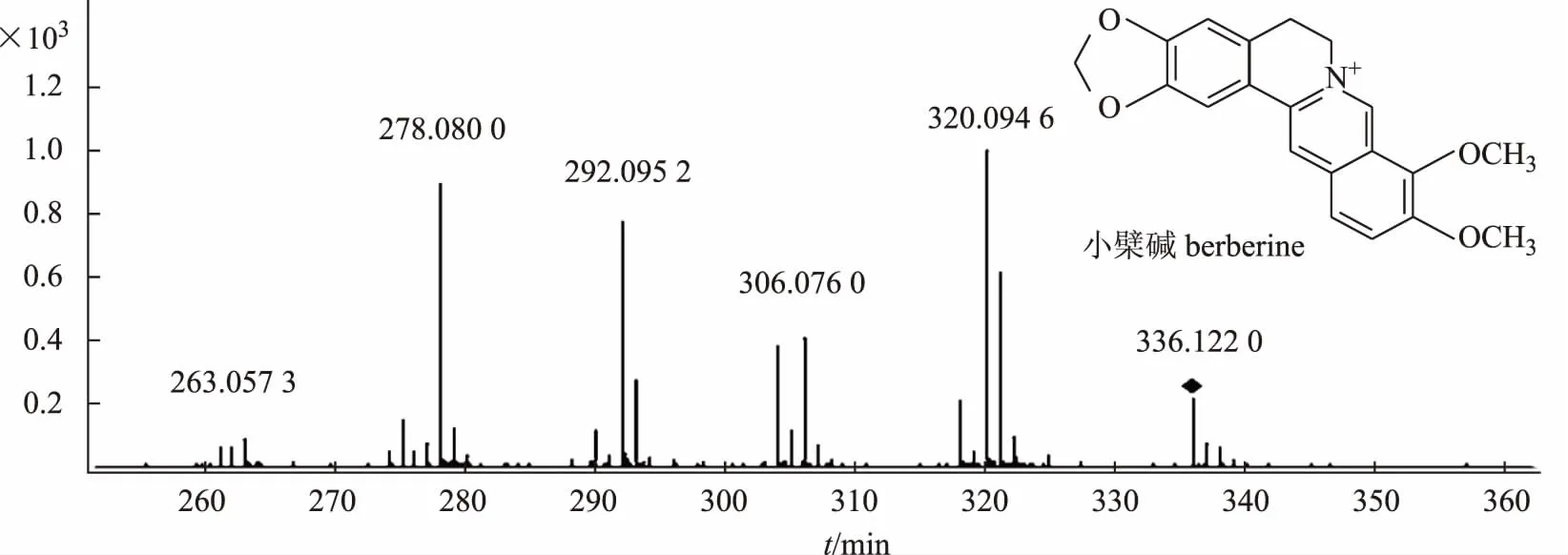
图4 小檗碱质谱图

322[M-CH4]+、323[M-CH3]+和308[M- CH3-CH3]+说明2个化合物中都存在相邻的甲氧基,化合物12中存在m/z320[M-H2O]+碎片离子,化合物14中不存在失去水的碎片离子,参考文献[16],推断化合物12为药根碱,推断化合物14为非洲防己碱。化合物15,离子化分子量为m/z336.122 8(C20H18NO4+),m/z334[M-2H]+、306[M-CO-2H]+和278[M-CO-2H-CO]+说明化合物中存在1个亚甲二氧基,m/z320[M-CH4]+、321[M-CH3]+和306[M-CH3-CH3]+说明该化合物中存在相邻甲氧基,综上所述,参考文献[17],推断化合物15为小檗碱。原小檗碱类生物碱9、10、12、14、15的质谱裂解途径见图5。

图5 原小檗碱类生物碱质谱裂解途径
3.3 四氢原小檗碱类生物碱
四氢原小檗碱类生物碱有两条裂解途径,第一条途径是RDA(Retro Diels-Alder reaction)裂解,发生在C环形成两分子小片段,B环裂解同样也可以形成两分子小片段[18]。第二条途径就是母核上丢失一些取代基,与原小檗碱类生物碱类似,四氢原小檗碱类生物碱对照品北美黄连碱特征碎片离子峰m/z176和m/z149为发生RDA裂解以及B环裂解所形成(北美黄连碱对照品二级质谱见图6),据此推断化合物4、8为四氢原小檗碱类生物碱。
化合物4和8,离子化分子量分别为m/z340.155 2(C20H22NO4+)和m/z324.115 2(C19H18NO4+),第一条途径m/z176是C环发生RDA裂解产生的碎片离子,m/z149是发生B环裂解产生的碎片离子;第二条途径,化合物4中存在m/z324[M- CH4]+和m/z310[M-CO-2H]+,说明化合物4中存在相邻的甲氧基和一个亚甲二氧基,化合物8中只存在m/z294[M-CO-2H]+,说明化合物8中存在2个亚甲二氧基。综上所述,参考文献[19],推断化合物4为北美黄连碱,化合物8为四氢黄连碱。四氢原小檗碱类生物碱4和8质谱裂解途径见图7。
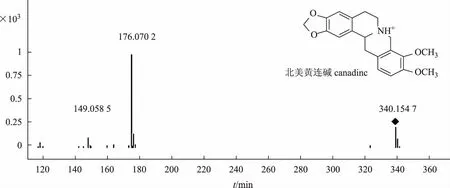
图6 北美黄连碱质谱图
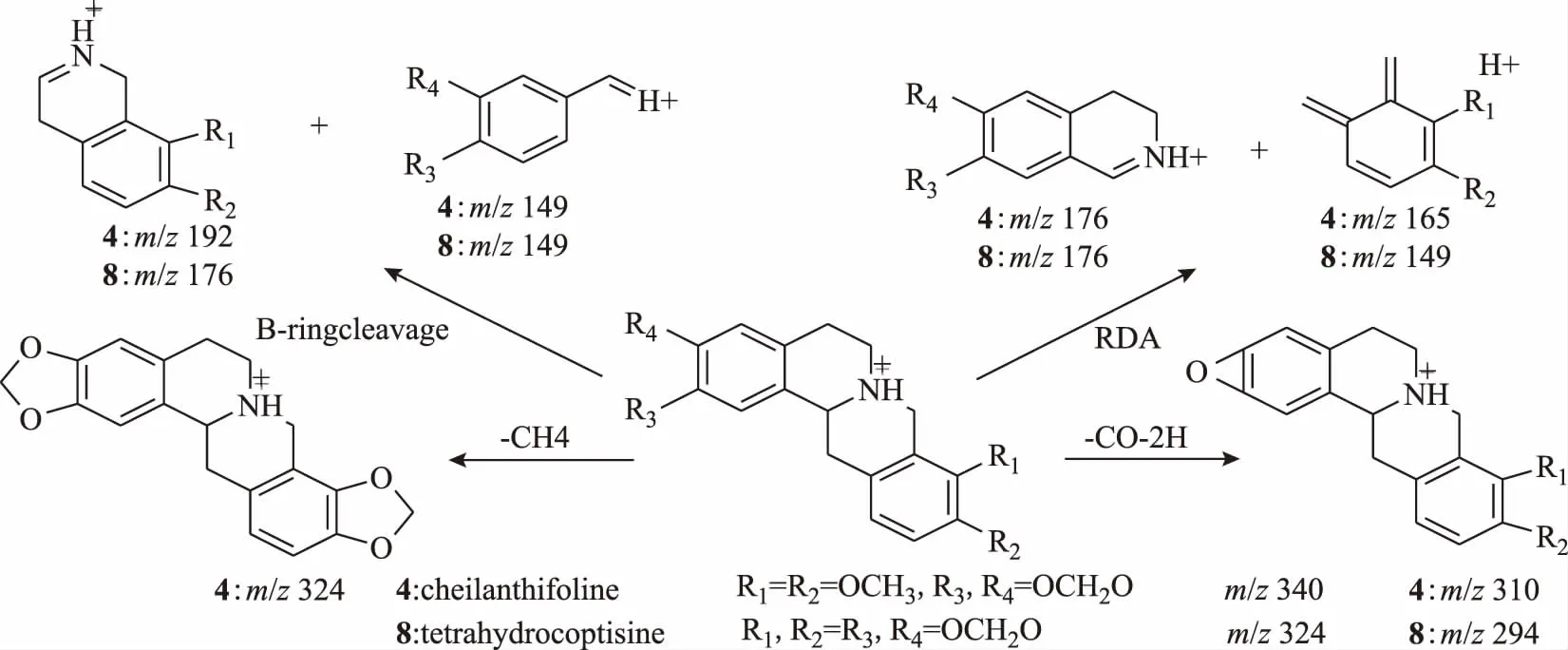
图7 四氢原小檗碱类生物碱质谱裂解途径
3.4 普罗托品类生物碱
普罗托品类生物碱中没有大π共轭体系易发生RDA裂解和α裂解,裂解后的碎片会继续失去一些小分子片段,普罗托品类生物碱另外一个特征性的质谱裂解就是会出现[M-H2O]+的碎片离子。别隐品碱特征碎片离子峰m/z206、m/z188、m/z149为RDA裂解和α裂解所产生,碎片离子峰m/z352为失去一分子H2O所产生(别隐品碱标准品二级质谱见图8)。据此故推断化合物5、6为普罗托品类。

图8 别隐品碱质谱图
离子。化合物5、6发生α裂解后产生m/z190、181、165的碎片离子,接着继续失去CO和2H形成m/z160的碎片离子。化合物5中存在m/z308[M-H2O-CO]+,化合物6中存在m/z336[M-H2O-CH4]+,说明化合物6中存在一个相邻的甲氧基,综上所述,参考文献[20],推断化合物5为原阿片碱,化合物6推断为别隐品碱。普罗托品类生物碱5和6质谱裂解途径见图9。
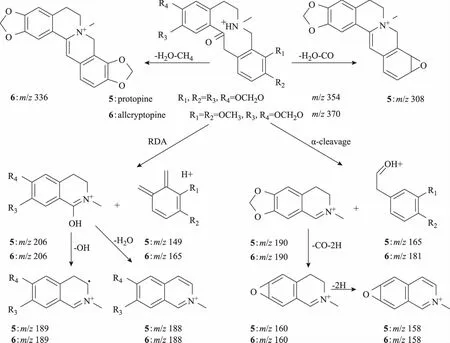
图9 普罗托品类生物碱质谱裂解途径
3.5 六氢苯并菲啶类生物碱
六氢苯并菲啶类生物碱由于11位接有羟基会失去H2O形成[M-H2O]+的碎片离子,由于存在氮甲基会发生α裂解失去CH3NH2形成[M-31]+的碎片离子。化合物3、7和11,其离子化分子量为m/z370.121 6(C20H20NO6+)、354.127 0(C20H20NO5+)和370.158 0(C21H24NO5+),二级质谱中都有失去H2O的碎片离子m/z352、336、352,都有失去CH3NH2的碎片离子m/z339、323、339。化合物3和7中存在m/z291[M-CO-2H]+,且化合物3比化合物7分子量大16,参考文献[21-22],化合物3的12位接有羟基。化合物11中存在m/z305[M-CH4]+的碎片离子,说明该化合物有相邻的甲氧基,综上所述,推断化合物3为白屈菜明碱,化合物7为白屈菜碱,化合物11为α-高白屈菜碱。六氢苯并菲啶类化合物3、7、11的质谱图裂解途径见图10。
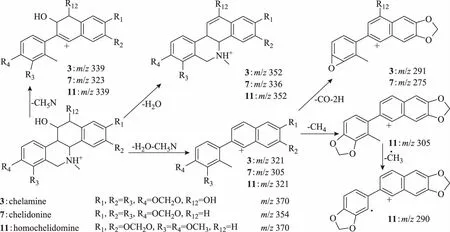
图10 六氢苯并菲啶类生物碱质谱裂解途径
3.6 苄基异喹啉类生物碱
化合物1,离子化分子量为m/z314.175 6(C16H24NO3+),苄基异喹啉类生物碱易失去(CH3)2NH或者CH3NH2,从而形成[M-45]+、[M-31]+的碎片峰,m/z269是失去一分子(CH3)2NH形成的碎片离子,接着发生α裂解形成m/z175碎片离子;m/z269的碎片离子发生β裂解形成m/z107的碎片离子,综上所述,推断化合物1为木兰箭毒碱,与文献报道相符[23]。生物碱1质谱裂解途径见图11。
3.7 阿朴芬类生物碱
化合物2,离子化分子量为m/z342.170 0(C20H24NO4+),阿朴芬类生物碱易失去一分子(CH3)2NH形成较稳定的[M-45]+碎片离子,主要是发生一些取代基的丢失。m/z310和282说明分子中存在相邻的羟基和甲氧基,二级质谱中m/z265是基峰失去一分子CO形成m/z237的碎片离子,综上所述,化合物2为木兰花碱,与文献报道相符[24]。生物碱2质谱裂解途径见图12。
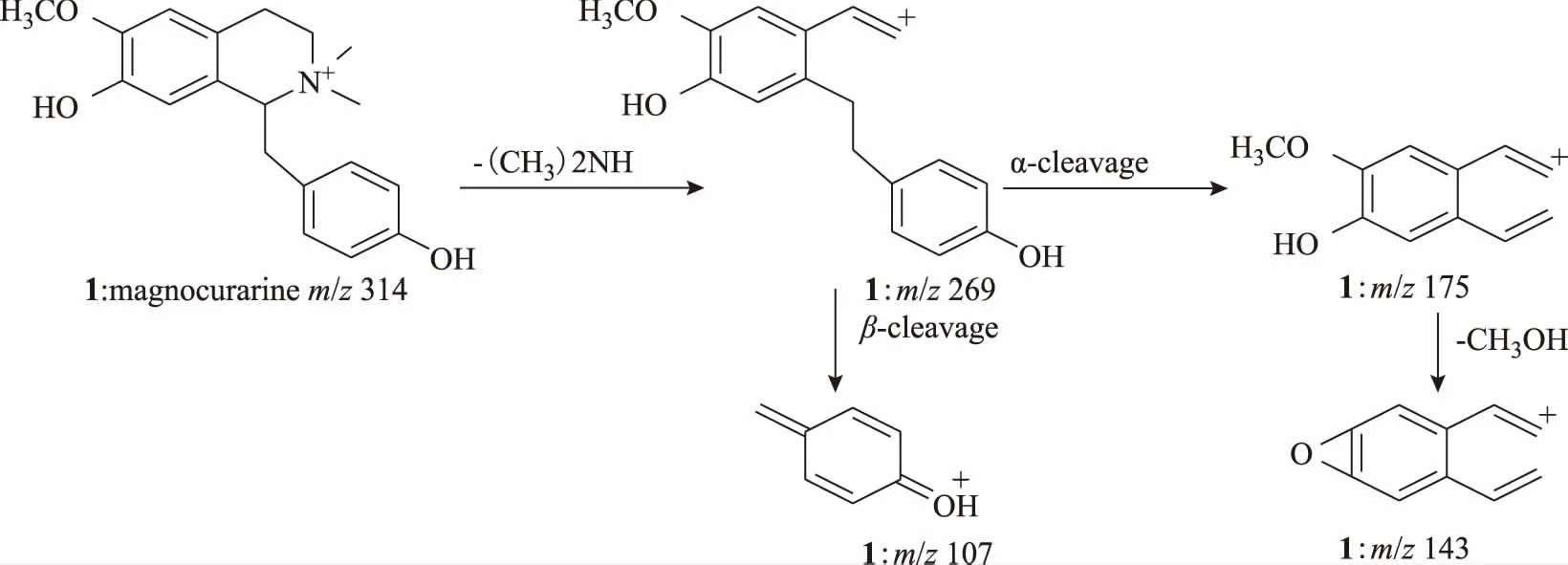
图11 苄基异喹啉类生物碱质谱裂解途径

图12 阿朴芬类生物碱质谱裂解途径
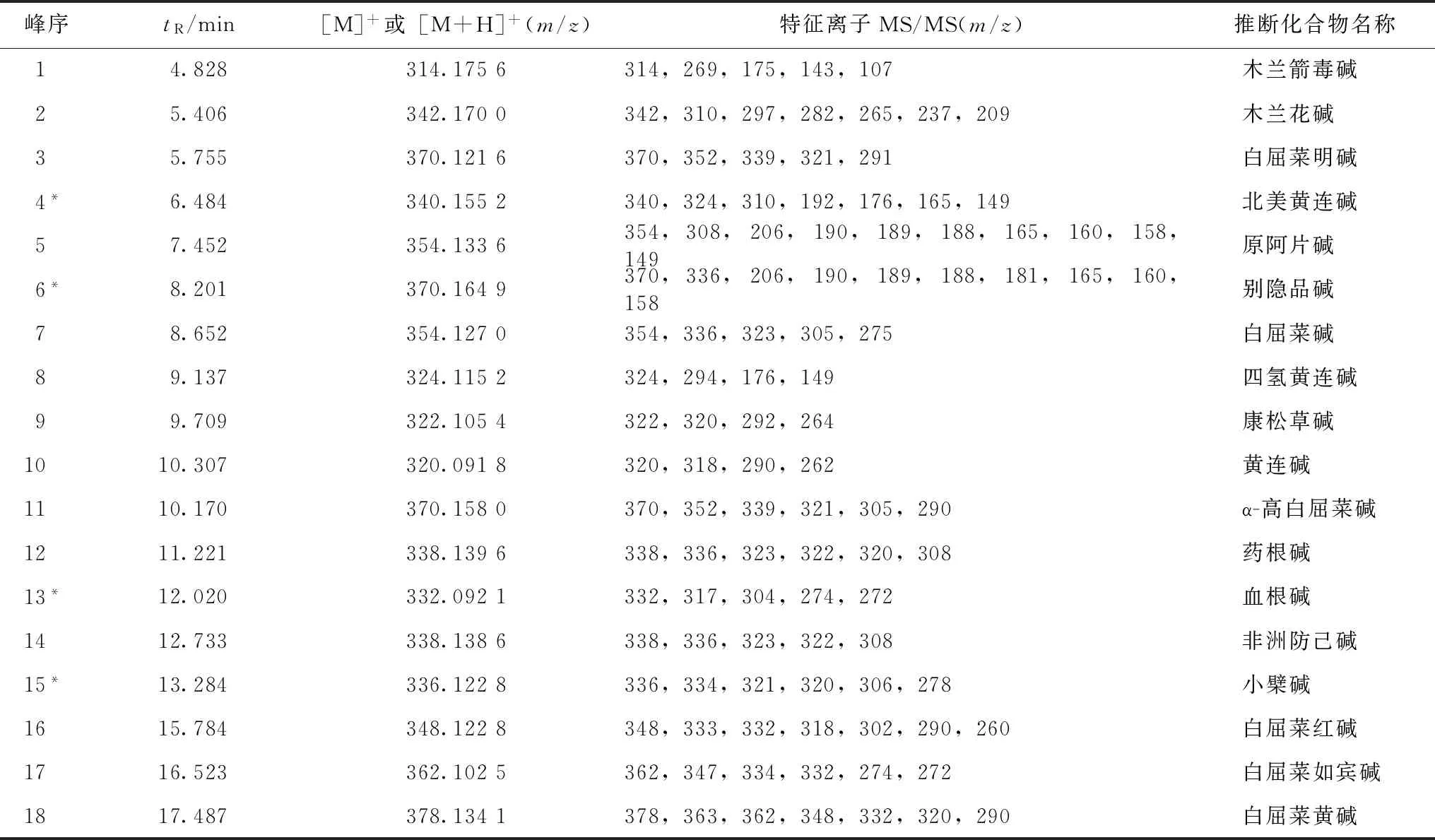
峰序tR/min[M]+或[M+H]+(m/z)特征离子MS/MS(m/z)推断化合物名称14.828314.1756314,269,175,143,107木兰箭毒碱25.406342.1700342,310,297,282,265,237,209木兰花碱35.755370.1216370,352,339,321,291白屈菜明碱4*6.484340.1552340,324,310,192,176,165,149北美黄连碱57.452354.1336354,308,206,190,189,188,165,160,158,149原阿片碱6*8.201370.1649370,336,206,190,189,188,181,165,160,158别隐品碱78.652354.1270354,336,323,305,275白屈菜碱89.137324.1152324,294,176,149四氢黄连碱99.709322.1054322,320,292,264康松草碱1010.307320.0918320,318,290,262黄连碱1110.170370.1580370,352,339,321,305,290α-高白屈菜碱1211.221338.1396338,336,323,322,320,308药根碱13*12.020332.0921332,317,304,274,272血根碱1412.733338.1386338,336,323,322,308非洲防己碱15*13.284336.1228336,334,321,320,306,278小檗碱1615.784348.1228348,333,332,318,302,290,260白屈菜红碱1716.523362.1025362,347,334,332,274,272白屈菜如宾碱1817.487378.1341378,363,362,348,332,320,290白屈菜黄碱
注:*表示对照品化合物。
4 结论
本文运用HPLC-Q-TOF/MS对白屈菜中生物碱进行分析,通过对照品的裂解和文献核对推断了18个生物碱,其中化合物1、4、12、14为首次在白屈菜中报道。HPLC-Q-TOF/MS具有快速、准确、无需对照品等特点,可以对多种类型的化合物进行定性鉴别。研究发现白屈菜中还存在很多微量生物碱,运用HPLC-Q-TOF/MS对白屈菜中化学成分的分离具有指导作用,对研究以白屈菜为原料开发的产品具有重要意义。
[1] 国家中医药管理局.中华本草[M].上海:上海科学技术出版社,1999.
[2] 韦祖巧,邹翔,季宇彬,等.白屈菜化学成分和药理作用的研究进展[J].中草药,2009,40(S1):38-40.
[3] García V P,Valdés F,Ayala J H,et al.Biosynthesis of antitumoral and bactericidal sanguinarine[J].Biomed.Biotechnol,2006(1):71-81.
[4] Gilca M,Gaman L,Atanasiu V,et al.An integrative review:traditional knowledge versus modern findings[J].Forschende Komplementarmedizin,2010,17(5):241-248.
[5] Jung H A,Yoon N Y,Choi J S,et al.Inhibitory activities of the alkaloids from Coptidis Rhizoma.Against aldose reductase[J].Archives of Pharmacal Research,2008,31(11):1405-1412.
[6] Min Y D,Yang M C,Lee K R,et al.Protoberberine alkaloids and their reversal activity of Pgp expressed multidrug resistance(MDR)from the rhizome of Coptis japonica Makino[J].Archives of pharmacal research,2006,29(9):757-761.
[7] Wynne P M,Vine J H,Amiet R G.Protopine alkaloids in horse urine[J].Journal of Chromatography B,2004,811(1):85-91.
[8] Yusoff M,Hamid H,Houghton P.Anticholinesterase inhibitory activity of quaternary alkaloid from Tinospora Crispa[J].Molecules,2014,19(1):1201-1211.
[9] 卿志星,程辟,曾建国.博落回中生物碱质谱裂解规律研究进展[J].中草药,2013,44(20):2929-2938.
[10] Henri Hoellinger,Micheline Re,Alain Deroussent.Quantitative liquid chromatographic determination of sanguinarine in cell culture medium and in rat urine and plasma[J].Journal of Chromatography B,2004,799:195-200.
[11] Ying Z C,Guo Z L,Yao S,et al.Analysis of alkaloids in Macleaya Cordata(Willd.)R.Br.Using high-performance liquid chromatography with diode array detectionand electrospray ionization mass Spectrometry[J].Journal of Chromatography A,2009,12(16):2104-2110.
[12] Dang T T,Onoyovwi A,Facchini P J,et al.Biochemical genomics for gene discovery in benzylisoquinoline alkaloid biosynthesis in opium poppy and related species[J]. Methods Enzymol,2012,515:231-266.
[13] Gathungu R M,Oldham J T,Bird S S,et al.Application of an integrated LC-UV-MS-NMR platform to the identification of secondary metabolites from cell cultures:benzophenanthridine alkaloids from elicited Eschscholzia californica(california poppy)cell cultures[J].Anal Methods,2012,4(5):1315-1325.
[14] Xunlong Z,Jiao G,Laiyou W,et al.Analysis of the Constituents in Rat Serum after Oral Administration of Fufang Zhenzhu Tiaozhi Capsule by UPLC-Q-TOF-MS/MS[J].Chromatographia,2012,75:111-129.
[15] Wang D W,Liu Z Q,Guo M Q,et al.Structural elucidation and identification of alkaloids inRhizomaCoptidisby electrospray ionization tandem mass spectrometry[J].Mass Spectrom,2004,39:1356-1365.
[16] Yan R,Wang Y,Liu Y P,et al.Comparative pharmacokinetics of berberine,palmatine and jatrorrhizine in rat plasma after oral administration of Rhizoma coptidis and Zuojinwan using liquid chromatography-tandem mass spectrometry[J].Iranian J Pharm Res,2012,11(3):949-957.
[17] Ma C H,Fan M S,Tang Y H,et al.Identification of major alkaloids and steroidal saponins in rat serum by HPLC-diode array detection-MS/MS following oral administration of Huangbai Zhi mu herb-pair extract[J].Biomed Chromatogr,2008,22:835-850.
[18] Zhi X Q,Pi C,Jian G Z,et al.Structural speculation and identification of alkaloids inMacleayacordatafruits by high-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry combined with a screening procedure.Rapid Commun.Mass SpecTrom[J].2014,28:1033-1044.
[19] Li L,Ye M,Kaishun B,et al.Liquid chromatography-tandem mass spectrometry for the identifycation of L-tetrahydropalmatine metabolites inPenicilliumjanthinellumand rats[J].Biomed Chromatogr,2006,20:95-100.
[20] Shi J,Zhang X Y,Ma Z J,et al.Characterization of aromatase binding agents from the dichloromethane extract of Corydalis yanhusuo using ultrafiltration and liquid Chromatography tandem mass spectrometry[J].Molecules,2010,15:3556-3566.
[21] Zhou Q,Liu Y,Wang X,et al.A sensitive and selective liquid chromatography-tandem mass spectro-metry method for simultaneous determination of five isoquinoline alkaloids from Chelidonium majus L.in rat plasma and its application to a pharmacokinetic study[J].J Mass Spectrom,2013,48:111-118.
[22] Fleming M J,McManus H A,Lautens M.Concise enantioselective total syntheses of(+)-homochelidonine,(+)-chelamidine,(+)-chelidonine,(+)-chelamine and(+)-norchelidonine by a Pd II catalyzed ring-opening strategy[J].Chemistry.2008,14(7):2112-2124.
[23] Yubo L,Tiejun Z,Xiaolan Z.Chemical fingerprint analysis of Phellodendri Amurensis Cortex by ultra performance LC/Q-TOF-MS methods combined with chemometrics[J].J Sep Sci,2010,33:3347-3353.
[24] Cai M,Zhou Y,Wang X L,et al.Rapid structural characterization of isomeric benzo phenanthridine alkaloids from the roots of Zanthoxylum nitidium by liquid chromatography combined with electrospray ionization tandemmass spectrometry[J].Rapid Commun Mass Spectrom,2007,21(12):1931-1936.
IdentificationofIsoquinolineAlkaloidsinChelidoniummajusbyHPLC-Q-TOF/MS
YANGPeng1,QINGZhixing1,ZUOZi1,YUKun1,ZENGJianguo1,2*
(1.CollegeofPharmacy,HunanUniversityofChineseMedicine,Changsha410208,China; 2.NationalandProvincialUnionEngineeringResearchCenterfortheVeterinaryHerbalMedicineResourcesandInitiative,HunanAgriculturalUniversity,Changsha410128,China)
Objective:To systematically and rapidly identify isoquinoline alkaloids inChelidoniummajususing the HPLC-Q-TOF/MS.Methods:The separation was performed on a XAqua C8column(150 mm×2.1 mm,5 μm)with acetonitrile-0.1% formic acid in water by gradient elution.The flow rate was 0.3 mL·min-1.Electrospray ionization-(ESI)source was applied and operated in positive ion mode.The structure of alkaloids was speculated by MS/MS fragmentation behaviors of standards and related references.Results:18 alkaloids were elucidated from the methanolic extracts ofCh.majus.Compounds magnocurarine(1),canadine(4),jatrorrhizine(12),columbamine(14)were reported firstly inCh.majus.Conclusion:HPLC-Q-TOF/MS is rapid and reliable method for identification of the alkaloids inCh.majus.The results would provide scientific evidence for further extraction and separation of components and study of pharmacodynamic material basis inCh.majus
Isoquinoline alkaloids;HPLC-Q-TOF/MS;ChelidoniummajusL.
长沙市科技计划重点项目(K1308182-21)
] 曾建国,教授,研究方向:中药资源与开发;Tel:(0731)84673824,E-mail:ginkgo@world-way.net
10.13313/j.issn.1673-4890.2017.2.003
2016-05-10)
*[
