转化生长因子-β1诱导肾小管上皮细胞老化及其作用机制的研究
2017-09-20
转化生长因子-β1诱导肾小管上皮细胞老化及其作用机制的研究
孙晗赵亚亚裴小华赵卫红
目的本研究旨在明确转化生长因子-β1(TGF-β1)与肾脏老化之间的关系并初步探讨其作用机制。方法体内实验:自然状态下不同年龄段C57小鼠通过肾脏免疫组化、蛋白改变来验证小鼠肾脏内TGF-β1表达随增龄发生的变化。体外实验:不同浓度的TGF-β1刺激肾小管上皮细胞48 h,观察老化指标改变,并用其抑制剂Decorin进行干预验证。结果体内实验中,小鼠肾脏内TGF-β1的表达随增龄而增加,幼龄组表达量很少或无表达;体外实验中,20 ng/ml TGF-β1可明显诱导肾小管上皮细胞老化,其中β-半乳糖苷酶、p53、p16等老化相关蛋白表达量均显著增加;而加入TGF-β1抑制剂Decorin干预组,Smad2、Smad3及p53、p16蛋白表达减少,Smad7蛋白表达增加。结论TGF-β1在老化肾脏中表达显著增加;其可能主要通过激活其下游信号分子Smad2、Smad3,抑制Smad7来激活肾小管上皮细胞肌纤维细胞转分化的作用,继而促进了老化相关纤维化的发生。
转化生长因子-β1; 肾脏老化; 肾小管上皮细胞
老龄化已成为2l世纪不可逆转的世界性趋势。据预测,到2037年我国老龄人口将达4亿。肾脏是受老化影响最明显的器官之一[1]。已知肾脏老化以肾小球硬化和肾间质纤维化为主要表现,而作为经典的致纤维化因子转化生长因子-β1(TGF-β1)是否在肾脏老化中同样发挥调节作用,且其作用机制如何,目前尚无定论。
因此,本研究分别从体内、外构建老化模型,探索TGF-β1与肾脏老化之间的关系及其作用机制。
1 材料与方法
1.1 材料 人肾近曲小管上皮细胞HK-2(美国ATCC公司)。实验动物:健康无特定病原体(healthy specific pathogen-free,SPF)级C57BL6/J小鼠(南京大学模式动物研究中心,体质量16~30 g)。
1.2 方法
1.2.1 分组
1.2.1.1 不同年龄分组:(1)6周龄组(6W);(2)3月龄组(3M);(3)7月龄组(7M);(4)11月龄组(11M);(5)15月龄组(15M);(6)19月龄组(19M)。
1.2.1.2 TGF-β1诱导HK2细胞老化分组:(1)HK2组,即本实验的对照组;(2)HK2+柠檬酸缓冲液(CB)组;(3)HK2+TGF-β1(10 ng/ml)组;(4)HK2+TGF-β1(15 ng/ml)组;(5)HK2+TGF-β1(20 ng/ml)组;(6)HK2+TGF-β1(40 ng/ml)组。
1.2.1.3 TGF-β1诱导HK2细胞老化的机制研究分组:(1)HK2组,即本实验的对照组;(2) HK2+CB组;(3) HK2+TGF-β1(20 ng/ml)组,即老化模型组;(4) HK2+TGF-β1(20 ng/ml)+Decorin 组,即 TGF-β1抑制剂组。
1.2.2 HK2细胞增殖实验:HK2细胞制成均匀悬液(细胞数量106/ml),在96孔板中接种细胞悬液100 μl/孔,将培养板在培养箱预培养24 h(37 ℃、5%CO2),随后按照10 ng/ml、15 ng/ml、20 ng/ml、40 ng/ml浓度梯度加入TGF-β1。
对照组加入相应体积的PBS,不同TGF-β1浓度设立5个复孔,将96孔板放入细胞培养箱中分别共培养48 h和72 h。取出后向每孔加入10 μl CCK-8溶液,将96板在培养箱中孵育3 h,用酶标仪测定在450 nm处的吸光值。
本实验主要以此方法筛选出适宜的浓度和时间范围。
1.2.3 β-半乳糖苷酶染色:将HK2细胞悬液接种于放置有玻片的6孔板中,按照不同浓度梯度加入TGF-β1。对照组加入相应体积的PBS,培养48 h,PBS漂洗2次。用含2%多聚甲醛和0.2%戊二醛在4 ℃固定5 min,然后用含1 mol/L MgCl2的PBS漂洗2次,加入SA-β-gal染色液在37 ℃孵育48 h。PBS漂洗终止反应,用伊红套染未着色细胞胞浆。
1.2.4 western blot检测各组蛋白水平的表达:各组分别取20 μg蛋白,进行十二烷基磺酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),然后电转移至0.22 μm的PVDF膜上。5%的牛奶封闭2 h,分别用p53(1∶500;Abcam)、p16(1∶500;Abcam)、Smad2(1∶500;Proteintech)、Smad3(1∶500; Proteintech)和Smad7(1∶500; Proteintech)一抗4 ℃孵育过夜,洗膜后,以1∶10000稀释的羊抗兔生物素标记二抗,室温孵育2 h,再次洗膜。ECL底物化学发光(Multi Sciences)显色后机器扫描存盘,以Tanon Gis软件进行条带分析。
1.2.5 免疫组织化学检测TGF-β1蛋白水平:采用SABC免疫组化试剂盒(SA1022),购自武汉博士德公司。石蜡切片,二甲苯脱蜡至水,抗原修复,BSA封闭,TGF-β1(Proteintech)一抗工作液浓度为1∶200,采用DAB显色,苏木素复染后,逐级脱水,中性树胶封片。片中出现棕黄色颗粒为阳性结果,每组染色均设以PBS代替一抗作阴性对照。
2 结果
2.1 TGF-β1在不同年龄组小鼠中的自然表达情况

注:与6周龄组比较,*P<0.05,***P<0.001。图1 TGF-β1在不同年龄组小鼠肾脏中的表达
western blot结果显示: TGF-β1蛋白表达在11月龄后开始明显上升,19月龄时表达量最大,显著高于6周龄组(P<0.05)(图1)。免疫组化结果显示:随着小鼠月龄不断增加,棕褐色物质表达亦增加,且呈时间依赖性;月龄最大组在肾小管上皮细胞中表达明显增加,见图2。
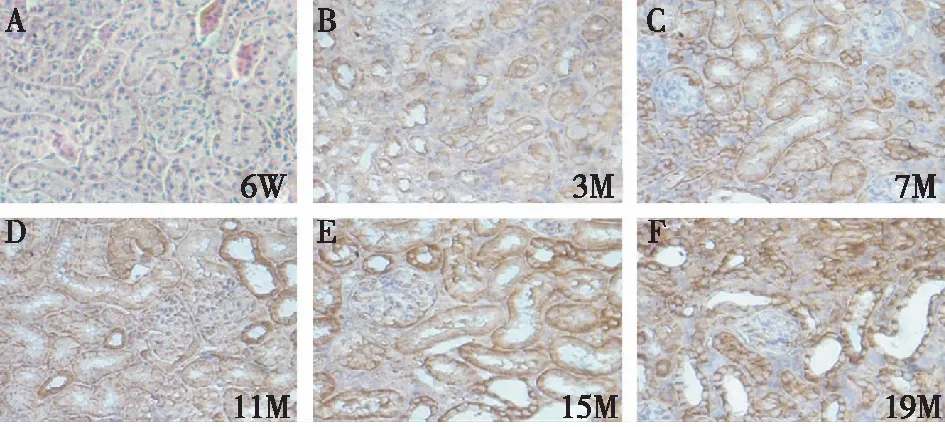
图2 不同年龄组小鼠肾脏 TGF-β1的表达(×400倍)
2.2 TGF-β1诱导HK2细胞老化实验结果
2.2.1 诱导HK2细胞老化实验的浓度和时间:适宜TGF-β1浓度(10~20 ng/ml)刺激HK2细胞48 h后,HK2细胞在450 nm处吸光值随着TGF-β1浓度增加呈现轻度下降趋势,但当TGF-β1浓度超过20 ng/ml时,HK2细胞在450 nm处吸光值明显下降(P<0.001)。 TGF-β1浓度超过10 ng/ml刺激HK2细胞72 h后,HK2细胞在450 nm处吸光值呈明显下降趋势(图3)。因此,确定使用10~40 ng/ml浓度的TGF-β1刺激48 h,以诱导HK2细胞进行老化实验。

图3 HK2细胞经不同浓度 TGF-β1刺激48、72 h后生存曲线
2.2.2 光镜下细胞形态改变:(1)在10~20 ng/ml浓度的TGF-β1刺激HK2细胞48 h后,可见HK2细胞正常形态消失,变为肥大、长梭形样的成纤维细胞形态,细胞上清中飘漂样死亡细胞增多, TGF-β1浓度为40 ng/ml时HK2细胞凋亡现象更为明显(图4)。
(2)HK2细胞经在10~20 ng/ml TGF-β1刺激48 h,β-半乳糖苷酶染色后可见,表达β-半乳糖苷酶的细胞数随浓度增加而增多,且呈剂量依赖性(图5);当 TGF-β1浓度为40 ng/ml时,β-半乳糖苷酶因HK2细胞的减少而降低。

注:A、B示正常组HK2细胞,细胞形态良好,C、D、E、F示随着 TGF-β1浓度增加,细胞凋亡逐渐增多,间隙增大,损伤程度递增,细胞老化明显;与HK2组比较,***P<0.001。图4 HK2细胞经 TGF-β1刺激48 h培养后光镜下形态(×100倍)
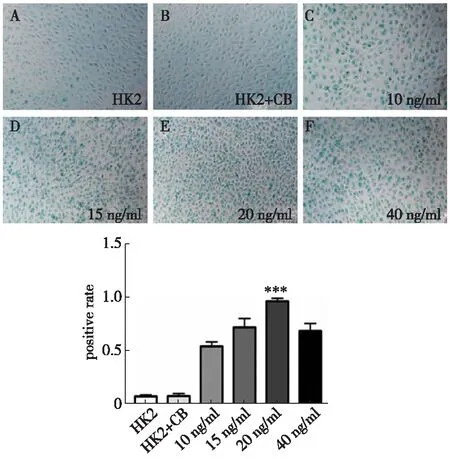
注:A、B示正常组HK2细胞,表达β-半乳糖苷酶的HK2细胞比率较少,C、D、E、示随着 TGF-β1浓度增加,胞浆中黄绿色物质明显增多。F示胞浆中黄绿色物质较E减少。图5 HK2细胞经 TGF-β1刺激48 h培养后β-半乳糖苷酶染色(×100倍)
2.2.3 western blot检测HK2细胞老化时p53、p16的蛋白水平变化:western-blot结果显示,HK2对照组低表达p53、p16蛋白;经不同浓度TGF-β1刺激48 h后,HK2细胞内p53、p16蛋白表达较对照组均增加,尤以20 ng/ml组与对照组差异显著(P<0.05)(图6);而40 ng/ml组中因HK2细胞凋亡较多,蛋白表达也随之减少。
2.3 加入TGF-β1抑制剂后蛋白变化 western blot检测HK2细胞老化时下游信号分子蛋白水平变化,结果显示,HK2组低表达Smad2、Smad3及p53、p16蛋白,高表达Smad7蛋白;HK2+TGF-β1组(20 ng/ml)HK2细胞内Smad2、Smad3及p53、p16蛋白表达较对照组显著增加,Smad7蛋白表达降低;而加入 TGF-β1抑制剂Decorin后,Smad2、Smad3及p53、p16蛋白表达量较HK2+TGF-β1组下降,Smad7蛋白表达增加,差异具有统计学意义(P<0.05)。见图7。
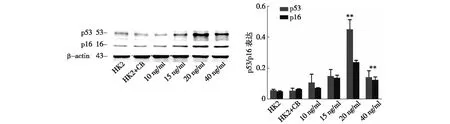
注:与对照组比较,*P<0.05图6 HK2细胞经 TGF-β1刺激48 h培养后P53、P16表达

注:与HK2+TGF-β1组比较,*P<0.05图7 老化HK2细胞加入 TGF-β1抑制剂Decorin后下游信号分子蛋白水平变化
3 讨论
老化是指生物发育成熟后,随着年龄的增加,自身机能减退,内环境稳定能力与应激能力下降,结构、组分逐步退行性变,趋向死亡的不可逆转的现象[2]。肾脏衰老近年得到了国内外研究者的重视。在40岁以后,大多数人群的肾小球滤过率即以每年1ml/min的速度递减[3]。
肾脏老化在组织形态学上,主要表现为局灶节段性肾小球硬化,伴毛细血管袢丧失、系膜基质增多和基底膜增厚;肾小管间质纤维化,管腔增大,单核细胞浸润等[4]。同时,细胞老化现象也日益突出,主要表现为端粒缩短、多种衰老相关基因表达异常,如老化相关β-半乳糖苷酶表达增加,细胞周期阻滞,复制能力下降,老化相关异染色质灶形成,p53、p21和p16 等细胞周期蛋白依赖激酶抑制因子表达增多等[5]。可见,肾脏老化是以肾小球硬化和肾间质纤维化为主要特征,与各种原因导致的肾脏慢性病变病理学特征相同。
TGF-β作为经典的致纤维化因子,是一组可调节细胞生长和分化的超家族。TGF-β1是TGF-β的一个亚型,在哺乳动物体内分布广泛,与肾脏疾病密切相关。本课题组及多项前期研究发现,TGF-β1表达增加可促进肾小管间质纤维化;而抑制其与受体结合,可减缓实验性纤维化程度[6-7]。同时, TGF-β1还有增加细胞外基质含量、调节肾脏细胞增殖和分化及破坏肾小球滤过屏障等作用[8]。新近研究发现,TGF-β1其基因多态性可能与老化、长寿及老年相关性疾病的发生发展有关[9]。
Smads作为TGF-β1胞内信号传导蛋白家族, 是目前细胞内唯一的TGF-β1受体直接作用底物,亦是介导配体与受体作用的信号,并由胞浆传至胞核。Sato等[10]对Smad3基因敲除小鼠模型的研究中发现 TGF-β1的致纤维化作用是由Smad3介导的。在缺乏Smad3的小鼠模型中发现,炎性细胞和成纤维细胞不能被 TGF-β1所趋化,进而抑制小管上皮细胞肌纤维细胞转分化和胶原的分泌,以及纤溶酶原激活抑制剂和金属蛋白酶组织抑制因子的表达。此外,Wang等[11]用超声法将Smad 7 基因转入小鼠体内,发现Smad2和Smad3的活化被抑制,肌成纤维细胞的聚集减少,Ⅰ、Ⅲ型胶原的生成也减少,这表明TGF-β1/Smad信号通路是导致进展性肾间质纤维化的关键通路,且主要受Smad2和Smad3的正向调节和Smad7的负向调节。由上可知,Smad2、Smad3和Smad7是TGF-β1实现其调节肾脏功能的主要下游信号分子。因此,有效切断TGF-β1的信号转导,是终止和减轻肾脏病变的关键[12]。而新近研究发现,TGF-β1的天然抑制剂Decorin主要通过Smad2、Smad3和Smad7途径来抑制TGF-β1活性,是TGF-β1活性的一种负反馈调节因子。进而,我们猜测,TGF-β1是通过上述途径来实现对肾脏老化的调节。
因此本研究结合上述理论基础,分别从体内外探讨TGF-β1与肾脏老化的关系。动物实验表明,小鼠肾脏内TGF-β1的表达随增龄而增加,幼龄组表达量很少或无表达,证实了TGF-β1与肾脏老化的发生发展密切相关,其可能主要以老化相关性纤维化调节肾脏老化进程;进一步在体外实验中,TGF-β1可诱导肾小管上皮细胞老化,其中β-半乳糖苷酶、p53、p16等老化相关蛋白表达量增加,且随着TGF-β1浓度及时间的增加,老化现象越明显;此外,在经TGF-β1诱导的老化肾小管上皮细胞内加入TGF-β1抑制剂Decorin后,Smad2,Smad3表达减少,Smad7表达增加,且p53、p16等老化相关蛋白表达量呈一定程度减少,初步证实了TGF-β1可能主要通过激活其下游信号分子Smad2、Smad3,抑制Smad7来诱导小管上皮细胞肌纤维细胞转分化的作用,继而促进了老化相关纤维化的发生。
另外,TGF-β1也可能从以下三个方面调节细胞周期,进而影响细胞老化。(1)作为TGF-β1调节生长抑制因子的靶蛋白-CDK4,TGF-β1可通过抑制其翻译来使表达下调,从而调控细胞周期。(2)TGF-β1通过调节CDK2-cyclinE活性,诱导靶细胞可逆地阻滞在G1期。(3)TGF-β1还可调节p15、p16和p27等抑制蛋白的表达进而影响细胞周期[13]。由此可见,TGF-β1通过多种机制参与肾脏的老化过程。
综上,本研究结合TGF-β1与老化研究的新进展,明确TGF-β1与肾脏老化之间的关系与联系,并初步探讨了TGF-β1促进肾脏老化的作用机制,进而为防治肾脏老化所引起的相关疾病提供了一定的理论基础。
[1] Zhang QL, Rothenbacher D. Prevalence of chronic kidney disease in population-based studies: systematic review[J]. BMC Public Health, 2008, 8(1):117.
[2] 邹承鲁.当代生物学[M].北京:中国致公出版社,2000,394-396.
[3] Klahr S,Morrissey J,Hruska K,et al.New approaches to delay the progression of chronic renal failure[J].Kidney Int Suppl,2002,(80):23-26.
[4] Silva FG.The aging kidney:a review-Part I[J].Int Urol Nephrol, 2005, 37(1):185-205.
[5] Qian Y, Chen X. Senescence regulation by the p53 protein family[J].Methods Mol Biol,2013,965:37-61.
[6] He J, Wang Y, Sun S, et al. Bone marrow stem cells-derived microvesicles protect against renal injury in the mouse remnant kidney model[J]. Nephrology, 2012, 17(5):493-500.
[7] Wang Y. Influence of erythropoietin on microvesicles derived from mesenchymal stem cells protecting renal function of chronic kidney disease[J]. Stem Cell Res Ther, 2015, 22(6):100-105.
[8] Hoshi S,Shu Y,Yoshida F,et al. Podocyte injury promotes progressive nephropathy in zucker diabetic fatty rats[J].Lab Invest,2002, 82(1):25-35.
[9] Blobe GC,Schiemann WP, Lodish HF. Role of transforming growth factor β in human disease[J]. N Engl J Med, 2000, 342: 1350-1358.
[10]Sato M,Muragaki Y,Saika S, et al. Targeted disruption of TGF-beta1/Smad3 signaling protects against renal tubulointerstitial fibrosis induced by unilateral ureteral obstruction [J].Clin Invest,2003,112(10):1486-1493.
[11]Wang W, Huang XR, Li AG, et al.Signaling mechanism of TGF-beta in prevention of renal inflammation:role of Smad7[J]. J Am Soc Nephrol, 2005, 16(5):1371-1383.
[12]朱翠,丁丽华,曾宪垠,等.TGF-beta/Smads信号转导通路的研究进展[J].生物技术通讯,2008,19 (4): 604-607.
[13]Zeisberq M, Bonner G, Maeshima Y, et al.Renal fibrosis:collagen composition and assembly regulates epithelial-mesenchymal transdifferentiation [J]. Am Pathol, 2001,159(4):1313-1321.
Mechanismsoftransforminggrowthfactor-β1inducedaginginHK2cells
SUNHan,ZHAOYa-ya,PEIXiao-hua,ZHAOWei-hong.
DivisionofNephrology,DepartmentofGeriatrics,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,China
ObjectiveTo investigate the relationship between transforming growth factor(TGF)-β1 and aging kidney, and to explore its possible mechanism.MethodsThe expression of TGF-β1 in kidney was examined by immunohistochemistry in different age groups of C57 mice. In vitro,by observing the changes of aging indicators, renal proximal tubular epithelial cell line (HK2)were stimulated with different concentrations of TGF-β1 for 48 hours or 72 hours,and intervened with TGF-β1 inhibitor.ResultsThe expression of TGF-β1 in the kidneys was increased with aging, but was little in young mice; The expression of β-galactosidase, p53, p16 and other aging-related protein were obviously increased in HK2 cells which were induced with 20 ng/ml TGF-β1. After the intervention of TGF-β1 inhibitor Decorin, the expression of Smad2 and Smad3 was decreased, Smad7 increased, while p53, p16 and other aging-related protein expression were reduced to some extent.ConclusionsTGF-β1 is significantly increased in aging kidney. It may activate the downstream signaling molecules Smad2, Smad3, inhibiting Smad7 to activate HK2 cells in myofibroblast transdifferentiation, and then promote the development of aging-related fibrosis.
transforming growth factor-β1; renal aging; renal tubular epithelial cells
国家重点基础研究发展计划(2013CB530803);国家自然科学基金面上项目(H0511-81370843;H0511-81670677);江苏高校优势学科建设工程资助项目(JX10231801)
210029江苏省南京市,南京医科大学第一附属医院老年肾科
赵卫红,Email:zhaoweihongny@njmu.edu.cn
R 692
A
10.3969/j.issn.1003-9198.2017.09.007
2017-04-05)
