罗格列酮对脓毒症大鼠急性肺损伤保护作用的研究
2017-09-20
罗格列酮对脓毒症大鼠急性肺损伤保护作用的研究
靳希成秦海东孙才智沈华张铮
目的探讨罗格列酮对脓毒症大鼠急性肺损伤的保护作用及其机制。方法按随机数字法,将54只健康清洁级雄性大鼠,随机分为3组,分别为对照组(C组),脓毒症急性肺损伤模型组(L组),罗格列酮治疗组(T组)。采用腹腔注射内毒素脂多糖(LPS)的方法建立脓毒症急性肺损伤模型,分别于注射LPS后3 h、6 h、12 h进行心脏取血。用酶联免疫吸附试验(ELISA)测定大鼠血清肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)水平,取肺组织做HE染色,观察肺组织光镜下的病理学改变,测肺湿/干重比值(W/D),并采用western-blot法检测肺组织血红素加氧酶(HO-1)蛋白的表达。结果与C组相比,L组和T组各时间点大鼠肺的W/D比值显著增加(P均<0.01);与L组比较,T组6、12 h时W/D显著降低(P<0.01)。与C组比较,L组与T组各时间点血清TNF-α、IL-6水平显著升高(P均<0.05);与L组比较,T组各时间点血清TNF-α、IL-6水平显著降低(P<0.01或P<0.05)。与C组相比,L组6、12 h时HO-1蛋白表达显著增高(P<0.01);与L组比较,T组各时间点HO-1蛋白表达显著增高(P<0.01)。结论预先加入罗格列酮可以对脓毒症大鼠急性肺损伤起保护作用,其机制可能与提高肺组织HO-1蛋白表达,减轻脓毒症大鼠的炎症反应有关。
罗格列酮; 脓毒症; 血红素加氧酶-1; 过氧化物酶体增值物激活受体γ
脓毒症作为一种临床上常见的危急重症,是由感染引起的一种全身炎症反应综合征(SIRS)[1],其病死率高。在脓毒症诱导的多器官功能衰竭中,肺脏是最早发生衰竭的器官之一。而事实上,呼吸衰竭是脓毒症病人的主要死因[2]。血红素加氧酶(heme oxygenase-1,HO-1)又名热休克蛋白32,参与包括抗炎、抗氧化、抗凋亡、抗增殖、以及免疫调节等一系列细胞保护过程[3]。罗格列酮(ROSI)作为过氧化物酶增值激活受体γ(PPAR-γ)的特异性激活剂,近年来其抗炎作用机制引起了大家的重视[4-6]。但关于ROSI是通过何种机制参与脓毒症抗炎反应的研究,国内外尚未见相关报道。本实验旨在通过观察ROSI对脓毒症大鼠急性肺损伤(ALI)的影响,探讨其对肺组织损伤的保护作用。
1 材料与方法
1.1 药物和试剂 ROSI(大连美仑生物科技有限公司),内毒素脂多糖(LPS)(美国Sigma公司),HO-1 (博士得生物公司),肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒(武汉USCN公司),白介素-6(IL-6)ELISA检测试剂盒(武汉USCN公司)。
1.2 实验动物分组与模型制备 健康成年雄性清洁级SD大鼠54只,体质量250~300 g,由南京医科大学附属南京医院实验动物中心提供。采用随机数字法将大鼠平均分成对照组、ALI模型组以及ROSI治疗组。参照文献[7]方法,大鼠经腹腔注射LPS 10 mg/kg制备脓毒症大鼠ALI模型。ALI模型组和对照组分别在腹腔注射LPS或等体积生理盐水前24 h和前30 min腹腔注射10%二甲基亚砜(DMSO)(1 ml/kg)。ROSI治疗组在腹腔注射LPS前24 h和前30 min腹腔注射10%DMSO+ROSI(10 mg/kg),本实验中动物处理方法符合动物伦理学标准。
1.3 检测指标及方法
1.3.1 肺组织湿/干质量(W/D)比值的测定:取大鼠左肺组织吸干血迹后称湿质量,再置入80℃烘箱48 h至恒重后称干质量,计算两者比值。
1.3.2 大鼠血清TNF-α、IL-6含量的测定:大鼠用10%水合氯醛麻醉后,左心室取血2 ml,常温静置2 h,离心取上清液,采用ELISA法检测血清各指标水平,操作步骤严格按照试剂盒说明进行。
1.3.3 western-blot 检测HO-1:按照western蛋白提取试剂盒说明书提取肺组织蛋白后保存在-80 ℃的冰箱待用。将肺组织蛋白样品行SDS-PAGE凝胶电泳,转膜1 h,封闭1 h,加入多克隆兔抗HO-1,孵育过夜,加入辣根过氧化酶标记的兔抗鼠IgG(1∶1500),孵育,ECL显影,曝光。采用Gel-Pro32软件进行灰度分析,其目的蛋白HO-1与内参灰度的比值即为目的蛋白的相对含量。
1.3.4 肺组织病理学观察:取右肺上叶的小块组织,于10%多聚甲醛中固定石蜡包埋,切为5 μm的切片行HE染色。光镜下观察肺组织病理改变。
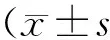
2 结果
2.1 大鼠一般情况 对照组大鼠毛皮光滑,反应灵敏,呼吸平稳,活动自如。ALI模型组大鼠于注射LPS后30 min逐渐出现摄食减少、活动减少、呼吸频率加快、精神萎靡、竖毛、寒战、嗜睡等症状,并随着时间的延长上述症状加重。ROSI治疗组大鼠症状较ALI模型组明显减轻。
2.2 肺组织病理变化 对照组肺组织结构正常,肺泡壁薄,肺泡腔内无渗出液和炎性细胞。3 h时ALI模型组大鼠肺泡间隔轻度增宽,少量炎细胞浸润,可见毛细血管扩张充血。6 h时部分肺泡萎陷,肺泡间隔中度增宽,较多炎细胞浸润,局灶见红细胞渗出。12 h时,肺组织失去正常结构部分实变,可见大量炎细胞呈片状分布,并有小脓肿形成,肺间质及肺泡腔内见灶性出血。与ALI模型组同时间点相比,ROSI治疗组病理改变程度明显减轻,12 h肺组织未见明显出血灶,仅见较多炎细胞浸润,见图1。
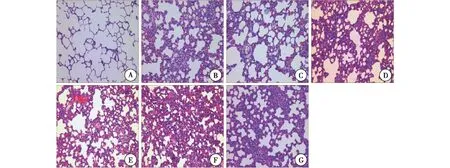
A: 正常对照组; B:ALI模型3 h组; C:ROSI治疗3 h组; D: ALI模型6 h组;E:ROSI治疗6 h组;F:ALI模型12 h组;G:ROSI治疗12 h组图1 大鼠肺组织病理改变(HE,×200)
2.3 各组大鼠肺W/D比值的变化 3 h、6 h、12 h时间点各组间W/D比值比较,差异具有统计学意义(F=58.96;F=87.66;F=195.80,P<0.001)。与对照组比较,ALI模型组和ROSI治疗组各时间点大鼠肺的W/D比值显著增加(P<0.01),与ALI模型组比较,ROSI治疗组肺W/D比值在6 h,12 h显著降低(P<0.01),在3 h时差异无统计学意义(P>0.05),见表1。
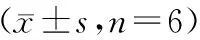
表1 各组大鼠肺组织W/D比值的变化
注:与同时间点对照组比较,**P<0.01;与同时间点ALI模型组比较,△△P<0.01
2.4 各组大鼠血清TNF-α、IL-6的变化 与对照组比较,ALI模型组各时间点血清TNF-α、IL-6水平均显著升高(P<0.05)。ROSI治疗组各时间点血清TNF-α、IL-6水平较ALI模型组明显下降(P<0.05)。ROSI治疗组3 h、6 h血清TNF-α、IL-6水平较对照组显著升高(P<0.05)。见表2,3。
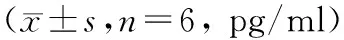
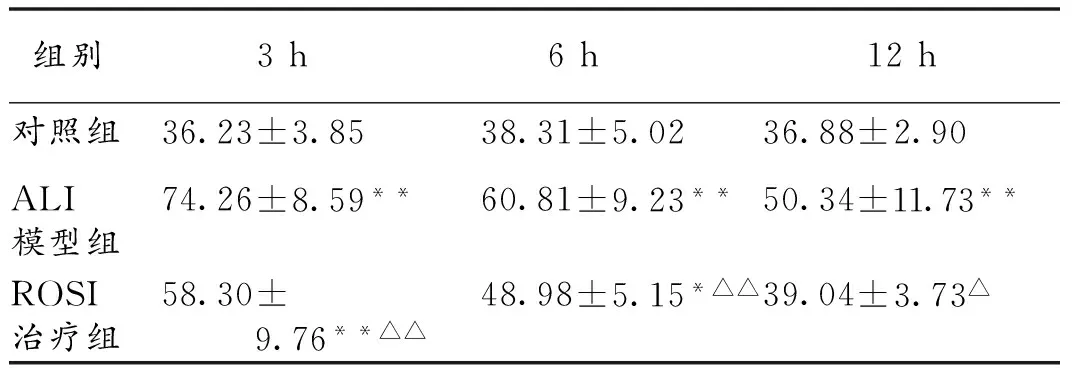
组别3h6h12h对照组36.23±3.8538.31±5.0236.88±2.90ALI模型组74.26±8.59**60.81±9.23**50.34±11.73**ROSI治疗组58.30±9.76**△△48.98±5.15*△△39.04±3.73△
注:与同时间点对照组比较,*P<0.05,**P<0.01;与同时间点ALI模型组比较,△P<0.05,△△P<0.01

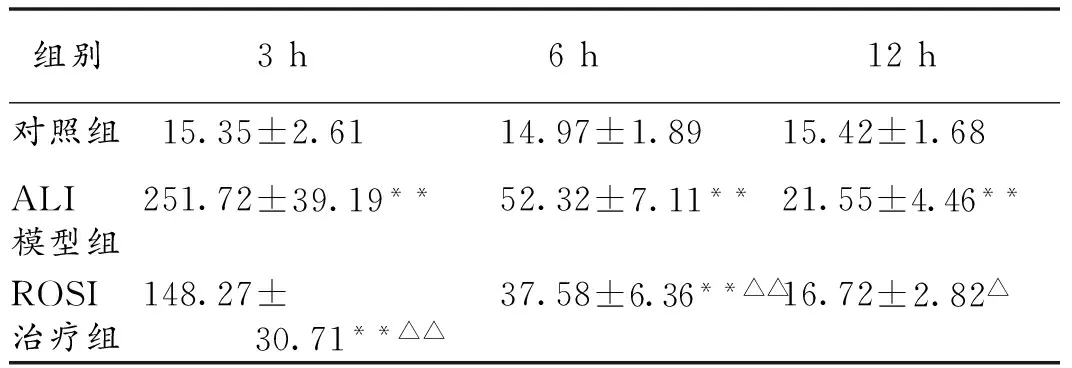
组别3h6h12h对照组15.35±2.6114.97±1.8915.42±1.68ALI模型组251.72±39.19**52.32±7.11**21.55±4.46**ROSI治疗组148.27±30.71**△△37.58±6.36**△△16.72±2.82△
注:与同时间点对照组比较,*P<0.05,**P<0.01;与同时间点ALI模型组比较,△P<0.05,△△P<0.01
2.5 各组大鼠肺组织HO-1蛋白量的变化 在ALI模型组,HO-1蛋白表达于6 h及12 h显著上升(P<0.01)。ROSI治疗组各时间点与对照组及ALI模型组相比显著上升(P<0.01)。组内比较,ALI模型组6 h较3 h显著上升(P<0.01),12 h较6 h上升差异无统计学意义(P>0.05)。ROSI治疗组6 h较3 h显著上升(P<0.01),12 h较6 h显著上升(P<0.01),见图2。
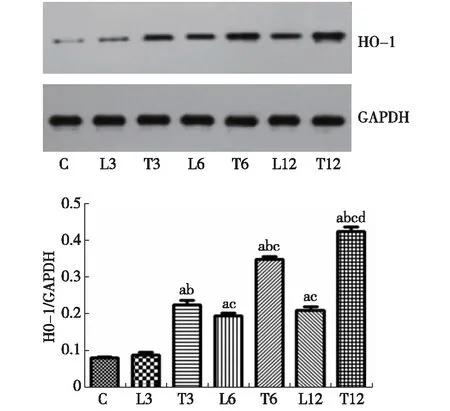
注:C:对照组;L3: ALI模型3 h组;T3:ROSI治疗3 h组;L6: ALI模型6 h组;T6:ROSI治疗6 h组;L12: ALI模型12 h组;T12:ROSI治疗12 h组;与L3组比较,P<0.01;与同时间点ALI模型组比较,bP<0.01,与同组内3 h时间点比较,cP<0.01;与同组内6 h时点比较,dP<0.01图2 各组肺组织HO-1蛋白含量
3 讨论
脓毒症是指由感染引起的全身炎症反应综合征,其进一步发展可以导致脓毒症休克以及多器官功能障碍综合征,成为临床危重病人的主要死亡原因之一[8]。而在脓毒症病情发展过程中,肺损伤往往是最早出现的。在动物ALI的模型中,LPS模型是最常用的模型之一。LPS是革兰阴性菌细胞外膜成分,本实验采用腹腔注射LPS(10 mg/kg)复制了脓毒症ALI模型,结果显示,与对照组比较,ALI组血清TNF-α,IL-6浓度及肺W/D比值显著升高(P<0.05),结合病理学结果,提示大鼠脓毒症肺损伤模型制备成功。
脓毒症是一种失控的炎症反应,而TNF-α是机体受到有害刺激后在单核巨噬细胞以及淋巴细胞最早分泌的,最关键的促炎细胞因子,它可以诱导IL-1、IL-6等细胞因子的产生,从而引发炎症的级联反应,使炎症细胞在肺部大量聚集,引起肺组织损伤。已有大量研究表明,TNF-α和IL-6在脓毒症休克肺损伤中起到了至关重要的作用[9-10]。此外,Ridemann等[11]实验表明,血清IL-6水平和脓毒症大鼠死亡率有关,它可以作为菌血症出现的一个早期诊断标志物,使用抗体去阻断IL-6可以显著提高脓毒症大鼠的生存率。本实验中,在ROSI治疗组我们预先加入ROSI,发现脓毒症大鼠血清各时间点TNF-α和IL-6水平显著降低,肺组织病理损伤明显改善,这与Wu等[12]研究结果一致,提示ROSI对脓毒症肺损伤的保护可能是通过降低血清TNF-α和IL-6来实现的。
HO-1是哺乳动物和人体内血红素代谢途径中的限速酶。HO-1有3种同工酶,分别是HO-1、HO-2、HO-3,其中HO-2和HO-3主要在生理情况下作用于体内,而HO-1是一种应激反应蛋白,低氧、氧化应激、炎症等病理情况下都可以诱导HO-1表达大量增加[13],并在受损脏器大量聚集,从而对机体起到抗炎、抗氧化、抗凋亡等保护作用。已经有体外和体内研究表明,HO-1可以通过减弱MAPKs和NF-κB信号通路的激活,减少脓毒症状态下TNF-α及IL-6的产生[14-15]。同时Ge等[16]研究发现LPS可诱导ALI中HO-1的表达上调,而当HO-1的活性被ZnPP抑制后,肺损伤加重,提示表达上调的HO-1对脓毒症ALI起到了一定的保护作用。本实验中,ALI模型组大鼠肺组织HO-1升高,表明LPS在诱导肺组织损伤的同时,也启动了包括HO-1在内的机体保护系统,但因为表达水平太低而不能够发挥有效的保护作用。而ROSI组,肺组织各时间点HO-1表达明显上升,炎症明显下降。因此,我们推断ROSI对炎症的下调作用是通过上调HO-1来实现的。
PPAR-γ是一种依赖配体激活的转录因子,属于核激素受体超家族的成员。被特定的配体激活之后,PPAR-γ进一步激活PPAR反应元件启动目标基因的转录。许多研究者认为HO-1是PPAR-γ下游的一个效应基因,是PPAR-γ的直接靶向基因[17], PPAR-γ可以通过改变HO-1基因启动子的多态性,促进HO-1蛋白的表达。而ROSI是高亲和力的PPAR-γ激动剂。研究发现巨噬细胞在缺乏PPAR-γ信号的情况下,不能抑制炎症因子的产生[18]。而且在面对氧化应激压力的情况下,在巨噬细胞中PPAR-γ可以稳定HO-1 mRNA的基因表达,HO-1 mRNA的半衰期降低和PPAR-γ基因表达的缺乏成平行关系[19]。本实验在预先加入ROSI的情况下,肺组织HO-1的表达呈现时间依赖性的增加,与同时点ALI模型组相比,肺组织W/D比明显下降,炎症指标和肺组织病理改变明显减轻。因此,我们推测ROSI可以通过增加HO-1蛋白的表达,而降低炎症反应,对损伤肺组织起到保护性作用。
综上所述,ROSI能有效减轻脓毒症大鼠ALI,其机制可能是通过提高肺组织的HO-1水平而减少各类炎症因子表达来实现的,其保护作用呈时间依赖性,从而为临床上治疗ALI提供了新的思路。
[1] Kim SJ, Park JS,Lee DW,et al. Trichostatin a protects liver against septic injury through inhibiting toll-like receptor signaling[J]. Biomol Ther (Seoul), 2016, 24(4): 387-394.
[2] Zhou P,Ma B,Xu S, et al. Knockdown of Burton’s tyrosine kinase confers potent protection against sepsis-induced acute lung injury[J]. Cell Biochem Biophys, 2014, 70(2): 1265-1275.
[3] Chen X,Wei SY,Li JS, et al. Overexpression of heme oxygenase-1 prevents renal interstitial inflammation and fibrosis induced by unilateral ureter obstruction[J]. PLoS One, 2016,11(1): e0147084.
[4] 邓佳,于健.罗格列酮对脓毒症急性肾损伤大鼠肿瘤坏死因子-α表达的影响[J]. 中华医学杂志,2015, 95(19): 1479-1482.
[5] 邓佳,于健.罗格列酮对脓毒症大鼠急性肾损伤的保护作用[J]. 中华医学杂志, 2016,96(29): 2311-2315.
[6] 曾勉,黄晓梅,何婉媚,等.罗格列酮联合头孢他啶对脓毒症大鼠过氧化物酶体增殖物激活受体γ活性和白细胞介素的影响[J].中国危重病急救医学,2012,24(9): 550-553.
[7] 芮蕾,陈威丞,朱继金,等. 双联抗血小板对脓毒症大鼠血小板功能和急性肺损伤的影响[J]. 中国急救医学, 2015,35(2): 97-100.
[8] Dellinger RP,Levy MM,Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013,39(2): 165-228.
[9] Singleton KD,Wischmeyer PE. Distance of cecum ligated influences mortality, tumor necrosis factor-alpha and interleukin-6 expression following cecal ligation and puncture in the rat[J].Eur Surg Res, 2003,35(6): 486-491.
[10]Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome[J]. J Pathol, 2004, 202(2): 145-156.
[11]Riedemann NC, Neff TA,Guo RF,et al. Protective effects of IL-6 blockade in sepsis are linked to reduced C5a receptor expression[J]. J Immunol, 2003, 170(1): 503-507.
[12]Wu WT, Lee CC,Lee CJ,et al. Rosiglitazone ameliorates endotoxin-induced organ damage in conscious rats[J]. Biol Res Nurs, 2011, 13(1): 38-43.
[13]Yu JB, Dong SA, Luo XQ, et al. Role of HO-1 in protective effect of electro-acupuncture against endotoxin shock-induced acute lung injury in rabbits[J]. Exp Biol Med (Maywood), 2013,238(6): 705-712.
[14]Otterbein LE, Bach FH,Alam J,et al. Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway[J]. Nat Med, 2000, 6(4): 422-428.
[15]Lee TS,Chau LY.Heme oxygenase-1 mediates the anti-inflammatory effect of interleukin-10 in mice [J]. Nat Med, 2002, 8(3): 240-246.
[16]Ge ZJ,Jiang GJ,Zhao YP, et al. Systemic perfluorohexane attenuates lung injury induced by lipopolysaccharide in rats: the role of heme oxygenase-1[J]. Pharmacol Rep, 2010,62(1): 170-177.
[17]Kronke G,Kadl A,Ikonomu E, et al. Expression of heme oxygenase-1 in human vascular cells is regulated by peroxisome proliferator-activated receptors[J]. Arterioscler Thromb Vasc Biol, 2007,27(6): 1276-1282.
[18]Bouhlel MA, Derudas B,Rigamonti E,et al. PPARgamma activation primes human monocytes into alternative M2 macrophages with anti-inflammatory properties[J]. Cell Metab, 2007,6(2): 137-143.
[19]von Knethen A,Neb H,Morbitzer V,et al. PPARgamma stabilizes HO-1 mRNA in monocytes/macrophages which affects IFN-beta expression[J]. Free Radic Biol Med, 2011, 51(2): 396-405.
Protectiveeffectsofrosiglitazoneonacutelunginjuryinducedbylipopolysaccharideinrats
JINXi-cheng,QINHai-dong,SUNCai-zhi,SHENHua,ZHANGZheng.
DepartmentofEmergency,NanjingFirstHospital,Nanjing210006,China
ObjectiveTo investigate the protective effect of rosiglitazone on acute lung injury(ALI) in rats with sepsis and to explore the possible mechanism.MethodsFifty-four healthy male rats were randomly divided into three groups: control group(group C), acute lung injury of sepsis group(group L),rosiglitazone treatment group(group T).The acute lung injury model of sepsis was established by intraperitioneal injection of 10 mg/kg LPS. The levels of serum TNF-α and IL-6 were measured by enzyme-linked immunosorbent assay(ELISA) 3 h,6 h,12 h after injection of endotoxin. The lung tissue was stained with hematoxylin and eosin(HE) and observed under light microscopy. The lung wet to dry weight ratio was measured, and the expression of HO-1 protein was detected by western blot.ResultsCompared with group C,W/D of lung tissue in group L and group T was significantly higher at each time point. Compared with group L, W/D of lung tissue in T group was significantly lower 6 h and 12 h after injection of LPS.The concentration of TNF-α and IL-6 in group L reached the peak 3 h after injection of LPS, then decreased with time. Compared with group C, serum levels of TNF-α and IL-6 in group L were significantly higher than those in group C at each time point. Compared with group L, levels of TNF-α and IL-6 in group T were significantly lower at each time point. Compared with group L, the expression of HO-1 protein in group T was significantly higher, and increased more significantly with time. Compared with group L, the pathological changes of lung tissue in group T were significantly reduced at each time point.ConclusionsOur study demonstrates that pretreatment with rosiglitazone may protect against acute lung injury in septic rats through increasing the level of HO-1 protein in lung tissue and alleviating inflammatory response in sepsis rats.
rosiglitazone; sepsis; heme oxygenase-1; peroxisome proliferator activated receptor γ
210006江苏省南京市,南京医科大学附属南京医院(南京市第一医院)急诊科
张铮,Email:Zz18351891108@126.com
R 459.7
A
10.3969/j.issn.1003-9198.2017.09.006
2016-10-23)
