结核分枝杆菌rBCG-Rv2029c重组疫苗的构建与鉴定
2017-09-03薛士鹏吴建勇齐红双党颍徐满永宏
薛士鹏,吴建勇,宋 彬,齐红双,李 英,党颍徐,满永宏
结核分枝杆菌rBCG-Rv2029c重组疫苗的构建与鉴定
薛士鹏1,吴建勇1,宋 彬1,齐红双2,李 英2,党颍徐2,满永宏1
目的构建结核分枝杆菌rBCG-Rv2029c重组疫苗并鉴定。方法通过PCR扩增Rv2029c抗原编码基因,然后用双酶切法将Rv2029c和pMV261质粒酶切,再将酶切产物连接成rpMV261-2029c重组质粒,用电穿孔法将该质粒导入BCG中构建成rBCG-Rv2029c重组疫苗,最后用SDS-PAGE和Western blotting鉴定表达的重组蛋白。结果通过PCR成功扩增出1 020 bp的Rv2029c基因,插入到pMV261质粒中,再把融合基因成功导入BCG中,经双酶切及基因比对鉴定证实,再通过热诱导后用Western blotting显示重组蛋白具有免疫原性。结论成功构建了结核分枝杆菌rBCG-Rv2029c重组活疫苗,为重组疫苗的免疫机制研究奠定基础。
卡介苗;重组疫苗;结核杆菌;Rv2029c
BCG(卡介苗)的免疫保护功能对儿童较理想,但其远期的免疫效果并不理想,在各类人群中的免疫保护作用不等[1]。其主要原因是MTB(结核分枝杆菌)感染为休眠感染及BCG中的基因丢失、突变,并且环境中分枝杆菌和MTB存在交叉抗原,从而影响了BCG接种效果[2]。所以各国学者近几年来,正致力于新型结核病疫苗的研究,如改良病毒疫苗[3]、DNA疫苗[4]、蛋白疫苗[5]、MTB减毒活疫苗[6]。
有研究发现,Rv2029c蛋白能在结核病病人和潜伏感染者中诱导特异性免疫应答,尤其在潜伏感染者中,其诱导的免疫反应远超过结核病病人,Rv2029c蛋白能起到较好的免疫刺激作用[7],且Rv2029c重组蛋白在人T细胞中也可刺激产生明显的免疫反应,同时,在感染MTB的人体中,Rv2029c具有显著的免疫原性[8]。所以本次实验拟将Rv2029c作为目的基因构建重组DNA疫苗,为新型结核病疫苗的免疫机制的研究奠定基础。
1 材料与方法
1.1 菌株与质粒 从结核分枝杆菌H37Rv分离的基因组DNA,以及含有大肠埃希菌-分枝杆菌穿梭表达质粒pMV261的大肠埃希菌菌液均由本实验室保存;BCG上海株(BCG-China strain):购于中国生物制品检定所,由南阳医学高等专科学校研究中心实验室常规培养并冻存。
1.2 实验试剂 用于质粒重组的限制性核酸内切酶BamH I和EcoR I、 TaqDNA聚合酶、dNTP、 DNA连接试剂盒、PCR清洁回收试剂盒、基因组提取试剂盒、胶回收纯化试剂盒、质粒提取试剂盒:购于大连宝生物科技有限公司;N-N`-亚甲基双丙烯酰胺、丙烯酰胺、Marker、TB-PPD:购于上海生物工程有限公司;结核病人血清:河南省南阳市第六人民医院提供;羊抗人抗体为Life Technologies(Invitrogen)公司产品。
1.3 重组基因的构建
1.3.1 Rv2029c基因的扩增 根据GenBank中报道的结核分枝杆菌Rv2029c基因序列,并结合质粒pMV261酶切位点设计-对引物即:P1: 5′-TA GGATCC TAC TGC CTC GGT CGC CGC A-3′;P2:5′-AT GAATTC TCA TGG CGA GGC TTC CGG GT-3′以结核分枝杆菌H37Rv基因组DNA为模板,P1、P2为引物进行PCR扩增。扩增产物用琼脂糖凝胶电泳鉴定。
1.3.2 rpMV261-2029c重组质粒的构建 用质粒提取试剂盒按操作步骤提取含有pMV261质粒的大肠埃希菌菌液。将目的基因和空质粒同时进行BamH I和EcoR I双酶切,将酶切产物加入连接液中 16 ℃过夜。将连接产物转化入DH5α大肠埃希菌感受态细胞中,然后挑取pMV261的卡拉霉素阳性质粒菌接种至LA(胰化蛋白胨:10 g;酵母提取物:5 g;氯化钠:10 g;琼脂粉:3 g;水:1 L)培养基上培养。如果转化的大肠埃希菌能在LA培养基上生长,则可初步判定质粒转化成功。再增菌培养,重提质粒,以重组质粒为模板,P1、P2为引物进行PCR扩增并用BamH I和EcoR I进行双酶切鉴定。将初步鉴定正确的菌液送上海生物公司测序。
1.4 重组卡介苗rBCG-Rv2029c的构建
1.4.1 BCG感受态细胞的制备[9]将BCG菌苗加入细菌培养瓶中,常规培养约4~6 周,当菌膜铺满培养基表面,即可制备感受态细胞。加入甘氨酸使其终浓度为5%,继续培养24 h,向培养瓶中加入高压灭菌玻璃珠,置于摇床上充分震荡培养,直至菌膜被打碎成单菌。50 mL离心管收集菌体,用10%超纯水稀释的甘油洗涤,以去除培养基中的离子和其它杂质,连续洗涤3次,最后再用10%甘油重悬BCG,即制成BCG感受态细胞。
1.4.2 重组质粒的电转化导入 取400 μL BCG感受态细胞悬液加入电穿孔杯中,再加入20 μL重组质粒rpMV261-2029c或pMV261空载体,轻轻混匀后,冰上放置30 min,即进行电转化。电转化条件设置为:电阻720 Ω,电压1.8 kv~2.2 kv(可调),其它参数自动调节,放电2~3次,2次放电间隔为2 min,以确保菌液温度不至于过高或BCG细胞破坏,3次放电结束后,置冰浴30 min,而后,将菌悬液加入含有20 μg/mL卡那霉素的Sauton 培养基中,37 ℃恒温孵箱培养。
1.5 重组卡介苗rBCG-Rv2029c的鉴定
1.5.1 卡拉霉素抗生素筛选 将上述电击转化后菌液经37 ℃静置培养后,若能够生长,说明该重组BCG卡介苗表达卡拉霉素抗性基因,由于pMV261上含有卡拉霉素抗性基因,则间接说明重组质粒已通过电转化成功导入卡介苗基因组,此重组卡介苗可进行如下鉴定。
1.5.2 重组卡介苗基因组DNA的提取、PCR鉴定及测序鉴定 扩增菌量,采集菌液重提重组卡介苗基因组,以重组卡介苗基因组为模板,以P1、P2为引物进行PCR扩增,凝胶成像分析系统对PCR产物进行分析,如有明显的扩增条带,则可初步判定该重组质粒已成功通过电转化导入BCG基因组。将PCR扩增鉴定阳性的重组卡介苗基因组保存,并送测序公司进行测序鉴定,测序结果在NCBI中进行blast比对。
1.5.3 重组蛋白的热诱导表达[10]和western-blot鉴定 取经鉴定后的阳性的重组卡介苗菌苗,从37 ℃的培养环境中迅速移入45 ℃的水浴中,使其处于热应激环境,作用30 min后将其取出。收集单菌菌液于PBS中,在冰浴下进行超声破菌。用PEG6000对破碎后的菌液进行浓缩,浓缩至原体积1/50左右即可。收集破菌上清及沉淀、细菌培养基进行SDS-PAGE电泳分析表达产物。然后,取目的胶带用半干转移系统将蛋白质转印至PVDF膜上,5%脱脂奶粉封闭抗原1 h,TBST(TBS液中加入终浓度为0.5%的Tween80分散剂)缓冲液洗涤5 min×3次,加入结核病病人血清(1∶100稀释),4 ℃过夜,次日复温至室温后再放置1 h,TBST洗涤5 min×3次,加入荧光标记的IgG二抗,室温孵育1 h后,DAB显色。
2 结 果
2.1 目的基因Rv2029c的PCR获取 PCR产物经1%琼脂糖凝胶电泳后,凝胶成像分析显示,在约1 020 bp处可见特异性扩增条带,与目的基因Rv2029c大小一致(如图1示)

M:M2000;1. Rv2029c基因M:DNA Marker D2000; 1. PCR product of rv2029c gene图1 目的基因Rv2029c的PCR扩增琼脂糖凝胶电泳 Fig.1 Agarose electrophoresis for PCR product of rv2029c
2.2 重组穿梭质粒的鉴定
2.2.1 重组质粒rpMV261-Rv2029c的抗生素筛选 将目的基因Rv2029及空质粒pMV261经双酶切后过夜连接,而后将链接子转化大肠埃希菌感受态细胞E.coliDH5a,结果在含卡那霉素的LB(胰化蛋白胨10 g;酵母提取物5 g;氯化钠10 g;水1 L)固体培养板上筛选得到数株重组菌落。挑取单菌落在含有卡那霉素的LB液体培养基中仍可增量,说明重组菌落可表达卡拉霉素抗性基因,初步判定重组质粒构建成功。
2.2.2 重组质粒的PCR扩增鉴定 以重组质粒rpMV361-Rv2029c为模板,P1、P2为引物进行PCR扩增鉴定,琼脂糖凝胶电泳结果显示,在约1 020 bp处可见明显电泳条带,其大小与Rv2029c基因大小相符(图2-1泳道)。提取上述3种鉴定均为阳性的重组质粒,送Invitrogen公司测序,通过在NCBI中进行blast比对后,提示目的基因Rv2029c与GenBank中收录的一致,未发生突变、错配、缺失等。
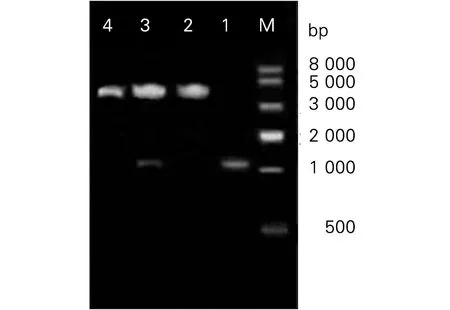
1. Rv2029c基因扩增产物;2. 重组质粒rpMV261-Rv2029c;3.BamH I和EcoR I对重组质粒rpMV261-Rv2029c进行双酶切,在1 020 bp处可见特异性酶切产物;4. BamH I和EcoR I对pMV261空质粒进行双酶切,未见酶切产物;M:DNA marker IV1: PCR product of rv2029c gene; 2: rpMV261-Rv2029c; 3:rpMV261-Rv2029/BamH I+EcoR I; 4: pMV261/BamH I+EcoR I; M: DNA Marker IV图2 重组质粒rpMV261-Rv2029c的双酶切鉴定Fig.2 PCR and restriction digestion of recombinant plasmid rpMV261-Rv2029c DNA Marker IV
2.2.3 重组质粒的酶切鉴定和测序鉴定 将重组质粒命名为rpMV261-Rv2029c,提取经抗生素筛选的阳性重组质粒,用限制性核酸内切酶BamH I和EcoR I对重组质粒进行双酶切,凝胶电泳显示,分别在4 500 bp和1 020 bp处可见清晰的电泳条带(图2),分别与pMV261空质粒载体和目的基因Rv2029c大小相符。
3.3 重组疫苗rBCG-R的鉴定
3.3.1 重组疫苗的抗生素筛选 将电转化后的菌液在含有卡那霉素的Sauton(苏通琼脂培养基)培养基中培养,8周后可见少量菌落在培养基表面长出,12周后重组菌体则可铺满培养基表面。将菌体转种后,经4周的培养,菌膜则可铺满整个培养基表面,呈侵袭性生长。
3.3.2 重组疫苗基因组DNA的PCR扩增鉴定和测序鉴定 将鉴定阳性的重组菌增菌培养,提取其基因组DNA并以此为模板,以P1、P2为引物进行PCR扩增鉴定,结果如图3显示:凝胶电泳在1 020 bp处可见明显扩增条带,与Rv2029c基因大小相符。而以rBCG-261和BCG基因组DNA为模板,相同条件下扩增则无特异性条带。提取经鉴定均为阳性的重组菌体基因组DNA送测序,结果通过NCBI进行blast比对后,显示目的基因未发生突变、缺失、错配等。
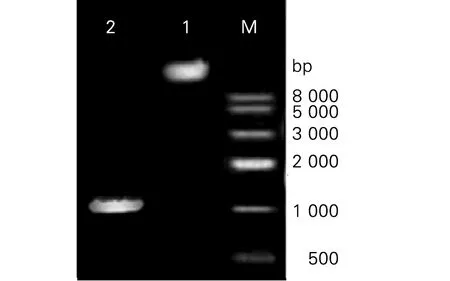
1.rBCG-R基因组DNA;2. 以rBCG-R基因组DNA为模板进行PCR扩增条带; M:Marker1. Genomic DNA of rBCG-R; 2. PCR amplification was performed using rBCG-R genomic DNA as template 图3 重组卡介苗rBCG-R的基因组提取及PCR鉴定Fig.3 PCR and restriction digestion of recombinant plasmid rBCG-R
3.3.3 目的蛋白在重组疫苗rBCG-R中的热诱导表达和Western-blot鉴定 重组卡介苗经过热诱导后表达目的蛋白,然后将目的蛋白经SDS-PAGE电泳分析,最后进行Western-blot检测。结果显示,DAB显色后在相对分子量约35 KD处出现了一条特异性反应条带,在菌体培养液和破菌上清中均可检出重组蛋白,如图4。

图4 重组蛋白的West-blot鉴定Fig.4 Recombinant protein identified by Western blot
3 讨 论
由于目前1/3以上的MTB感染以休眠菌的形式存活于体内,一种理想的TB疫苗不仅能诱导机体产生针对活动性MTB的免疫反应,还要求结核菌疫苗能有效提供针对休眠MTB的免疫保护,从而达到增强机体对结核杆菌免疫保护的能力。
MTB休眠存活调节子系统为DosR[11](Dormancy survival regulon),该系统包含近50个基因,其表达产物与MTB休眠密切相关。研究发现,当MTB处于营养素缺乏、缺氧及酸性微环境等应激条件下,Rv2029c呈持续高表达状态,提示Rv2029c在MTB休眠中发挥关键作用[12]。
所以,本研究以MTB休眠相关基因Rv2029c为目的基因[12]构建重组卡介苗新型结核病疫苗rBCG-Rv2029c,主要目的是使该疫苗具有针对休眠MTB的免疫保护能力。此外,我们以BCG为基础构建重组卡介苗,BCG中含有众多活动性MTB表达抗原,使rBCG-Rv2029c既具备诱导针对活动性MTB免疫应答的能力,同时,由于重组蛋白为休眠相关抗原Rv2029c,使rBCG-Rv2029c又具备诱导产生针对休眠MTB的免疫反应。
另外,rBCG是活疫苗,接种体内后能自我繁殖,可持续表达其自身蛋白和重组蛋白,不断刺激免疫系统产生持续的免疫应答。该应答不仅针对BCG表达的众多免疫显性抗原,更重要的是其表达的重组蛋白可诱导产生特异性的免疫反应,如针对MTB休眠显性抗原的免疫应答,通过该方式,可显著提高重组疫苗的免疫预防效果。同时,rBCG疫苗具备保存条件不高(4°C冷藏即可)、适合大量生产、培养条件简单、获取容易、价格低廉[13-16]等有利条件。并且,rBCG疫苗构建的基础是BCG,具有较高的安全性[17]。
本次实验把MTB休眠相关基因Rv2029c成功的转化入了BCG活疫苗中,通过抗生素初筛及基因的比对,Rv2029c没有发现有错配,缺失等,并且在热诱导的条件下能够表达休眠相关蛋白,只不过表达的量及进入机体后能否表达尚有待进一步研究,为该类新型疫苗的免疫性及安全性评价奠定基础。
[1] Migliori GB, Centis R, Lange C, et al. Emerging epidemic of drug-resistant tuberculosis in Europe, Russia, China, South America and Asia: current status and global perspectives[J]. Curr Opin Pulm Med, 2010, 16(3): 171-179. DOI: 10.1097/MCP.0b013e328337573e
[2] Roberto ZC. Update on the development of TB vaccines[J]. Curr Pharmaceutic Biotechnol, 2014, 14(11): 940-946.
[3] Hill AV, Reyes-Sandoval A, Hara OG, et al. Prime-boost vectored malaria vaccines: Progress and prospects[J]. Human Vaccine, 2010, 6(1): 78-83.
[4] Cayabyab MJ, Kashino SS, Campos-Neto A. Robust immune response elicted by a novel and uniqueMycobacteriumtuberculosisprotein using an optimized DNA/protein heterologous prime/boost protocol[J]. Immunology, 2012, 135(3): 216-225. DOI: 10.1111/j.1365-2567.2011.03525.x[5] Windish HP, Dytgue MS, Ireton G, et al. Protection of mice fromMycobacteriumtuberculosisby ID87/GLA-SE, a novel tuberculosis subunit vaccine candidate[J]. Vaccine, 2012, 31(1): 278. DOI: 10.1016/j. vaccine.2011.07.094
[6] Juarea-Rodriquez MD, Yang J. Live attenuatedSalmonellavaccine displaying regulated delayed lysis and delayed antigen synthesis to confer protection againstMycobacteriumtuberculosis[J]. Infect Immun, 2012, 80(2): 815-831. DOI: 10.1128/IAI.05526-11
[7] Hozumi H, Tsujimura K, Yamamura Y, et al. Immunogenicity of dormancy-related antigens in individuals infected withMycobacteriumtuberculosisin Japan[J]. Int J Tuberc Lung Dis, 2013, 17(6): 818-824. DOI: 10.5588/ijtld.12.0695
[8] Riano F, Arroyo L, Paris S, et al. T cell responses to DosR and Rpf proteins in actively and latently infected individuals from Colombia[J]. Tuberculosis, 2012, 92(2): 148-159. DOI: 10.1016/j.tube.2011.12.005
[9] Langermann S, Palaszynski SR, Burlein JE, et al. Protective humoral response against pneumococcal infection in mice elicited by recombinant bacille Calmette-Guérin vaccines expressing pneumococcal surface protein A[J]. Exp Med, 1994: 180 (6): 2277-2286.
[10] Anderson P, Askgaard D, Ljungqvist L, et al. Protein released fromMycobacteriumtuberculosisduring growth[J]. Infect Immun, 1991, 59(6): 1905-1910.
[11] Pieters J.Mycobacteriumtuberculosisand the macrophage: maintaining a balance[J]. Cell Host Microbe, 2008, 3(6): 399-407. DOI: 10.1016/j.chom.2008.05.006.
[12] Roupie V, Romano M, Zhang L, et al. Immunogenicity of eight dormancy regulon-encoded proteins ofMycobacteriumtuberculosis-infected mice[J]. Infect Immunol, 2007, 75(2): 941-949. DOI: 10.1128/IAI.01137-06
[13] Deng YH, He HY, Zhang FJ. Immunogenicity and protective efficacy conferred by a novel recombinantMycobacteriumbovisBacillusCalmette-Guerin strain expressing Interleukin-12p70 of human cytokine and Ag85A ofMycobacteriumtuberculosisfusion protein[J]. Scandinavian J Immunol, 2013, 78(6): 497-506. DOI: 10.1111/sji.12116
[14] Palavecino CE, Cespedes PF, Gomez RS, et al. Immunization with a recombinantBacillusCalmette-Guerin strain confers protective Th1 immunity against the human metapneumovirus[J]. Immunology, 2014, 192(1): 214-223. DOI: 10.4049/jimmunol.1300118
[15] Singh S, Saraav I, Sharma S. Immunogenic potential of latency associated antigens againstMycobacteriumtuberculosis[J]. Vaccine, 2014, 32(6): 712-716. DOI 10.1016/j.vaccine.2013.11.065
[16] Kruzel ML, Actor JK, Zimecki M, et al. Novel recombinant human lactoferrin: differential activation of oxidative stress related gene expression[J]. J Biotechnology, 2013, 168(4): 666-675.DOI: 10.1016/j.jbiotec.2013.09.011
[17] Makino M. Development of a novel recombinant BCG for tuberculosis vaccine[J]. Jap J Leprosy, 2013, 82(3): 107-110.
Man Yong-hong, Email: man-yh@foxmail.com
ConstructionandidentificationofrecombinantrBCG-Rv2029cvaccineofMycobacteriumtuberculosis
XUE Shi-peng1,WU Jian-yong1,SONG Bin1,QI Hong-shuang2, LI Ying2,DAGN Ying-xu2,MAN Yong-hong1
(1.DepartmentofBasicMedical,NanyangMedicalCollege,Nanyang473061,China; 2.NanshiHospitalAffiliatedtoHenanUniversity,Nanyang473006,China)
We constructed a recombinant vaccine ofMycobacteriumtuberculosisrBCG-Rv2029c, and then identified it. Rv2029c antigen encoding gene was amplified by PCR. The enzyme digestion products were ligated into rpMV261-2029c recombinant plasmid,after double digestion of Rv2029c and pmv261 vector, and then we introduced the plasmid into BCG to construct rBCG-Rv2029c recombinant vaccine by electroporation method. Finally, we analyzed the expression of the recombinant protein by SDS-PAGE and Western blotting. A total of 1 020 bp Rv2029c gene successfully amplified by PCR was inserted into the plasmid pmv261, then the fusion gene was successfully transduced into BCG. After identified by double enzyme digestion, confirmed by gene alignment and by thermally induced with Western blotting, the recombinant protein had a free primary. The recombinant live vaccine ofM.tuberculosisrBCG-Rv2029c is successfully constructed, which lay a foundation for the study of the immune mechanism of recombinant vaccine.
BCG vaccine; recombinant vaccine;Mycobacteriumtuberculosis; Rv2029c
10.3969/j.issn.1002-2694.2017.08.016
校自科NYYZ006
满永宏,Email: man-yh@foxmail.com
1.南阳医学高等专科学校基础医学部,南阳 473061; 2.河南大学附属南阳南石医院,南阳 473006
Supported by the Natural Science Foundation of Nanyang Medical College (No.NYYZ006)
R378
:B
:1002-2694(2017)08-0744-04
2016-01-15编辑:梁小洁
