紫花苜蓿对铜的吸收、积累和耐受机制研究
2017-08-14张丽萍沈亚婷
张丽萍+沈亚婷

摘 要 采用原位微区X射线荧光分析法(In-situ micro-X-ray fluorescence spectrometry, μ-XRF)和分步提取技术, 研究了苜蓿幼苗中Cu原位微区分布特征及其根茎叶中Cu的不同结合形态。结果表明, 苜蓿根部富集Cu浓度高达12.06 mg/g, 是茎的8倍, 叶的4.9倍。微区分布结果表明, 过量Cu暴露下的苜蓿根部是富集Cu的主要部位, 且在根茎交界处存在Cu的阻隔屏障, 以减轻过量Cu对地上部分的毒害作用。过量Cu(大于50 μmol/L时)还抑制了苜蓿对Zn和Ca的向上吸收, 增强了苜蓿对Fe的吸收, 但对K和Mn的吸收影响不明显。亚细胞分步提取结果表明, 根细胞中主要通过形成难溶的残渣态(41%)和细胞壁螯合态(20%)实现对过量Cu的固定; 而在茎中则以疏水蛋白质结合态、细胞壁结合态、残渣态、水溶态等4种形式存在, 以进一步减少过量Cu向叶中输送; 在叶中, 进入叶细胞的过量Cu主要以液泡区隔和难溶残渣态形式存在, 以实现对Cu的耐受和解毒。
关键词 紫花苜蓿; 铜; 植物分步提取; 原位微区X射线荧光分析法; 形态
1 引 言
我国铜矿储量丰富, 随着对Cu需求量日益增加, 铜矿的大规模开采使得我国很多地区土壤中的Cu含量超标[1,2], 典型工业区Cu的超标率甚至高达97%[3]。Cu是生物体必需的微量元素, 是生命过程中许多酶的固有组成成分之一, 在生物体中多以有机复合物形式(如金属蛋白等)存在, 参与催化生物系统中涉及氧的电子传递和氧化还原反应[4]。但过量的Cu会影响人类造血功能, 导致人体肝硬化、运动和知觉神经障碍等[5]。Cu进入土壤后的赋存状态相对长期稳定, 易通过食物链进入人体, 严重危害人类健康[6,7], 因此, 使用绿色环保、成本低廉的植物重金属修复技术, 降低污染土壤中的重金属含量, 成为研究的热点。
紫花苜蓿是一种分布广泛的豆科牧草, 具有较好的Cu耐受性和富集性, 对Cu污染土壤具有较好的植物修复前景。众多学者在Cu暴露下紫花苜蓿对Cu的积累量及其生理生化特征变化等方面已开展了大量研究[8~14]。丁克强等[10]发现, 100 μg/g Cu土培60天时苜蓿根中积累28.71 μg/g Cu, 是茎的3倍; 王文星等[11]的研究显示, 400 μg/g Cu盆栽30天, 根部积累量为地上部的26倍。过量Cu显著增加苜蓿体内ROS水平, 导致脂质过氧化[12], 抑制苜蓿光合作用和呼吸作用[13]。在高浓度Cu胁迫下, 紫花苜蓿体内能产生复杂的耐受解毒机制。超过10 μmol/L Cu处理下就会引发苜蓿叶片中抗氧化机制, 在不同浓度的Cu胁迫下, 傅里叶变换红外光谱分析显示, 紫花苜蓿根中有机酸含量先降后升; 茎的生理生化特征变化不明显; 高浓度处理时, 叶中的可溶性糖和可溶性蛋白浓度等先升后降[14]。关于Cu在苜蓿内的转运及耐受机制方面的研究尚不全面, 细胞内小分子有机酸、氨基酸和金属硫蛋白等物质螯合过量Cu形成低毒性物质, 或进行转运区隔处理, 以减少细胞质中自由Cu2+浓度, 降低毒害作用。Wang等[15]对Cd应激下两种紫花苜蓿提取, 发现都產生了MT2a-和MT2b-两大类金属硫蛋白。在高浓度Pb处理下, 进入苜蓿根表皮细胞中的Pb有63%储存在液泡中[16]。Printz等[17]的研究表明, Cu在苜蓿茎中优先与烟草胺结合以阻断Cu的向上迁移。在30~100 μmol/L Cu处理时, 苜蓿中主要的生物巯基化合物(hGSH、Cys和GSH)总量下降, 但各物种比例维持不变, 未检测到PC [9]; 对紫花苜蓿茎部的Cu进行微区定位, 发现Cu沉积在茎的形成层。紫花苜蓿对Cu的吸收、富集和解毒的机理尚需进一步探索。
原位微区X射线荧光分析法(Micro-X-ray fluorescence spectrometry, μ-XRF)可以获得元素纳米-微米尺度的空间分布特征和元素相关性数据, 揭示元素在样品中的动态分布过程和生物代谢机理[18,19]。开展Cu在紫花苜蓿体内的原位无损微区分布和结合形态的特征研究是研究苜蓿对Cu转运区隔的关键。本研究采用μ-XRF技术和分步提取方法, 揭示过量Cu暴露下紫花苜蓿中Cu在器官和组织水平的分布特征, 以及在不同器官和组织中Cu的形态特征, 从而进一步探究紫花苜蓿对Cu积累、转运的微观过程, 揭示其对Cu的耐受机制。
2 实验部分
2.1 仪器与试剂
原位微区X射线荧光光谱仪(μ-XRF, 国家地质实验测试中心自主研发); NexION 300型电感耦合等离子体质谱(ICP-MS, 美国Perkin Elmer公司); LRH-GSI智能型人工气候箱(韶关市泰宏医疗器械有限公司); KQ-500DB型数控超声波清洗器; HR/T20M HR/T16M台式高速冷冻离心机(湖南赫西仪器装备有限公司)。
北方六级苜蓿种子(上海春茵草坪技术有限公司); CuSO4·5H2O(分析纯, 天津市光复科技有限公司); HNO3(BV-Ⅲ级)、HCl(优级纯)和H2O2(MOS级)均购自北京化学试剂研究所; 崩溃酶(Sigma公司); 三羟甲基氨基甲烷(Tris, 优级纯, 北京化学试剂公司); 十二烷基硫酸钠 (SDS, 化学纯, 国药集团化学试剂有限公司); CH3COONH4(分析纯, 国药集团化学试剂有限公司); Hoagland培养液配制使用的溶质有:KH2PO4、ZnSO4·7H2O、Na2-EDTA、FeSO4·7H2O、Ca(NO3)2·4H2O和H2MoO4(分析纯, 国药集团化学试剂有限公司); KNO3(分析纯, 北京红星化工厂); MgSO4·7H2O、H3BO3和MnCl2·4H2O CuSO4·5H2O(分析纯, 天津市光复科技有限公司)。
2.2 植物培养
选取颗粒大小一致的紫花苜蓿种子, 置于放有湿润滤纸的培养皿中, 并置于光照培养箱中萌发(温度25℃、相对湿度50%, 光照强度4000 Lx, 光照时间16 h)。待长出一对子叶时, 置于Hoagland培养液中培养两周左右。至长出第二片真叶时, 选取长势一致的植株, 移苗至浮标上, 在不同浓度梯度的Cu溶液中暴露一周。每个浓度下设3组重复, 每组19棵苗。收获的植株分为地下部分(根)和地上部分(茎叶), 用水清洗多次后, 用去离子水和超纯水分别清洗3次, 40 ℃干燥10 h后测干重, 分析Cu对苜蓿生长情况和生物量的影响。
用同样培养方法在1000 μmol/L Cu溶液中培养紫花苜蓿一周后收获, 分根茎叶进行不同器官Cu浓度总量分析和Cu不同结合形态的分步提取实验。另培养少数苜蓿, 发芽后立即用浮标移入Cu溶液(0、50和1000 μmol/L)中培养一周, 用于μ-XRF分析。
2.3 苜蓿根茎叶中Cu浓度测定
干燥后样品使用密闭高压釜在HNO3-H2O2体系中以150℃高温消解10 h。消解液经定容、稀释、过滤(0.45 μm滤膜)后, 采用ICP-MS测试Cu含量。使用的标准物质有GSB-1(大米)、GSB-3(玉米)和GSB-7(茶叶)。
2.4 苜蓿根茎叶中Cu的结合形态分布提取与分析
收获的植物鲜样干燥两天后, 用液氮(
Symbolm@@ 196℃)打破細胞壁后, 研磨成均质粉末。取50 mg于离心管中, 逐步用1 mL萃取液在超声池中(超声功率100%, 频率40 kHZ, 温度22℃)按以下顺序依次提取[20]:(1)10 mmol/L Tris-HCl(pH 7.4)用于提取细胞质和液泡中水溶性的Cu; (2)含2%崩溃酶的10 mmol/L Tris-HCl(pH 7.4)用于提取细胞壁中的Cu; (3)含1% SDS(十二烷基硫酸钠)的10 mmol/L Tris-HCl(pH 7.4)用于提取疏水蛋白质结合的Cu; (4)10 mmol/L CH3COONH4(pH 4.6)用于提取小分子有机酸结合的Cu; (5)过滤, 检测滤后残渣中的Cu。每步萃取时间1 h, 萃取液冰浴10 min后, 4℃、15000 r/min高速冷冻离心15 min, 取上清液在相同条件下再次离心。所得四步的提取液用0.45 μm滤膜过滤, 在4℃放置片刻消除泡沫后, 用ICP-MS测定提取液中的Cu含量, 最后一步所得残渣经HNO3-H2O2消解后, 再用ICP-MS测定Cu含量。
2.5 苜蓿幼苗中Cu的原位微区分布测定
用原位微区X射线荧光光谱仪(μ-XRF)[21]分别对3种不同Cu浓度暴露下的苜蓿幼苗进行原位微区扫描, 通过毛细管聚焦技术将X射线聚焦成微束级别, 激发样品后得到样品中的元素特征X射线, 并使用Si漂移探测器探测荧光信号, 以实现对样品微小区域的元素相对含量信息的分析[22]。仪器最小光斑可达18 μm, 用于谱峰识别的单点采谱时间为60 s。用于样品微区扫描的参数设定为:电压47.0 kV, 电流0.799 mA, 步长80 μm(1000 μmol/L Cu的幼苗采谱步长为50 μm), 每点采谱时间为5 s。
3 结果与讨论
3.1 Cu胁迫对苜蓿生长情况的影响
随着Cu浓度递增, 苜蓿生长受到的胁迫也逐渐增加。在50 μmol/L Cu培养下, 苜蓿开始出现部分植株矮小, 叶片萎黄, 侧根减少等现象。植物叶片变黄是受重金属胁迫下叶绿体被破坏、光催化反应受损的典型症状[23]。Printz等[17]发现, 0.30 ~3.0 μmol/L Cu是紫花苜蓿最佳生长条件, Cu浓度超过3.0 μmol/L, 苜蓿开始产生毒害效应; 10 μmol/L Cu暴露下就可观察到叶片变黄的现象; 在1000 μmol/L Cu暴露下, 紫花苜蓿几乎没有侧根发育, 且其主根较空白组变得细软轻飘, 但并未致死, 表现出紫花苜蓿对Cu的良好耐性。
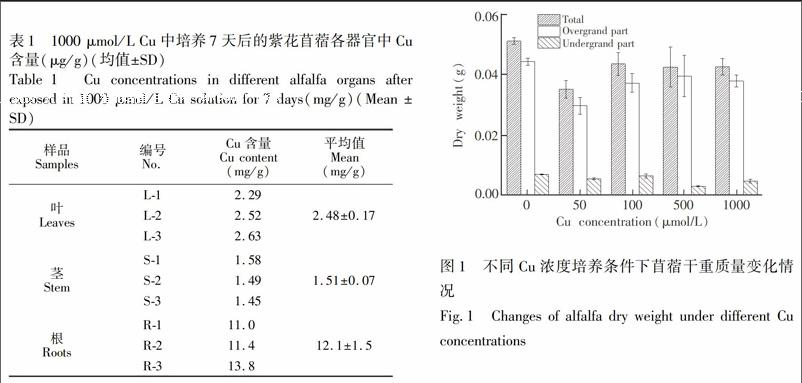
Cu的胁迫不仅影响植物叶片生理状态, 还影响植物的生物量(图1)。苜蓿干重随Cu浓度的增加呈先下降后升高随后维持相对稳定的特征。苜蓿地上部变化曲线与总量基本相同的现象与紫花苜蓿总生物量的变化主要受地上部生物量的变化影响的报道一致[24]。50 μmol/L Cu暴露下, 苜蓿整体生物量显著下降了31.4%, 表明50 μmol/L Cu很大程度上抑制了苜蓿的生长和新陈代谢。但在50~1000 μmol/L Cu胁迫期间, 苜蓿干重呈回升趋势, 并维持平稳。由此推测, 可能在超过50 μmol/L Cu胁迫时苜蓿体内开始形成某种Cu的特殊耐受机制, 抵制了重金属的进一步毒害作用, 以维持其相对正常的生长。
3.2 苜蓿对Cu的吸收富集能力
苜蓿对Cu有较强的积累能力, 其根部是积累富集Cu的主要场所, 减少了Cu对苜蓿地上部各器官的毒害[8]。由表1可见, 1000 μmol/L Cu中培养1周后的紫花苜蓿各器官中Cu积累量为根>叶>茎。结果显示苜蓿根部是主要积累Cu的部位, 其积累量达到12.1 mg/g, 积累浓度是茎的8倍, 叶的4.9倍。苜蓿表现出对铜的高度富集能力。Wang等[8]发现100 μmol/L Cu溶液培养7天后, 苜蓿中Cu含量即达到4.42 mg/g; Flores-Caceres[9]实验发现半水培15天后的苜蓿在100 μmol/L Cu溶液培养7天后, 其根中Cu积累量为410 μg/g, 是嫩枝的19倍、空白组的5倍。以上实验结论与本实验相近, 都显示紫花苜蓿具有高Cu耐受性, 且主要在根中积累解毒, 其次在叶和茎中少量积累以减少毒害效应。
3.3 苜蓿中Cu的原位微区分布
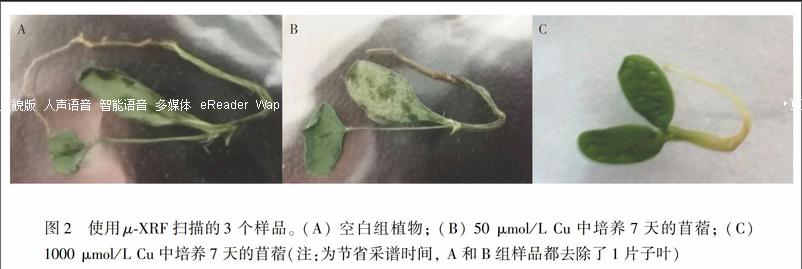
毒性元素侵害植物主要有叶、茎和根3条途径, 其中根是最主要的途径[25]。μ-XRF是研究元素微区分布特征的重要手段, 因此, 本研究采用μ-XRF研究苜蓿对Cu的吸收。刚发芽的紫花苜蓿幼苗用浮标分别移入3个不同浓度梯度的Cu暴露液中, 7天后植株的生长状态如图2所示, 50 μmol/L Cu中暴露7天的苜蓿幼苗与空白组均已生长出真叶, 1000 μmol/L Cu培养7天后明显抑制了植物真叶的生长, 取样时仍为无真叶的子叶状态。
由于根中Cu含量最高, 故將50 μmol/L Cu暴露下的苜蓿根进行μ-XRF单点能谱分析, 确认感兴趣区的圈定范围及元素特征谱线识别, 由图3可见, 苜蓿根中显示了明显的CuKα特征峰。
苜蓿中的微区分布信息(图4)显示, 过量Cu胁迫时, 苜蓿根部富集大量Cu。空白组反映了Cu作为紫花苜蓿必需营养元素吸收和输送时的分布状态, 即根茎叶中的Cu含量相当, 且存在明显的Cu连续分布区域, 地上部子叶边缘处Cu含量也较多。50和1000 μmol/L Cu暴露下的苜蓿均表现出根尖向上浓度逐渐增加, 在根与茎的交接处达到Cu积累峰值的特征, 而苜蓿茎叶中Cu含量相对较少。表明受Cu胁迫的苜蓿主要通过根部富集, 且在根与茎的交界处形成屏障, 实现抑制过量Cu向上运输, 从而减轻了对地上部分的毒害。
过量Cu不仅影响植物本身的Cu输送和代谢平衡, 还影响了植物对其它元素的吸收。本研究表明, Cu过量明显抑制苜蓿对Zn和Ca的向上输送, 但增加了植株对Fe的吸收, 而对K和Mn的吸收的影响不明显。 不同植物物种对Fe和Zn的吸收受Cu胁迫的影响并不一致, 但过量Cu会破坏Ca2+从植物根向茎的传输[26]。K+由于在植物中以离子态存在且具有较强移动性[27], 因而受Cu胁迫的影响不大。
3.4 紫花苜蓿细胞中Cu的结合形态特征
苜蓿各器官中Cu的结合形态是了解其耐受和解毒机理的关键。根茎叶分步提取结果(图5)表明, 苜蓿根部显著富集大量的Cu, 抑制其向地上部迁移, 减缓了重金属对地上部的毒害作用, 这与前面的结论一致。 在各个器官中Cu结合形态存在差异, 根中Cu在残渣态中含量最高, 细胞壁结合态、水溶态和蛋白质结合态次之, 且含量相当; 茎中Cu在4种结合态中的含量差异不大; 叶中Cu在水溶态和残渣态中含量最高, 其次分别是细胞壁结合态和蛋白质结合态。根茎叶中有机酸结合态的Cu含量均为最少, 说明小分子有机酸在紫花苜蓿对Cu耐性作用中不发挥主要作用。
植物根中细胞壁以及胞间层是吸收重金属的主要场所[17], 细胞质[28]、细胞质膜和根中小囊泡[29]能区隔存储重金属。实验数据显示根部主要的解毒方式为将Cu转化为残渣态, 从而与生命代谢过程相对隔离; 茎里主要为细胞间质和液泡中储存的水溶态Cu, 多余的Cu也可以在茎中形成细胞壁结合态; 叶中过量的Cu部分主要存在于细胞间质和液泡中, 另一部分形成难溶的沉淀与生命代谢过程相对隔离。有研究者对Cd胁迫下的模式植物拟南芥用同样方法进行分步提取[20]发现, 根中水溶态Cd比例最高(46%), 叶中水溶态Cd含量最高(58%), 这也显示了不同植物种属对元素的耐受性和解毒行为的差异。植物中Cu结合形态的分步提取技术提供了Cu在苜蓿各器官内的分布信息, 为揭示苜蓿对Cu吸收转运机制提供了重要信息。
4 结 论
不同Cu浓度胁迫下苜蓿生长情况的实验表明, 过量Cu会抑制植物生长, 但并不致死, 苜蓿表现出一定的重金属Cu耐受性。原位微区和消解测定苜蓿各器官Cu浓度的实验表明, 苜蓿主要在根部积累大量Cu, 减少向上运输, 从而抵制Cu胁迫带来危害。根部主要通过形成难溶的残渣态和细胞壁螯合态实现对过量Cu的固定, 且大量储存于根茎分界点处; 部分可以通过植株根茎分界处进入向上输送过程的Cu, 在茎中进一步通过与细胞壁或疏水蛋白质结合, 形成残渣态, 以水溶态形式停留于液泡, 降低向上输送量; 叶中Cu主要区隔在液泡中, 形成难溶残渣态储存, 以降低毒性。过量的Cu明显抑制了植物对Zn和Ca的向上吸收, 增强了Fe的吸收, 对K和Mn等元素的吸收影响较小。未来还需要借助多种形态分析手段深入探究Cu在苜蓿体内具体的结合形态、在根茎叶亚细胞中的分布及含量。
References
1 Li Y, Wang H, Wang H, Yin F, Yang X, Hu Y. Environ. Sci. Pollut. Res., 2014, 21(21): 12569-12582
2 Li Z, Ma Z, van der Kuijp T J, Yuan Z, Huang L. Sci. Total Environ., 2014, s468-469: 843-853
3 SUN Peng, LI Yan-Wei, ZHANG Lian-Ke, LI Yu-Mei, WANG Wei-Da, YU Wei-Jia. Rock Miner. Anal., 2016, 35(4): 433-439
孙 鹏, 李艳伟, 张连科, 李玉梅, 王维大, 余维佳. 岩矿测试, 2016, 35(4): 433-439
4 Cohu C M, Pilon M. Cell Biology of Copper. Springer Berlin Heidelberg, 2010: 55-74
5 HU Guo-Liang, ZHANG Cai-Ying. Biol. Disast. Sci., 2012, (1): 99-102
胡国良, 张彩英. 生物灾害科学, 2012, (1): 99-102
6 GAO Mei-Jiao, JIN Ling, GUO Xiao-Rui. Open J. Nat. Sci., 2014, 02(2): 18-23
高媚娇, 金 玲, 郭晓瑞, 自然科学, 2014, 02(2): 18-23
7 He J, Ji Z X, Wang Q Z, Liu C F, Zhou Y B. Ecol. Eng., 2016, 87: 102-109
8 Wang S H, Zhang H, Zhang Q, Jin G M, Jiang S J, Jiang D, He Q Y, Li Z P. J. Agron. Crop. Sci., 2011, 197(6): 418-429
9 Flores-Caceres M L, Hattab S, Hattab S, Boussetta H, Banni M, Hernandez L E. Plant.Sci., 2015, 233: 165-173
10 DING Ke-Qiang, LUO Yong-Ming. J. Agro. Environ. Sci., 2005, 24(4): 766-770
丁克强, 骆永明. 农业环境科学学报, 2005, 24(4): 766-770
11 WANG Wen-Xing, CAO Cheng-You, CUI Zhen-Bo, XU Shu-Kun. J. Northeast. Univ. (Nat. Sci.), 2006, 27(10): 1161-1164
王文星, 曹成有, 崔振波, 徐淑坤. 东北大学学报: 自然科学版, 2006, 27(10): 1161-1164
12 Zhang H, Xia Y G, Shen Z. Planta, 2008, 227(2): 465-475
13 WANG Rui-Gang, TANG Shi-Rong, GUO Jun-Kang, ZHAO Yu-Jie,SONG Zheng-Guo. Ecol. Environ. Sci., 2010, 19(12): 2922-2928
王瑞刚, 唐世荣, 郭军康, 赵玉杰, 宋正国. 生态环境学报, 2010, 19(12): 2922-2928
14 FU Chuan, YU Shun-Hui, HUANG Yi-Min, DENG Hong-Ping. Acta Ecol. Sin., 2014, 34 (5): 1149-1155
付 川, 余顺慧, 黄怡民, 邓洪平. 生态学报, 2014, 34(5): 1149-1155
15 Wang X j, Song Y, Ma Y h. Environ. Pollut., 2011, 159(12): 3627-3633
16 YE Chun-He. Soil Environ. Sci., 2002, 11(4): 331-334
叶春和. 土壤与环境, 2002, 11(4): 331-334
17 Printz B, Guerriero G, Sergeant K, Audinot J N, Guignard C, Renaut J, Lutts S, Hausman J F. Plant Cell Physiol., 2016, 57(2): 407-422
18 Rauwolf M, Turyanskaya A, Roschger A, Prost J, Simon R, Scharf O, Radtke, M, Schoonjans, T, Guilherme, Buzanich A, Klaushofer K. J. Synchrotron Radia., 2017, 24(1): 307-311
19 Singh A, Luening K, Brennan S, Homma T, Kubo N, Nowak S H, Pianetta P. Iucr. J.Synchrotron Radia., 2017, 24(1): 283-287
20 Poe-Pawlak K, Ruzik R, Abramski K, Ciurzyska M, Gawrońska H. Anal. Chim. Acta, 2005, 540(1): 61-70
21 LUO Li-Qiang, SHEN Ya-Ting, MA Yan-Hong, XU Tao, CHU Bin-Bin, ZENG Yuan, LIU Jian. Spectrosc. Spect. Anal., 2017, 37(4): 1003-1008
罗立强, 沈亚婷, 马艳红, 许 涛, 储彬彬, 曾 远, 柳 检. 光谱学与光谱分析, 2017, 37(4): 1003-1008
22 LUO Li-Qiang. X-Ray Fluorescence Spectrometry. Beijing: Chemical Industry Press, 2008: 30
罗立强. X射线荧光光谱仪. 北京: 化学工业出版社,2008: 30
23 Bernal M, Ramiro M V, Cases R, Picorel R, Yruela I. Physiol. Plantarum., 2006, 127(2): 312-325
24 YUAN Min, TIE Bo-Qing, TANG Mei-Zhen, SUN Jian. Acta Pratacul. Sin., 2005, 14(6): 57-62
袁 敏, 铁柏清, 唐美珍, 孙 健. 草业学报, 2005, 14(6): 57-62
25 LIU Jian, LUO Li-Qiang. Rock Miner. Anal., 2015, 34(3): 269-277
柳 檢, 罗立强. 岩矿测试, 2015, 34(3): 269-277
26 Maksymiec W, Baszyński T. Acta Physiol. Plant., 1998, 20(4): 411-417
27 Shen Y T. X-Ray Spectrom., 2014, 43(3): 146-151
28 Wojas S, Hennig J, Plaza S, Geisler M, Siemianowski O, Skodowska A, Ruszczyn'ska A, Bulska E, Antosiewicz D M. Environ. Pollut., 2009, 157(10): 2781-2789
29 Najmanova J, Neumannova E, Leonhardt T, Zitka O, Kizek R, Macek T, Mackovaa M, Kotrba P. Ind. Crop. Prod., 2012, 36(1): 536-542
