乳腺癌新辅助化疗疗效评价方法的相关研究
2017-08-07牛海刚郭建平朱福义赵宏耀侯志刚田晓爱
牛海刚,郭建平,朱福义,赵宏耀,侯志刚,田晓爱
(1山西医科大学汾阳学院外科学教研室,汾阳 032200;2山西省汾阳医院普外科;3山西省汾阳医院病理科;*通讯作者,E-mail:n965401@163.com)
乳腺癌新辅助化疗疗效评价方法的相关研究
牛海刚1*,郭建平2,朱福义2,赵宏耀2,侯志刚2,田晓爱3
(1山西医科大学汾阳学院外科学教研室,汾阳 032200;2山西省汾阳医院普外科;3山西省汾阳医院病理科;*通讯作者,E-mail:n965401@163.com)
目的 探讨乳腺癌术前临床结合病理评价新辅助化疗的效果。 方法 52例患者接受2个周期多西他赛、表柔比星、环磷酰胺(TAC)方案化疗,然后行乳房超声波检查的临床评价,临床评价无效的病例在超声波引导下行空芯针穿刺乳房病灶获取病理组织行病理评价,分析全部患者临床评价与术前临床结合病理评价的差异。全部病例继续TAC新辅助化疗2周期后行临床评价,全部病例行改良根治术,术后获得病理组织行病理评价。新辅助化疗4个周期后,分析全部患者临床评价与术后病理评价之间的差异。 结果 2个周期新辅助化疗后,临床评价有效29例,术前临床结合病理评价40例,临床结合病理评价的效果与临床评价的效果比较两者之间差异有统计学意义(P<0.05);全部患者经4个周期新辅助化疗后,病理完全缓解与临床完全缓解的一致率为62.8%。 结论 术前临床结合病理评价能更能准确反映新辅助化疗的效果,有可能作为选择新辅助化疗方案的依据之一。
乳腺癌; 新辅助化疗; 临床评价; 病理评价
乳腺癌新辅助化疗(neoadjuvant chemotherapy,NAC)是指诊断为乳腺癌患者在手术前先用细胞毒药物进行的治疗,到临床评价化疗无效时行手术治疗。NAC开始是治疗丧失手术机会的乳腺癌患者,逐步发展到今天已广泛应用到临床Ⅱ、Ⅲ期的乳腺癌患者。手术前化疗,如果临床评价化疗有效,肿瘤可缩小降期,原先判断不可手术的可行手术治疗;同时通过肿瘤病灶的变化可判断选择的化疗药物是否有效,为乳腺癌手术后继续化疗提供选择药物的依据,有研究显示新辅助化疗后如果病灶能达到病理完全缓解,患者远期生存率可得到提高[1]。而对新辅助化疗效果的判断的指标有术前临床评价和术后病理评价。术前临床评价是采用影像仪器测量新辅助化疗后肿瘤体积的变化。乳房肿瘤经新辅助化疗后退缩模式不一导致术前临床评价与术后病理学评价不完全相符,部分患者不能获得最佳的新辅助化疗效果。因此,单纯依据临床评价对新辅助化疗疗效进行判断有效率欠佳,当临床评价新辅助化疗无效或进展时,停止化疗,行乳腺癌改良根治术获取肿瘤组织做病理评价再次判定新辅助化疗的疗效。本研究旨在探索在手术前获取病理学资料与临床评价相结合,是否能更有效显示新辅助化疗疗效。
1 资料与方法
1.1 研究对象
收集2014-05~2016-05山西省汾阳医院普通外科乳腺病区52例Ⅱ-Ⅲ期单侧原发性乳腺癌患者,女性,27-69岁,中位年龄54岁。入组时未行有关乳腺癌的放疗、化疗及内分泌,病灶影像学可测,无化疗禁忌证。依据美国癌症联合会(AJCC)乳腺癌第7版进行分期,新辅助化疗前经全身骨扫描和胸腹部CT排除肺、脑、肝、骨转移。入组患者的基本临床资料见表1。
表 1 乳腺癌患者52例新辅助化疗前的临床资料
Table 1 Clinical data of 52 patients with breast cancer before neoadjuvant chemotherapy
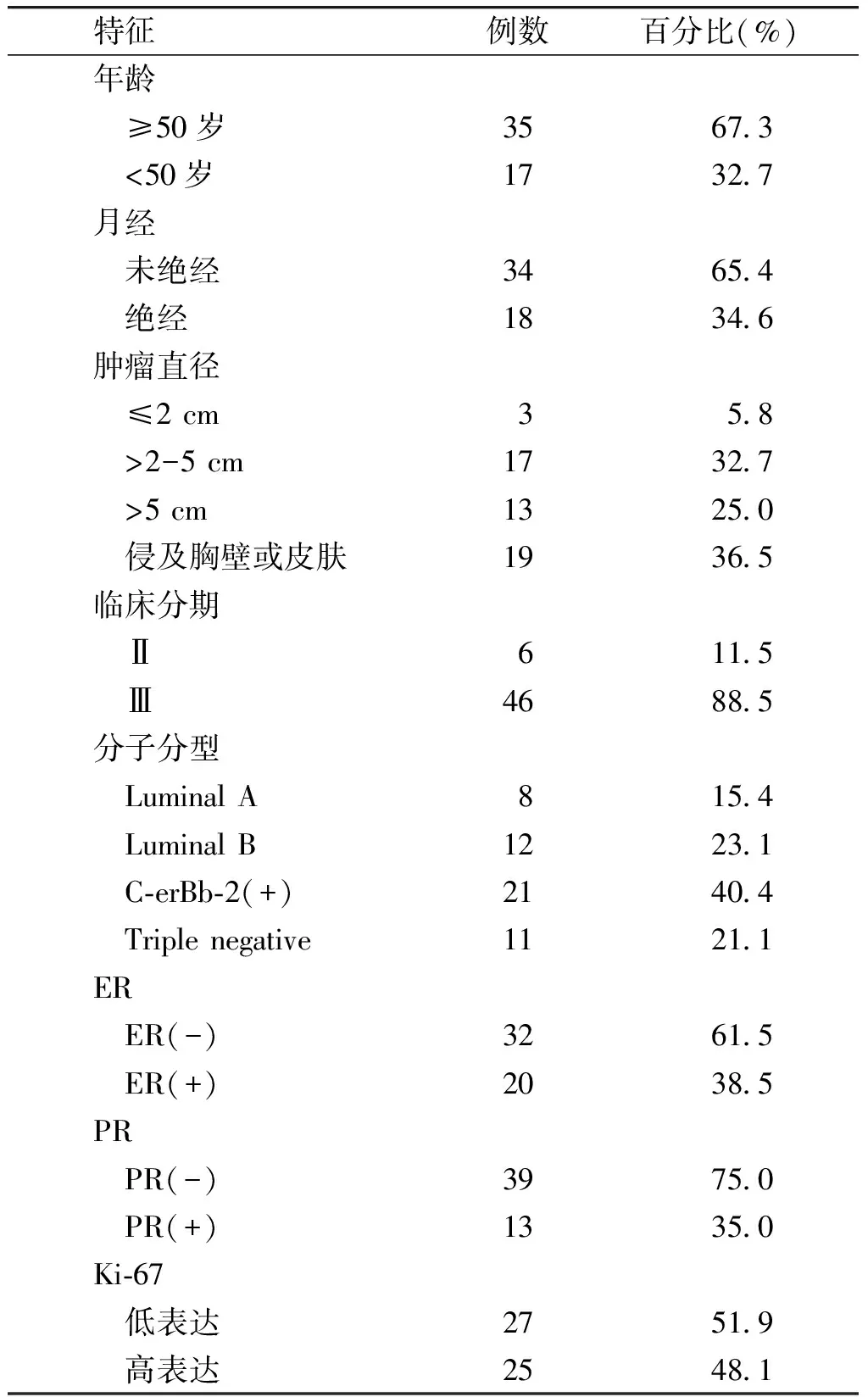
特征例数百分比(%)年龄 ≥50岁35673 <50岁17327月经 未绝经34654 绝经18346肿瘤直径 ≤2cm358 >2-5cm17327 >5cm13250 侵及胸壁或皮肤19365临床分期 Ⅱ6115 Ⅲ46885分子分型 LuminalA8154 LuminalB12231 C⁃erBb⁃2(+)21404 Triplenegative11211ER ER(-)32615 ER(+)20385PR PR(-)39750 PR(+)13350Ki⁃67 低表达27519 高表达25481
1.2 研究方法
1.2.1 术前临床评价 患者开始新辅助化疗前先经乳房超声波评价肿瘤情况,化疗2个周期后再评价一次。临床评价采用WHO的标准[2]。临床完全缓解(CR):肿瘤病灶完全消失;临床部分缓解(PR):化疗后测得肿瘤病灶垂直的两条最长径乘积减少≥50%;病情稳定(SD):两径乘积减少<50%,或增加≤25%;疾病进展(PD):肿瘤病灶垂直的两条最长径乘积增加>25%或出现新的肿瘤病灶。临床总有效率(OR)=CR+PR。
1.2.2 标本采集 化疗前采集标本:新辅助化疗前,在超声波引导下对全部患者用美国巴德(Bard)公司的空芯活检枪(直径1.8 mm)行空芯针穿刺肿瘤,获得肿瘤标本,10%中性福尔马林溶液固定,对肿瘤标本行细胞病理学及免疫组化检测,以确定肿瘤细胞形态及分子分型。
乳腺癌改良根治术前采集标本:经2个周期新辅助化疗后,经乳房超声临床评价为SD的病例在超声波引导下再次使用空芯穿刺肿瘤病灶,每个病灶取标本,固定,显微镜下观察肿瘤细胞的变化做病理评价,将临床与病理结合进行新辅助化疗疗效评价。
术后采集标本:经4个周期新辅助化疗后,全部患者行乳腺癌改良根治术,在切除的乳房内找到肿瘤病灶部位,取肿瘤组织,固定,行病理评价。
1.2.3 病理评价 病理完全缓解(pCR):新辅助化疗后肿瘤病灶显微镜下观察肿瘤区、腋窝淋巴结无癌细胞或存留导管原位癌,无远位其他部位转移。
病理化疗反应分级:依据Miller-Payne(MP)分级系统评价[3]。1级(G1),肿瘤细胞总数无变化;2级(G2),肿瘤细胞总数减少≤30%;3级(G3),肿瘤细胞总数减少30%-90%;4级(G4),肿瘤细胞基本消失,肿瘤细胞总数减少≥90%;5级(G5),肿瘤细胞完全消失,但导管原位癌(DCIS)可以存在。G4+G5为显著有效,G1+G2+G3为反应轻微或无效。
1.2.4 新辅助化疗方案 多西他赛75 mg/m2,d1,表柔比星100 mg/m2,d1,环磷酰胺500 mg/m2,d1;每3周为1周期。每次化疗结束后检查血细胞,了解各种细胞分类的变化,如果患者出现中性粒细胞减少症,对症治疗。
1.3 统计学方法
所有试验数据使用SPSS20.0软件处理,计数资料采用χ2检验,资料方差不齐时采用Mann-Whitney检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2个周期新辅助化疗后临床评价与临床病理评价的比较
52例乳腺癌患者行2个周期新辅助化疗后,CR 3例占5.8%,PR 26例占50.0%,SD 23例占44.2%,PD 0例,临床评价有效率(CR+PR)55.8%。临床评价SD患者再次行活检穿刺,病理化疗分级MP4-5 11例,MP1-3 12例。临床评估与病理化疗分级相结合新辅助化疗有效率(CR+PR+MP4-5)76.9%。2个周期新辅助化疗结束后,临床评价与临床结合病理评价的结果不同,且两者间差异有统计学意义(P<0.05,见表2)。
表 2 2周期新辅助化疗临床评价和临床病理评价结果
Table 2 Results of efficacy of neoadjuvant chemotherapy evaluated by clinical and clinical-pathological evaluation after 2-cycle treatment
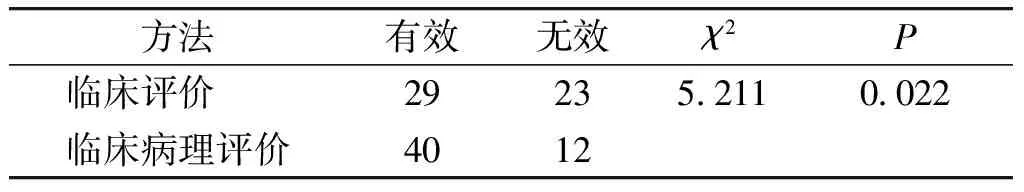
方法有效无效χ2P临床评价 292352110022临床病理评价4012
2.2 新辅助化疗2个周期与4个周期临床评价的比较
52例患者全部行新辅助化疗4个周期后,CR 5例为9.6%,PR 35例为67.3%,SD 12例为23.1%,PD 0例,临床评估有效率(CR+PR)为76.9%。4个周期与2个周期经临床评价的新辅助化疗疗效差异有统计学意义(P<0.05,见表3)。
表 3 不同周期新辅助化疗后临床变化
Table 3 Clinical changes after different cycles of neoadjuvant chemotherapy
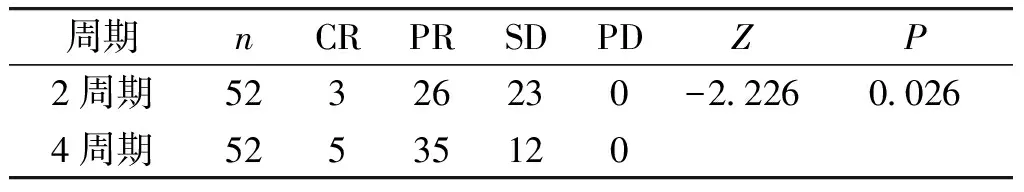
周期nCRPRSDPDZP2周期52326230-222600264周期52535120
2.3 4个周期新辅助化疗后病理完全缓解与临床完全缓解的比较
接受4个周期新辅助化疗的52例乳腺癌患者,全部行乳腺癌改良根治术,经显微镜观察所有肿瘤组织病理学化疗反应情况,1级7例(13.4%),2级10例(19.2%),3级14例(26.9%),4级9例(17.3%),5级12例(23.1%)。病理评价有效率40.4%,较临床评价有效率降低。乳腺癌改良根治术后5例患者获得临床完全缓解,其中3例病理完全缓解,2例病理未完全缓解。乳腺癌改良根治术后12例患者获得病理完全缓解,其中3例临床完全缓解,9例临床未完全缓解(见表4)。临床缓解与病理缓解符合率为62.8%。
表 4 乳腺癌改良根治术后临床评价与病理评价的对比
Table 4 Comparison of clinical efficacy between clinical and pathological evaluation

临床评价病理评价完全缓解未完全缓解合计完全缓解 325未完全缓解93847合计124052
3 讨论
局部晚期乳腺癌不能行手术治疗的选择化疗,逐步发现部分患者经化疗后具备行手术治疗的条件,可获得更好的疗效。故将在手术前先化疗方法称为新辅助化疗。随着人们对新辅助化疗研究及临床实践的不断探索,将新辅助化疗逐步用于可能手术且需要化疗的病例。
现在,临床医师通常采用临床评价系统来判定新辅助化疗疗效,临床评价系统有WHO标准和RECIST标准。WHO标准是计算乳房肿瘤病灶两个最长直径乘积的变化作为评价新辅助化疗疗效的方法。而RECIST则以肿瘤病灶的最长径之和来评价肿瘤的大小[2]。两者都与肿瘤体积相关,测量肿瘤体积的方法有超声、MRI等。杨涛等[3]研究MRI三维重建可更高预测肿瘤退缩的模式。自动乳腺全容积成像是通过三维立体超声来显现成像,但不能对化疗后肿瘤残留、纤维化导致的立体形态未变而肿瘤细胞减少作出鉴别[4]。
有研究证实乳腺癌患者接受新辅助化疗后达到pCR较未达pCR者可获得更长的生存获益[5]。故临床医师认为病理完全缓解可作为评价接受新辅助化疗的乳腺癌患者预后的独立预测指标。研究发现乳腺癌新辅助化疗有效率可高达60%-90%[6],甚至20%的患者可达到病理完全缓解[7],但大约10%-35%的患者却会出现化疗药物耐受,甚至会在新辅助化疗期间肿瘤细胞不受化疗药物影响而扩增展[8,9],从而失去了通过早期手术局部控制病情的机会。
目前判定乳腺癌新辅助化疗确切疗效的金标准是行乳腺癌改良根治术后的病理评价。包括NSABP B-18临床试验的分级系统[10]与Miller-Payne分级系统(Miller-Payne grading system)[11]。NSABP B-18临床试验依据肿瘤对化疗药物反应情况分为3类:肿瘤病理完全缓解、病理部分缓解以及无病理反应。M-P分级系统是依据肿瘤细胞对化疗药物反应情况分为5个级别。MP分级中的5级等同于NSABP B-18中的完全病理缓解(tpCR)。乳腺癌患者肿瘤细胞对使用的细胞毒药物表现出敏感和不敏感。对药物敏感的肿瘤细胞,新辅助化疗可使肿瘤分期迅速降期,甚至获得病理完全缓解。NSABP B-18试验发现接受新辅助化疗后手术与先手术再行辅助化疗的两者乳腺癌患者对比,他们总的生存获益差异无统计学意义[12,13],而新辅助化疗后能达到病理完全缓解的乳腺癌患者较病理未完全缓解的具有较高OS和DFS率。
目前评价乳腺癌新辅助化疗疗效的主要指标是临床评价及乳房术后病理评价。乳房手术前临床评价是反映新辅助化疗后乳房肿瘤病灶大小变化的,受检查手段影响易出现偏差,不足以反映肿瘤细胞新辅助化疗后的真实情况,而现在临床上使用的病理评价常需要行乳房手术后获得肿瘤组织标本,可能使部分敏感的尚未达到病理完全缓解的患者停止继续新辅助化疗而失去病理完全缓解的机会,而影响生存受益。寻找能更有效评价新辅助化疗疗效的方法是该新辅助化疗目前研究的热点之一。
乳腺癌肿瘤病灶经化疗药物作用后,会出现“向心性退缩”和“筛状”或“蜂巢状”退缩[14]。“筛状”或“蜂巢状”退缩的特点是肿瘤病灶大体形态变化与其内部肿瘤细胞减少不协同,导致术前临床评价与术后病理评价不一致。本研究中在术前采用穿刺针穿刺活检获取病理信息,再结合临床一起评价新辅助化疗疗效,可发现更多的化疗有效的病例。空芯穿刺针活检术因其使用便捷临床已被广大医师接受。本试验中化疗2个周期后临床评价CR及PR的属于临床评价有效,可继续行新辅助化疗,未行穿刺。SD中因肿瘤退缩模式的因素可能存在化疗有效的,行穿刺活检行病理评价,可能有助于部分病例获得继续新辅助化疗机会。
本文通过对临床评估SD患者采用穿刺活检获取病理学资料来探索更有效的新辅助化疗疗效评估方法,仅对SD组行病理学评价,未对CR、PR组行病理学评价,未能了解这两组的病理学变化,不能完整反映2周期新辅助化疗病理变化情况,以后将对临床评估、PD行进一步研究。空芯针穿刺活检因取材有限是否与手术后病理变化一致还有待进一步研究。
[1] Rastogi P, Anderson SJ,Bear HD,etal.Preoperative chemotherapy:updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-l 8 and B-27[J].J Clin Oncol,2008,26(5):778-785.
[2] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2015版)[J].中国癌症杂志,2015,25(9):692-754.
[3] 杨涛,张朝蓬,刘广,等.MRI三维评价乳腺癌新辅助化疗后残余肿瘤范围的准确性[J].中华外科杂志,2015,53(4):280-284.
[4] 李云凌,赵斌,冯鑫至.乳腺摄影与超声弹性成像对乳腺疾病诊断的对比性研究[J].医学影像学杂志,2010,20(10):1452-1455.
[5] Alfredo B,Vito A.Pathologic complete response as a potential surrogate for the clinical outcome in patients with breast cancer after neoadjuvant therapy:a meta-regression of 29 randomized prospective studies[J].J Clin Oncol,2014,32(34):3883-3891.
[6] Fisher B,Bryant J,Wolmark N,etal.Effect of preoperative chemotherapy on the outcome of women with operable breast cancer[J].J Clin Oncol,1998,16(8):2672-2685.
[7] Colleoni M, Goldhirsch A. Neoadjuvant chemotherapy for breast cancer:any progress[J]? Lancet Oncol,2014,15(2):131-132.
[8] VonMG,Raab G,CaPuto A,etal.Doxorubicin with cyclophosphamide followed by docetaxel every 21 days compared with doxorubicin and docetaxel every 14 days as preoperative treatment in operable breast cancer:the GEPARDUO study of the German Breast Group[J].J Clin Oncol,2005,23(12):2676-2685.
[9] Bear HD,Anderson S,Brown A,etal.The effect on tumor response of adding sequential preoperative docetaxel to preoperative doxorubicin and cyclophosphamide:preliminary results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27[J].J Clin Oncol,2003,21(22):4165-4174.
[10] Wolmark N,Wang J,Mamounas E,etal.Preoperative chemotherapy in patients with operable breast cancer:nine-year results from National Surgical Adjuvant Breast and Bowel Project B-18[J].J Natl Cancer Inst Monogr,2001,(30):96-102.
[11] Ogston KN,Miller ID,Payne S,etal.A new histological grading system to assess response of breast cancers to primary chemotherapy:prognostic significance and survival[J].Breast,2003,12(5):320-327.
[12] Mieog JS,van der Hage JA,van de Velde CJ. Preoperative chemotherapy for women with operable breast cancer[J].Cochrane Database Syst Rev, 2007,(2):CD005002.
[13] Kong X,Moran MS,Zhang N,etal. Meta-analysis confirms achieving pathological complete response after neoadjuvant chemotherapy predicts favourable prognosis for breast cancer patients[J].Eur J Cancer,2011,47:2084-2090.
[14] van der Hage JA,Comelis JH,van de Velde CJ,etal.Preoperative chemotherapy in primary operable breast cancer:results from the European Organization for Research and Treatment of Cancer trial 10902[J].J Clin Oncol,2001,19:4224-4237.
Study on efficacy evaluation of neoadjuvant chemotherapy for breast cancer
NIU Haigang1*,GUO Jianping2,ZHU Fuyi2,ZHAO Hongyao2,HOU Zhigang2,TIAN Xiaoai3
(1DepartmentofGeneralSurgery,FenyangCollegeofShanxiMedicalUniversity,Fenyang032200,China;2DepartmentofGeneralSurgery,ShanxiProvincialHospital;3DepartmentofPathology,ShanxiProvincialHospital;*Correspondingauthor,E-mail:n965401@163.com)
ObjectiveTo explore the clinical-pathologic evaluation of the efficacy of neoadjuvant chemotherapy for breast cancer before operation.MethodsAll 52 patients
two cycles of docetaxel, epirubicin and cyclophosphamide(TAC) chemotherapy. The efficacy of neoadjuvant chemotherapy was clinically assessed using ultrasound examination. Then the patients with stable disease(SD) underwent ultrasound-guided core needle biopsy to evaluate the pathological changes. The efficacy between clinical evaluation before surgery and clinical-pathological evaluation system was compared. After another two cycles of TAC chemotherapy, all patients were clinically evaluated, and the pathological changes after modified radical mastectomy of breast cancer were evaluated after surgery. The efficacy between clinical evaluation after surgery and pathological evaluation system was compared.ResultsAfter two cycles chemotherapy, 29 cases were effective by clinical evaluation, and 40 cases were effective by clinical-pathological evaluation. The efficacy was statistically different between two evaluation methods(P<0.05). After four cycles chemotherapy, the agreement rate between complete pathological response and complete clinical response was 62.8%.ConclusionThe clinical-pathological evaluation may more accurately reflect the efficacy of neoadjuvant chemotherapy, and it may be used as a basis for the selection of neoadjuvant chemotherapy plans.
breast cancer; noadjuvant chemotherapy; clinical evaluation; pathological evaluation
吕梁市科技攻关计划基金资助项目(2015sf52)
牛海刚,男,1976-01生,硕士,讲师,E-mail:n965401@163.com
2017-04-14
R737.9
A
1007-6611(2017)07-0733-04
10.13753/j.issn.1007-6611.2017.07.021
