microRNA-211在脑胶质瘤中的表达及其与临床病理预后的关系
2017-08-07梅喜平邵碧波袁利学冯辉斌
梅喜平,郑 鲲,邵碧波,袁利学,冯辉斌*
(1鄂东医疗集团黄石市中心医院,湖北理工学院附属医院重症医学科,黄石 435000;2鄂东医疗集团黄石市中心医院,湖北理工学院附属医院肾脏疾病发生与干预湖北省重点实验室;*通讯作者,E-mail:fhb1022hs@sina.com)
microRNA-211在脑胶质瘤中的表达及其与临床病理预后的关系
梅喜平1,2,郑 鲲1,2,邵碧波1,2,袁利学1,2,冯辉斌1,2*
(1鄂东医疗集团黄石市中心医院,湖北理工学院附属医院重症医学科,黄石 435000;2鄂东医疗集团黄石市中心医院,湖北理工学院附属医院肾脏疾病发生与干预湖北省重点实验室;*通讯作者,E-mail:fhb1022hs@sina.com)
目的 探讨胶质瘤组织中microRNA-211(miR-211)的表达及其在预测胶质瘤患者预后中的价值。 方法 qRT-PCR法检测52例神经胶质瘤组织以及12例正常脑组织中miR-211的表达水平,分析其与胶质瘤患者临床病理特征及其预后之间的关系。 结果 胶质瘤组织中miR-211的表达水平(0.41±0.24)明显低于正常脑组织(1.00±0.13,P<0.001),并且与WHO分级呈负相关趋势(WHO Ⅲ-Ⅳ,0.21±0.14vsWHO Ⅰ-Ⅱ,0.60±0.18,P=0.016)。胶质瘤组织中miR-211的表达水平与WHO分级和KPS评分密切相关,而与患者年龄、性别、肿瘤位置、肿瘤直径等均无关。miR-211高表达组患者的生存率明显高于miR-211低表达组,差异有统计学意义(P=0.037)。胶质瘤的WHO分级增高、KPS评分<80分及miR-211低表达均是影响胶质瘤患者预后的危险因素。 结论 miR-211在胶质瘤组织中呈低表达,与胶质瘤患者预后显著相关,可作为预测胶质瘤患者预后的独立因子及治疗新靶点。
胶质瘤; microRNA-211; 预后
神经胶质瘤大约占颅内肿瘤的46%,发病率为(3-10)/10万[1]。由于神经胶质瘤细胞具有无限增殖的特征以及极强的侵袭性,因而其呈浸润性生长,很容易侵犯到周围正常脑组织,且生长迅速,手术通常很难将其完全切除,术后复发率较高,患者的生存时间短、死亡率高、预后差。尽管目前采用手术切除联合放疗、化疗的治疗方式取得了一定的进展,但治疗效果远非令人满意[2]。早期缺乏有效的诊断及治疗靶点,是目前胶质瘤诊疗中的难点。近年来,探索可反映胶质瘤患者预后的标志物和有效的治疗靶点是目前研究的热点。
microRNA(miRNA)是一类为19-25个核苷酸的内源性非编码小RNA,广泛存在于真核生物中。miRNA通常与靶基因mRNA的3′端非翻译区(3′UTR)结合调控靶基因表达[3]。近年来,越来越多的研究发现异常表达的miRNA可影响促癌基因或抑癌基因的功能从而促进或者抑制肿瘤的形成和进展。先前的研究证实miR-211可抑制肝癌、黑色素瘤以及口腔癌等的发生发展[4-6]。但miR-211在胶质瘤中的表达及其与患者临床病理特征和预后的关系尚不清楚。本研究通过检测miR-211在不同级别胶质瘤组织和正常脑组织中的表达,分析其与胶质瘤患者临床病理特征以及预后之间的关系,从而为临床上胶质瘤的早期诊断及治疗提供新的思路。
1 资料与方法
1.1 一般资料
本研究回顾性分析黄石市中心医院2009-02~2011-12期间收治的52例神经胶质瘤患者的临床资料,所有入选患者均具备完整的术后5年随访资料。所有病例均行手术切除肿瘤组织,且入选病例术前均未行放化疗。所有切除的肿瘤组织标本立刻储存在-80 ℃液氮中,以备分离提取RNA。入选患者中男性31例,女性21例,年龄在26-77岁,平均56岁。根据2007年WHO中枢神经系统肿瘤分类标准进行组织学分级:Ⅰ级8例,Ⅱ级11例,Ⅲ级19例,Ⅳ级14例。另外12例正常脑组织标本取自因重型颅脑损伤需行内减压术的患者。该研究获得黄石市中心医院伦理委员会同意,所有患者术前均签署知情同意书,昏迷患者由直系亲属代签。
1.2 胶质瘤组织和正常脑组织中miR-211的检测
胶质瘤组织和正常脑组织标本中总RNA采用Trizol法提取(Invitrogen,CA,USA),然后采用紫外分光光度计来确定其纯度和浓度,测定组织标本在波长260 nm和280 nm处的吸光度比值,并计算OD260/OD280,确保OD值在1.8-2.1。应用qRT-PCR检测胶质瘤组织和正常脑组织标本中miR-211的表达水平,以RNU6B为内参。所有样品至少重复3次。
1.3 随访
受试者从手术之日起至少每3月以门诊或入院复查、电话等随访方式进行患者预后随访,随访资料同时进行更新。随访截止日期为2016年12月。
1.4 统计学处理
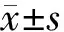
2 结果
2.1 miR-211在胶质瘤组织中表达明显降低
qRT-PCR检测结果显示,与正常脑组织(1.00±0.13)相比,胶质瘤组织中miR-211表达水平(0.41±0.24)显著下降(P<0.001)。miR-211表达水平随着胶质瘤WHO分级的增高而降低(WHO Ⅲ-Ⅳ0.21±0.14vsWHO Ⅰ-Ⅱ0.60±0.18,P=0.016),提示miR-211表达水平与WHO分级呈负相关趋势。
2.2 miR-211表达与胶质瘤临床病理特征的关系
miR-211在所有胶质瘤病理组织样本中平均的表达水平为0.41±0.24,据此,将患者分为两组:miR-211低表达组(31例,miR-211表达低于平均水平)和miR-211高表达组(21例,miR-211表达高于平均水平)。进一步研究miR-211的表达水平与临床病理特征的关系,结果显示:胶质瘤组织中低表达水平的miR-211与高组织学分级和低KPS评分密切相关,而与患者年龄、性别、肿瘤位置、肿瘤直径等均无关(见表1)。
2.3 miR-211的表达与胶质瘤患者预后的关系
Kaplan-Meier分析结果显示,miR-211高表达组患者的生存率明显高于miR-211低表达组,差异有统计学意义(P=0.037,见图1)。
为了进一步研究miR-211的表达在胶质瘤患者中的预后价值,本研究进行了包括年龄、性别、KPS评分、组织学分级、肿瘤直径、肿瘤位置、miR-211表达水平等影响因素的单因素生存分析,结果显示miR-211低表达、KPS评分<80分、高组织学分级是胶质瘤患者预后不良的指标(见表2)。为了研究miR-211的表达是否是胶质瘤患者预后的独立因素,进行多因素Cox比例风险回归模型,结果显示:miR-211低表达、KPS评分<80分、高组织学分级均是影响胶质瘤患者预后的独立危险因素(见表3)。
表 1 miR-211表达与胶质瘤患者临床病理特征的关系 (例)
Table 1 Relationship between the expression level of miR-211 and clinicopathological characteristics in glioma patients (cases)
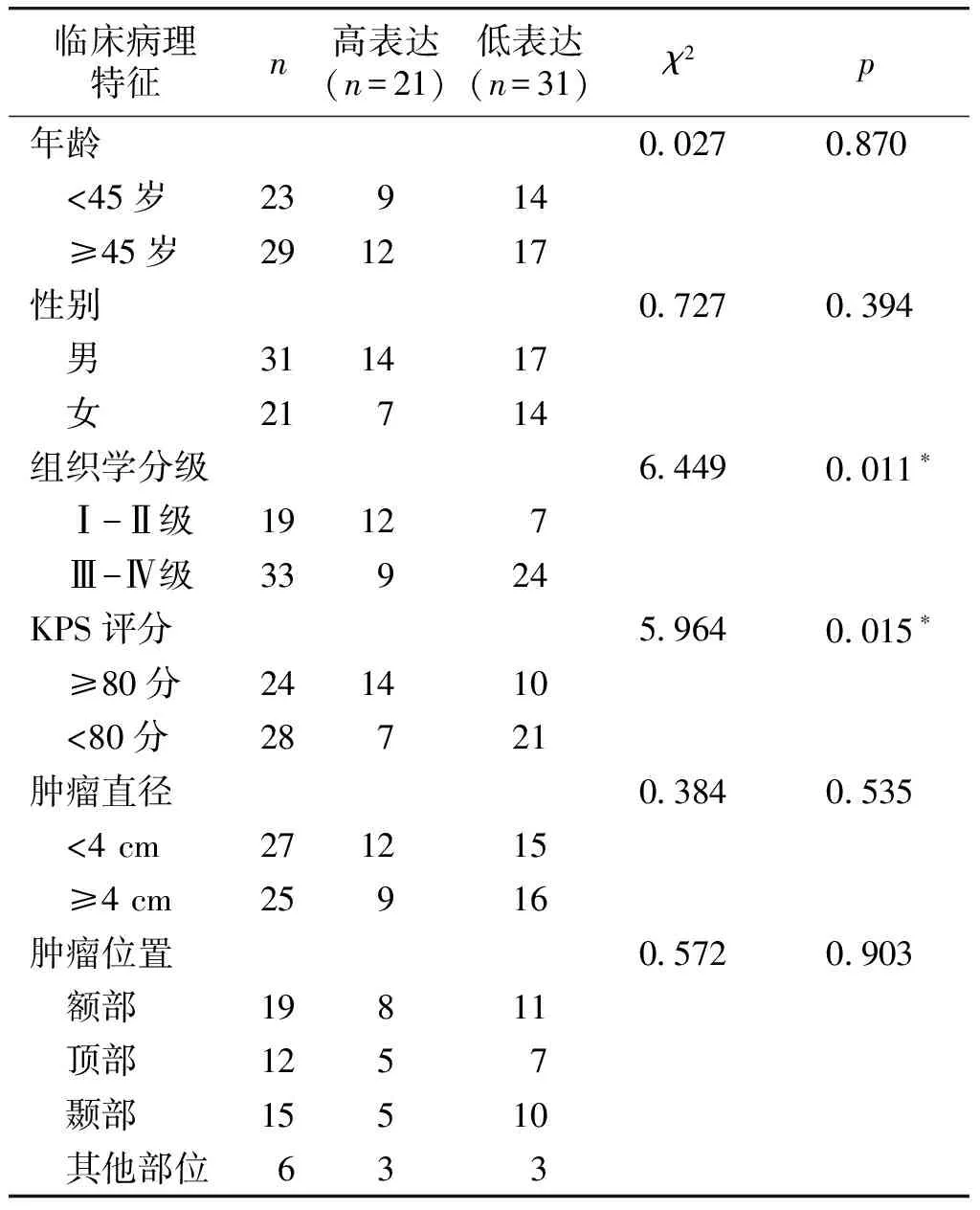
临床病理特征n高表达(n=21)低表达(n=31)χ2p年龄00270.870 <45岁23914 ≥45岁291217性别07270394 男311417 女21714组织学分级64490011∗ Ⅰ-Ⅱ级19127 Ⅲ-Ⅳ级33924KPS评分59640015∗ ≥80分241410 <80分28721肿瘤直径03840535 <4cm271215 ≥4cm25916肿瘤位置05720903 额部19811 顶部1257 颞部15510 其他部位633

图1 miR-211高表达组和低表达组患者生存率的比较Figure 1 Comparison of overall survival rate in glioma patients with high miR-211 expression and low miR-211 expression
3 讨论
脑胶质瘤是神经系统最常见的恶性肿瘤,其恶性程度高、易复发、预后较差。目前的治疗方法包括手术切除、放疗和化疗,神经胶质瘤患者的预后仍然很差,尤其是高级别的胶质母细胞瘤患者,其生存时间仅为12-15个月[7]。目前,胶质瘤的临床诊疗中缺乏有效的可预测胶质瘤患者预后的生物学标志物。尽管大量的研究证实胶质瘤患者的预后与许多因素有关,包括WHO分级、KPS评分等,然而患者的异质性使得这些因素不能精确评估患者预后[8]。因此深入研究胶质瘤发生发展的分子机制,寻找一种可靠的可准确预测胶质瘤患者预后的标志物,从而为胶质瘤的早期诊断、治疗以及评价预后提供新的思路。
表 2 胶质瘤患者总生存期的单因素Cox分析结果
Table 2 Univariate Cox regression analysis of overall survival in glioma patients

临床病理特征 HR95%CIP 年龄(<45岁vs≥45岁)13360721-25140384 性别(男vs女)12280686-22470526 KPS评分(<80分vs≥80分)19351126-35260026 组织学分级(Ⅰ-Ⅱ级vsⅢ-Ⅳ级)18231061-33250041 肿瘤直径(<4cmvs≥4cm)13790829-25740352 肿瘤位置 顶部vs额部07240298-17260768 颞部vs额部06430293-15090811 其他部位vs额部14050826-25570407 miR⁃211表达水平(低vs高)25871436-48610005
表 3 胶质瘤患者总生存期的多因素Cox分析结果
Table 3 Multivariate Cox regression analysis of overall survial in glioma patients
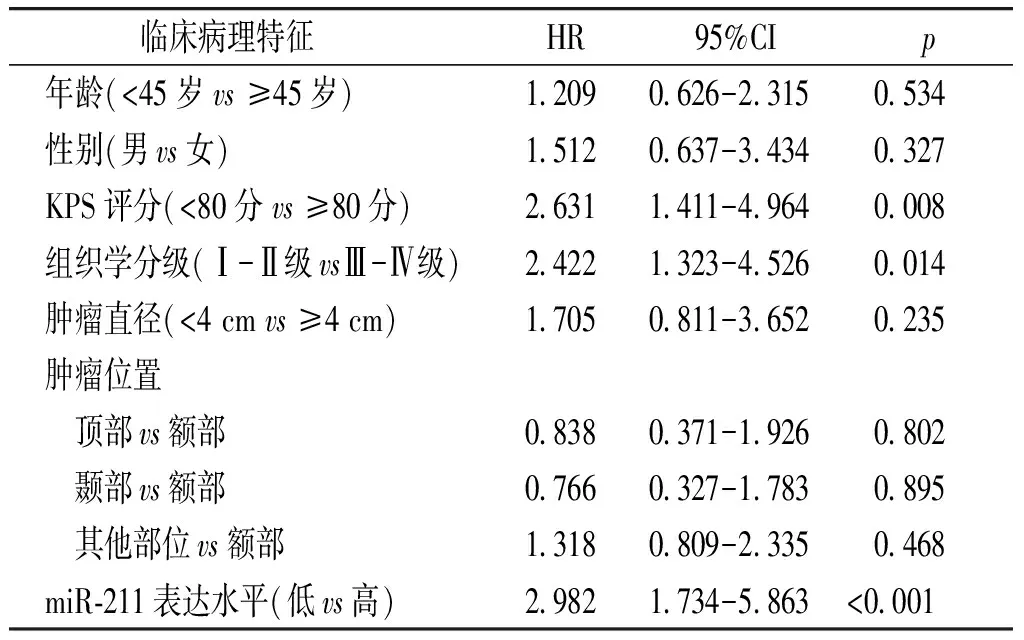
临床病理特征 HR95%CIp 年龄(<45岁vs≥45岁)12090626-2315 0534 性别(男vs女)15120637-3434 0327 KPS评分(<80分vs≥80分)26311411-4964 0008 组织学分级(Ⅰ-Ⅱ级vsⅢ-Ⅳ级)24221323-4526 0014 肿瘤直径(<4cmvs≥4cm)17050811-3652 0235 肿瘤位置 顶部vs额部08380371-1926 0802 颞部vs额部07660327-1783 0895 其他部位vs额部13180809-2335 0468 miR⁃211表达水平(低vs高)29821734-5863<0001
近年来,越来越多的研究证实miRNA可在转录后水平调节目标靶基因的表达,影响肿瘤细胞的增殖、分化、迁移以及凋亡等生理过程,从而在肿瘤的发生和发展中发挥促进或者抑制作用。很多研究同时发现很多miRNAs在肿瘤组织中的表达水平与患者的生存率密切相关,可作为评价肿瘤患者预后的指标。例如在胶质瘤组织中表达下调的miR-34a[9]、miR-203[10]and miR-145[11]等,以及表达上调的miR-21[12]、miR-10b[13]、miR-650[14]等均与胶质瘤患者的不良预后密切相关。也有研究发现异常表达的miR-211参与了许多肿瘤的发生发展过程[15,16]。Asuthkar的研究团队[17]证实,miR-211可抑制胶质瘤细胞的增殖和侵袭性,诱导胶质瘤细胞的凋亡,提示miR-211未来可能作为治疗胶质瘤的新靶点。然而,miR-211评价胶质瘤患者临床预后的价值却没有报道。在这里,我们将调查miR-211的表达与胶质瘤患者的临床病理特征以及临床预后之间的关系。
该研究中,我们应用RT-PCR技术检测miR-211在胶质瘤组织和正常脑组织中的表达,结果显示,miR-211在胶质瘤组织中的表达水平显著低于正常脑组织。进一步分析miR-211的表达水平与胶质瘤患者临床病理特征之间的关系,结果显示:胶质瘤组织中miR-211的表达水平与WHO分级、KPS评分密切相关,而与患者年龄、性别、肿瘤位置、肿瘤直径等均无关。最后,本研究探讨了miR-211的表达与胶质瘤患者预后的关系。本研究的随访数据显示,miR-211高表达组患者的5年生存率明显高于miR-211低表达组。同时研究证实miR-211在肿瘤组织中的低表达可作为评价胶质瘤患者预后的独立因素。
综上,本研究证实miR-211在胶质瘤组织中表达降低,且其表达水平与胶质瘤患者的临床预后有关,可作为预测胶质瘤患者临床预后的独立危险因素,而miR-211在胶质瘤中的作用机制,是否还有更多的靶基因以及信号通路参与其中,将是我们团队下一步的研究方向。
[1] Ricard D, Idbaih A, Ducray F,etal. Primary brain tumours in adults[J]. Lancet, 2012,379(9830):1984-1996.
[2] Stupp R, Hegi ME, Mason WP,etal. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial[J]. Lancet Oncol, 2009,10(5):459-466.
[3] Cai Y, Yu X, Hu S,etal. A brief review on the mechanisms of miRNA regulation[J]. Genomics Proteomics Bioinformatics, 2009,7(4):147-154.
[4] Ura S, Honda M, Yamashita T,etal. Differential microRNA expression between hepatitis B and hepatitis C leading disease progression to hepatocellular carcinoma[J]. Hepatology, 2009,49(4):1098-1112.
[5] Levy C, Khaled M, Iliopoulos D,etal. Intronic miR-211 assumes the tumor suppressive function of its host gene in melanoma[J]. Mol Cell, 2010,40(5):841-849.
[6] Chang KW, Liu CJ, Chu TH,etal. Association between high miR-211 microRNA expression and the poor prognosis of oral carcinoma[J]. J Dent Res, 2008,87(11):1063-1068.
[7] McNamara S. Treatment of primary brain tumours in adults[J]. Nurs Stand, 2012,27(14):42-47.
[8] Nagpal S, Recht CK, Bertrand S,etal. Phase II pilot study of single-agent etirinotecan pegol(NKTR-102) in bevacizumab-resistant high grade glioma[J]. J Neurooncol, 2015,123(2):277-282.
[9] Guessous F, Zhang Y, Kofman A,etal. microRNA-34a is tumor suppressive in brain tumors and glioma stem cells[J]. Cell Cycle, 2010,9(6):1031-1036.
[10] Dontula R, Dinasarapu A, Chetty C,etal. MicroRNA 203 modulates glioma cell migration via Robo1/ERK/MMP-9 signaling[J]. Genes Cancer, 2013,4(7-8):285-296.
[11] Lee HK, Bier A, Cazacu S,etal. MicroRNA-145 is downregulated in glial tumors and regulates glioma cell migration by targeting connective tissue growth factor[J].PLoS One, 2013,8(2):e54652.
[12] Gabriely G, Wurdinger T, Kesari S,etal. MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators[J]. Mol Cell Biol,2008,28(17):5369-5380.
[13] Sasayama T, Nishihara M, Kondoh T,etal. MicroRNA-10b is overexpressed in malignant glioma and associated with tumor invasive factors, uPAR and RhoC[J]. Int J Cancer, 2009,125(6):1407-1413.
[14] Sun B, Pu B, Chu D,etal. MicroRNA-650 expression in glioma is associated with prognosis of patients[J]. J Neuro-Oncol, 2013,115(3):375-380.
[15] Maftouh M, Avan A, Funel N,etal. miR-211 modulates gemcitabine activity through downregulation of ribonucleotide reductase and inhibits the invasive behavior of pancreatic cancer cells[J]. Nucleosides Nucleotides Nucleic Acids, 2014,33(4-6):384-393.
[16] Sakurai E, Maesawa C, Shibazaki M,etal. Downregulation of microRNA-211 is involved in expression of preferentially expressed antigen of melanoma in melanoma cells[J]. Int J Oncol, 2011,39(3):665-672.
[17] Asuthkar S, Velpula KK, Chetty C,etal. Epigenetic regulation of miRNA-211 by MMP-9 governs glioma cell apoptosis, chemosensitivity and radiosensitivity[J]. Oncotarget, 2012,3(11):1439-1454.
The expression of microRNA-211 in glioma tissues and its value in predicting prognosis
MEI Xiping1,2,ZHENG Kun1,2,SHAO Bibo1,2,YUAN Lixue1,2,FENG Huibin1,2*
(1DepartmentofIntensiveCareUnit,HuangshiCentralHospital,AffiliatedHospitalofHubeiPolytechnicUniversity,EdongHealthcareGroup,Huangshi435000,China;2HubeiKeyLaboratoryofKidneyDiseasePathogenesisandIntervention,HuangshiCentralHospital,AffiliatedHospitalofHubeiPolytechnicUniversity,EdongHealthcareGroup;*Correspondingauthor,E-mail:fhb1022hs@sina.com)
ObjectiveTo investigate the expression of microRNA-211(miR-211) in glioma tissues and assess its relationship with prognosis of glioma patients.MethodsRT-PCR was performed to examine the expression level of miR-211 in 52 glioma tissues and 12 normal brain tissues. The correlation of miR-211 with clinicopathological factors and prognosis was investigated.ResultsThe expression of miR-211 was significantly lower in glioma tissues than that in normal brain tissues(0.41±0.24vs1.00±0.13,P< 0.001), and negatively associated with advanced WHO classification(WHO Ⅲ-Ⅳ0.21±0.14vsWHO Ⅰ-Ⅱ0.60±0.18,P=0.016).The miR-211 expression level was significantly lower in patients with the advanced WHO pathological grade of glioma and low KPS. However,the miR-211 expression level was not significantly associated with age, gender, tumor location, or tumor diameter. Furthermore, the overall survival rate of glioma patients with low miR-211 expression was significantly lower than that of patients with high miR-211 expression(P=0.037).Advanced WHO grade, KPS score less than 80 scores,and low expression of miR-211 were the independent risk factors for predicting the poor prognosis of glioma patients.ConclusionThe miR-211 is down-regulated in glioma tissues and associated with the prognosis of glioma patients. The miR-211 might be an independent prognostic indicator and a potential therapeutic target for glioma patients.
glioma; microRNA-211; prognosis
梅喜平,男,1981-09生,硕士,主治医师,E-mail:270303147@qq.com
2017-03-29
R730.264
A
1007-6611(2017)07-0711-04
10.13753/j.issn.1007-6611.2017.07.016
