肌萎缩性侧索硬化患者脑脊液和血清IL-6、IL-15的临床分析
2017-08-07臧大维
郑 勇,臧大维
(天津市第一中心医院神经内科,天津 300192;*通讯作者,E-mail:dwzang656@163.com)
肌萎缩性侧索硬化患者脑脊液和血清IL-6、IL-15的临床分析
郑 勇,臧大维*
(天津市第一中心医院神经内科,天津 300192;*通讯作者,E-mail:dwzang656@163.com)
目的 检测肌萎缩性侧索硬化(amyotrophic lateral sclerosis,ALS)患者脑脊液(CSF)和血清中白细胞介素-6(IL-6)、白细胞介素-15(IL-15)的水平变化,并分析其与临床参数的相关性。 方法 通过ELISA酶联免疫吸附法分别检测42例ALS患者和62例非炎症性神经疾病(non-inflammatory neurological disease,NIND)对照组患者脑脊液和血清标本中IL-6、IL-15水平。统计患者的病程、ALS功能评分量表(ALSFRS-r)评分并计算疾病进展率(DPR)。分析IL-6及IL-15与各种临床参数的相关性。 结果 ALS患者脑脊液中IL-6和IL-15的水平相对于ALS患者血清中的IL-6和IL-15水平显著增加(P<0.05), 与DPR呈正相关(P<0.01),与病程时间呈负相关(P<0.01)。ALS患者CSF中的IL-6和IL-15与患者生存率相关(P<0.05)。 结论 ALS患者脑脊液中的IL-6和IL-15水平比血清中的更高,其临床测量有益于ALS的疾病分化和进展评估,对疾病诊断和进展具有潜在的临床意义。
肌萎缩性侧索硬化; 白细胞介素; 疾病进展率; ALSFRS-r
肌萎缩性侧索硬化(amyotrophic lateral sclerosis,ALS)是一种致命的神经变性疾病,其影响脑和脊髓中的运动神经元,导致麻痹并最终死亡[1]。目前已经发表了多种ALS生物标志物相关的研究结果[2],这些研究注重于CSF或血清中生物标志物的鉴定,大多数研究中的生物标志物的变化可以区分ALS患者与健康对照受试者,但一些研究结果受到分析中样本数量的限制和不同对照组的影响[3,4]。此外,在最近的一些研究中,在CSF或血清中所检测生物标志物研究的重点更侧重于疾病的诊断而不是临床预后等相关的研究[5,6]。既往研究[7]观察到ALS患者脑脊液和血清中白细胞介素IL-10、IL-12及粒细胞-巨噬细胞集落刺激因子(GM-CSF)等的升高,但目前几乎没有关于脑脊液中IL-6、IL-15水平如何影响ALS患者(特别是中国的ALS患者)疾病进展的相关研究。我们通过对大量ALS患者血清及脑脊液中的IL-6、IL-15水平进行测量,以观察这些白细胞介素水平对ALS的影响,并分析IL-6、IL-15是否可以作为ALS患者疾病分化和进展评价的指标。
1 材料与方法
1.1 研究对象
本研究经天津市第一中心医院人体临床试验委员会批准(2009SN-K041和2015SN-K001)。参与本研究的患者选自2010-01~2015-05期间在天津市第一中心医院神经内科病房住院的ALS患者与非炎症性神经系统疾病(NIND)患者,所有参加研究的患者均已签署书面知情同意书,所有ALS患者符合修订的EI Escorial临床确诊标准;非炎症性神经系统疾病(NIND)对照组患者包括:紧张型头痛(n=23)、低钾血症(n=9)、低颅内压(n=18)、脑脊液漏出(n=12)。在早晨8时至中午12时之间,通过腰椎穿刺获得脑脊髓液(CSF)样品,并通过静脉穿刺获得外周全血样品。在腰椎穿刺之前对每个ALS患者进行修订ALS功能评定量表(ALSFRS-r)评分及疾病进展速率(DPR)的计算。DPR计算公式为:DPR=(48-ALSFRS-r)/病程(月)。通过对ALS患者电话访问或门诊复诊跟踪患者的生存状况。ALS和NIND患者的情况见表1。
表 1 ALS和非炎症性神经系统疾病患者一般资料
Table 1 Clinical characteristics of the ALS and NINDC patients

组别男/女年龄(岁)临床诊断(确诊/可能)临床发病(B/L)疾病进展率(DPR,%)ALSFRS⁃r病程时间(月)ALS组22/205215±31822/2018/24161±0153349±0651469±188NIND组32/305332±311N/AN/AN/AN/AN/A
B:延髓症状起病;L:四肢症状起病;ALSFRS-r:肌萎缩性侧索硬化功能评定量表;N/A:不适用
1.2 仪器与试剂
人白细胞介素ELISA试剂盒(R&D Systems,USA);BioTek Synergy 2酶标仪(BioTek,USA)。
1.3 方法
1.3.1 血清和CSF标本收集 从所有患者(42例ALS患者和62例NIND患者)抽取血液标本,并在2 h内在4 ℃以3 000 r/min离心10 min,将上清液保存在-80 ℃冰箱直至实验开始;从取得血液标本到标本离心的平均时间为(68.28±7.96)min。同时通过腰椎穿刺获取42例ALS患者和62例NIND患者的CSF标本,并立即在4 ℃以800 r/min离心5 min,将上清液储存在-80 ℃冰箱直到实验开始;从腰椎穿刺获取脑脊液标本到标本离心的平均时间为(18.29±5.52)min。
1.3.2 IL-6、IL-15的ELISA检测 使用ELISA试剂盒(R&D Systems,USA)并按照说明书要求测定IL-6、IL-15在脑脊液及血清中的水平。
1.4 统计学方法
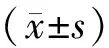
2 结果
2.1 ALS和NIND患者年龄分析
ALS和NIND患者之间在年龄方面没有统计学差异(见表1)。
2.2 ALS和NIND患者脑脊液和血清中的IL-6、IL-15水平分析
与NIND患者相比,ALS患者的脑脊液IL-6、IL-15显著增加,但在血清中没有统计学差异(见表2)。
表 2 ALS和NIND患者脑脊液和血清中的IL-6、IL-15水平比较 (ng/ml)
Table 2 IL-6, IL-15 levels in cerebrospinal fluid and serum of ALS and NINDC patients (ng/ml)

指标标本ALS组NIND组IL⁃6脑脊液20811±211∗15625±600血清 12856±53212028±479IL⁃15脑脊液44159±1223∗40320±159血清 28253±116227975±1216
与NIND组的比较,*P<0.05
2.3 两种因子与DPR、病程时间和ALSFRS-r的关联
ALS患者的脑脊液中的IL-6与DPR呈正相关,与病程时间负相关,与ALSFRS-r不相关;IL-15与DPR呈正相关,与病程时间负相关,与ALSFRS-r不相关(见表3)。
表 3 ALS患者脑脊液中IL-6,IL-15与DPR、病程时间和ALSFRS-r评分水平的相关分析
Table 3 Correlation of the levels of IL-6,IL-15 in cerebrolpinal fluicl with DPRs, durations, and ALSFRS-r scores

指标疾病进展率(DPR)病程时间ALSFRS⁃rrPrPrPIL⁃60391600010-0319300153-0185301881IL⁃1505872<00001-04981<00001-0133803712
2.4 ALS患者的存活与IL-6,IL-15的水平之间的关联
入选本研究的42例ALS患者跟踪随访至就诊后54个月,IL-6生存率中值为41.22,依照中值将IL-6分为高于中值组及低于中值组,IL-15生存率中值为46.96,依照中值将IL-15分为高于中值组及低于中值组。与低于中值的IL-6和IL-15组相比,高于中值的IL-6和IL-15组的寿命显着降低(见图1)。
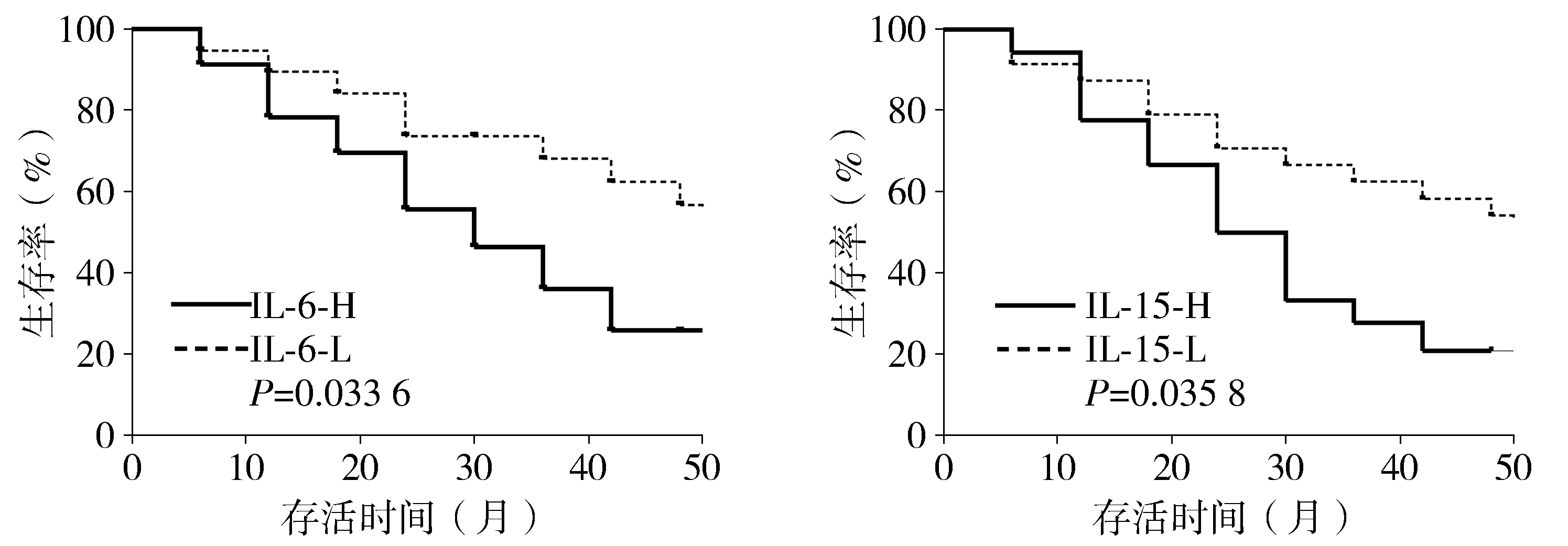
IL-6-H、IL-15-H:具有高于中值的IL-6、IL-15水平的ALS患者;IL-6-L、IL-15-L:具有低于中值IL-6、IL-15水平的ALS患者图1 ALS患者的生存分析Figure 1 Survival analyses of ALS patients
3 讨论
IL-6是Hirano等首次描述的B细胞分化因子,通常由T细胞衍生,但也可由其他细胞产生,包括CNS中的星形胶质细胞和小胶质细胞[8,9]。在单纯疱疹病毒脑炎和其他细菌和病毒引起的CNS感染中,脑脊液中的IL-6水平也普遍升高;相反,在非感染性CNS炎性疾病中结果具有多变性,在系统性红斑狼疮中检测到IL-6,但在多发性硬化(MS)中未检测到IL-6[10]。IL-6可诱导神经元分化并在神经元分化中发挥神经营养调节作用。此外,IL-6在脑损伤时明显增加。IL-6可能由ALS中的星形胶质细胞或小胶质细胞产生,作为运动神经元或其他CNS细胞变性的非特异性应答反应[11,12]。我们研究发现,ALS患者脑脊液中IL-6水平比对照组患者脑脊液中IL-6水平明显增高,并发现ALS患者脑脊液中IL-6水平与DPR或病程时间之间有显著关联。在脑组织中,具有更高水平的IL-6,因此,在ALS患者发病状态下,其脑脊液中的IL-6的变化应更具有特异性,而ALS患者血清中的IL-6水平变化并不明显。
IL-15是促炎细胞因子,它由活化的血液单核细胞、巨噬细胞、树突状细胞和活化的神经胶质细胞产生,促进T细胞增殖、诱导细胞溶解效应,包括天然杀伤细胞和细胞毒性细胞,在某些神经疾病如多发性硬化和痴呆症中IL-15刺激B细胞增殖和分泌免疫球蛋白[13,14]。本研究结果显示,ALS患者脑脊液中的IL-15水平与对照组患者的脑脊液中的IL-15水平显著不同,与DPR正相关,并与病程时间负相关。这可能与IL-15参与ALS中枢神经系统炎症活性有关[15]。相反,与西方关于ALS患者的研究[16]不同,在我们研究中发现ALS患者和对照之间的血清IL-15水平没有差异,这可能与种族或患者选择的差异有关,而且血清中IL-15的水平容易受许多其他因素和疾病的影响,这可能导致不可预测的变化。
本研究我们主要集中检测ALS患者脑脊液和血清中的IL-6、IL-15的变化。与对照组相比,ALS患者的脑脊液中的IL-6、IL-15水平显著增加。ALS患者脑脊液中的IL-6和IL-15水平比血清中的IL-6和IL-15水平更具有特异性,并且与疾病进展密切相关。具有较低IL-6,IL-15水平的ALS患者比具有较高IL-6,IL-15水平的ALS患者存活时间更长。
鉴于上述关于ALS患者脑脊液和血清中IL-6、IL-15水平的研究发现,可以合理地假设,脑脊液中IL-6和IL-15水平的变化比血清中的变化更可靠。已有证据表明免疫因素可能参与ALS的致病机制[16],本研究观察到所有两种白细胞介素在脑脊液或血清中都增加,这些白细胞介素可能是参与ALS致病机制中作为免疫激活的潜在标志物。
总之,本研究发现,检测脑脊液中IL-6和IL-15的水平对ALS患者疾病鉴别诊断和进展有一定的临床潜在价值。由于脑脊液中这些白细胞介素的水平与血清中的不同,因此脑脊液中这些白细胞介素的测量在疾病的诊断和评估疾病进展方面比血清测量更可靠。本研究无法确定脑脊液中IL-6和IL-15水平的变化是否与疾病发生或结果相关。
[1] Frakes AE, Braun L, Ferraiuolo L,etal. Additive amelioration of ALS by co-targeting independent pathogenic mechanisms[J]. Ann Clin Transl Neurol, 2017, 4(2):76-86.
[2] Gagliano SA, Pouget JG, Hardy J,etal. Genomics implicates adaptive and innate immunity in Alzheimer's and Parkinson's diseases[J]. Ann Clin Transl Neurol, 2016, 3(12):924-933.
[3] Qi Y, Yin X, Wang S,etal. Differential peroxisome proliferator activated receptors activity in a rodent model of amyotrophic lateral sclerosis[J]. Int J Clin Exp Med, 2015, 8(3):3743-3751.
[4] Gray E, Larkin JR, Claridge TD,etal. The longitudinal cerebrospinal fluid metabolomic profile of amyotrophic lateral sclerosis [J]. Amyotroph Lat Scl Fr,2015,16(7-8):456-463.
[5] Kuhle J, Lindberg RL, Regeniter A,etal. Increased levels of inflammatory chemokines in amyotrophic lateral sclerosis [J].Eur J Neurol, 2009,16(6):771-774.
[6] Chen X, Guo X, Huang R,etal. An exploratory study of serum creatinine levels in patients with amyotrophic lateral sclerosis [J]. Neurol Sci, 2014,35(10):1591-1597.
[7] Frakes AE, Braun L, Ferraiuolo L,etal. Additive amelioration of ALS by co-targeting independent pathogenic mechanisms[J]. Ann Clin Transl Neurol, 2017, 4(2):76-86.
[8] Patin F, Baranek T, Vourc'h P,etal. Combined metabolomics and transcriptomics approaches to assess the IL-6 blockade as a therapeutic of ALS: Deleterious alteration of lipid metabolism[J]. Neurotherapeutics, 2016, 13(4):905-917.
[9] Mizwicki MT, Fiala M, Magpantay L,etal. Tocilizumab attenuates inflammation in ALS patients through inhibition of IL6 receptor signaling[J]. Am J Neurodegener Dis, 2012, 1(3):305-315.
[10] Ringer C, Tune S, Bertoune MA,etal. Disruption of calcitonin gene-related peptide signaling accelerates muscle denervation and dampens cytotoxic neuroinflammation in SOD1 mutant mice[J]. Cell Mol Life Sci, 2017, 74(2):339-358.
[11] Furukawa T, Matsui N, Fujita K,etal. Increased proinflammatory cytokines in sera of patients with multifocal motor neuropathy[J]. J Neurol Sci, 2014, 346(1-2):75-79.
[12] Tönges L, Günther R, Suhr M,etal. Rho kinase inhibition modulates microglia activation and improves survival in a model of amyotrophic lateral sclerosis[J]. Glia, 2014,62(2):217-232.
[13] Choi MR, Kim HY, Park JY,etal. Selection of optimal passage of bone marrow-derived mesenchymal stem cells for stem cell therapy in patients with amyotrophic lateral sclerosis[J]. Neurosci Lett, 2010, 472(2):94-98.
[14] Rentzos M, Zoga M, Paraskevas GP,etal. IL-15 is elevated in cerebrospinal fluid of patients with Alzheimer's disease and frontotemporal dementia[J]. J Geriatr Psychiatry Neurol, 2006, 19(2):114-117.
[15] Ishiguro M, Okada A, Asai K,etal. Stimulation of neuronal cells by culture supernatant of T lymphocytes triggered by anti-CD3 mAb followed by propagation in the presence of interleukin-2[J]. Microbiol Immunol, 2016, 60(1):47-55.
[16] Rentzos M, Rombos A, Nikolaou C,etal.Interleukin-15 and interleukin-12 are elevated in serum and cerebrospinal fluid of patients with amyotrophic lateral sclerosis[J]. Eur Neurol, 2010,63(5):285-290.
Clinical analysis of IL-6 and IL-15 in cerebrospinal fluid and serum of patients with amyotrophic lateral sclerosis
ZHENG Yong,ZANG Dawei*
(DepartmentofNeurology,TianjinFirstCenterHospital,Tianjin300192,China;*Correspondingauthor,E-mail:dwzang656@163.com)
ObjectiveTo investigate the changes of interleukin-6(IL-6) and interleukin-15(IL-15) in cerebrospinal fluid(CSF) and serum, and their correlation with amyotrophic lateral sclerosis(ALS).MethodsThe levels of IL-6 and IL-15 in cerebrospinal fluid and serum in 42 patients with ALS and 62 patients with non-inflammatory neurological disease(NIND) were detected by ELISA. The ALS function rating scale(ALSFRS-r) score was calculated and the disease progression rate(DPR) was calculated. The correlation between IL-6 and IL-15 levels and various clinical parameters was analyzed.ResultsThe levels of IL-6 and IL-15 were significantly higher in cerebrospinal fluid of ALS patients than those in serum of ALS patients(P<0.05). The levels of IL-6 and IL-15 in cerebrospnal fluid were positively correlated with DPR(P<0.01), but negatively correlated with duration of disease(P<0.01). IL-6 and IL-15 levels in cerebrospinal fluid of ALS patients were associated with patient survival(P<0.05).ConclusionIL-6 and IL-15 levels in cerebrospinal fluid are beneficial for disease differentiation and progression assessment of ALS. IL-6 and IL-15 levels in cerebrospinal fluid are more reliable than those in serum, and have potential clinical implications for disease diagnosis and progression.
amyotrophic lateral sclerosis; interleukin; disease progression rate; ALSFRS-r
天津市卫生局科技基金资助项目(2015KZ022)
郑勇,男,1972-07生,学士,主治医师,E-mail:pdadns@sina.com
2017-03-19
R745
A
1007-6611(2017)07-0702-04
10.13753/j.issn.1007-6611.2017.07.014
