钙调蛋白小亚基Capn4对依托铂甙诱导的鼻咽癌细胞CNE2 DNA损伤修复的作用
2017-08-07吴丽贤
王 丰,王 慧,吴丽贤,郑 鸣*
(1福建中医药大学中西医结合学院,福州 350004;2福建医科大学药学院药理系;*通讯作者,E-mail:zming_1956@163.com)
钙调蛋白小亚基Capn4对依托铂甙诱导的鼻咽癌细胞CNE2 DNA损伤修复的作用
王 丰1,王 慧2,吴丽贤2,郑 鸣2*
(1福建中医药大学中西医结合学院,福州 350004;2福建医科大学药学院药理系;*通讯作者,E-mail:zming_1956@163.com)
目的 研究钙调蛋白小亚基Capn4对依托铂甙(VP-16)诱导的鼻咽癌细胞CNE2 DNA损伤修复中的作用及可能影响的修复通路。 方法 构建shRNA下调Capn4表达的CNE2细胞并以Western blot法验证;高内涵检测γ-H2AX在CNE2细胞及下调Capn4表达的CNE2细胞中的平均荧光强度,分析下调Capn4对 VP-16诱导的CNE2细胞DNA损伤修复的作用;NHEJ(非同源重组修复)通路特异性的质粒EJ5-GFP用Fugen6 HD转入CNE2细胞及下调Capn4的CNE2细胞,用高内涵仪检测GFP的阳性率,观察下调Canp4对VP-16诱导的鼻咽癌细胞DNA损伤NHEJ修复通路的影响。 结果 shRNA确实下调Capn4在鼻咽癌细胞中的表达。2.5 μmol/L VP-16处理CNE2Vector细胞和CNE2Capn4(-)细胞后6 h和12 h,CNE2Capn4(-)的损伤都较空载体的CNE2Vector细胞高;下调Capn4表达对VP-16造成的CNE2细胞DNA损伤修复有抑制作用(P<0.01)。2.5 μmol/L VP-16作用后,CNE2Capn4(-)细胞与CNE2Vector细胞相比较GFP平均荧光强度明显更低;下调CNE2表达能够抑制DNA损伤后NHEJ通路的修复(P<0.01)。 结论 在鼻咽癌细胞中下调Capn4的表达能抑制VP-16所致的DNA损伤修复,这种作用可能是通过抑制NHEJ通路实现的。
Capn4; 鼻咽癌; VP-16; shRNA; NHEJ通路
鼻咽癌是起源鼻咽上皮细胞的恶性肿瘤,发病率具有明显的地域分布特征,在东南亚地区和中国南方有极高的发病率[1]。鼻咽癌的主要治疗手段是放疗,总体疗效较好,但仍有较多患者存在放疗照射野内局部的残留和复发,提示在这部分患者中存在放疗抵抗,这与DNA双键断裂[2]损伤修复机制(DNA damage repair,DDR)有密切的关系。不能修复的DSB将导致肿瘤细胞死亡。DNA修复主要通过两种机制实现:一种是同源重组修复(HR),使用姐妹染色体的同源序列重新合成DNA;另一种是非同源重组修复(NHEJ),断裂的DNA末端重新连接,可以在没有模板的情况下进行DNA修复,但也更容易发生错误。DNA修复能力异常激活和增强是导致鼻咽癌细胞对DNA损伤剂耐药的重要分子基础;相反,修复缺陷则使肿瘤对放化疗提高敏感性。依托泊苷(VP-16)是鬼臼毒素的半合成衍生物,诱导人鼻咽癌细胞产生DNA双链损伤,有文献报道VP-16诱导DNA损伤的同时,促进NHEJ修复,这可能是鼻咽癌化疗抵抗的的原因之一[3]。钙调蛋白Calpain[4]是Ca2+依赖半胱氨酸蛋白水解酶,Capn4是Calpain小分子亚基,分子量为28 kDa,使Calpain形成二聚体。目前在多种肿瘤中有发现Calpain的异常表达。Calpain参与多种肿瘤细胞的增殖和凋亡[5,6]。本研究拟研究钙调蛋白小亚基Capn4对VP-16所致的鼻咽癌细胞CNE2 DNA损伤修复的作用及可能影响的修复通路。
1 材料与方法
1.1 细胞株和主要试剂
人鼻咽癌细胞CNE2购自中国科学院上海生命科学研究院细胞资源中心,293T细胞购自福建医科大学细胞动物实验中心。Capn4下调的人鼻咽癌细胞CNE2Capn4(-)和空载体转染的对照细胞CNE2Vector为药学院药理实验室构建。Hyclone RPMI1640 培养基和Hyclone胎牛血清均购于美国ThermoScientific。慢病毒质粒pGC-LV、包装质粒pHelper 1.0和pHelper 2.0 购自上海吉凯基因化学技术有限公司。高内涵检测γ-H2AX试剂盒购自美国Thermo scientific公司。VP-16注射液购自齐鲁制药有限公司。
1.2 细胞培养
CNE2细胞、293T细胞、CNE2Vector和CNE2Capn4(-)培养于含10%胎牛血清、青霉素100 IU/ml和链霉素100 μg/ml的RPMI 1640 培养液中,置37℃、5% CO2孵育箱中培养,取对数生长期细胞用于实验。
1.3 构建shRNA载体转染CNE2细胞抑制Capn4表达
Genbank中Capn4基因已知序列见图1。
1 gggggcggtg cttgatatgg gagtagtctg attgtgtggg accaggacaa tgtggtcctg
61 aggggactga tgtggagttt tggcgggtgg ggcttatggg tctgggctca gcctgcattg
121 gctaacctgg agatgaacgt taaagcgagg cggctgcgca gtacaacccg gagcccccgc
181 ccccacgcac acattactcc aacattgagg ccaacgagag tgaggaggtc cggcagttcc
241 ggagactctt tgcccagctg gctggagatg acatggaggt cagcgccaca gaactcatga
301 acattctcaa taaggttgtg acacgacacc ctgatctgaa gactgatggt tttggcattg
361 acacatgtcg cagcatggtg gccgtgatgg atagcgacac cacaggcaag ctgggctttg
421 aggaattcaa gtacttgtgg aacaacatca aaaggtggca ggccatatac aaacagttcg
481 acactgaccg atcagggacc atttgcagta gtgaactccc aggtgccttt gaggcagcag
541 ggttccacct gaatgagcat ctctataaca tgatcatccg acgctactca gatgaaagtg
601 ggaacatgga ttttgacaac ttcatcagct gcttggtcag gctggacgcc atgttccgtg
661 ccttcaaatc tcttgacaaa gatggcactg gacaaatcca ggtgaacatc caggagtggc
721 tgcagctgac tatgtattcc tgaactggag ccccagaccc gccccctcac tgccttgcta
781 taggagtcac ctggagcctc ggtctctccc agggccgatc ctgtctgcag tcacatcttt
841 gtggggcctg ctgacccaca agcttttgtt ctctcagtac ttgttaccca gcttctcaac
901 atccagggcc caatttgccc tgcctggagt tccccctggc tctaggacac tctaacaagc
961 tctgtccacg ggtctcccca ttcccaccag gccctgcaca cacccactcc gtaacctctc
1021 ccctgtacct gtgccaagcc tagcacttgt gatgcctcca tgccccgagg gccctctctc
1081 agttctggga ggatgactcc agtccctgca cgccctggca cacccttcac ggttgctacc
1141 caggcggcca agctccagac cgtgccagac ccaggtgccc cagtgccttt gtctatattc
1201 tgctcccagc ctgccaggcc caggaggaaa taaacatgcc ccagttgctg atctctaaaa
1261 aaaaaaaaaa a
图1 Genbank中Capn4基因已知序列
Figure 1 The known sequencing of Capn4 gene in Genbank
根据Genbank中Capn4基因已知序列,按siRNA序列设计原则,应用Ambion公司网上在线设计工具设计,并将选出的siRNA序列进行BLAST搜索,作同源性分析以保证序列的特异性,最后确定3个区段。根据capn4cDNA序列构建表达capn4 mRNA特异的,含绿色荧光蛋白基因(EGFP)的shRNA 真核表达质粒CAPNS1-RNAi。CAPNS1-RNAi作用的3个靶序列分别为5′-CCACAGAACTCATGAACAT-3′ (CAPNS1-RNAi89)、5′-AGGCCATATACAAACAGTT-3′(CAPNS1-RNAi90)及5′-ATGTTCCGTGCCTTCAAAT-3′(CAPNS1-RNAi91);阴性对照CON207作用的靶序列为:5′-TTCTCCGAACGTGTCACGT-3′。利用包装质粒pHelper 1.0和pHelper 2.0转染CNE2细胞,并用Western blot法测Capn4的表达情况。
1.4 高内涵技术检测细胞DNA损伤
取对数生长期CNE2Vector和CNE2Capn4(-)细胞以适合的密度接种在96孔板中,次日细胞贴壁后,分组进行药物处理,用不同浓度VP-16处理CNE2细胞2 h,高内涵技术检测其DNA损伤情况,用2.5 μmol/L浓度作为造模损伤浓度,预处理CNE2细胞2 h,洗掉药物,加入新培养基重新孵育,在0,6,12,24 h,检测其DNA损伤情况;PBS洗涤2次,弃上清;每管加入100 μl固定液,室温 15 min,离心弃上清,用100 μl Wash Buffer洗涤2 次,每次10 min,弃上清;每孔加入100 μl Permeabilization Buffer,室温 15 min,离心弃上清,用100 μl Wash Buffer洗涤2次,每次10 min,弃上清;封闭。每孔加入100 μl 1× Blocking Buffer,室温 15 min,离心弃上清;每孔加入50 μl一抗,室温1 h,离心弃上清,用100 μl Wash Buffer Ⅱ洗涤2次,每次10 min,弃上清;用100 μl Wash Buffer Ⅱ洗涤2次,每次10 min,弃上清;每孔加入50 μl二抗,室温避光45 min,离心弃上清,用100 μl Wash Buffer Ⅱ洗涤2 次,每次10 min,弃上清;用100 μl Wash Buffer Ⅱ洗涤2次,每次10 min,弃上清;每孔再加入新的200 μl Wash Buffer,将细胞转移到96孔板中,平板离心机离心,上机检测。
1.5 DNA损伤后NHEJ修复通路检测
将NHEJ通路特异性的质粒EJ5-GFP用Fugen6 HD转入CNE2Vector和CNE2Capn4(-)细胞,选择稳定表达EJ5-GFP的CNE2/EJ5-GFP细胞,转入pCBASceI质粒表达I-SceⅠ酶,切割EJ5-GFP基因,形成双链断裂(DSB),如果细胞通过NHEJ途径修复将表达GFP,用高内涵仪检测GFP的阳性率,可检测出通过NHEJ修复的细胞。
1.6 统计学分析
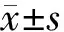
2 结果
2.1 构建3株shRNA载体转染CNE2细胞下调Capn4表达并以Western blot验证
三株shRNA载体(CAPNS1-RNAi21291-1, CAPNS1-RNAi21290-1, CAPNS1-RNAi21289-2)构建成功并转染CNE2,均下调Capn4在CNE2中的表达,其中CAPNS1-RNAi21289-2下调Capn4表达最显著,差异有统计学意义(P<0.01,见图1)。
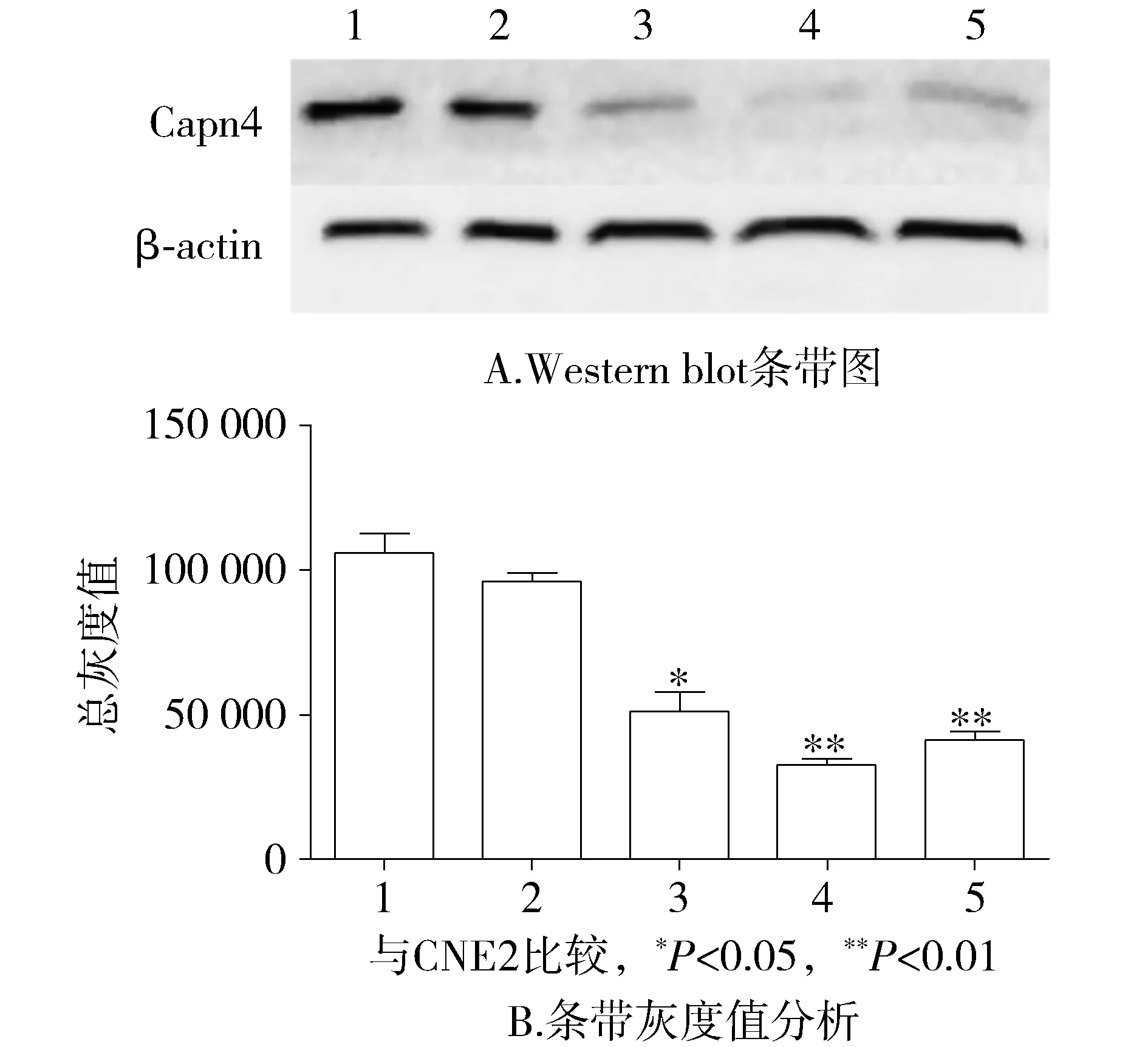
1.CNE2; 2.CNE2Vector; 3.RNAi-21290-1;4.RNAi-21289-2; 5.RNAi-21291-1图1 Western blot分析3株shRNA下调Capn4在CNE2中的表达Figure 1 Expression of Capn4 after transfected with three shRNA in CNE2 cells by Western blot
2.2 ArrayScanTM高内涵技术检测VP-16对CNE2Vector和CNE2Capn4(-)细胞DNA损伤修复的影响
用不同浓度VP-16处理CNE2细胞2 h,高内涵技术检测其DNA损伤情况,由图2可以看到,随着VP-16浓度的增加,其DNA损伤率呈浓度依赖性上升。用2.5 μmol/L浓度作为造模损伤浓度,预处理CNE2细胞2 h,洗掉药物,加入新培养基重新孵育,在0,6,12,24 h,检测其DNA损伤情况,由图3可知,随着时间的推延,DNA损伤逐渐被修复。
用2.5 μmol/L浓度VP-16处理CNE2Vector细胞和CNE2Capn4(-)细胞2 h,洗掉药物,加入新培养基重新孵育,在0,6,12 h,高内涵检测各组细胞γ-H2AX的平均荧光强度。结果显示,在6 h和12 h,CNE2Capn4(-)的损伤都较空载体的CNE2Vector细胞高,差异有统计学意义(P<0.05见图4)。

图2 ArrayScanTM高内涵检测VP-16对CNE2细胞DNA损伤的量效Figure 2 Effect of ArrayScan High-Content Systems on DNA damage and repair of CNE2Vectorand CNE2Capn4(-) cells treated with different doses of VP-16
2.3 NHEJ通路特异性的质粒转染CNE2细胞后分析Capn4 对DNA损伤修复的作用
将NHEJ通路特异性的质粒EJ5-GFP用Fugen6 HD转入细胞,选择稳定表达EJ5-GFP的细胞株,转入pCBASceI质粒表达I-SceⅠ。2.5 μmol/L的VP-16作用后,选取48 h时间点,用ArrayScanTM高内涵分析修复后的GFP平均荧光强度。结果显示:在获得I-SceⅠ限制性酶切位的表达EJ5-GFP的CNE2Capn4(-)细胞与CNE2Vector细胞细胞,以2.5 μmol/L的VP-16作用48 h,CNE2Capn4(-)细胞的GFP平均荧光强度明显更低(P<0.01,见图5)。

图4 ArrayScanTM高内涵检测VP-16对CNE2Vector细胞和CNE2Capn4(-)细胞DNA损伤修复的影响Figure 4 Effect of ArrayScan High-Content Systems on DNA damage and repair of CNE2Vectorand CNE2Capn4(-) cells
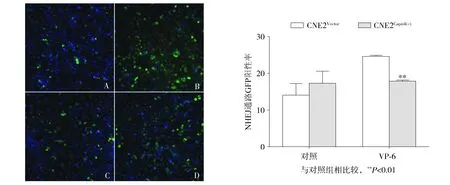
A.未加药处理共同转染EJ5-GFP和I-SceⅠ限制性酶切质粒的CNE2Vector细胞;B.VP-16作用48 h,共同转染EJ5-GFP和I-SceⅠ限制性酶切质粒的CNE2 Vector细胞;C.未加药共同转染EJ5-GFP和I-SceⅠ限制性酶切质粒的CNE2Capn4(-)细胞;D.VP-16作用48 h,共同转染EJ5-GFP和I-SceⅠ限制性酶切质粒的CNE2Capn4(-)细胞图5 ArrayScanTM高内涵检测VP-16对CNE2细胞NHEJ修复通路的影响 (×10)Figure 5 Effect of high content technique on NHEJ repair pathway in CNE2Vector and CNE2Capn4(-)cells (×10)
3 讨论
鼻咽癌治疗常使用的放疗和化疗方案往往通过损伤DNA来杀灭鼻咽癌细胞。DNA双键断裂(DNA double strain break,DSB)是最严重的DNA损伤方式[2]。在DNA损伤中,DSB对肿瘤细胞是最致命的打击,它的修复主要通过两种机制实现:一种是HR,使用姐妹染色体的同源序列重新合成DNA,需要Rad51[7],BRCA1[8]和BRCA2参与,这些蛋白在DNA损伤处形成聚集点(foci);另一种是NHEJ,断裂的DNA末端重新连接,可以在没有模板的情况下进行DNA修复,但也更容易发生错误,主要依赖Ku70/80异二聚体[9]与DNA依赖的蛋白激酶催化亚单位(DNA-PKcs)[10]结合形成DNA-PK全酶,后者募集XRCC4[11]和DNA连接酶Ⅳ完成NHEJ修复。DNA修复能力异常激活和增强是导致鼻咽癌细胞对DNA损伤剂耐药的重要分子基础;相反,修复缺陷则使肿瘤对其高敏感。因此,干扰鼻咽癌细胞DNA修复很可能增敏基于DNA损伤的鼻咽癌放化疗作用。
本实验中使用的依托泊苷(VP-16)是鬼臼毒素[3]的半合成衍生物,可诱导细胞产生DNA双链损伤,临床上广泛用于治疗急性粒细胞白血病等恶性肿瘤。在真核细胞中,外源性化学、物理及生物性物质所致的DSB都可能会触发H2AX的快速磷酸化,从而形成γ-H2AX。实验研究中,γ-H2AX可通过Western blotting法检测,或应用免疫荧光技术,可以清楚地观测到以γ-H2AX焦点形成为特征的DNA双链断裂的区域,这种染色质的改变通常被认为是细胞对DSB做出的敏感反应。目前,γ-H2AX的水平已经成为公认的DSBs发生早期的标志[12]。因此本实验用高内涵技术检测γ-H2AX焦点情况来判断DNA损伤水平。
Capn4(又称CapnS1)是calpain蛋白的一个小分子调节亚基,在调节calpain的稳定性和活性中发挥着至关重要的作用。多项研究表明Capn4的缺失引起calpain-1和calpain-2功能障碍。在转基因小鼠中的研究显示敲除Capn4基因可显著降低calpain活性,从而影响小鼠的正常发育,导致胚胎早期死亡;敲除Capn4 能降低成纤维细胞的迁移和黏附能力。最近的研究报道Capn4在肝细胞癌和肝内胆管上皮细胞癌中高表达[13,14],而且Capn4表达程度与患者的预后密切相关。干扰Capn4的表达能够显著降低肝细胞癌和肝内胆管上皮细胞癌的细胞侵袭和迁移能力。本课题组前期工作表明,无论是在mRNA水平还是在蛋白水平,新鲜细针穿刺活检鼻咽癌组织中的Capn4表达要明显高于正常鼻咽组织。而且,EB病毒感染者Capn4阳性表达率高于无EB病毒感染;肿瘤分化程度越高,Capn4的阳性表达率越低;肿瘤分期越晚,Capn4的阳性表达率越高;出现远处及淋巴结转移的阳性表达率要明显高于未转移的。Kaplan-Meier生存期分析显示Capn4在鼻咽癌中表达的程度与鼻咽癌患者的预后密切相关,Capn4高表达的患者总生存期、无进展生存期均低于低表达者。从而表明Capn4在鼻咽癌恶性生物学行为中起着重要的作用。
本实验结果显示,下调Capn4的表达对VP-16诱导的CNE2细胞DNA损伤修复有抑制作用,而这种抑制作用可能是通过抑制NHEJ通路完成的。有报道显示[15],钙离子内流能使m-Calpain从胞质转位到胞核,从而水解Ku80,裂解的Ku80能够促进DNA双链断裂的修复活性。故而转位的m-Calpain通过Ku80的裂解促进了NHEJ通路修复。这一结论与我们实验结果一致。而Capn4与NHEJ修复通路上哪些蛋白相互作用以及是否影响细胞周期蛋白尚待进一步研究。Capn4的抑制可能成为鼻咽癌放化疗后抑制DNA损伤修复的重要因素。
[1] Huang T, Liu Q, Huang H,etal. Study on genetic epidemiology of nasopharyngeal carcinoma in Guangdong, China[J]. Chin J Med Genet, 2002, 19(2):134-137.
[2] Khanna KK, Jackson SP. DNA double-strand breaks: signaling, repair and the cancer connection[J]. Nat Genet, 2001, 27(3):247-254.
[3] Hare I, Gencheva M, Evans R,etal.Invitroexpansion of bone marrow derived mesenchymal stem cells alters DNA double strand break repair of etoposide induced DNA damage[J]. Stem Cell Int, 2016, 2016:8270464.
[4] Goll DE, Thompson VF, Li H,etal. The calpain system[J]. Physiol Rev, 2003, 83(3):731-801.
[5] Vosler PS, Brennan CS, Chen J. Calpain-mediated signaling mechanisms in neuronal injury and neurodegeneration[J]. Mol Neurobiol, 2008, 38(1):78-100.
[6] Raynaud F, Marcilhac A. Implication of calpain in neuronal apoptosis. A possible regulation of Alzheimer's disease.[J]. FEBS J, 2006, 273(15):3437—3443.
[7] Suwaki N, Klare K, Tarsounas M,etal. RAD51 paralogs: Roles in DNA damage signalling, recombinational repair and tumorigenesis[J]. Semin Cell Devl Biol, 2011, 22(8):898-895.
[8] Kass EM, Helgadottir HR, Chen CC,etal. Double-strand break repair by homologous recombination in primary mouse somatic cells requires BRCA1 but not the ATM kinase[J].Proc Natl Acad Sci USA, 2013, 110(14):5564-5569.
[9] Dolan D, Nelson G, Zupanic A,etal. Systems modelling of NHEJ reveals the importance of redox regulation of Ku70/80 in the dynamics of DNA damage foci[J]. PLoS One, 2013, 8(2):e55190.
[10] Li X, Tian J, Bo Q,etal. Targeting DNA-PKcs increased anticancer drug sensitivity by suppressing DNA damage repair in osteosarcoma cell line MG63[J]. Tumor Biol, 2015, 36(12):9365-9372.
[11] Wang Z, Lin H, Hua F,etal. Repairing DNA damage by XRCC6/KU70 reverses TLR4-deficiency-worsened HCC development via restoring senescence and autophagic flux[J]. Autophagy, 2013, 9(6):925-927.
[12] Riballo E, K? hne M, Rief N,etal. A pathway of double-strand break rejoining dependent upon ATM, artemis, and proteins locating to γ-H2AX foci[J]. Mol Cell, 2004, 16(5):715-716.
[13] Kimura Y, Koga H, Araki N,etal. The involvement of calpain-dependent proteolysis of the tumor suppressor NF2 (merlin) in schwannomas and meningiomas[J]. Nat Med, 1998, 4(8):915-922.
[14] Lakshmikuttyamma A, Selvakumar P, Kanthan R,etal. Overexpression of m-calpain in human colorectal adenocarcinomas[J]. Cancer Epidemiol Biomarkers Prev, 2004, 13(10):1604-1609.
[15] Baek KH, Yu HV, Kim E,etal. Calcium influx-mediated translocation of m-calpain induces Ku80 cleavage and enhances the Ku80-related DNA repair pathway[J]. Oncotarget, 2016, 7(21): 30831-30844.
Effect of Capn4 on DNA damage repair of nasopharyngeal carcinoma cell CNE2 induced by VP-16
WANG Feng1,WANG Hui2,WU Lixian2,ZHENG Ming2*
(1CollegeofIntegrativeMedicine,FujianUniversityofTCM,Fuzhou350004,China;2DepartmentofPharmacology,FujianMedicalUniversity;*Correspondingauthor,E-mail:zming_1956@163.com)
ObjectiveTo investigate the effect of Capn4 on the repair of nasopharyngeal carcinoma cell line CNE2 induced by VP-16 and its possible pathways.MethodsThe Capn4 knockdown CNE2 cells using shRNA were constructed and further identified by Western blot. ArrayScan High-Content Systems were used to analyze the mean fluorescence intensity of γ-H2AX in CNE2 cells and CNE2 cells with down-regulation of Capn4. Non-homologous end joining(NHEJ) pathway-specific plasmid EJ5-GFP was transfected into CNE2 cells and CNE2 cells with down-regulated Capn4 by Fugen6 HD. The positive rate of GFP was detected by ArrayScan High-Content Systems. And the effect of Canp4 down-regulation on VP-16-induced DNA damage NHEJ pathway in CNE2 cells was observed.ResultsThe shRNA inhibited Capn4 expression in CNE2 cells. After treated with 2.5 μmol/L VP-16 for 6 h and 12 h, the damages of CNE2Capn4 (-)cells were higher than those of CNE2Vectorcells. Down-regulation of Capn4 expression inhibited the DNA damage of CNE2 cells induced by VP-16(P<0.01).Compared with CNE2Vectorcells, the GFP average fluorescence intensity of the CNE2Capn4 (-)cells after treated with 2.5 μmol/L VP-16 was significantly lower. Down-regulation of Capn4 expression inhibited the repair of NHEJ pathway in CNE2 cells after DNA damage(P<0.01).ConclusionDown-regulation of Capn4 expression can inhibit radiation-induced DNA damage repair, which may be achieved by inhibition of NHEJ pathway.
Capn4; nasopharyngeal carcinoma; VP-16; shRNA; NHEJ pathway
国家自然科学基金资助项目(81572662)
王丰,女,1979-02生,硕士,讲师,E-mail:fangfei1931@126.com
2017-03-26
R739.6
A
1007-6611(2017)07-0685-06
10.13753/j.issn.1007-6611.2017.07.010
