RNAi沉默Arl4c对结肠癌细胞株HCT116增殖能力的影响
2017-08-07訾永宏李小宝陈红梅
訾永宏,李小宝,陈红梅
(1延安大学附属医院普外科,延安 716000;2延安职业技术学院医学系;*通讯作者,E-mail:ziyonghong2016@163.com)
RNAi沉默Arl4c对结肠癌细胞株HCT116增殖能力的影响
訾永宏1*,李小宝1,陈红梅2
(1延安大学附属医院普外科,延安 716000;2延安职业技术学院医学系;*通讯作者,E-mail:ziyonghong2016@163.com)
目的 探讨利用RNA干扰技术沉默Arl4c基因对结肠癌HCT116细胞株增殖的影响。 方法 将Arl4c基因的si-RNA稳定转染至HCT116细胞,采用RT-PCR、Western blot鉴定干扰效果,以HCT116细胞沉默Arl4c基因组为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组,分别采用四甲基偶氮唑蓝(MTT)法、细胞倍增时间、平板克隆形成实验、流式细胞术检测沉默Arl4c基因后,HCT116细胞生长速度、细胞周期、克隆形成能力的改变。 结果 沉默Arl4c基因后,实验组细胞的生长速度明显下降,G1期细胞增多、S期细胞减少,空白对照、空质粒对照组和实验组细胞平均倍增时间分别为(4.718±0.212)h,(4.981±0.24)h和(6.0±0.137)h;空白对照、空质粒对照组和实验组平均细胞克隆形成数目分别为121±9.00,117±10.00和80±9.00。实验组与空白对照、空质粒对照组相比较,差异有统计学意义(P<0.05)。 结论 Arl4c基因的沉默能够抑制结肠癌细胞HCT116的增殖,可能在结肠癌的发生发展中起重要作用。
RNA干扰; 基因沉默; Arl4c; 结肠癌; HCT116
结肠癌是胃肠道常见的肿瘤,严重危害着人类生命健康,随着诊断技术及治疗的进步,5年生存率仅为50%。结肠癌的发生是多基因多阶段的过程,现代靶向技术的不断进步,使得对结肠癌相关基因的探讨变得更有意义[1]。ADP-核糖基化样因子4C(ADP-ribosylation factor-like 4C,Arl4c)是Arl家族的成员,是ADP-核糖基化因子(ADP-ribosylation factor,Arf)的亚家族成员之一[2],在细胞内的囊泡运输和信号转导过程中具有重要作用。越来越多的研究表明,Arl4c与人类肿瘤的发生发展关系密切[3,4]。本实验前期也发现Arl4c在结肠癌中过表达[1],但其对结肠癌发生过程中的具体作用目前还不十分清楚。因此,本实验拟进一步探讨Arl4c对结肠癌细胞株HCT-116生物学表型的影响。
1 材料与方法
1.1 细胞株、主要试剂与仪器
HCT116细胞购自中南大学细胞中心,由本课题组保存。0.25% Trypsino为长沙研科生物科技有限公司产品(中国),RPMI1640培养基为Gibico公司产品(美国),新生小牛血清为Biology Industries公司产品(以色列),pGCsi/U6/GFP载体购自上海吉凯基因有限公司,四甲基偶氮唑蓝(MTT)为鼎国生物技术有限公司产品,细胞培养板为Corning公司产品(美国),转染试剂Lipofectamine 2000 Reagent为上海英维捷基贸易有限公司产品,Anti-Arl4c McAb、HRP-Rabbit anti Mouse IgG为上海优宁维生物科技股份有限公司产品(中国)。细胞培养箱为Thermor公司产品(美国),倒置显微镜为Olympus公司产品(日本),酶标仪为Bio-TK公司产品(美国)。
1.2 pGC/U6/GFP/si-Arl4c重组载体构建
从基因Bank中提取Arl4c基因(序列号:NM_001282431),设计、合成Arl4c的干扰序列:5′-GGAGGTTCTTCTACTCGCC-3′,并定向克隆入pGCsi/U6/GFP载体,以空载体pGCsi/U6/GFP(Mock)为对照。
1.3 细胞转染
将待转染的HCT116细胞接种于24孔细胞培养板,培养其密度至80%左右,转染方法参照LipofectamineTM2000说明书进行:具体操作如下:将2 μl脂质体2000加入48 μl无血清RPMI1640培养基中轻轻混匀,37 ℃静置5 min;在49 μl RPMI1640无血清培养基中分别加入1 μg重组质粒pGC/U6/GFP/si-Arl4c和1 μg对照质粒pGC/U6/GFP(Mock),轻轻混匀,室温静置5 min;将上述两种混合液,轻轻混匀,37 ℃温箱中孵育20 min;D-Hanks液将待转染细胞洗涤1次,加入450 μl无抗生素的无血清RPMI1640培养基,再加入含有重组质粒的混合溶液,轻轻混匀,37 ℃ 5% CO2培养4 h;弃上清,并换新鲜的RPMI1640完全培养基37 ℃培养48 h,弃上清并传代,加入含400 μg/ml G418的培养基筛选阳性克隆。
1.4 RT-PCR鉴定干扰效果
总RNA抽提及RT-PCR按产品说明书进行。逆转录按FERMENTAS公司的试剂盒说明书操作。逆转录条件:42 ℃ 60 min,70 ℃ 10 min,反应终止后冰上冷却,-20 ℃保存。PCR条件:95 ℃ 1 min预变性;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,循环30次;72 ℃延伸10 min。其中人Arl4c的正向引物为:5′-CATCTACGTGGTGGACTCGG-3′,反向引物为:5′-TGAGGGACTTCCTGCGTTTC-3′,产物大小293 bp。其中人GAPDH的正向引物为:5′-GAGAAGGCTGGGGCTCATTT-3′,反向引物为:5′-AGTGATGGCATGGACTGTGG-3′,产物大小231 bp。扩增产物用1%琼脂糖凝胶电泳鉴定。
1.5 Western blot鉴定干扰效果
根据细胞蛋白提取说明抽提细胞蛋白质。采用聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,分别制备浓度为10%的分离胶和浓度为5%浓缩胶;各取50 μg蛋白样品,按比例加入适量5%的巯基乙醇,100 ℃煮沸变性5 min。电泳:初始电压60 V,约30 min,将电压调至100 V,约2 h;转膜:100 V转膜约1 h。转膜完成后,NC膜用含5%的脱脂奶粉4 ℃封闭过夜。封闭后的NC膜经PBST洗板3次×5 min,加入含1 ∶400的Anti-Arl4c McAb,摇床上室温反应2 h,将膜取出PBST洗3次×5 min,加1 ∶3 000稀释的兔抗小鼠HRP-Rabbit anti Mouse IgG,摇床上室温下避光反应60 min;PBST洗板3次×5 min,暗室曝光、显影、定影,扫描。
1.6 MTT法测定细胞生长曲线
以Arl4c基因沉默组的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组,每组细胞均按5×103/孔接种于96孔培养板,37 ℃、5% CO2培养24 h;每孔再加入MTT至终浓度为5 g/L,继续培养4 h;弃上清,加入DMSO 200 μl;待蓝紫色结晶颗粒充分溶解后,测OD490值。然后以OD值为纵轴,时间为横轴绘制细胞生长曲线,比较实验组与对照组细胞的生长速度。
1.7 细胞倍增时间测定
以Arl4c基因沉默组的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组,每组细胞均按103/孔接种于24孔板,置于37 ℃、5% CO2培养24 h;用胰酶消化并进行细胞计数。每组设4个复孔,实验重复3次。计算每组细胞的平均倍增时间。倍增时间公式如下:TD=t[lg2/(lgNt-lgN0)],其中,TD为细胞倍增时间;t为培养时间;N0,Nt分别代表接种后及培养t小时的细胞数。
1.8 平板克隆形成能力测定
以Arl4c基因沉默组的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组。取对数生长期细胞接种6孔板,每孔加入1 000个细胞,置于37 ℃、5% CO2培养2周;弃上清,PBS洗板2次,甲醇固定15 min;Giemsa染色15 min,水洗,空气干燥;显微镜下计数克隆数,细胞数大于50个的计数为1个克隆数。每个浓度组细胞均设3个平行样,每个实验重复3次,计算平均克隆形成数。
1.9 细胞周期的测定
以Arl4c基因沉默组的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组,每组细胞均按5×l03接种于细胞培养瓶,贴壁后用无血清培养基洗涤2次,再用无血清培养基继续培养12 h;胰酶消化,离心收集细胞,PBS洗2次,PI染色30 min,流式细胞仪分析,并按以下公式计算其增殖指数(proliferative index,PI)。公式为PI=(G2M+S)/(G0/1+S+G2M)×l00%。
1.10 统计学分析
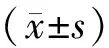
2 结果
2.1 HCT116/si-Arl4c、HCT116/si-M细胞系的构建
结果显示,Arl4c mRNA在HCT116/pGC/U6/GFP/si-Arl4c细胞中表达明显降低,而在HCT116和HCT116/pGC/U6/GFP细胞的Arl4c mRNA水平变化不明显,分别将HCT116/pGC/U6/GFP/si-Arl4c和HCT116/pGC/U6/GFP细胞系命名为HCT116/si-Arl4c和HCT116/si-M(见图1A)。进一步采用Western blot方法分别检测HCT116,HCT116/si-Arl4c和HCT116/si-M细胞中Arl4c蛋白的表达水平,结果显示,Arl4c蛋白在HCT116/si-Arl4c细胞中表达明显降低(见图1B),结果与RT-PCR检测结果相一致。成功建立沉默Arl4c的细胞系,用于后续实验。
2.2 细胞生长曲线
以Arl4c基因沉默组的HCT116细胞(HCT116/si-Arl4c)为实验组,以转染空质粒的HCT116细胞(HCT116/si-M)和空白的HCT116细胞为对照组,用MTT实验检测其生长速度。结果表明,与对照组细胞HCT116、HCT116/si-M相比,实验组细胞HCT116/si-Arl4c的生长速度明显下降(见图2)。
2.3 细胞倍增时间
HCT116、HCT116/si-M和HCT116/si-Arl4c细胞平均倍增时间为分别为(4.718±0.212)h、(4.981±0.24)h和(6.0±0.137)h,与对照组HCT116、HCT116/si-M细胞相比,沉默Arl4c基因后,实验组细胞平均倍增时间明显延长,与对照组比较,差异有统计学意义(P<0.05,见图3)。
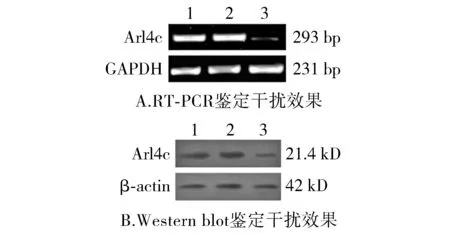
1.HCT116细胞;2.HCT116/si-M细胞;3.HCT116/si-Arl4c细胞图1 稳定转染pGC/U6/GFP/si-Arl4c和pGC/U6/GFP的实验结果Figure 1 Identification of cells with stable transfection of pGC/U6/GFP/si-Arl4c and pGC/U6/GFP by RT-PCR and Western blot
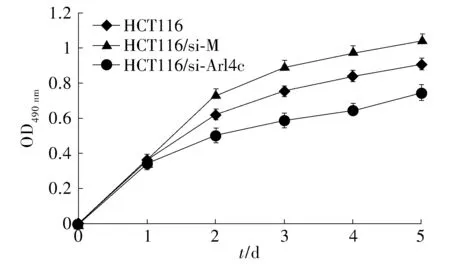
图2 MTT法检测Arl4c沉默组细胞和对照组细胞的生长曲线Figure 2 Cell proliferation curve of HCT116 with or without Arl4c silencing by MTT assay
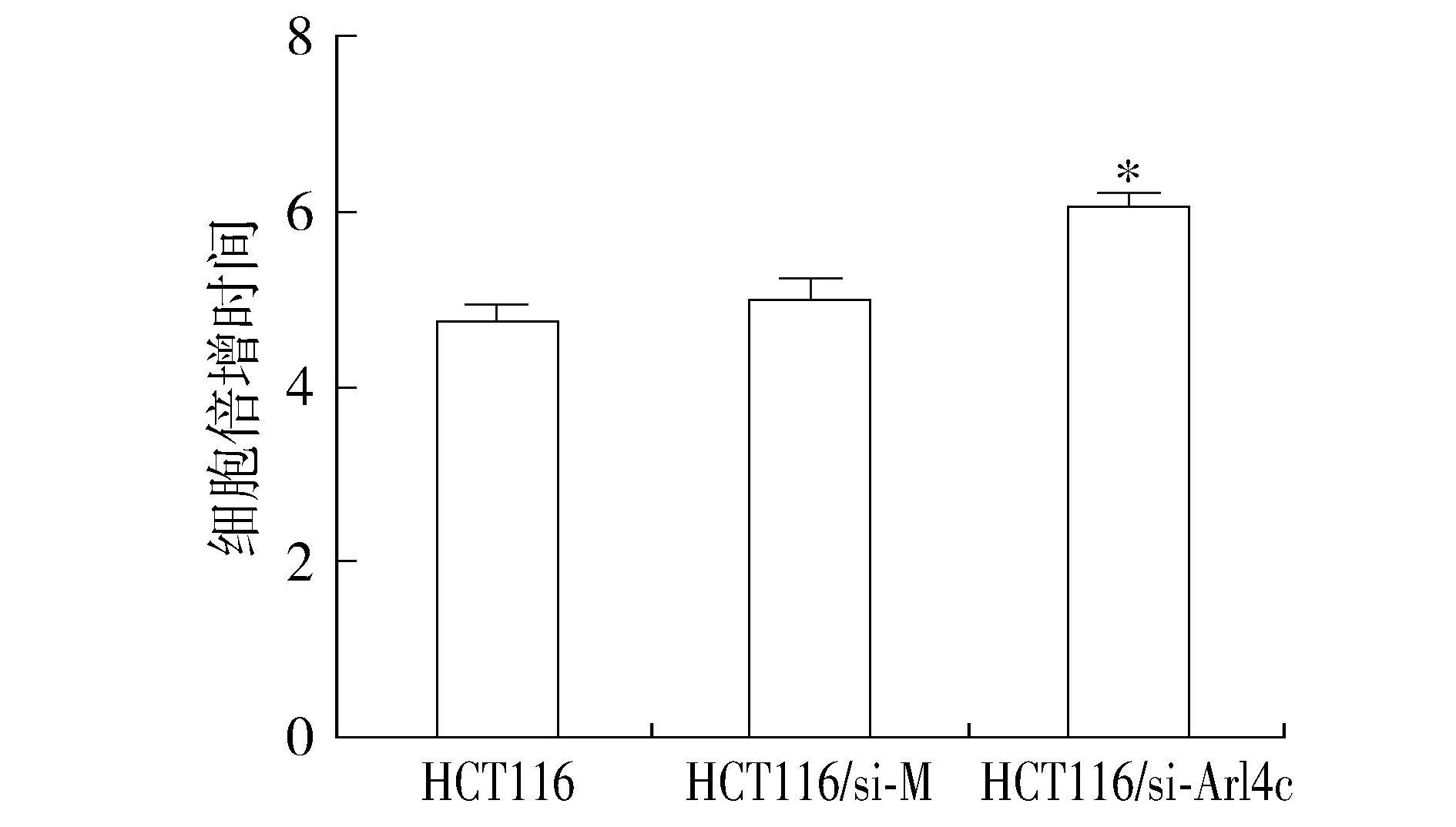
与HCT116和HCT116/si-M比较,*P<0.05图3 沉默Arl4c基因后HCT116细胞的平均倍增时间Figure 3 The cells double times of HCT116 with or without Arl4c knockdown
2.4 克隆形成能力
结果显示:HCT116、HCT116/si-M、HCT116/si-Arl4c细胞克隆形成数目分别为121±9.00,117±10.00、80±9.00,沉默Arl4c基因后,明显减弱了HCT116细胞的克隆形成能力,与对照组HCT116、HCT116/si-M比较,差异有统计学意义(P<0.05,见图4)。
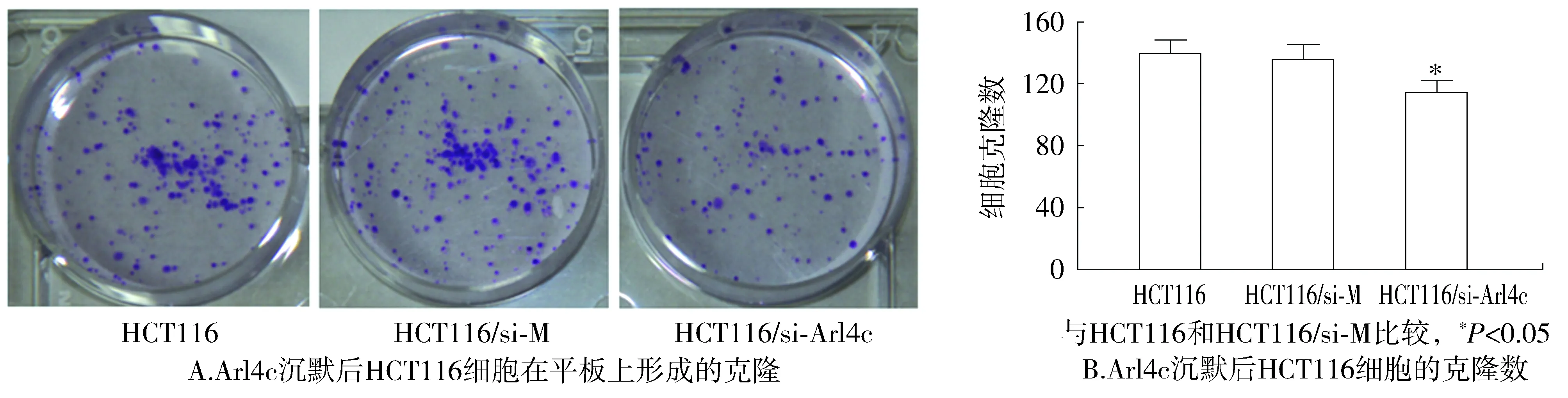
图4 平板克隆形成实验结果Figure 4 Results of colony formation
2.5 细胞周期的分布
流式细胞仪检测细胞周期的分布结果显示,实验组HCT116/si-Arl4c细胞与对照组HCT116、HCT116/si-M相比,实验组细胞HCT116/si-Arl4c G1期细胞增多,S期细胞减少(见图5,6),其结果与细胞生长曲线、平板克隆形成实验结果趋势相一致。
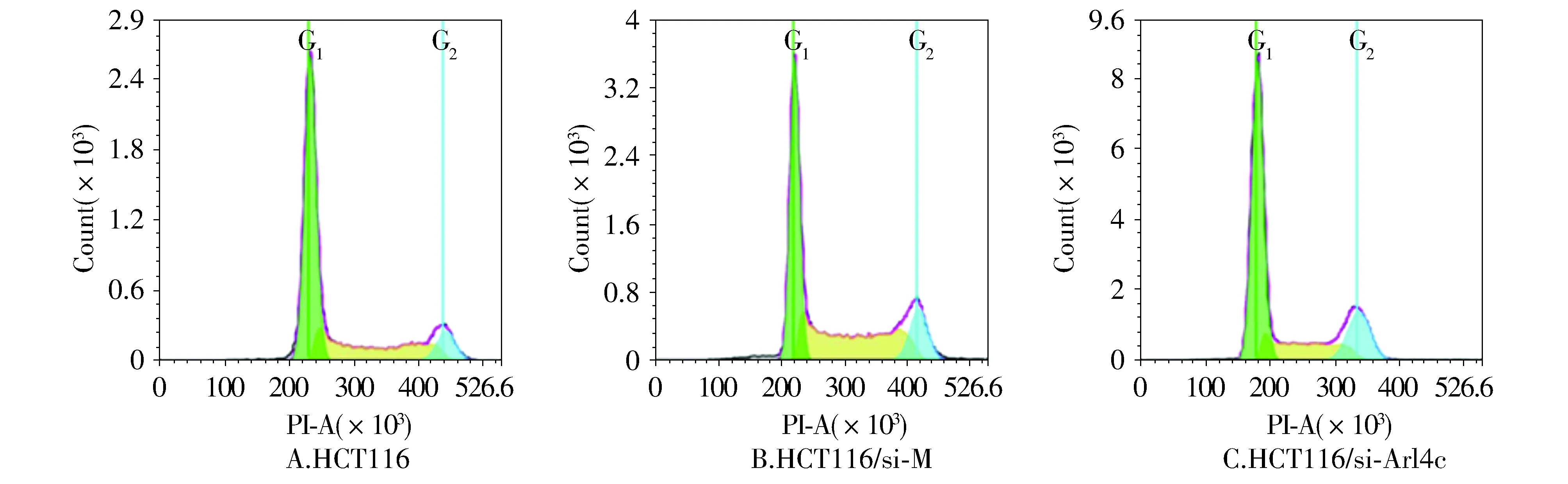
图5 Arl4c基因沉默后HCT116细胞周期检测Figure 5 Changes of cells cycle of HCT116 after Arl4c gene silencing

图6 Arl4c沉默后HCT116细胞的周期分布Figure 6 Distribution of cell cycle of HCT116 cells after Arl4c gene silencing
3 讨论
Arl4c也称为Arl7,是含有192个氨基酸的属于小GTP酶的蛋白[5]。Arl4c是Arf和Arl家族成员中特殊的成员,其特殊性在于其是唯一mRNA表达由肝脏X受体-类视黄醇X受体激动剂或人巨噬细胞中的胆固醇负载诱导,Arl4c可能在AI(apoA-I)依赖性胆固醇分泌过程中起作用并且可以通过与微管的相互作用调节细胞内水泡运输[6]。Arl4c蛋白在其C-末端含有核定位信号,在细胞膜、细胞质中都可以存在,其功能和定位取决于它们受控的GTP的结合和水解[7]。研究显示Arl4c可能在胆固醇代谢紊乱中起着重要的作用[8]。
前期研究发现Arl4c在结肠癌组织中高表达,在结肠癌细胞株HCT116中高表达,且Arl4c的表达在结肠癌不同性别、不同年龄、不同临床分期及有无淋巴结转移的患者中差异无统计学意义,而在不同病理分化的患者中差异有统计学意义[4],这提示Arl4c可能在结肠癌的发生及早期发展中起到重要作用。因此,本研究利用RNA干扰(RNA interference, RNAi)技术特异性地抑制结肠癌细胞HTC116中Arl4c基因的表达,通过MTT、细胞倍增时间、平板克隆形成实验、流式细胞术实验研究Arl4c对结肠癌细胞HTC116增殖的影响,结果Arl4c表达的降低能明显地抑制结肠癌细胞HTC116的增殖,减弱结肠癌细胞HTC116的克隆形成能力,这说明Arl4c在结肠癌发生发展中扮演着重要角色。Fujii等[3]研究显示Arl4c在肺癌中高表达,而在正常肺组织中未见表达,认为Arl4c参与肺癌的发生,并且可能用于抑制肺癌细胞增殖和侵袭的新的靶向治疗,同时认为Arl4c表达的增加是由于APC、β-连环蛋白及Ras的遗传改变,使得Wnt和EGF信号通路被活化,促进肿瘤的发生。由于Wnt/β-catenin和EGF/Ras信号通路的改变引起Arl4c表达异常导致肿瘤的发生。Arl4c在肺肿瘤和舌肿瘤样本中高表达,而在相对应的非肿瘤样本中不表达,且肿瘤样本中Arl4c基因3′端非翻译区DNA甲基化现象明显减弱。10-11易位甲基胞嘧啶双加氧酶(TET)可介导DNA去甲基化,在肺癌细胞NCI-H520中高表达,敲除NCI-H520细胞中TET基因可减少5-羟甲基胞嘧啶(5hmC)的表达水平,并且促进3′端非翻译区DNA甲基化,降低Arl4c的表达,同时减弱了Arl4c介导的细胞迁移能力[9]。这说明Arl4c与肿瘤细胞的功能密切相关。Arend等[10]研究认为Ar14c是通过Wnt/β-连环蛋白通路参与上皮-间质转化,这一转化途径是肿瘤发生的起始事件。
总之,干扰Arl4c基因表达可引起结肠癌细胞周期阻滞,从而导致细胞增殖倍增能力的降低,提示Arl4c在结肠癌的发生发展中起着重要的作用,这为以Arl4c为靶点的结肠癌的诊断及治疗提供理论依据及靶向策略。
[1] 訾永宏,姬乐,陈红梅,等.Arl4c在结肠癌中的表达及其临床意义[J].山西医科大学学报,2017,48(1):44-46.
[2] Gillingham AK, Munro S. The small G proteins of the Arffamily and their regulators[J]. Annu Rev Cell Dev Biol,2007,23:579-611.
[3] Fujii S, Matsumoto S, Nojima S,etal. Arl4c expression in colorectal and lung cancers promotes tumorigenesis and may represent a novel therapeutic target[J]. Oncogene,2015,34(37):4834-4844.
[4] Su D, Katsaros D, Xu S,etal. ADP-ribosylation factor-like 4C (ARL4C), a novel ovarian cancer metastasis suppressor, identified by integrated genomics[J]. Am J Transl Res,2015,7(2):242-256.
[5] Burd CG, Strochlic TI, Setty SR. Arf-like GTPases: not so Arf-like after all[J]. Trends Cell Biol,2004,14(12):687-694.
[6] Wei SM, Xie CG, Abe Y,etal. ADP-ribo-sylation factor like 7 (ARL7) interacts with alpha-tubulin and modulates intracellular vesicular transport[J]. Biochem Biophys Res Commun,2009,384(3):352-356.
[7] Hofmann I, Thompson A, Sanderson CM,etal. The Arl4 family of small G proteins can recruit the cytohesin Arf6 exchange factors to the plasma membrane[J]. Curr Biol,2007,17(8):711-716.
[8] Sun D, Zhang J, Xie J,etal. MiR-26 controls LXR-dependent cholesterol efflux by targeting ABCA1 and ARL7[J]. FEBS Lett,2012,586(10):1472-1479.
[9] Fujii S, Shinjo K, Matsumoto S,etal.Epigenetic upregulation of ARL4C, due to DNA hypomethylation in the 3'-untranslated region, promotes tumorigenesis of lung squamous cell carcinoma[J].Oncotarget,2016,7(49):81571-81587.
[10] Arend RC, Londono-Joshi AI, Straughn JM Jr,etal. The Wnt/β-catenin pathway in ovarian cancer: a review[J].Gynecol Oncol,2013,131(3):772-779.
Effect of Arl4c gene silencing by RNA interference on cell proliferation of colon cancer cell line HCT116
ZI Yonghong1*,LI Xiaobao1,CHEN Hongmei2(1
DepartmentofGeneralSurgery,AffiliatedHospitalofYan’anUniversity,Yan’an716000,China;2DepartmentofMedicine,Yan’anVocationalandTechnicalCollege;*Correspondingauthor,E-mail:ziyonghong2016@163.com)
ObjectiveTo investigate the effects of RNA interference-mediated gene silence of Arl4c on the proliferation of colon cancer cell line HCT116.MethodsColon cancer cell line HCT116 was transfected with Arl4c small interfering RNA(siRNA), and then the expression of Arl4c was determined by RT-PCR and Western blot. HCT116 cells after Arl4c gene knockdown were chosen as experimental group, and HCT116 cells transfected with empty plasmid transfection and HCT116 cells were chosen as control groups. Then the proli-feration of HCT116 was examined by 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide(MTT) assay, the cell doubling time of HCT116 was examined by double time assay, the colony formation ability of HCT116 was examined by colony formation assay, and the cell cycles of HCT116 were examined by flow cytometry assay.ResultsCompared with the blank control group and empty plasmid control group, the growth ability in experimental group was significantly decreased,G1phase cells increased, and S phase cells decreased. The doubling time in blank control group,empty plasmid group and experimental group was (4.718±0.212)h,(4.981±0.24)h,(6.0±0.137)h. The colony number was 121±9.00 in blank control group,117±10.00 in empty plasmid control group, and 80±9.00 in experimental group, and there was significant difference between control groups and experimental group(P<0.05).ConclusionArl4c gene silencing by RNAi can suppress the proliferation of colon cancer cell line HCT116, and it may be involved in colon cancer progression.
RNA interference; gene silencing; Arl4c; colon cancer; HCT116
訾永宏,男,1982-02生,学士,主治医师.E-mail:ziyonghong2016@163.com
2017-03-29
R735.35
A
1007-6611(2017)07-0676-05
10.13753/j.issn.1007-6611.2017.07.008
