pSilencer 3.1-Sirt3基因RNA干扰表达载体的构建及鉴定
2017-08-07马晓军韩洛川史海龙
曲 璇,李 军,马晓军,韩洛川,史海龙
(陕西中医药大学基础医学院生物学教研室,咸阳 712046;*通讯作者,E-mail:quxuan519@163.com)
pSilencer 3.1-Sirt3基因RNA干扰表达载体的构建及鉴定
曲 璇*,李 军,马晓军,韩洛川,史海龙
(陕西中医药大学基础医学院生物学教研室,咸阳 712046;*通讯作者,E-mail:quxuan519@163.com)
目的 构建Sirt3基因的RNA干扰载体,并在真核细胞中进行pSilencer 3.1-Sirt3的功能鉴定。 方法 利用体外DNA合成技术及液相色谱纯化技术合成Sirt3干扰序列,通过酶切将干扰序列连接至pSilencer 3.1载体中,将阳性克隆载体转入感受态大肠杆菌细胞后,筛选阳性克隆,通过第二代体外DNA测序技术进行序列测定。将测序正确的克隆用于Western blot实验和real time PCR实验,以对其在真核细胞中的正确表达和内源性Sirt3的干涉效果进行鉴定。 结果 PCR扩增得到序列测定结果与干扰序列完全一致。构建的pSilencer 3.1-Sirt3质粒在AGS和SGC-7901细胞中进行基因的转染,pSilencer 3.1-Sirt3能够有效抑制内源性Sirt3的mRNA水平和蛋白质水平的表达。 结论 成功构建获得Sirt3干扰载体,并有效降低Sirt3的mRNA和蛋白质水平的表达,为今后Sirt3的功能研究提供良好的基础。
Sirtuin-3; RNA干扰; 载体构建
自从20世纪70年代在酵母中首次发现两种组蛋白去乙酰化酶以来,组蛋白乙酰化和去乙酰化的研究越来越受到关注。近年来,人们发现去乙酰化酶Sirtuin-3(Sirt3)具有依赖于NAD的组蛋白去乙酰化酶活性,能够对乙酰化的线粒体蛋白进行脱乙酰基[1-3]。目前已发现Sirt3主要定位于肝、脑、肾和心脏等富含线粒体的组织器官中[3,4],Sirt3的作用底物有AceCS2、琥珀酸脱氢酶和谷氨酸脱氢酶等重要的能量代谢相关酶类,这对于维持和调节线粒体的正常生理功能具有重要意义[5,6]。大量研究表明,Sirt3可能与细胞生长、衰老、应激反应、能量代谢、DNA的损伤修复、细胞周期调控以及细胞的凋亡密切相关[2,7,8]。
RNA干扰(RNA interference, RNAi)是由双链RNA(double stranded RNA)分子在mRNA水平关闭相应序列基因表达,诱发的特定基因沉默的过程。RNAi技术可造成特异性基因沉默,广泛应用于基因功能研究中。
因此,基于Sirt3对细胞的重要意义,本研究构建了针对人Sirt3基因的特异性短发卡RNA(short hairpin RNA, shRNA)真核表达载体,并观察了其在胃癌细胞AGS和SGC-7901中对Sirt3基因表达的抑制作用。这对于进一步研究Sirt3与疾病发生的关系、解读相关机制、探讨其生物学功能均具有重要意义。
1 材料与方法
1.1 细胞及主要试剂
HEK293、AGS和SGC-7901细胞购自中科院细胞库,由本实验室冻存;大肠杆菌XL10由第四军医大学生物化学与分子生物学实验室惠赠;干扰质粒pSilencer 3.1-H1 neo及pSilencer 3.1阴性对照载体购自Ambion公司,BamHⅠ和HindⅢ等限制性核酸内切酶、DNA连接酶均购自TaKaRa;质粒提取试剂盒及凝胶回收纯化试剂盒均购自U-gene公司;Sirt3单克隆抗体为CST公司产品。
1.2 人Sirt3基因特异性RNAi片段的设计及合成
采用Vector NTI 5.0软件,根据人Sirt3的cDNA序列和干扰载体的设计要求,设计3对siRNA寡核苷酸链(Sirt3-938:5′-CUUGCUGCUGUGGUUGAUTT-3′;Sirt3-1211:5′-GCUUGAUGGACCAGACAAATT-3′;Sirt3-2419:5′-GCGCCUUAAUAAGAACAAATT-3′)。序列由上海生工生物工程公司合成。
1.3 人Sirt3基因siRNA干扰序列的鉴定
将合成的3对Sirt3的siRNA干扰序列转染胃癌细胞AGS和SGC-7901,按LipofectAMINE2000脂质体转染试剂盒说明书进行操作。将5×105个AGS和SGC-7901细胞/每孔接种于6孔板,接种后24 h取三对100 nmol/L siRNA序列分别与10 μl的LipofectAMINE2000混匀,进行瞬时转染。转染后24 h,收集蛋白检测Sirt3蛋白水平的表达。
1.4 pSilencer 3.1-Sirt3载体的构建

1.5 LipofectAMINE2000瞬时转染真核细胞
按LipofectAMINE2000脂质体转染试剂盒说明书进行操作。将AGS和SGC-7901细胞5×105个/孔接种于6孔板,接种后24 h,取4 μg阴性对照空载体、pSilencer 3.1-Sirt3质粒分别与10 μl的LipofectAMINE2000混匀,20 min后进行瞬时转染。
1.6 Western blot检测Sirt3的蛋白水平表达
分别收集25 cm2培养瓶中阴性对照组、pSilencer 3.1-Sirt3干扰组的细胞样品,用RIPA裂解液裂解细胞,提取蛋白进行定量,加入5×SDS凝胶加样缓冲液,煮沸5 min,按照蛋白定量结果进行加样,行12% SDS-PAGE凝胶电泳,采用半干法将蛋白转移至NC膜上。将NC膜用5%脱脂奶封闭,分别加入Sirt3多抗(1 ∶1 000)和β-actin单抗(1 ∶1 000),室温孵育1 h,用山羊抗兔或山羊抗小鼠二抗(1 ∶5 000),室温孵育1 h,用ECL发光,胶片显色,分析结果。以β-actin为内参照。
1.7 Real-time PCR检测Sirt3的mRNA水平表达
按TRIzol试剂盒说明书分别提取AGS和SGC-7901细胞组、pcDNA3.1阴性对照载体、pcDNA3.1-Sirt3过表达实验组样品的总RNA。按说明书进行RT-PCR,反转录合成cDNA的第一条链,Sirt3的扩增引物(上游引物:5′-CCCCAAGCCCTTTTTCACTTT-3′;下游引物:5′-CGACACTCTCTC AAGCCCA-3′),PCR扩增条件为:预变性94 ℃持续5 min,变性94 ℃ 30 s、退火55 ℃ 30 s、延伸72 ℃ 30 s,共30个循环,72 ℃延伸7 min。以GAPDH为内参照(上游引物为5′-ACCCAGAAGACTGTGGATGG-3′,下游引物为5′-TCTAGACGGCAGGTCAGGTC-3′)。PCR扩增条件同Sirt3扩增条件相同。以上2对PCR引物均由上海生工生物工程公司合成。PCR结束后,将所得结果按照公式进行数据分析。
2 结果
2.1 人Sirt3干扰序列对Sirt3蛋白水平表达的鉴定
相对于阴性对照组,Sirt3-938、Sirt3-1211和Sirt3-2419三组siRNA转染至胃癌细胞中,均有效抑制Sirt3蛋白表达(见图1)。其中Sirt3-938干扰序列作用最明显,可用于后期实验研究。
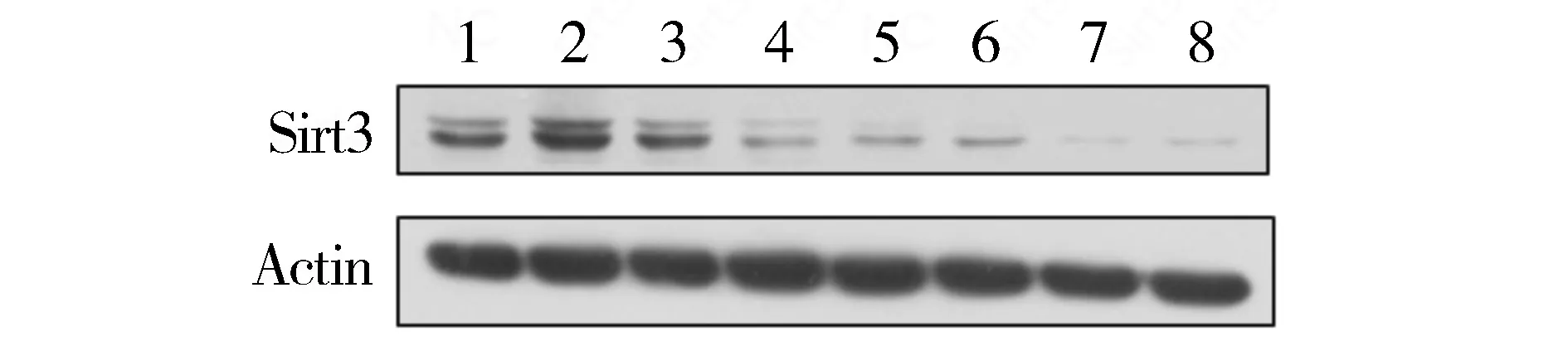
1-4.AGS细胞;5-8.SGC-7901细胞;1,5.阴性对照;2,6.转染Sirt3-1211;3,7.转染Sirt3-2419;4,8.转染Sirt3-938图1 Sirt3-938、Sirt3-1211 and Sirt3-2419降低Sirt3蛋白水平的表达Figure 1 Sirt3-938,Sirt3-1211 and Sirt3-2419 decreased the protein expression of Sirt3
2.2 人Sirt3基因真核干扰表达载体pSilencer 3.1-Sirt3的构建和鉴定
合成的2条寡核苷酸链退火后形成双黏端的双链DNA片段,将该片段和pSilencer 3.1-H1 neo分别用BamHⅠ和Hind Ⅲ进行双酶切。最终由T4DNA连接酶将两者连接后,构成质粒pSilencer 3.1-Sirt3(构建过程见图2)。为了验证载体构建是否正确,首先用内切酶BamHⅠ和Hind Ⅲ对pSilencer 3.1-Sirt3进行酶切鉴定,在小于100 bp的位置观察到目的片段经2%琼脂糖凝胶电泳,初步证明克隆构建成功。为了进一步验证,将得到的阳性菌株送上海生工生物工程技术公司测序,证实干扰序列成功插入载体中,pSilencer 3.1-Sirt3干扰载体构建成功。
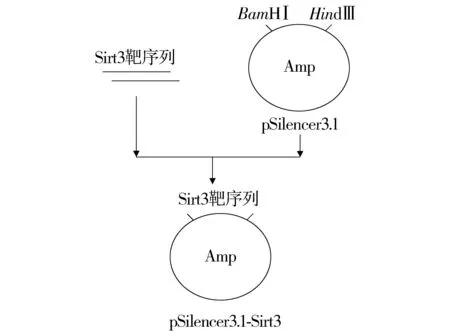
图2 pSilencer3.1-Sirt3载体的构建Figure 2 The construction of pSilencer3.1-Sirt3
2.3 实时定量PCR检测Sirt3的mRNA表达水平
按TRIzol试剂盒说明书分别提取AGS和SGC-7901细胞组、阴性对照载体、pSilencer 3.1-Sirt3转染组样品的总RNA。按说明书进行RT-PCR,反转录合成cDNA的第一条链,Sirt3的扩增引物(上游引物:5′-CCGCGGTACCATGGCGTTCTGGGGTTG-3′;下游引物:5′-CCGCTCTAGACTATTTGTCTGGTCCATCAAGC-3′)。PCR扩增条件为:预变性94 ℃ 5 min,变性94 ℃ 30 s、退火55 ℃ 30 s、延伸72 ℃ 30 s,共30个循环,72 ℃延伸7 min。以GAPDH为内参照。PCR结束后,将所得结果按照公式进行数据分析。结果显示Sirt3干扰载体有效降低Sirt3的mRNA水平(见图3)。

与对照组比较,*P<0.000 1图3 pSilencer 3.1-Sirt3在AGS和SGC-7901细胞均能够显著降低Sirt3mRNA的表达Figure 3 The pSilencer 3.1-Sirt3 down-regulated the mRNA level of Sirt3 in both AGS and SGC-7901 cells
2.4 Western blot检测Sirt3蛋白水平的表达
结果表明,干扰载体转染组细胞的Sirt3蛋白的表达水平明显受到抑制(见图4)。这与RNA水平的检测结果一致,证实Sirt3干扰载体在两种肿瘤细胞中有效地抑制了Sirt3的蛋白表达。以上结果证明Sirt3干扰载体构建成功,可用于后期实验研究。
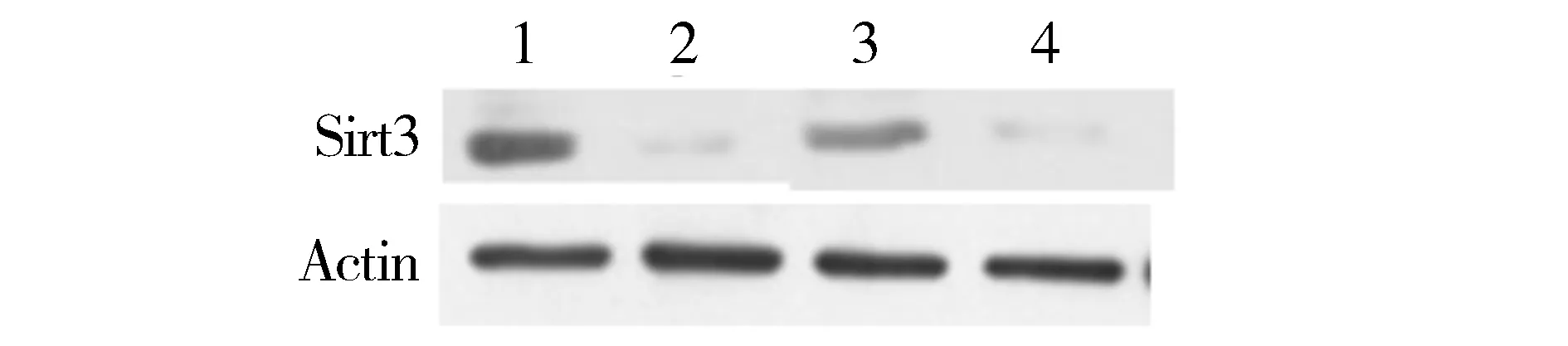
1.AGS阴性对照; 2.AGS细胞转染pSilencer 3.1-Sirt3;3.SGC-7901阴性对照;4.SGC-7901细胞转染pSilencer-3.1-Sirt3图4 pSilencer 3.1-Sirt3降低Sirt3的蛋白水平的表达Figure 4 The pSilencer 3.1-Sirt3 down-regulated the protein level of Sirt3
3 讨论
Sirt3是唯一在遗传学上与人的寿命相关的成员,由于其主要在线粒体定位,因此具有特殊的研究意义[9]。许多研究表明,在应激条件或细胞膜去极化条件下,Sirt3会促进线粒体有氧氧化功能,对于细胞的生存和维持能量的供应必不可缺[7,10]。Sirt3在组织器官中的表达缺陷或突变则与许多疾病的发生密切相关,如心脏功能缺陷、神经退行性病变等[11,12]。活性氧(reactive oxygen species,ROS)是导致细胞损伤的重要因素,目前认为,Sirt3主要从三个方面清除内源性ROS的水平:Sirt3可以通过去乙酰化的方式直接激活超氧化物歧化酶2(superoxide dismutase 2,SOD2),清除ROS[13,14];Sirt3通过增强电子传递链的功能,提高ATP生成效率,减少ROS生成[15,16];Sirt3通过激活转录因子FOXO3A活性,促进抗氧化因子的转录和表达[17,18]。此外,最新的研究发现Sirt3在肿瘤细胞中的作用机制也成为科学界的一个研究重点[19]。现已证实SIRT3在基因组稳定性方面可能发挥重要的作用。另外,Sirt3还可以通过破坏HIF-1α的稳定性来介导代谢重组,然后调节糖酵解基因的表达,从而抑制肿瘤的发生,证明了Sirt3在细胞代谢中的重要作用[20]。因此,本研究首先筛选了三对Sirt3干扰序列,从中筛选Sirt3干涉效果最好的一对(Sirt3-938),并将该序列成功插入干涉载体中。结果显示pSilencer3.1-Sirt3在真核细胞中有效降低内源性Sirt3的mRNA水平和蛋白质水平,这对于进一步研究Sirt3与疾病发生的关系、解读相关机制、探讨其生物学功能均具有重要意义。
[1] Koentges C, Bode C, Bugger H. SIRT3 in cardiac physiology and disease[J]. Front Cardiovasc Med, 2016, 3: 38.
[2] Ashraf N, Zino S, Macintyre A,etal. Altered sirtuin expression is associated with node-positive breast cancer[J]. Br J Cancer, 2006, 95(8): 1056-1061.
[3] Yamamoto H, Schoonjans K, Auwerx J. Sirtuin functions in health and disease[J]. Mol Endocrinol, 2007, 21(8):1745-1755.
[4] Michan S, Sinclair D. Sirtuins in mammals: insights into their biological function[J]. Biochem J, 2007, 404(1):1-13.
[5] Kim HS, Patel K, Muldoon-Jacobs K,etal. SIRT3 is a mitochondria-localized tumor suppressor required for maintenance of mitochondrial integrity and metabolism during stress[J]. Cancer Cell, 2010, 17(1):41-52.
[6] Lu Y, Wang YD, Wang XY,etal. SIRT3 in cardiovascular diseases: Emerging roles and therapeutic implications[J]. Int J Cardiol, 2016, 220:700-705.
[7] Hirschey MD, Shimazu T, Goetzman E,etal. SIRT3 regulates mitochondrial fatty-acid oxidation by reversible enzyme deacetylation[J]. Nature, 2010, 464(7285):121-125.
[8] Hebert AS, Dittenhafer-Reed KE, Yu W,etal. Calorie restriction and SIRT3 trigger global reprogramming of the mitochondrial protein acetylome[J]. Mol Cell, 2013, 49(1):186-199.
[9] Chen J, Wang A, Chen Q. SirT3 and p53 deacetylation in aging and cancer[J]. J Cell Physiol, 2016.
[10] Yang W, Nagasawa K, Munch C,etal. Mitochondrial sirtuin network reveals dynamic SIRT3-dependent deacetylation in response to membrane depolarization[J]. Cell, 2016, 167(4): 985-1000 e21.
[11] Winnik S, Auwerx J, Sinclair DA,etal. Protective effects of sirtuins in cardiovascular diseases: from bench to bedside[J]. Eur Heart J, 2015, 36(48):3404-12.
[12] Kincaid B, Bossy-Wetzel E. Forever young: SIRT3 a shield against mitochondrial meltdown, aging, and neurodegeneration[J]. Front Aging Neurosci, 2013, 5:48.
[13] Qiu X, Brown K, Hirschey MD,etal. Calorie restriction reduces oxidative stress by SIRT3-mediated SOD2 activation[J]. Cell Metab, 2010, 12(6):662-667.
[14] Chen Y, Zhang J, Lin Y,etal. Tumour suppressor SIRT3 deacetylates and activates manganese superoxide dismutase to scavenge ROS[J]. EMBO Rep, 2011, 12(6):534-541.
[15] Ahn BH, Kim HS, Song S,etal. A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis[J]. Proc Natl Acad Sci U S A, 2008, 105(38):14447-14452.
[16] Rahman M, Nirala NK, Singh A,etal. Drosophila Sirt2/mammalian SIRT3 deacetylates ATP synthase beta and regulates complex V activity[J]. J Cell Biol, 2014, 206(2):289-305.
[17] Sundaresan NR, Gupta M, Kim G,etal. Sirt3 blocks the cardiac hypertrophic response by augmenting Foxo3a-dependent antioxidant defense mechanisms in mice[J]. J Clin Invest, 2009, 119(9): 2758-2771.
[18] Peserico A, Chiacchiera F, Grossi V,etal. A novel AMPK-dependent FoxO3A-SIRT3 intramitochondrial complex sensing glucose levels[J]. Cell Mol Life Sci, 2013, 70(11):2015-2029.
[19] Ansari A, Rahman MS, Saha SK,etal. Function of the SIRT3 mitochondrial deacetylase in cellular physiology, cancer, and neurodegenerative disease[J]. Aging Cell, 2017, 16(1):4-16.
[20] Finley LW, Carracedo A, Lee J,etal. SIRT3 opposes reprogramming of cancer cell metabolism through HIF1alpha destabilization[J]. Cancer Cell, 2011, 19(3):416-428.
Construction and biological function identification of pSilencer 3.1-Sirt3 vector
QU Xuan*,LI Jun,MA Xiaojun,HAN Luochuan,SHI Hailong
(ShaanxiUniversityofChineseMedical,Xianyang712046,China;*Correspondingauthor,E-mail:quxuan519@163.com)
ObjectiveTo construct the Sirt3 interference vector, and verify its biological function in mammal cells.MethodsThe Sirt3 interference sequence was synthesized byinvitroDNA synthetic technology and liquid chromatogram purification assay. The fragments were inserted into pSilencer 3.1 by digestion and DNA ligation. The resulted plasmid was transformed into competentEscherichiacolicells. The positive clone was selected and sequenced with the second DNA sequencing technology. The correct plasmid was used to observe its expression in eukaryotic cells and the invention efficacy of endogenous Sirt3 by Western blot and real time PCR assays.ResultsThe sequence of the pSilencer 3.1-Sirt3 was consistent with that of the Sirt3 interference sequence. After the pSilencer 3.1-Sirt3 vector was transfected into AGS and SGC-7901 cells, the endogenous Sirt3 mRNA and protein expression was inhibited.ConclusionThe construction of pSilencer 3.1-Sirt3 vector is successfully obtained. The vector of pSilencer 3.1-Sirt3 can efficiently decrease the mRNA and protein expression of Sirt3. The results may provide a basis for the further studies on the roles of Sirt3.
Sirtuin-3(Sirt3); RNA interference; vector construction
国家自然科学基金资助项目(81502370)
曲璇,女,1983-05生,博士,讲师,E-mail:quxuan519@163.com
2017-03-02
Q789
A
1007-6611(2017)07-0650-04
10.13753/j.issn.1007-6611.2017.07.003
