埃克替尼一线治疗基因敏感突变的晚期非小细胞肺癌的临床效果
2017-07-01曾爱屏于起涛
曾爱屏+于起涛


[摘要] 目的 评价埃克替尼一线治疗基因敏感突变的晚期非小细胞肺癌的近期效果和不良反应。 方法 回顾性分析2013年1月~2015年10月在广西医科大学附属肿瘤医院就诊的表皮生长因子受体(EGFR)基因突变的晚期非小细胞肺癌患者,口服埃克替尼125 mg/次,3次/d,直至肿瘤进展或出现不能耐受的毒副作用。评估患者的临床疗效、不同时间段的获益率、不良反应。 结果 59例患者中位无进展生存期(PFS)为13.1(2.1,72.4)个月,完全缓解(CR)2例,部分缓解(PR)40例,疾病稳定(SD)13例,疾病进展(PD)4例,全组客观缓解率(CR+PR)为71.2%,疾病控制率(CR+PR+SD)为93.2%,主要的毒副作用是皮疹、腹泻,未见间质性肺病及血液学毒性出现。 结论 埃克替尼能有效提高EGFR基因突变的晚期非小细胞肺癌患者的疗效及患者获益率,且安全性高,但该药的靶向及精准治疗仍需后期大样本多中心的研究来证实。
[关键词] 埃克替尼;表皮生长因子受体;基因突变;非小细胞肺癌;近期疗效;不良反应
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-7210(2017)05(b)-0080-04
[Abstract] Objective To evaluate the short-term efficacy and adverse reactions of Icotinib as first-line therapy for advanced non-small cell lung cancer with sensitive gene mutations. Methods A retrospective analysis was conducted to the advanced non-small cell lung cancer patients with epidermal growth factor receptor (EGFR) mutations, who were treated in Affiliated Tumor Hospital of Guangxi Medical University from January 2013 to October 2015. The patients were prescribed Icotinib medication, once 125 mg, 3 times/day, until tumor showed progression or the toxic side effects could not be tolerated. The clinical efficacy, benefit ratio in different periods, and adverse reactions were evaluated. Results The median progression free survival (PFS) was 13.1 (2.1, 72.4) months in 59 patients, with completed remission (CR) in 2 cases, partial remission (PR) in 40 cases, stable disease (SD) in 13 cases, and progressive disease (PD) in 4 cases. The objective remission rate (CR+PR) was 71.2%, and the disease control rate (CR+PR+SD) was 93.2%. The main side effects were rash and diarrhea. No interstitial lung disease and hematologic toxicity were observed. Conclusion Icotinib can effectively improve the efficacy and benefit rate of advanced non-small cell lung cancer patients with EGFR mutations, with high safety, but the target and precise treatment of this drug still needs large sample and multicentric researches to be confirmed.
[Key words] Icotinib; Epidermal growth factor receptor; Gene mutations; Non-small cell lung cancer; Short-term efficacy; Adverse reactions
肺癌是世界惡性肿瘤中发病率及病死率最高的疾病,每年有超过100万的新发病例,其中超过80%的患者被确诊为非小细胞肺癌(NSCLC),目前,NSCLC是世界范围上发病率与病死率居于前列的恶性肿瘤之一[1-2]。在各种类型的肺癌中,NSCLC占80%~85%,手术切除是其治疗的最有效手段,但因为肺癌发病的隐匿性,大多数患者确诊时已丧失了早期手术切除的机会。晚期NSCLC占NSCLC发病总数的40%左右[3],传统晚期NSCLC的治疗多以化疗为主要的治疗方式,但其效果较为局限,患者的中位生存时间仅为0.8年[4]。随着科技进步及基因技术的不断发展,靶向治疗在肿瘤中的应用越来越广。2010年,埃克替尼作为国内首个也是继厄洛替尼和吉非替尼后第3个表皮生长因子受体(EGFR)-TKI药物,已经成为国内晚期NSCLC EGFR突变患者一线治疗的标准药物。目前关于晚期NSCLC近期疗效的相关报道较少。本研究回顾性分析59例EGFR基因突变的晚期NSCLC患者口服埃克替尼的用药情况,观察其生存函数及不良反应,为晚期NSCLC的治疗提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月~2015年10月在广西醫科大学附属肿瘤医院就诊的具有完整随访记录的经细胞学或组织病理学确诊为局限晚期(Ⅲb期和Ⅳ期)19外显子缺失突变或21外显子EGFR突变的59例NSCLC患者的临床资料,其中男26例,女33例;年龄45~81岁,中位年龄59岁;病理类型:腺鳞癌2例,腺癌57例;分期:Ⅲb期4例,Ⅳ期55例;外显子19缺失29例,外显子21 L858R突变30例。
1.2 纳入与排除标准
纳入标准:①所有患者均为晚期NSCLC,符合国际抗癌联盟(UICC)和美国癌症联合会(AJCC)于2009年发布的第7版肺癌TNM分期[5],且EGFR敏感突变;②所有病例至少具有1个可客观测量的临床病灶;③治疗前血常规、肝肾功能及心电图均未发现明显异常;④应用盐酸埃克替尼期间均未行其他化疗、介入治疗等可能影响疗效评价的干预方法;⑤所有患者均自愿参加本研究,并签署知情同意书。
排除标准:①治疗期间进行其他抗肿瘤治疗;②无可测量的临床病灶;③认知功能障碍,交流沟通不畅,精神病;④不能配合治疗;⑤哺乳或妊娠期者。
1.3 方法
所有患者均给予盐酸埃克替尼(浙江贝达药业有限公司,批号:20151106;规格:125 mg/片),口服,1片/次,3次/d。持续用药至患者不能耐受或疾病进展为止。服药期间禁用其他全身抗肿瘤药物。注意观察患者咳嗽、咯血、气短、疼痛等不良症状的改善情况及自身饮食、睡眠、体能状态的变化情况。每2个月进行1次体格检查、美国东部肿瘤协作组(ECOG)评分、肝肾功能检查、肿瘤标志物检查及实体肿瘤病灶多层螺旋CT等影像学检查。采用蝎形扩增阻滞突变系统(Scorpions-ARMS)检测患者的EGFR突变状态。
1.4 疗效判定标准
疗效评估:主要考察无进展生存期(PFS)、临床疗效(疾病客观缓解率及疾病控制率)。PFS指患者从接受埃克替尼治疗到明确疾病进展或某种原因导致死亡的时间。患者在接受埃克替尼治疗开始1个月后,依据实体瘤疗效评价标准(RECIST)进行疗效评估。疗效稳定以上2个月接受1次CT和其他影像学检查进行疗效评价。完全缓解(CR):所有可见目标病灶消失,且持续>4周。部分缓解(PR):与基线检查比较,病灶长径总和缩小≥30%;单径可测量病灶取病灶最大直径之和减少>50%,且持续>4周。疾病稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。疾病进展(PD):基线病灶长径总和增加20%或出现新病灶。疾病客观缓解包括CR+PR。疾病控制包括CR+PR+SD。
获益患者判断标准:PFS不低于6个月为获益患者。门诊、电话随访,最后随访截止时间为2016年5月20日。获益率=获益患者例数/总例数×100%。
相关不良反应:根据美国国家癌症研究所(NNCI)通用标准第3版(NCI-CTC3.0)进行不良反应的分级评定,共计0~4级。0级为正常;Ⅰ级:轻度毒性;Ⅱ级:中度毒性;Ⅲ级:重度毒性;Ⅳ级:威胁生命;Ⅴ级:具有因果关系的死亡。
1.5 统计学方法
采用统计软件SPSS 21.0对实验数据进行分析,非正态分布计量数据以M(P25,P75)表示,采用Wilcoxon秩和检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 59例患者临床疗效的评价
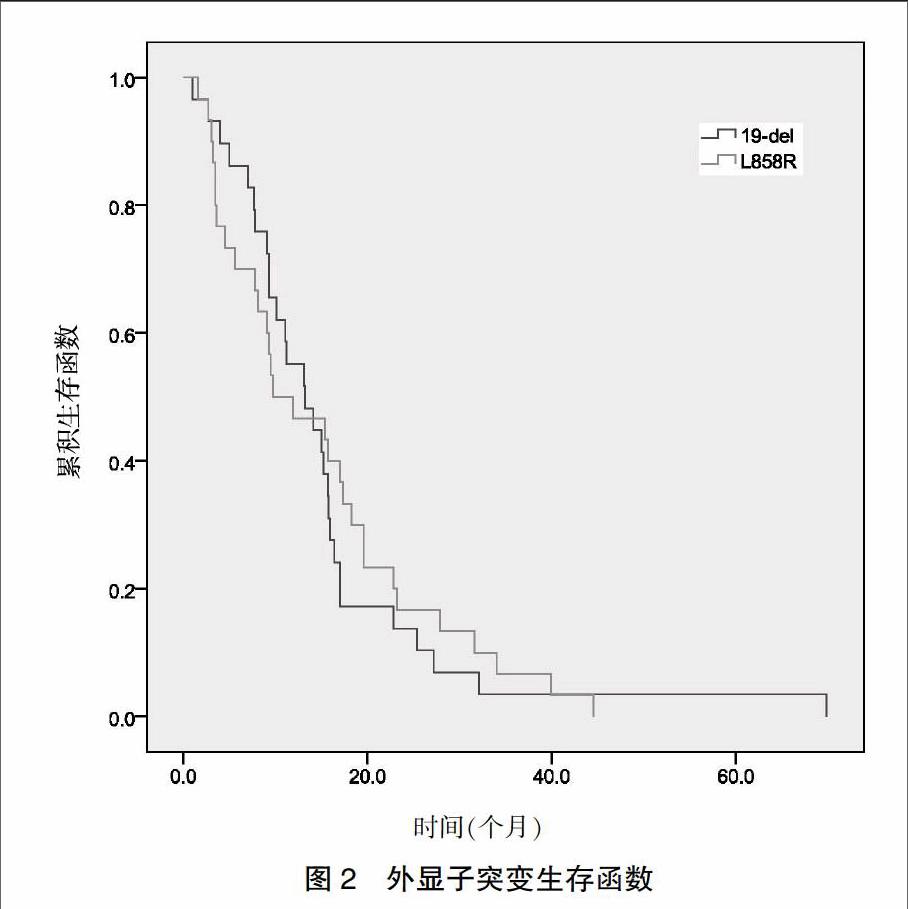
59例患者中位PFS为13.1个月,其中EGFR突变型为13.1(2.1,72.4)个月,19外显子突变生存函数的中位PFS为13.2(2.0,70.1)个月,21外显子突变生存函数的中位PFS为9.8(2.2,44.1)个月,差异无统计学意义(P = 0.778)(图1~2)。59例患者中,CR 2例,PR 40例,SD 13例,PD 4例,全组客观缓解率(CR+PR)为71.2%,疾病控制率(CR+PR+SD)为93.2%。59例患者1年获益率及2年获益率分别为83.05%(49例)、64.41%(38例)。
2.2 不良反应
59例患者出现的主要不良反应是皮疹和腹泻。皮疹发生率为32.2%(19/59),其中Ⅰ~Ⅱ度占28.8%(17/59)、Ⅲ~Ⅳ度占3.3%(2/59)。腹泻发生率为28.8%(17/59),均为Ⅰ~Ⅱ度。余还可见皮肤干燥者6例(11.8%)、转氨酶升高5例(8.5%)、恶心呕吐6例(10.2%),均为Ⅰ~Ⅱ度(表1),多无需特殊处置。无患者因不良反应停药。
3 讨论
肺癌发病率、病死率占恶性肿瘤之首,其中以NSCLC为主,肺癌患者60%以上确诊时为Ⅲ、Ⅳ期,失去了根治的机会,临床常使用铂类药物进行化疗,但其治疗效果有限,三代含铂方案的化学治疗客观缓解率仅为30%~40%[6-8],且毒副作用较明显,未取得突破性进展,不能有效改善患者的生活质量。
近年来,随着科技的不断进步,靶向用药以其准确的定位已较为广泛地被应用在肿瘤的治疗中,避免正常组织细胞受到损伤,在提高患者生存期及改善生活质量方面发挥着明显的作用。EGFR是一种广泛分布于人体各组织细胞膜上的多功能糖蛋白,是HER/ErbB家族成员之一,该家族包括HER1、HER2、HER3和HER4。EGFR-TKI作用于受体包内区,与ATP竞争性结合,通过抑制EGFR自身磷酸化达到阻止传导的目的,进而抑制肿瘤的增殖、侵袭和转移[9-10]。近年来EGFR-TKI的广泛应用明显改变了肿瘤疗效不理想的现状。相关研究表明,给予EGFR敏感突变的晚期NSCLC患者使用EGFR的酪氨酸激酶抑制剂治疗,能显著延长患者生存期,联合放化疗,较单纯放化疗更能延长患者的总生存期,且毒副作用较化疗也小。EGFR的酪氨酸激酶抑制剂主要包括厄洛替尼、吉非替尼、埃克替尼,埃克替尼与吉非替尼相比,具有相似的化学结构及分子作用机制,但其安全性更高。
埃克替尼作为我国第一个具有自主知识产权的小分子靶向抗癌新药物,也是世界上继厄洛替尼和吉非替尼上市后第3个EGFR-TKI药物,完全由我国科学工作者与肿瘤临床专家自主原创,其能够选择性抑制EGFR及其突变体,但对其余激酶均无明显抑制作用[11-14],属于口服酪氨酸激酶受体抑制剂,是以EGFR激酶为靶标的靶向抗癌药物,能够显著提高有EGFR突变患者的疗效。首项比较盐酸埃克替尼与吉非替尼疗效的头对头Ⅲ期临床研究[15]结果显示,盐酸埃克替尼疗效不低于吉非替尼,与吉非替尼比较,盐酸埃克替尼具有毒副作用轻、安全性高、耐受性好的临床特点。埃克替尼的不良反应主要表现为腹泻、皮疹,且不良反应发生率较低,耐受性更好[16-18]。
本研究回顾性分析盐酸埃克替尼一线治疗59例EGFR敏感性突变的晚期NSCLC患者的效果,结果显示,59例患者中位PFS为13.1个月,提示盐酸埃克替尼一线治疗EGFR基因敏感性突变的患者能够改善患者各项身体功能,延长生存期。改善症状和提高患者生存质量是埃克替尼治疗有突变的晚期NSCLC的一大优势。与之前的报道如NEJ002试验(PFS 10.8個月)[19]、WJTOG3405(PFS 9.2个月)[20]接近。
随访中发现患者的不良反应主要表现为皮疹和腹泻。皮疹发生率为32.2%,且为Ⅰ~Ⅲ度;腹泻发生率为28.8%,均为Ⅰ~Ⅱ度,口服易蒙停和蒙脱石散后症状有所改善。余还可见皮肤干燥、转氨酶升高、恶心呕吐,均为Ⅰ~Ⅱ度。其他肝肾损伤及血液学毒性程度均较低,且因埃克替尼治疗相关不良反应终止治疗的发生率为0,提示患者对埃克替尼治疗的耐受性较好。在生存期方面,19外显子突变生存函数的中位PFS为13.2个月,21外显子突变生存函数的中位PFS为9.8个月,存在外显子19缺失突变的患者更能从EGFRTKI治疗中获益,但差异无统计学意义。Yang 等[21]的CTONG-0901最新研究结果显示,无论接受厄洛替尼还是吉非替尼治疗,EGFR 19外显子和21外显子突变患者PFS无显著差异,而EGFR 19外显子突变患者的缓解率显著优于21外显子突变患者。本研究与上述内容较为一致。
综上所述,埃克替尼一线治疗EGFR敏感性突变的晚期NSCLC的效果肯定,对于ECOG评分较差的患者也能得到较好的疗效,能有效提高患者获益率,且安全性优势明显,已成为国内晚期NSCLC EGFR突变患者一线治疗的标准药物。但本研究例数相对不足,后期仍需大样本、多中心的研究来更深层次地证实该药的靶向及精准治疗。
[参考文献]
[1] Siegel R,Ma J,Zou Z,et al. Cancer statistics,2014 [J]. CA Cancer J Clin,2014,64(1):9-29.
[2] Chen WQ,Zeng HM,Zheng RS,et al. Cancer Incidence and Mortality in China,2007 [J]. Chin J Cancer Res,2012,24(1):1-8.
[3] Novello S,Le Chevalier T. Chemotherapy for non-small cell lung cancer. Part 1:early stage disease [J]. Oncology,2003,17(3):357-364.
[4] Macedo-Porez EO,Morales-Oyarvide V,Mendoza-Garcia VO,et al. Long progression-free survival with first-·line paclitaxel plus platinun is associated with impmved response and progression-free survival with second line docetaxel in advanced non-smal1 cell lung cancer [J]. Cancer Chemother Pharmacol,2014,74(4):681-690.
[5] 王鑫,支修益.国际肺癌研究协会(IASLC)第八版肺癌TNM分期解读[J/CD].中华胸外科电子杂志,2016,3(3):70-76.
[6] Huang H,Zhu S,Wang S,et al. Quick regression of brain metastases from lung adenocarcinoma with epidermal growth factor receptor-tyrosine kinase inhibitor treatment:A case report and literature review [J]. Mol Clin Oncol,2016,5(2):380-382.
[7] Li JR,Zhang Y,Zheng JL. Icotinib combined whole brain radiotherapy for patients with brain metastasis from lung adenocarcinoma harboring epidermal growth factor receptor mutation [J]. J Thorac Dis,2016,8(7):1504-1512.
[8] Jin Y,Shao Y,Shi X,et al. Mutational profiling of non-small-cell lung cancer patients resistant to first-generation EGFR tyrosine kinase inhibitors using next generation sequencing [J]. Oncotarget,2016,7(38):61755-61763.
[9] Rao GE,Rahaman SA,Rani AP. Insights from molecular modeling,docking and simulation of imidazole nucleus containing chalcones with EGFR kinase domain for improved binding function [J]. Bioinformation,2016,12(2):48-53.
[10] Mushi RT,Yang Y,Cai Q,et al. Ovarian metastasis from non-small cell lung cancer with ALK and EGFR mutations:A report of two cases [J]. Oncol Lett,2016,12(6):4361-4366.
[11] Xu J,Shen L,Zhang BC,et al. HER2 overexpression reverses the relative resistance of EGFR-mutant H1975 cell line to gefitinib [J]. Oncol Lett,2016,12(6):5363-5369.
[12] Biaoxue R,Hua L,Wenlong G,et al. Efficacy and safety of icotinib in treating non-small cell lung cancer:a systematic evaluation and meta-analysis based on 15 studies [J]. Oncotarget,2016,7(52):86902-86913.
[13] Xu X,Zhao A,Zheng L,et al. PS01.65:EGFR Exon 19 Deletion Mutation Patients Obtain Optimal Survival in Icotinib Treated Non-Small Cell Lung Cancer Patient with Brain Metastases:Topic:Medical Oncology [J]. J Thorac Oncol,2016,11(11S):S311.
[14] Zhu Z,Chai Y. Complete remission of liver metastasis in a lung cancer patient with epidermal growth factor mutation achieved with Icotinib [J]. Thorac Cancer,2016,7(6):681-683.
[15] Shi Y,Zhang L,Liu X,et al. Icotinib versus gefitinib in previously treated advanced non-small-cell lung cancer(ICOGEN):a randomised,double-blind phase 3 non-inferiority trial [J]. Lancet Oncol,2013,14(10):953-961.
[16] Shi Y,Sun Y,Ding C,et al. China Experts Consensus on Icotinib for Non-small Cell Lung Cancer Treatment(2016 version)[J]. Zhongguo Fei Ai Za Zhi,2016,19(7):489-494.
[17] Yao S,Zhi X,Wang R,et al. Retrospective study of adjuvant icotinib in postoperative lung cancer patients harboring epidermal growth factor receptor mutations [J]. Thorac Cancer,2016,7(5):543-548.
[18] 聶磊,李雅,邹春芳,等.盐酸埃克替尼治疗非小细胞肺癌疗效观察[J].癌症进展,2016,14(11):1153-1155.
[19] Miyauchi E,Inoue A,Kobayashi K,et al. Efficacy of chemotherapy after first-line gefitinib therapy in EGFR mutation-positive advanced non-small cell lung cancer-data from a randomized Phase Ⅲ study comparing gefitinib with carboplatin plus paclitaxel(NEJ002)[J]. Jpn J Clin Oncol,2015,45(7):670-676.
[20] Mitsudomi T,Morita S,Yatabe Y,et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405):an open label,randomised phase 3 trial [J]. Lancet Oncol,2010,11(2):121-128.
[21] Yang JJ,Zhou Q,Yan HH,et al. A phase Ⅲ randomised controlled trial of erlotinib vs gefitinib in advanced non-small cell lung cancer with EGFR mutations [J]. Br J Cancer,2017,116(5):568-574.
(收稿日期:2017-02-01 本文编辑:张瑜杰)
