环氧化酶-2/前列腺素E2在结直肠癌中的表达及临床意义
2017-06-05郝秀轻白美玲郭博伟
郝秀轻,白美玲,郭博伟,张 凡
1.河北北方学院附属第一医院病理科,河北 张家口 075000; 2.河北北方学院病理教研室
环氧化酶-2/前列腺素E2在结直肠癌中的表达及临床意义
郝秀轻1,白美玲2,郭博伟1,张 凡1
1.河北北方学院附属第一医院病理科,河北 张家口 075000; 2.河北北方学院病理教研室
目的探讨环氧化酶-2(COX-2)、前列腺素E2(PGE2)在结直肠癌中的表达及其与结直肠癌临床特征的关系。方法选取2009年8月1日-2012年8月1日于河北北方学院附属医院经病理检查确诊为结直肠癌78例患者的组织标本。免疫组化染色检测COX-2和PGE2的表达,并分析其与患者临床病理学特征的关系。结果结直肠癌组织中COX-2阳性表达率显著增加,与肿瘤大小、分化程度、浸润深度、淋巴结转移和Dukes分期相关;结直肠癌组织中PGE2阳性表达率显著增加,与肿瘤的分化程度、浸润深度、淋巴结转移和Dukes分期相关。Pearson相关分析表明,COX-2与PGE2在结直肠癌组织中的阳性表达显著正相关。结论COX-2、PGE2与结直肠癌的浸润、侵袭和转移密切相关。
环氧化酶-2;前列腺素E2;结直肠癌;临床意义
结直肠癌是世界上最常见消化道恶性肿瘤,其发病率在所有恶性肿瘤中居第三位,在美国和欧洲肿瘤死亡原因中居中第二位[1];在我国其发病率和病死率分别居肿瘤的第三位和第四位[2]。近年来,随着人民生活条件的改善,高脂肪、高热饮食增加,体力锻炼缺乏,加之烟酒不良嗜好、环境污染和社会压力等,导致我国结直肠癌发病率和病死率明显上升,尤其青年人的比例逐渐增加[3]。结直肠癌的发病隐匿、表现不典型,确诊时约25%已发生转移,且5年存活率低于65%。临床上结直肠癌的治疗仍以手术为主,辅以放疗和化疗。但患者术后局部复发和全身转移等传统的结直肠癌临床分期或分型相同的患者,其结局可能差别很大。因此,临床和基础研究一直在寻找结直肠癌预后的标志物。
环氧化酶-2(Cyclooxygenase-2,COX-2)是环氧化酶的一种诱导性亚型,在肿瘤、炎症等状态下表达显著增加,通过产生各种前列腺素类物质发挥多样性生物学效应。目前认为,COX-2的表达与肿瘤的发生、增殖、分化和血管新生密切相关。多项基础研究[4-6]表明,结直肠癌中COX-2、前列腺素E2(Prostaglandin E2,PGE2)的表达显著增加。但COX-2/PGE2表达增加的生物学意义及与肿瘤病理学特征的关系值得探讨。本研究采用免疫组化链酶亲和素-生物素技术检测78例结直肠癌患者COX-2/PGE2表达,探讨COX-2、PGE2表达在结直肠癌发病中的意义。
1 资料与方法
1.1 一般资料选取河北北方学院附属第一医院2009年8月1日-2012年8月1日经病理检查确诊为结直肠癌的组织标本78例,男40例,女38例,年龄(59.7±11.5)岁;结肠癌42例,直肠癌36例;高分化腺癌20例,中分化腺癌41例,低分化腺癌17例;所有患者术前均未接受放疗或化疗。Dukes分期:A期9例,B期33例,C期25例,D期11例。
1.2 免疫组化检测全部标本经4%多聚甲醛缓冲液固定,石蜡包埋,4 μm连续切片,HE染色确定标记部位。应用COX-2多克隆兔抗人抗体(福州迈新生物有限公司),PGE2单克隆兔抗人抗体(福州迈新生物有限公司),严格按照试剂盒操作步骤,全自动免疫组化机进行操作。
1.3 判定标准COX-2、PGE2阳性表达判定:细胞膜和(或)细胞质内有棕黄色颗粒沉着为阳性细胞。根据阳性细胞数和阳性细胞着色深度进行综合评分:阳性细胞数<5%计0分,5%~24%计1分,25%~49%计2分,50%~74%计3分,≥75%计4分;基本不着色计0分,淡黄色计1分,黄色计2分,棕黄色计3分。COX-2/PGE2阳性评分值=阳性细胞数×染色强度,每例标本至少计数3个视野,求均数,<3为阴性,≥3为阳性。
1.4 统计学处理采用SPSS 19.0软件进行处理。计数资料采用χ2检验;COX-2与PGE2阳性表达评分的相关性采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 COX-2和PGE2表达结直肠癌周正常组织中COX-2部分切片可见细胞的胞膜和(或)胞质内有棕黄色颗粒,大部分呈阳性表达,COX-2的阳性表达率为14.8%(8/54),癌组织大部分切片可见细胞膜和细胞质内有深棕黄色颗粒沉着,癌组织中COX-2阳性表达率为80.8%(63/78),差异有统计学意义(χ2=55.842,P=0.000);与肿瘤的大小、分化程度、浸润深度、淋巴结转移和Dukes分期相关(P<0.05);但与患者性别、年龄及肿瘤的发生部位无关。结直肠癌周正常组织中PGE2的阳性表达率为11.1%(6/54),癌组织中PGE2阳性表达率为76.9%(60/78),差异有统计学意义(χ2=55.282,P=0.000);与肿瘤的分化程度、浸润深度、淋巴结转移和Dukes分期有关(P<0.05);但与患者性别、年龄、肿瘤的发生部位和肿瘤大小无关(P>0.05,见图1、表1)。
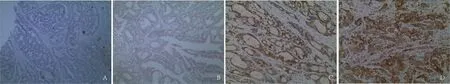
图1 结直肠癌中COX-2和PGE2的表达(400×)
A:癌周正常组织中COX-2阴性表达;B:癌周正常组织中PGE2阴性表达;C:癌组织中COX-2阳性表达;D: 癌组织中PGE2阳性表达
Fig 1 Expressions of COX-2 and PGE2in colorectal carcinoma (400×)
A: the negative expression of COX-2 in peritumoral normal tissue of colorectal carcinoma; B: the negative expression of PGE2in peritumoral normal tissue of colorectal carcinoma; C: the positive expression of COX-2 in colorectal carcinoma; D: the positive expression of PGE2in colorectal carcinoma
表1 在结直肠癌中COX-2、PGE2的表达与临床病理特征的关系 [例数(%)]
Tab 1 The relationship between COX-2 and PGE2expressions and clinical pathological features of colorectal carcinoma [n(%)]
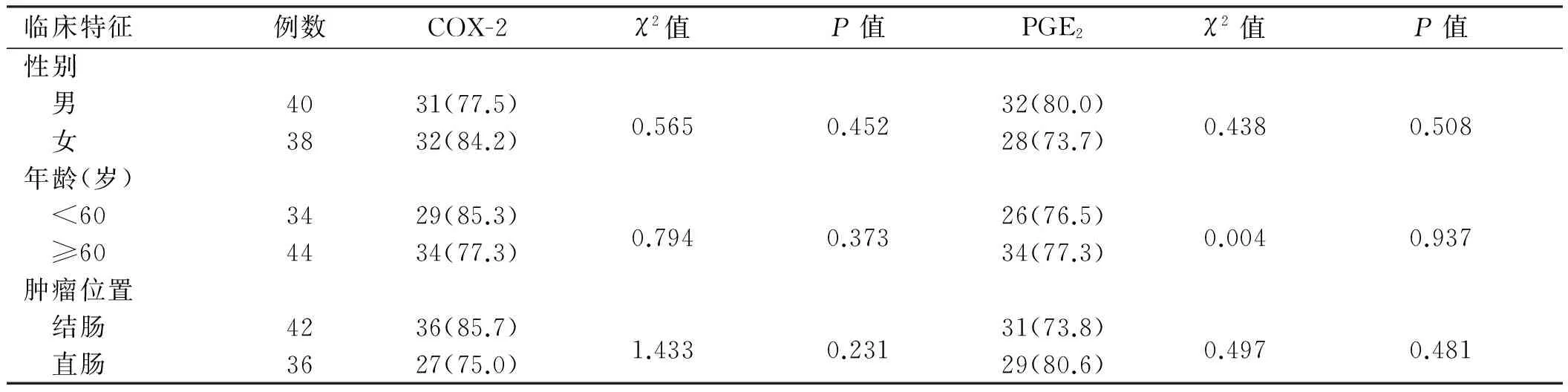
临床特征例数COX-2χ2值P值PGE2χ2值P值性别 男4031(77.5)0.5650.45232(80.0)0.4380.508 女3832(84.2)28(73.7)年龄(岁) <603429(85.3)0.7940.37326(76.5)0.0040.937 ≥604434(77.3)34(77.3)肿瘤位置 结肠4236(85.7)1.4330.23131(73.8)0.4970.481 直肠3627(75.0)29(80.6)
续表1
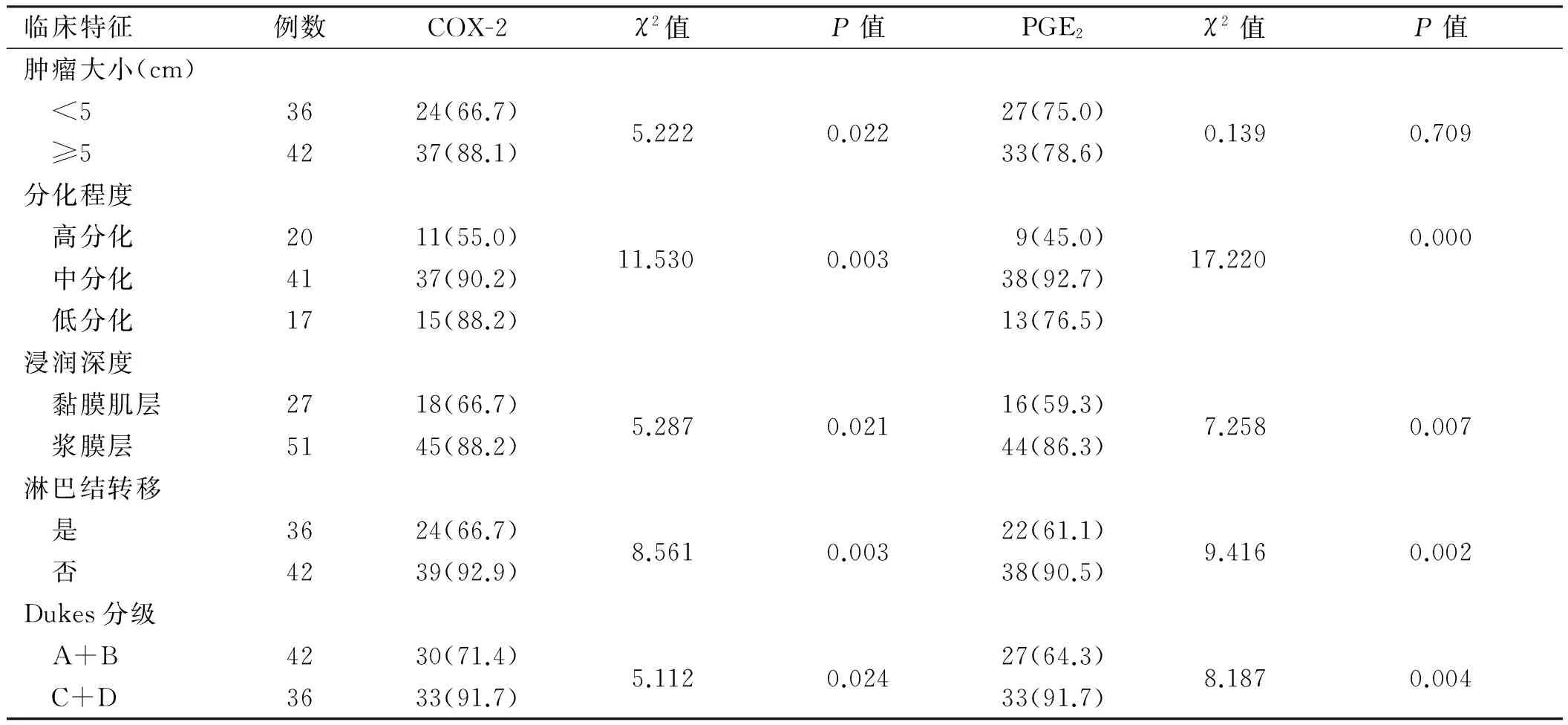
临床特征例数COX-2χ2值P值PGE2χ2值P值肿瘤大小(cm) <53624(66.7)5.2220.02227(75.0)0.1390.709 ≥54237(88.1)33(78.6)分化程度 高分化2011(55.0)11.5300.0039(45.0)17.2200.000 中分化4137(90.2)38(92.7) 低分化1715(88.2)13(76.5)浸润深度 黏膜肌层2718(66.7)5.2870.02116(59.3)7.2580.007 浆膜层5145(88.2)44(86.3)淋巴结转移 是3624(66.7)8.5610.00322(61.1)9.4160.002 否4239(92.9)38(90.5)Dukes分级 A+B4230(71.4)5.1120.02427(64.3)8.1870.004 C+D3633(91.7)33(91.7)
2.2 COX-2与PGE2阳性表达的相关性分析结直肠癌组织中COX-2表达积分值与PGE2表达积分值的Pearson相关分析表明,COX-2与PGE2在结直肠癌组织中阳性表达呈显著正相关(R2=0.297,P=0.000,见图2)。
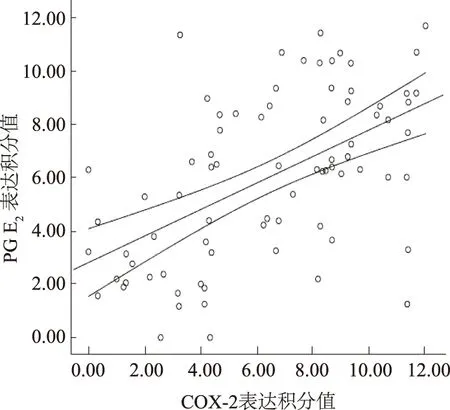
Fig 2 结直肠癌中COX-2和PGE2的相关性分析
Fig 2 The analysis of pearson correlation between COX-2 and PGE2expression in colorectal carcinoma
3 讨论
COX-2催化花生四烯酸产生前列腺素H2(PGH2),PGH2非常不稳定,又迅速在各自催化酶的作用下形成PGD2、PGE2、PGF2a、PGI2和血栓素A2(TXA2)[4]。COX-2是各种前列腺素类物质生成的限速酶,通过各种前列腺类物质及其特异性受体发挥多样性的生理与病理生理学效应。大量基础研究表明,胃癌、结肠癌、胰腺癌、神经胶质瘤等细胞系中COX-2表达显著增加,抑制COX-2的表达具有显著的抗肿瘤效应[5-7]。Abrahao等[8]报道,体外培养的头颈部鳞癌细胞系COX-2表达增加、PGE2分泌增多,COX-2抑制剂处理后,PGE2分泌下降、细胞增殖活性降低;给予外源性PGE2或特异性EP3受体激动剂,可显著增加细胞内DNA的合成。Ruan等[9]、Yoshida等[10]也证实了COX-2/PGE2在肿瘤发生中的作用。因此,以COX-2、PGE2为靶点寻找肿瘤诊断和治疗的新策略受到人们的重视。但来自临床调查的数据对COX-2在不同肿瘤中的具体作用并不太明确。
我们以结直肠癌患者为对象的临床研究表明,相比癌周正常组织,癌组织中COX-2和PGE2的表达显著增加,而且COX-2与PGE2的表达呈显著正相关。COX-2的表达显著影响肿瘤的大小、分化程度、浸润深度、淋巴结转移和Dukes分期,这与王庆娜等[11]研究结果一致;PGE2的表达与肿瘤的分化程度、浸润深度、淋巴结转移和Dukes分期有关。提示,COX-2/PGE2信号通路在结直肠癌的发生、发展和侵袭过程中扮演重要角色。但其具体机制仍有待进一步研究。COX-2在肿瘤组织中的表达除了抑制细胞凋亡、促进脉管新生外,Cao等[12]研究发现,乳腺癌细胞中COX-2还可以通过下游的信号分子PGE2导致Akt2、ZEB2和Snail信号的活化,进而引起肿瘤细胞的上皮-间质转化(epithelial-mesenchymal transition, EMT),降低细胞间的黏附,增加其浸润、侵袭和转移能力。Fujii等[13]实验显示,COX-2抑制剂可显著恢复头颈部鳞状细胞癌内E-钙黏蛋白(E-cadherin)的表达,抑制EMT,改善愈后。Shan等[14]结果表明,膀胱癌的发病过程中也存在显著的EMT,给予患者萝卜硫素通过COX-2/MMP2或9/Snail、ZEB1和miR-200c/ZEB1可显著抑制EMT的产生。我们的实验结果也表明,COX-2/PGE2在结直肠癌的发生、发展过程中也可能有类似的事件发生,但是相关数据较少,需要进一步的直接证据支持。肿瘤发生、发展过程中的异质性决定了COX-2/PGE2在不同个体中的表达水平差异很大,甚至COX-2表达水平相同的患者,由于肿瘤微环境的不同,其产生的前列腺素类物质的种类和产量也有差异。因此,阐明COX-2/PGE2在肿瘤微环境中的表达和调节机制将为肿瘤的研究提供新思路。
总之,我们的研究表明COX-2/PGE2与结直肠癌的浸润、侵袭和转移密切相关,以COX-2/PGE2为靶点的防治策略的选择将为结直肠癌的诊治打开新视野。
[1]Peng L, Zhou Y, Wang Y, et al. Prognostic significance of COX-2 immunohistochemical expression in colorectal cancer: a meta-analysis of the literature [J]. PLoS One, 2013, 8(3): e58891.
[2]万德森. 我国结直肠癌的流行趋势及对策[J]. 中华肿瘤杂志, 2011, 33(7): 481-483. Wan DS. Epidemiological trend and control strategy of colorectal cancer in China [J]. Chin J Oncol, 2011, 33(7): 481-483.
[3]王宁, 孙婷婷, 郑荣寿, 等. 中国2009年结直肠癌发病和死亡资料分析[J]. 中国肿瘤, 2013, 22(7): 515-520. Wang N, Sun TT, Zheng RS, et al. An analysis of incidence and mortality of colorectal cancer in China, 2009 [J]. China Cancer, 2013, 22(7): 515-520.
[4]Khan N, Farooq AD, Sadek B. Investigation of cyclooxygenase and signaling pathways involved in human platelet aggregation mediated by synergistic interaction of various agonists [J]. Drug Des Devel Ther, 2015, 9(7): 3497-3506.
[5]Liu XJ, Chen ZF, Li HL, et al. Interaction between cyclooxygenase-2, Snail, and E-cadherin in gastric cancer cells [J]. World J Gastroenterol, 2013, 19(37): 6265-6271.
[6]Zhen, Y, Zhang, W, Liu, C, et al. Exogenous hydrogen sulfide promotes C6 glioma cell growth through activation of the p38 MAPK/ERK1/2-COX-2 pathways [J]. Oncol Rep, 2015, 34(5): 2413-2422.
[7]Jiang C, Wang Q, Xu Z, et al. Cyclooxygenase-2 knockdown using retinoic acid chalcone (RAC), a promising therapeutic strategy for colon cancer [J]. Am J Cancer Res, 2015, 5(6): 2012-2021.
[8]Abrahao AC, Castilho RM, Squarize CH, et al. A role for COX2-derived PGE2and PGE2-receptor subtypes in head and neck squamous carcinoma cell proliferation [J]. Oral Oncol, 2010, 46(12): 880-887.
[9]Ruan D, So SP. Prostaglandin E2produced by inducible COX-2 and mPGES-1 promoting cancer cell proliferation in vitro and in vivo [J]. Life Sci, 2014, 116(1): 43-50.
[10]Yoshida K, Fujino H, Otake S, et al. Induction of cyclooxygenase-2 expression by prostaglandin E2stimulation of the prostanoid EP4 receptor via coupling to Gαi and transactivation of the epidermal growth factor receptor in HCA-7 human colon cancer cells [J]. Eur J Pharmacol, 2013, 718(1-3): 408-417.
[11]王庆娜, 朱海杭, 刘军. 结肠癌中骨桥蛋白与环氧化酶-2 的表达及临床意义[J]. 胃肠病学和肝病学杂志, 2012, 21(2): 137-139. Wang QN, Zhu HH, Liu J. Expression and clinical significance of OPN and COX-2 in colon cancer [J]. Chin J Gastroenterol Hepatol, 2012, 21(2): 137-139.
[12]Cao J, Yang X, Li WT, et al. Silencing of COX-2 by RNAi modulates epithelial-mesenchymal transition in breast cancer cells partially dependent on the PGE2cascade [J]. Asian Pac J Cancer Prev, 2014, 15(22): 9967-9972.
[13]Fujii R, Imanishi Y, Shibata K, et al. Restoration of E-cadherin expression by selective Cox-2 inhibition and the clinical relevance of the epithelial-to-mesenchymal transition in head and neck squamous cell carcinoma [J]. J Exp Clin Cancer Res, 2014, 33(1): 40-52.
[14]Shan Y, Zhang L, Bao Y, et al. Epithelial-mesenchymal transition, a novel target of sulforaphane via COX-2/MMP2, 9/Snail, ZEB1 and miR-200c/ZEB1 pathways in human bladder cancer cells [J]. J Nutr Biochem, 2013, 24(6): 1062-1069.
(责任编辑:马 军)
Expressions of Cyclooxygenase-2 and Prostaglandin E2in colorectal carcinoma and the clinical significance
HAO Xiuqing1, BAI Meiling2, GUO Bowei1, ZHANG Fan1
1.Department of Pathology, the First Affiliated Hospital of Hebei North University, Zhangjiakou 075000; 2.The Pathology Teaching and Research Section, Hebei North University, China
Objective To investigate the expressions of Cyclooxygenase-2 (COX-2) and Prostaglandin E2(PGE2) in colorectal carcinoma and the clinical significance.Methods Tissue specimens of 78 patients with colorectal carcinoma admitted from Aug. 1, 2009 to Aug. 1, 2012 in the First Affiliated Hospital of Hebei North University were enrolled in the study. The expressions of COX-2 and PGE2were measured by immunohistochemical staining and the clinical relevance of expressions of COX-2 and PGE2with clinical pathological features of colorectal carcinoma were analyzed according to patients’ medical records.Results The expression of COX-2 in colorectal carcinoma was significantly increased and related with tumor size, differentiation, depth of invasion, lymph node metastasis and Dukes classification. The expression of PGE2in colorectal carcinoma was significantly increased and related with tumor differentiation, depth of invasion, lymph node metastasis and Dukes classification. Pearson correlation analysis indicated that the expression of COX-2 in colorectal carcinoma had a positive correlation with PGE2.Conclusion The expressions of COX-2 and PGE2may accelerate infiltration, invasion and metastasis of colorectal carcinoma.
Cyclooxygenase-2; Prostaglandin E2; Colorectal carcinoma; Clinical significance
郝秀轻,主治医师,医学硕士,研究方向:消化道肿瘤的基础与临床。E-mail:haoxiuqing07@sohu.com
10.3969/j.issn.1006-5709.2017.02.006
R735.3+4
A 文章编号:1006-5709(2017)02-0142-04
2016-07-05
