玳玳花瓣脂氢过氧化物裂解酶基因cDNA的克隆及原核表达
2017-05-30郭凤芝许颖妍熊青刘涛吕恃衡陈桂信佘文琴
郭凤芝 许颖妍 熊青 刘涛 吕恃衡 陈桂信 佘文琴


摘 要 以玳玳花瓣为材料,采用RT-PCR和RACE技术,克隆了玳玳HPL基因cDNA全长,全长为1 776 bp,其中包含52 bp的5′非编码区,224 bp的3′非编码区,1 500 bp的编码区(编码499个氨基酸,分子量为55.7 ku)。将该HPL基因cDNA编码区的核苷酸序列及所推导的氨基酸序列与其他植物的HPL基因cDNA序列进行比较,推断玳玳花瓣HPL属于13-HPL类。通过PCR扩增得到了玳玳HPL基因组全长。测序结果显示玳玳HPL基因中包含1个长2 374 bp的内含子。将分离出来的玳玳HPL基因cDNA的编码区序列插入pET-15b载体上构建原核表达载体,在细菌BL21细胞中进行原核表达。结果表明:该编码区片段可在原核细胞中大量表达,其表达产物分子量大小约为55 ku,与13-HPL蛋白的分子量55.7 ku相符。本研究为下一步利用HPL基因cDNA进行遗传转化研究奠定基础,将为花卉香味的遗传改良提供一条新途径。
关键词 玳玳(Citrus aurantium);脂氢过氧化物裂解酶;cDNA全长;原核表达
中图分类号 Q785 文献标识码 A
Abstract In this research, the full length cDNA of Hydroperoxide lyase(HPL)from Daidai(Citrus aurantium)petals was cloned by RT-PCR and RACE and tried to express this gene in E.coli. The cDNA sequence of Daidai HPL was 1 776 bp long. It contained an ORF encoding 499 amino acid residues(Mw=55.7 ku), a 5′ untranslated region of 52 bp and a 3′ untranslated region of 224 bp. Daidai HPL was a hydrophilic protein. Compared with HPLs of other plants, this phylogenetic analysis suggested that Daidai HPL was a member of the 13-HPL family. Genomic fragment of Daidai HPL gene was also amplified by using PCR, and subsequent sequencing analysis showed that the Daidai HPL gene contained one intron of 2 374 bp. The Daidai HPL gene cDNA was inserted into the vector pET-15b. The expression construct was transformed into BL21 and was induced. Daidai HPL was expressed at high level in E.coli. SDS-PAGE analysis showed that Daidai HPL was 55 ku, which is approximately the same with the calculated molecular weight 55.7 ku. The research aimed to control the expression of HPL gene and regulate he production of scents in plants, and provide a new approach to the genetic improvement of flower scents.
Key words Daidai(Citrus aurantium); hydroperoxide lyase; full length cDNA; expression in E.coli.
doi 10.3969/j.issn.1000-2561.2017.04.014
玳玳花(Citrus aurautium)又名回青橙、代代,原產中国浙江,属芸香科的常绿灌木或小乔木,为酸橙的变种,是重要的木本香花及观果植物。其花洁白,香气浓郁,可供窨制花茶、香精提取和入药。
香味是花卉品质的一个重要组成,近年来,随着人们生活水平和欣赏品位的提高,花香的遗传改良开始受到重视。由于花香气成分、结构及其生物合成过程比较复杂,花香形成机制和遗传改良的研究进展缓慢。前人研究认为,产生花香的物质通常有萜类、醛类和醇类等。刘廷礼等[1]对玳玳花的香气物质成分进行了研究,结果表明,癸醛、壬醛、芳樟醇、牻牛儿醇等为玳玳花香味物质的重要成分。
在植物体中许多醛类和醇类香味物质或其主要合成前体主要来源于植物体中的脂氧化途径。脂氢过氧化物裂解酶(hydroperoxide lyase,HPL)是脂氧化途径中的一个关键酶,能催化脂氢过氧化物裂解生成短链醛(醇)。这些挥发性短链醛(醇)具有芬芳气味,是许多植物特异气味的主要成分或前体[2]。随着生化技术分析技术的进步,在香味物质的组成及其生物合成途径、香味形成过程中关键酶的纯化等方面取得了可喜的进展,目前己经从西瓜幼苗[3]、大豆幼苗[4]、茶叶[5]、向日葵子叶下胚轴[6]、橄榄果实[7]、黄瓜[8]、番茄果实[9]等植物器官中纯化了HPL。近年来,PCR技术、cDNA文库构建与筛选、RACE技术等分子生物学技术在植物上广泛应用,Matsui等[10]在进行HPL生理生化研究的基础上,首先从甜椒叶片和果实中克隆了HPL基因的cDNA全长,此后,拟南芥[11-12]、番茄[13]、紫花苜蓿[14]、黄瓜[15]、番石榴[16]、甜瓜[17]、马铃薯[18-19]、西瓜[20]、杏[21]、水稻[22]等植物的HPL基因cDNA全长相继被克隆。
本研究以玳玳花瓣为材料,采用RT-PCR和RACE等分子生物学技术,分离玳玳HPL基因cDNA全长,并对其原核表达和基因组序列进行研究,为今后的HPL遗传转化研究提供基础,能够通过分子手段增强或削弱的香气,为花卉香味的遗传改良提供一条新途径。
1 材料与方法
1.1 材料
供试植株玳玳种植在福建农林大学校花圃内,将即将开放的玳玳花蕾,装入铝箔袋中并作好标记,液氮速冻后带回实验室, 立即贮藏于-80 ℃冰箱备用。
cDNA第一链合成试剂盒(RevertAIDTM M-First Strand cDNA Synthesis Kit)、3′RACE试剂盒(3′RACE System for Rapid Amplification of cDNA Ends)和5′RACE试剂盒(5′RACE System for Rapid Amplification of cDNA Ends)购于Invitrogen公司;3S柱离心式PCR产物小量快速纯化试剂盒购于申能博采生物科技有限公司;DNA片段快速纯化/回收试剂盒(DNA Fragment Quick Purification/Recover Kit)购于北京鼎国生物技术有限责任公司;TaKaRa LA TaqTM、TaKaRa Ex TaqTM、T4-DNA连接酶、Marker DL 2000、限制性核酸内切酶等购于TakaRa生物工程(大连)有限公司;Taq DNA polymerase(5.0 U/μL)、RNase A等购于北京天为时代科技有限公司。大肠杆菌(Escherichia coli)DH5α购于天为时代科技有限公司,pGEM-T-Easy载体购于Promega公司,转化受体菌为大肠杆菌DH5α菌株和BL21(DE3)plyss菌株,表达载体为pET-15b。
1.2 方法
1.2.1 玳玳HPL基因cDNA全长及基因组全长扩增
采用CTAB法提取玳玳花瓣总RNA,SDS法提取玳玳花瓣总DNA,采用紫外分光光度计和1%琼脂糖凝胶电泳对总 RNA、总DNA的质量与含量进行检测。参照甜椒、拟南芥、番茄、紫花苜蓿、番石榴、马铃薯、甜橙等的HPL基因的核苷酸序列设计2对保守区引物(CF1、CR1和CF2、CR2)(表1)。参照cDNA第一链合成试剂盒(RevertAIDTM M-First Strand cDNA Synthesis Kit)对玳玳HPL基因cDNA保守区进行扩增,根据保守区cDNA的测序结果和5′RACE试剂盒及3′RACE试剂盒的使用说明书的要求,设计5′RACE逆转录引物(5D-GSP0)及5′RACE下游引物(5D-GSP1和5D-GSP2)与3′RACE上游引物(3D-GSP3和3D-GSP4)(表1),引物序列均委托上海博亚生物技术有限公司合成。
玳玳cDNA全长扩增:以玳玳cDNA为模板进行PCR扩增,反应总体系为50 μL,其中包括ddH2O 39.5 μL,10×PCR Buffer 5 μL,10 mmol/L dNTPs 1 μL,上下游引物(10 μmol/L)各2 μL,Taq酶(5 U/μL)0.5 μL,反应条件为:94 ℃ 2 min;94 ℃ 30 s,55~64 ℃(根据引物Tm值确定)30 s,72 ℃ 1~4 min(根据扩增片段决定),30个循环;72 ℃ 10 min;4 ℃保存。
玳玳HPL基因组全长扩增:反应体系同玳玳cDNA全长扩增,反应条件为:94 ℃ 5 min进行热启动;94 ℃ 25 s,68 ℃ 4 min,5个循环;94 ℃ 25 s,65 ℃ 4 min,10个循环;94 ℃ 25 s,62 ℃ 4 min,20个循环;72 ℃ 10 min;4 ℃保存。
PCR扩增产物连接到pEG-T-Easy Vector载体上,化学转化到大肠杆菌DH5α感受態细胞中,菌液PCR检测,筛选阳性克隆,将扩增出目的条带的样品菌液送到上海博亚生物技术有限公司进行序列测定。利用NCBI网站、DNAMAN软件对测序序列进行分析与拼接,得到了玳玳HPL基因cDNA、基因组全长序列。
1.2.2 玳玳HPL基因生物信息学分析 对所获得的玳玳HPL基因全长进行生物信息学分析,利用Blast 进行核苷酸序列同源性分析,采用DNAMAN进行蛋白质理化性质分析,并利用DNAMAN软件,将玳玳与其他已经登录的18种植物的HPL氨基酸序列作多重比对,并绘制进化树。
1.2.3 玳玳HPL基因的原核表达 根据测序结果,设计基因编码区两端的特异引物:上游引物(HPL-S1)和下游引物(HPL-S2)(表1),委托上海生工生物工程技术服务有限公司合成。反应体系为50 μL,其中包括ddH2O 38.5 μL,10×PCR Buffer 5 μL,10 mmol/L Dntp 1 μL,HPL-S1(10 mmol/L) 2 μL,HPL-S2(10 mmol/L)2 μL,cDNA 1 μL,Taq酶(5 U/μL)0.5 μL,反应条件为:94 ℃ 2 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 10 min;4 ℃保存。扩增产物确定为HPL基因,连接克隆到pGEM-T Easy Vector中,化学转化DH5α菌株,进行菌液PCR筛选阳性克隆,阳性菌落提取质粒并进行双酶切检测,确认获得重组表达质粒pGEM-T Easy-HPL。将重组表达质粒转化BL21 plyss感受态细胞,挑取单克隆进行菌液PCR及重组质粒酶切验证,将阳性菌液按1%的量加入含有Amp的LB培养基中,于37 ℃ 220 r/min,摇培至菌液OD600达0.4~0.8时,加入IPTG至终浓度为1 mmol/L,37 ℃ 220 r/min,摇培4~12 h,每隔2 h取样1次,10 000 r/min离心1 min,收集菌体,1×SDS Loading Buffer重悬菌体,沸水煮5 min,冰上冷却,离心,取上清进行SDS-PAGE分析。
2 结果与分析
2.1 玳玳HPL基因cDNA全长序列的获得与分析
从图1可看出,玳玳花瓣总RNA质量较好,28S、18S的带型整齐清楚,且28S的带比18S的带更亮(28S rRNA的亮度大约是18S rRNA的2倍),说明提取的总RNA较完整,未发生降解。分光光度计检测结果显示,OD260/OD280=1.98,说明样品中没有蛋白质和酚类的污染;OD260/230=2.03,说明RNA样品中也没有其他小分子物质的污染。利用DNAMAN分析软件将保守区cDNA、3′RACE和5′RACE(图2)得到的核苷酸序列进行拼接,得到了玳玳HPL基因cDNA全长序列,玳玳HPL基因cDNA全长为1 776 bp(在GenBank中的登录号为DQ866816),其中开放阅读框为1 500 bp(图2),编码499个氨基酸,分子量为55.7 ku,5′非编码区为52 bp,3′非编码区为224 bp。
2.2 玳玳HPL基因组全长序列的获得与分析
以玳玳总DNA为模板,用HPL-S1和HPL-S2作为上、下游引物进行PCR扩增反应,得到一条约4 000 bp大小的特异片段(图3),将该PCR产物进行回收,经过连接、转化、蓝白斑筛选和质粒PCR鉴定,获得含重组质粒的阳性菌落。将重组质粒进行测序,结果见图4。分析测序结果表明,扩增到的玳玳HPL基因组序列长为4 093 bp,将其与玳玳HPL基因cDNA全长进行序列比对,结果发现此序列包含1个内含子,长为2 374 bp。内含子两端有AGGT……AGGT的剪切信号序列。编码区序列存在15个点突变,7个会造成氨基酸的改变,但没有移码和无意突变(即变成终止子的突變)。
2.3 玳玳HPL基因生物信息学分析
2.3.1 玳玳HPL基因同源性和进化树分析 将玳玳HPL基因cDNA的全长序列在NCBI网站上进行Blast比对,结果表明,该序列与黄瓜和甜瓜HPL基因cDNA的同源性最低,分别为33.3%和33.2%,而与甜橙和粗柠檬HPL基因cDNA的同源性最高,分别为99%和98%,表明所克隆的基因为HPL基因。
将玳玳与其他已经登录的18种植物的HPL氨基酸序列作多重比对,并绘制进化树(图5)。结果显示,植物的HPL基本上聚为两大类:13-HPL(玳玳、粗柠檬、甜橙、紫花苜蓿、番茄、马铃薯、甜椒、烟草、番石榴、黄瓜2、拟南芥、香蕉、大麦)和9-HPL(杏)、9/13-HPL(甜瓜、黄瓜AF229811、截形苜蓿、截形苜蓿2)。两大聚类中又分为许多小聚类,基本上是同物种或物种亲缘关系近的HPL序列一致性较高;物种亲缘关系远的序列一致性较低。玳玳、粗柠檬和甜橙3种植物同属于芸香科柑橘属,亲缘关系近,因此其序列一致性非常高(达98%)。
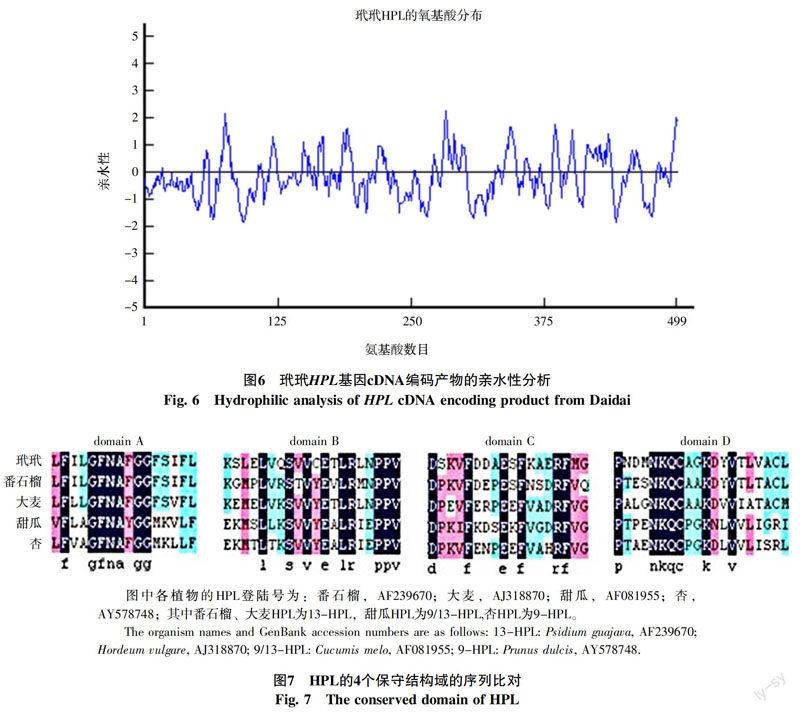
2.3.2 玳玳HPL基因cDNA全长编码产物的保守结构域及氨基酸组成分析 利用DNAMAN软件分析玳玳HPL基因cDNA全长编码产物,从氨基酸的组成看,20种氨基酸都有出现,以丝氨酸出现次数最多(54次),其次为亮氨酸(51次),色氨酸和组氨酸出现次数最少(仅出现6次)。从氨基酸的类型看,非极性氨基酸有8种,共出现247次,占总数(499)的49.5%;不带电荷的极性氨基酸有7种,出现140次,占总数的28.1%;碱性氨基酸有3种,出现56次,占总数的11.2%;酸性氨基酸出现56次,占总数的11.2%。总的来说,极性氨基酸总数为252,超过非极性氨基酸总数为247。为了确定HPL基因cDNA编码产物的亲水或疏水性,对其进行亲水性分析(图6),由此推测,玳玳花瓣HPL基因cDNA的编码产物为亲水性多肽。
HPL属于细胞色素P450(CytP450)蛋白质家族,将玳玳HPL的4个保守序列区与其他植物的进行多重比对(图7),结果发现,4个结构域中的一些序列在整个HPL家族中相当保守。如结构域A中的Phe-X-X-Gly-Phe-Asn-X-X-Gly-Gly,结构域B中的Leu-X-X-Ser-X-Val-X-Glu-X-Leu-Arg-X-X-Pro-Pro,结构域C中的Phe-XXX-Arg,结构域D中Pro-X-X-X-Asn-Lys-Gln-Cys-Ala/Pro-Gly/Ala-Lys-Asp/Asn-X-Val结构。但玳玳的HPL也存在其独特性,如L螺旋区附近的与亚铁血红素的绑定位点附近的保守序列(domain D)Pro-X-X-X-Asn-Lys-Gln-Cys-Ala/Pro-Gly/Ala-Lys-Asp/Asn-X-Val中参与亚铁血红素绑定的Cys前面的第二个残基Arg被Lys代替。B结构域中的酪氨酸在玳玳HPL中被半胱氨酸代替;C结构域中大部分植物有的脯氨酸,在玳玳中被丝氨酸取代,这是否是玳玳HPL特有的结构特征,还有待进一步验证。
2.4 玳玳HPL基因的原核表达分析
重组表达质粒pGEM-T Easy-HPL在大肠杆菌中,经过IPTG诱导实现了高效蛋白表达,提取总蛋白进行SDS-PAGE分析,电泳结果显示出HPL融合表达的特异条带(图8,图中黑色箭头标出),该条带大小约为55 ku与HPL蛋白分子量55.7 ku的理论值相符。诱导2 h后HPL蛋白表达明显增加,诱导4 h与诱导2 h的蛋白表达量无明显变化。
3 讨论
前人研究结果表明,HPL是一个多基因家族编码的蛋白,属于细胞色素P450s(CYP74)家族;同种植物不同组织器官,可能有不同的HPL基因,植物的HPL基因有13-HPL、9-HPL和9/13-HPL三大家族,根据植物不同组织器官中底物的过氧基位置的差异,HPL家族基因的表达也有所不同[14]。同一个物种或物种亲缘关系近的HPL基因的序列同源性较高;物种亲缘关系远的序列同源性较低。每个HPL基因家族中又可能有多个基因现象,加上HPL基因在染色体上有多拷贝现象,如在番茄等植物中的HPL基因就有2个或2个以上的拷贝数[11],因此,植物HPL基因家族具有复杂性。
尽管植物HPL是由复杂的多基因家族编码的,但所有植物的HPL都存在4个保守的区域。本研究获得的玳玳HPL基因cDNA序列与同属于芸香科柑橘属植物的粗柠檬、甜橙的HPL cDNA序列同源性非常高(分别达99%和97%),尤其是编码活性中心区域的核苷酸序列高度保守;玳玳HPL蛋白质的结构域分析结果表明,该蛋白具有植物细胞色素P450家族A、B、C、D共4个保守区域的典型特征;因此初步判断本研究获得的基因属于HPL基因家族。另有研究结果表明,植物的HPL存在的4个保守区域;一个是定位在L螺旋前面的Phe-X-X-Gly-X-Arg-X-Cys-X-Gly,其中的半胱氨酸残基被认为是亚铁血红素的第5个配位基;第2个是由K螺旋区的Glu-X-X-Arg和L螺旋区玳玳Pro-Glu-Arg-Phe组成的ERR组合,这套组合被认为起到稳定核心结构的作用。第3个是位于I螺旋区的Ala/Gly-Gly-X-Asp/Glu-Thr-thr/Ser,此结构被认为和氧的结合有关系。第4个是C螺旋区的Trp/His-X-X-X-Arg,其具有调整亚铁血红素丙酸酯的作用[12]。玳玳HPL的确个保守结构域是否存在上述功能还有待进一步的研究。
玳玳HPL进化树分析结果表明,该基因与13-HPL基因聚为一类,进一步推测,玳玳HPL属于13-HPL家族。前人研究结果表明13-HPL 催化相关底物后产生的各类物质不仅与植物的抗病虫和伤害的能力有关,同时该物质还是植物中香气物质的重要成分[14]。本研究玳玳HPL基因催化相关底物后产生的物质是否与玳玳浓郁的花香有关,该花香是否又具有抗病虫和伤害的能力,有待进一步研究。
为了能够进一步确证所获得的玳玳HPL基因编码的氨基酸序列与蛋白结构及探究其可能存在的功能。本研究首先對玳玳HPL基因进行初步的原核表达分析,结果表明该基因经诱导2 h后在BL21中明显表达,为后续收集获得大量玳玳HPL蛋白进行相关研究变成可能。此外,本研究为了能够更好地统筹研究HPL基因,由基因组到转录与翻译,及其蛋白功能之间存在的关系,对玳玳HPL基因组进行了扩增,将玳玳HPL基因组扩增产物与玳玳HPL基因cDNA全长进行序列比对,结果发现编码区序列存在15个点突变,7个会造成氨基酸的改变。综上所述,玳玳HPL基因cDNA、基因组DNA的克隆与相关分析,及该基因的原核表达的初步试验成功,为后续玳玳HPL基因相关功能的研究与利用HPL基因cDNA进行遗传转化研究、花卉香味的遗传改良奠定基础。
参考文献
[1] 刘廷礼, 邱 琴, 赵 怡. 代代花挥发油化学成分的GC-MS研究[J]. 中国药物化学杂志, 2000, 11(4): 38-40.
[2] 赵 凌, 沈文飚, 翟虎渠, 等. 植物的脂氢过氧化物裂解酶[J]. 植物生理学通讯, 2004, 40(2): 135-140.
[3] Noordermeer M A, Veldink G A. Fatty acid hydroperoxide lyase: A plant cytochrome P450 enzyme involved in wound healing and pest resistance[J]. Chembiochem A European Journal of Chemical Biology, 2001, 2(7-8): 494-504.
[4] Olias J M, Rios J J, Valle M, et al. Fatty acid hydroperoxide lyase in germinating soybean seedlings[J]. Journal of Agricultural & Food Chemistry, 1990, 38(3): 624-630.
[5] Matsui K, Toyota H, Kajiwara T, et al. Fatty acid hydroperoxide cleaving enzyme, hydroperoxide lyase, from tea leaves[J]. Phytochemistry, 1991, 30(7): 2 109-2 113.
[6] Itoh A, Vick B A. The purification and characterization of fatty acid hydroperoxide lyase in sunflower[J]. Biochimica Et Biophysica Acta, 1999, 1436(3): 531-540.
[7] Salas J J, Sánchez J. Hydroperoxide lyase from olive(Olea europaea)fruits[J]. Plant Science, 1999, 143(1): 19-26.
[8] Hornostaj A R, Robinson D S. Purification of hydroperoxide lyase from cucumbers[J]. Food Chemistry, 1999, 66(2): 173-180.
[9] Suurmeijer C N S P, Pérez-Gilabert M, Unen D J V, et al. Purification, stabilization and characterization of tomato fatty acid hydroperoxide lyase[J]. Phytochemistry, 2000, 53(2): 177-185.
[10] Matsui K, Shibutani M, Hase T, et al. Bell pepper fruit fatty acid hydroperoxide lyase is a cytochrome P450(CYP74B)[J]. Febs Letters, 1996, 394(1): 21-24.
[11] Bate N J, Sivasankar S, Moxon C, et al. Molecular characterization of an Arabidopsis gene encoding hydroperoxide lyase, a cytochrome P-450 that is wound inducible[J]. Plant Physiology, 1998, 117(4): 1 393-1 400.
[12] Matsui K, Wilkinson J, Hiatt B, et al. Molecular cloning and expression of Arabidopsis fatty acid hydroperoxide lyase[J]. Plant & Cell Physiology, 1999, 40(5): 477-481.
[13] Howe G A, Lee G I, Itoh A, et al. Cytochrome P450-dependent metabolism of oxylipins in tomato. Cloning and expression of allene oxide synthase and fatty acid hydroperoxide lyase[J]. Plant Physiology, 2000, 123(2): 711-724.
[14] Noordermeer M A, Dijken A J H V, Smeekens S C M, et al. Characterization of three cloned and expressed 13-hydroperoxide lyase isoenzymes from alfalfa with unusual N-terminal sequences and different enzyme kinetics[J]. European Journal of Biochemistry, 2000, 267(9): 2 473-2 482.
[15] Imku C. Fatty acid 9- and 13-hydroperoxide lyases from cucumber[J]. Febs Letters, 2000, 481(2): 183-188.
[16] Tijet N, Waspi U, Gaskin D J H, et al. Purification, molecular cloning, and expression of the gene encoding fatty acid 13-hydroperoxide lyase from guava fruit(Psidium guajava)[J]. Lipids, 2000, 35(7): 709-720.
[17] Tijet N, Schneider Cmuller B L, Brash A R. Biogenesis of volatile aldehydes from fatty acid hydroperoxides: Molecularcloning of a hydroperoxide lyase (CYP74C) with specificity for both the9-and 13-hydroperoxides of linoleic and linolenic acids[J]. Archives of Biochemistry & Biophysics, 2001, 386(2): 281-289.
[18] Vancanneyt G, Sanz C, Farmaki T, et al. Hydroperoxide lyase depletion in transgenic potato plants leads to an increase in aphid performance[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(14): 8 139-8 144.
[19] 薛慶海, 沐万孟, 江 波, 等. 马铃薯脂氢过氧化物裂解酶cDNA的克隆及其在大肠杆菌中的表达[J]. 食品与发酵工业, 2009(12): 34-38.
[20] Fukushige H, Hildebrand D F. Watermelon(Citrullus lanatus)hydroperoxide lyase greatly increases C6 aldehyde formation in transgenic leaves[J]. Journal of Agricultural & Food Chemistry, 2005, 53(6): 2 046-2 051.
[21] Mita G, Quarta A, Fasano P, et al. Molecular cloning and characterization of an almond 9-hydroperoxide lyase, a new CYP74 targeted to lipid bodies[J]. Journal of Experimental Botany. 2005, 56(419): 2 321-2 333.
[22] Chehab E W, Raman G, Walley J W, et al. Rice HYDROPEROXIDE LYASES with unique expression patterns generate distinct aldehyde signatures in Arabidopsis[J]. Plant Physiology, 2006, 141(1): 121-134.
