HAART治疗前后HIVAN患者血清胱抑素C与糖类抗原-125水平变化及意义
2017-05-03冯润川兰玲鲜谢志满梁茂裕葛利辉罗向佳何琦
冯润川,兰玲鲜,谢志满,梁茂裕,葛利辉,罗向佳,何琦
(南宁市第四人民医院·广西艾滋病临床治疗中心,南宁530023)
HAART治疗前后HIVAN患者血清胱抑素C与糖类抗原-125水平变化及意义
冯润川,兰玲鲜,谢志满,梁茂裕,葛利辉,罗向佳,何琦
(南宁市第四人民医院·广西艾滋病临床治疗中心,南宁530023)
目的 观察HIVAN高效抗反转录病毒治疗(HAART)前后人类免疫缺陷病毒相关性肾病(HIVAN)患者血清胱抑素C(Cystatin C)、糖类抗原-125(CA-125)水平变化并探讨其意义。方法 选取50例HIVAN患者(观察组),应用罗氏全自动PPE生化仪,分别采用比浊法及电化学发光法检测HAART治疗前及治疗后6个月血清Cystatin C、CA-125水平,并与同期健康体检者50例(对照组)对比。采用COULTER EPICS XL 型流式细胞仪测定CD4+T细胞数、CD4+T/CD8+T值。相关性分析采用Spearman相关分析法。结果 观察组治疗前血清Cystatin C、CA-125水平明显高于对照组(P均<0.01); HAART治疗6个月后,观察组血清CA-125水平下降较明显,与治疗前比较(P<0.05),而Cystatin C下降不明显,与治疗前比较差异无统计学意义(P>0.05);CD4+T细胞数、CD4+T/CD8+T值升高明显,与治疗前比较差异有统计学意义(P均<0.05)。相关分析结果提示,CD4+T细胞与hs-CRP、CA-125呈负相关(r分别为-3.326、-2.910,P均<0.05);而CD4+T细胞与Cystatin C、Ccr、GFR无相关性(r分别为0.285、0.101、0.225,P均>0.05)。GFR与Cystatin C、CA-125、hs-CRP呈负相关(r分别为-2.352、-4.022、-3.022,P均<0.05)。结论 HAART治疗前HIVAN患者血清Cystatin C、CA-125水平明显升高,治疗后血清CA-125水平下降明显;监测血清Cystatin C、CA-125水平,有助于观察和评估HIVAN患者肾脏损害发生、进展和预后。
艾滋病;艾滋病相关性肾病;高效抗反转录病毒治疗;胱抑素C;糖类抗原-125
人类免疫缺陷病毒相关性肾病(HIVAN)最早于20世纪80年代中期被首次报道。HIV感染者并发的肾脏损害包括慢性肾脏病(CKD)和急性肾功能不全(ARF)。临床多表现为HIV相关的CKD,即首先出现严重的蛋白尿,进而迅速发展为终末期肾病(ESRD),故HIVAN患者接受抗病毒治疗是合理的选择。近年临床研究提示,HIVAN患者接受蛋白酶抑制剂(PI)治疗较未接受抗病毒治疗或仅接受核苷类逆转录酶抑制剂(NRTI),更能减缓肾功能损害;单用齐多夫定治疗,肾功能改善有限,接受高效抗反转录病毒治疗(HAART),HIVAN患者肾功能获得显著改善,肾活检结果提示,肾脏病理情况显著改善,还能降低HIVAN患者复发率。我院作为广西艾滋病临床治疗中心,收治的HIVAN患者按照HIV感染者合并CKD的治疗指南(美国感染病学会推荐方案)执行并给予HAART治疗,根据患者病情及肾功能分级等情况综合治疗。本研究筛选2013年1月~2015年12月在我院感染科病房或门诊就诊HIV/AIDS合并肾功能损害患者,并符合研究条件的HIVAN患者进行HAART治疗,观察了50例HIVAN患者HAART治疗前后血清胱抑素-C(Cystatin C)、糖类抗原-125(CA-125)水平变化,并探讨其意义。
1 资料与方法
1.1 临床资料 2013年1月~2015年12月在我院感染科病房或门诊就诊,并进行登记管理的HIV/AIDS合并肾功能损害患者450例,筛选符合研究条件的HIVAN患者50例(观察组),其中男36例、女14例,年龄24~70(42±15)岁;体质量指数(BMI)为(18.8±2.5)kg/m2。CKD1~2期14例,CKD3期18例,CKD4期12例,CKD5期6例。不洁性生活史26例,有吸毒史9例,有不洁性生活史及吸毒史6例,其他如输血感染等其他途径9例。有上述艾滋病高危因素共41例(82%)。HIVAN诊断:符合HIV感染/AIDS诊断标准[1],患者均经广西壮族自治区疾病预防控制中心蛋白印迹试验(WB)确证HIV-I抗体阳性。CKD定义[2]:肾损害(肾脏结构或功能异常)≥3个月,伴有或不伴有肾小球滤过率(GFR)的降低,表现为下列异常之一:①有病理学检查异常;②有肾损害的指标,包括血、尿检查异常,或影像学检查异常;③GFR<60 mL/(min·1.73 m2)≥3个月,有或无肾损害。肾损害评价方法:肾排泄功能测定、尿蛋白定性和定量检测及肾活检等。HIVAN高效抗反转录病毒治疗(HAART)及随访标准按照2005年3月卫生部颁布《艾滋病诊疗指南》要求执行。接受HAART第一线治疗方案:齐多夫定(AZT)0.3 g/次(2次/d)+拉米夫定(3TC)0.3 g/次(1次/d)+奈韦拉平(NVP)0.2 g/次(2次/d),并按照国家规定定期随访。排除标准:明确的继发性肾病;严重高血压、冠心病、甲状腺疾病、肝脏疾病及糖尿病、严重心功能不全、严重机会感染或未控制者、任何其他影响寿命或影响试验的严重疾病﹙如全身免疫性疾病、恶性肿瘤、严重肝肾衰竭等﹚、女性均无妊娠;治疗过程中不配合或中途失访者。本研究通过南宁市第四人民医院伦理委员会审核批准,患者均知情同意。随访半年,并记录相关指标。另选取同期健康体检者50例作为对照组,男32例、女18例,年龄25~66(40±14)岁;BMI为(22.8±2.6)kg/m2,均经酶联免疫吸附试验初筛HIV抗体阴性。对照组50例无艾滋病高危因素。两组年龄和性别构成差异均无统计学意义(P均>0.05)。
1.2 指标观察 ①血清Cystatin C、CA-125检测:入组患者均收集相关病历资料,于次日抽取空腹静脉血,应用罗氏全自动PPE生化仪,分别采用比浊法及电化学发光法检测血清Cystatin C、CA-125,符合HAART治疗的观察组患者经治疗6个月再次检测血清Cystatin C、CA-125水平,同时常规综合对症治疗,监测肝肾心功能等生化指标,并记录相关临床症状。②CD4+T细胞数、CD4+T/CD8+T值测定:采用COULTER EPICS XL 型流式细胞仪。③血生化指标测定:肝功能、肾功能血清肌酐(SCr)、尿素氮(BUN)、尿酸(UA)及血清钾离子K+、心肌酶谱、血脂分析等用美国雅培公司C8000全自动生化仪测定,并计算肾小球滤过率(GFR)。内生肌酐清除率公式:Ccr=[(140-年龄)×体质量(kg)]/[0.818×Scr(μmol/L)]。成人正常值 80~120 mL/min。④其他:如凝血功能;高敏C反应蛋白(hs-CRP)。
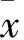
2 结果
观察组HAART治疗前及治疗6个月后血清Cystatin C、CA-125、hs-CRP水平与对照组比较均明显升高(P均<0.05)。而观察组治疗前及治疗6个月与治疗前比较,血清Cystatin C、CA-125、hs-CRP水平均有所下降,CA-125、hs-CRP下降更明显(P均<0.05)。肾功能指标Ccr、GFR值有上升趋势,但无统计学意义(P均>0.05)。细胞免疫指标CD4+T细胞数及CD4+T/CD8+T值均明显升高(P均<0.05)。见表1。相关分析结果提示,CD4+T细胞数与hs-CRP、CA-125呈负相关(r分别为-3.326、-2.910,P均<0.05);而CD4+T细胞数与Cystatin C、Ccr、GFR无显著相关性(r分别为0.285、0.101、0.225,P均>0.05)。GFR与Cystatin C、CA-125、hs-CRP呈负相关(r分别为-2.352、-4.022、-3.022,P均<0.05)。
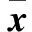
表1 对照组和观察组HAART前后各观察指标比较(±s)
注:与对照组比较,*P<0.05,**P<0.01;与同组HAART治疗前比较,▲P<0.05。
3 讨论
据统计,在HIV感染者中,肾功能异常者可占30%,HIV/AIDS相关肾脏疾病已成为终末期肾病的一个常见病因,并加剧艾滋病的进展并导致死亡[3]。HIV/AIDS合并肾功能损害具体损伤机制目前尚未阐明,主要认为是炎症损伤学说、免疫损伤机制等。研究[4,5]显示,HIV对肾损害常见表现有:①直接侵犯肾脏引起HIVAN,表现为肾病综合征,并迅速进展为终末期肾脏病。②HIV引起的相关感染,如肾脏感染等,亦会严重影响患者的肾脏功能。③艾滋病高危危险因素,亦会引起肾脏病理性改变,如静脉应用海洛因引起肾脏局灶性节段性肾小球硬化(FSGS)样变,临床表现并发高血压,数年后进展为终末期肾脏病。④使用肾损药物所致,或许与部分抗逆转录病毒药物对肾脏肌酐清除率造成影响有关。部分抗逆转录病毒药物亦能造成肾功能损害,如替诺福韦易造成肾功能不全、茚地那韦易造成患者肾结石等。⑤HIV/AIDS有合并高血压、糖尿病、慢性乙肝/丙肝等基础疾病所致肾损害等。
血清Cystatin C即称为半胱氨酸蛋白酶抑制蛋白C,是一种低相对分子质量碱性糖化蛋白质。在所有的有核细胞内表达,且不受年龄、性别、炎症因子、脂血和溶血等因素影响。目前研究发现其参与调节半胱氨酸蛋白酶的活性,对组织糖化蛋白B、H、L有抑制作用,参与各种生理病理作用[6]。研究提示,HIVAN患者血清Cystatin C水平明显升高,血Ccr及GFR值降低,肾功能损害,血清Cystatin C可作为一个敏感反映肾小球滤过功能的指标,对早期诊断肾功能损害有重要价值。而血CA-125是一种上皮源性的黏液大分子糖蛋白,主要作为卵巢癌的诊断、疗效判断和随访的肿瘤标志物。此后发现血CA-125升高还见于其他肿瘤及非肿瘤性疾病,包括肝病、肾衰竭、胸膜炎、慢性心力衰竭等。多数认为主要与他们共同的胚胎来源-体腔上皮有关。本研究经校正排除肝病、胸膜炎、严重心力衰竭、肿瘤等,HIVAN患者血CA-125水平明显高于正常对照及正常值平均水平,且患者肾功能损害指标肾小球滤过率均明显下降,肾功能损害明显,炎症因子标志物hs-CRP亦明显升高;相关分析结果显示,GFR与血清Cystatin C、CA-125、hs-CRP呈负相关。由此认为诱导CA-125分泌增加的机制除积液直接刺激间皮细胞外,亦可能与HIVAN患者低免疫状态的隐形感染,营养状态低下、病毒直接侵害等导致炎症因子分泌增加及免疫损伤因素有关。HIVAN疾病进展同免疫功能紊乱有关,持续的免疫激活导致HIV疾病恶化,而炎症反应在机体免疫激活过程中扮演重要角色,炎症因子如C-反应蛋白、肿瘤坏死因子、白细胞介素6等被看作免疫功能紊乱的标志物[7,8]。近年来临床研究提示血清Cystatin C、CA-125在心脑血管疾病、心力衰竭、糖尿病、糖尿病肾病等疾病发展和预后中有明显效应作用,尤其是肾功能不全及慢性心力衰竭患者。
本研究结果显示,观察组HAART治疗前及治疗后6个月血清Cystatin C、CA-125、hs-CRP水平比对照组明显升高,差异有统计学意义;经6个月HAART治疗,血清Cystatin C、CA-125、hs-CRP水平有所下降,而CA-125、hs-CRP下降更明显,与治疗前比较差异有统计学意义。另外观察组肾功能指标Ccr、GFR值及细胞免疫指标CD4+T计数及CD4+T/CD8+T值均明显低于对照组,差异有统计学意义,说明观察组患者肾功能损害明显,机体细胞免疫功能低下。经6个月HAART治疗,肾功能指标Ccr、GFR值上升,患者免疫重建,肾功能有好转趋势,临床症状改善,但与治疗前比较差异无统计学意义;而细胞免疫指标CD4+T计数及CD4+T/CD8+T值均明显升高,与治疗前比较差异有统计学意义。提示HIVAN患者机体细胞免疫功能低下,CD4+T计数及CD4+T/CD8+T值均明显下降,体质量指数偏低,表现消瘦、营养不良,脂肪分布异常,部分有贫血表现;与正常人群相比,有较高的艾滋病高危行为,表现为性乱、吸毒及静脉注射毒品等为主;实验室检查提示HIVAN患者肾功能损害指标Ccr、GFR值降低,血清Cystatin C水平明显升高,临床主要以轻中度损害为主,终末期肾病患者较少,临床症状轻,以基础治疗为主。炎症指标hs-CRP及CA-125水平明显升高,考虑其可能参与HIVAN患者肾损害炎症损伤机制,可累及肾小球、肾小管、肾间质和血管等[9]。
总之,HIVAN患者血清Cystatin C、CA-125水平高表达,HAART治疗6个月后有下降趋势,CA-125水平下降更明显。HAART治疗能有效抑制全身炎症因子,有效促进机体免疫重建。通过监测血清Cystatin C、CA-125水平,有助于观察和评估HIVAN患者肾脏损害发生、进展和预后。
[1] 中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南[J].中华传染病杂志,2006,24(2):133-143.
[2] 唐荣,凌云,卢洪洲.HIV/AIDS合并慢性肾病者的治疗指南[J].中国艾滋病性病,2006,12(6):585-587.
[3] Jain S, Gautam V, Naseem S. Acute-phase proteins:As diagnostic tool[J]. Pharm Bioallied Sci, 2011,3(1):118-127.
[4] 刘旭辉,云鹰.HIV/AIDS相关性肾损伤的病因及早期监测研究进展[J].医学综述,2009,15(8):1239-1241.
[5] 徐丹,张威.尿蛋白加速肾小管损伤机制研究进展[J].生理科学进展,2016,47(2):157-160.
[6] 姚震.胱氨酸蛋白酶抑制剂C诊断早期肾功能损害的研究[J].检验医学与临床,2008,5(1):34-35.
[7] Liovat AS, Rey-Cuille MA, Lecuroux C, et al. Acute plasma biomarkers of T cell activation set-point levels and of disease progression in HIV-1 infection[J]. PLoS One, 2012,7(10):46-143.
[8] Nixon DE, Landay AL. Biomarkers of immune dysfunction in HIV [J]. Curr Opin HIV AIDS, 2010,5(6):498-503.
[9] Rosenberg AZ, Naicker S, Winkler CA, et al. HIV-associated nephropathies: epidemiology ,pathology, mechanisms and treatment[J]. Nat Rev Nephrol, 2015,11(3):150-160.
广西壮族自治区卫计委自筹经费科研项目(Z2015168)。
冯润川(E-mail:fengrunchuan10000@163.com)
10.3969/j.issn.1002-266X.2017.09.025
R512.91
B
1002-266X(2017)09-0074-03
2016-12-18)
