CpG位点选择对焦磷酸测序法检测肝癌SMP30启动子甲基化的影响
2017-05-03莫之婧郑顺心周素芳
莫之婧,郑顺心,周素芳
(广西医科大学,南宁530021)
·论著·
CpG位点选择对焦磷酸测序法检测肝癌SMP30启动子甲基化的影响
莫之婧,郑顺心,周素芳
(广西医科大学,南宁530021)
目的 选择适宜的CpG位点用于焦磷酸测序法检测肝癌衰老标记蛋白30(SMP30)启动子甲基化。方法 提取人肝癌细胞系SMCC-7721和BEL-7404的基因组DNA,设计针对SMP30基因序列1和序列2的扩增和测序引物,焦磷酸测序法检测SMP30基因序列1和序列2中的CpG位点甲基化程度,并用Sanger测序法验证序列2中出现的SNP位点。结果 SMCC-7721和BEL-7404细胞系中,SMP30基因序列1中6个CpG位点低甲基化,与SMP30基因低表达不符,且测序结果质量评估均为失败。SMP30基因序列2中6个CpG位点高甲基化,与SMP30基因低表达相符,前2个CpG位点均为通过,而后4个CpG位点均为失败。去除第5和第6个CpG位点,只检测SMP30基因序列2中poly(T)结构前4个CpG位点,SMCC-7721细胞系中甲基化程度分别为100%、90%、100%和80%;BEL-7404细胞系中甲基化程度分别为100%、92%、100%和77%。除第3个CpG位点为失败,其余CpG位点均为通过。Sanger测序显示SMCC-7721和BEL-7404细胞系在第3个CpG位点前存在SNP位点,且均为A。结论 焦磷酸测序时选择靠近基因转录起始点上游且在poly (T)结构之前的CpG位点,测得的SMP30启动子甲基化值较准确。
肝癌;衰老标记蛋白30;甲基化;焦磷酸测序
DNA甲基化是常见的表观遗传学修饰方式,在基因表达调控中发挥重要作用[1]。DNA甲基化的定量测定在病理情况下有重要意义[2],检测肿瘤相关基因的甲基化水平对肿瘤发生机制的阐明、肿瘤早期诊断和治疗有重要意义[3]。衰老标记蛋白30(SMP30)是肝癌相关抗原之一[4]。本课题组通过使用特异siRNA抑制人肝癌HepG2细胞内SMP30表达,发现细胞的增殖和侵袭能力增强[5]。研究发现肝癌癌旁组织中SMP30 mRNA和蛋白质表达水平均升高,而在癌灶组织中表达水平均降低[6]。研究[7~9]表明,高频率的抑癌基因启动子区域甲基化在肝细胞癌(HCC)是一普遍的、早期事件。SMP30在肝癌组织中表达水平下降现象可能是DNA甲基化发挥作用的结果。焦磷酸测序法采用的是边合成边测序的方法,掺入核苷酸后释放的焦磷酸可生成等量的ATP,ATP经酶转化成相应比例的光信号,根据加入的核苷酸类型和测得的光信号强度可实时记录模板DNA的核苷酸序列[10]。用焦磷酸测序法分析DNA甲基化模式,只需经简单反应,就能获得若干个CpG位点的精确甲基化值,且重复性好[11]。然而,在应用焦磷酸测序法进行甲基化测定时,常因CpG位点的选择不当或序列存在poly (T) 结构和单核苷酸多态性(SNP)位点,无法得到高质量的测序结果。2014年9月,本研究以SMP30基因CpG岛为研究对象,采用焦磷酸测序法检测其甲基化状况,研究上述情况下对DNA甲基化测定的影响,并优化检测方法,以获得准确可靠的SMP30启动子甲基化检查结果,为进一步研究甲基化水平与肿瘤发生的关系奠定实验基础。
1 材料与方法
1.1 材料 SMCC-7721和BEL-7404细胞系购自复旦IBS细胞资源中心。用含10%胎牛血清(Gbico公司)的高糖DMEM培养液(Gbico公司),置于37 ℃、5%CO2条件下培养。台式高速离心机(Thermo公司);BIO RAD POWER PAC 3000(BIO RAD公司);BIO RAD DNA SUB CELL(BIO RAD公司);ABI 9700 PCR 扩增仪(Applied Biosystems公司);NanoDrop ND-2000微量紫外分光光度计(Thermo公司);凝胶成像系统 GIS-1600(上海天能公司);PyroMark Q96 ID焦磷酸测序仪(Qiagen公司)。
1.2 SMCC-7721和BEL-7404细胞系中SMP30基因表达检测 细胞系总RNA提取使用RNA提取试剂盒(Omega公司),按照RT-PCR试剂盒(Takara)说明书逆转录为cDNA。SMP30基因荧光定量PCR上游引物:5′-GTGGATGCCTTTGACTATGACC-3′,下游引物:5′-CTTCCCCTCAGCATCAATACAC-3′;GAPDH为内参,上游引物:5′-TGCACCACCAACTGCTTAGC-3′,下游引物:5′-GGCATGGACTGTGGTCATGAG-3′。PCR反应条件:95 ℃预变性2 min,95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,共40个循环。反应体系为20 μL,其中cDNA 2 μL,引物0.8 μL,SYBR Premix Ex TaqTM 10 μL和ROX 0.4 μL,加超纯水补齐至20 μL。
1.3 SMP30启动子甲基化检测方法 在UCSC Genome Browser(http://www.genome.ucsc.edu/)上查找SMP30基因的CpG岛序列,其CpG岛位于chrX:46937632-46938149,长度为518个碱基,含45个CpG位点。下游引物5′端由生物素修饰。序列1:上游引物:5′-TTGTTAGGGGAGGTTTTGTAGGATT-3′,下游引物:5′-ACTTAACAAATAAATAACATAAACCTAAA-3′,测序引物:5′-GGGAGGTTTTGTAGGATTTT-3′;序列2:上游引物:5′-GGGGAGGGGTTTTAGGTTTATGT-3′,下游引物:5′-ATCTCCTTCTAACAATCAACTATCA-3′,测序引物:5′-GGGTTTTAGGTTTATGTTATTTAT-3′。细胞系DNA提取按DNA提取试剂盒(Axygen)说明书进行,然后按照甲基化修饰试剂盒(Qiagen)说明书对基因组DNA进行亚硫酸盐处理,使DNA中的无甲基化修饰的C转化为U,然后通过PCR扩增转化为T。焦磷酸测序:PCR反应体系为50 μL,其中模板2 μL,5×buffer GC 10 μL,Taq酶(5 U/μL) 0.2 μL,dNTP(10 mmol/L) 1 μL,上下游引物各1 μL,加超纯水补齐至50 μL。焦磷酸测序模板扩增反应条件为95 ℃ 3 min,94 ℃ 30 s, 54 ℃ 30 s,72 ℃ 1 min,40个循环;72 ℃ 7 min。
1.4 序列1甲基化程度检测 选择SMP30基因转录起始点上游序列1的6个CpG位点,焦磷酸测序法检测甲基化程度。
1.5 序列2甲基化程度检测 选择SMP30基因转录起始点上游序列2的6个CpG位点检测甲基化程度。当只检测序列2中前4个CpG位点甲基化值时,用焦磷酸测序仪自带软件 PyroMark Assay Design编辑程序时,选择不分析后2个CpG位点甲基化值。
1.6 SNP位点Sanger测序方法 样品总DNA送北京六合华大基因科技有限公司进行Sanger测序。
2 结果
2.1 SMCC-7721和BEL-7404细胞系中SMP30基因表达水平 SMP30基因在SMCC-7721和BEL-7404细胞系中均呈低表达(表1)。
2.2 序列1甲基化程度检测结果 SMCC-7721细胞系6个CpG位点甲基化程度分别为39.61%、16.94%、18.23%、17.83%、19.62%和12.29%;BEL-7404细胞系6个CpG位点甲基化程度分别为42.02%、17.84%、19.67%、20.22%、23.73%和16.74%(图1)。甲基化程度不高,与SMP30基因在两种细胞系中低表达不符,序列1的6个CpG位点未能显示甲基化与基因表达量的负相关性,且测序结果质量评估均为失败。
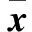
表1 SMP30基因在SMCC-7721和BEL-7404细胞系中表达(±s)
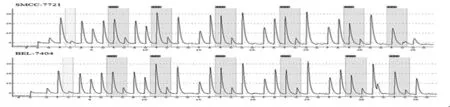
图1 CpG位点示意图和热解图
2.3 序列2甲基化程度检测结果 SMCC-7721细胞系 6个CpG位点甲基化程度分别为100%、100%、100%、84.64%、100%和100%,测序结果质量评估显示前2个CpG位点为通过,后4个CpG位点为失败;BEL-7404细胞系6个CpG位点甲基化程度分别为100%、100%、100%、74.31%、100%和100%(图2A)。测序结果的质量评估显示前2个CpG位点为通过,后4个CpG位点为失败。两种细胞系的SMP30基因CpG位点均为高甲基化,与SMP30基因的低表达相符。第4个和第5个CpG位点之间有一段序列CGTTTCCCCTCCCCTCG经亚硫酸盐修饰转化后,无甲基化修饰的C会转变为T,序列转变为CGTTTTTTTTTTTTTCG,形成poly (T) 结构(图2B),影响了测序质量评估。

图2 热解图和poly (T)结构图
SMCC-7721细胞系前4个CpG位点的甲基化程度分别为100%、90%、100%和80%(均值为92.5%);BEL-7404细胞系前4个CpG位点甲基化程度分别为100%、92%、100%和77%(均值为92.25%)。见图3。除第3个CpG位点为失败,其余3个CpG位点均为通过。第3个CpG位点为失败,提示该位点前某个位置可能存在SNP位点或突变,影响测序质量评估。
2.4 Sanger测序验证结果 查询NCBI显示SMP30基因转录起始点上游序列2的第3个CpG位点前有SNP位点:rs3814905,此SNP位点位于chrX:47078300-47078300,等位基因频率为A:15.232%(575/3775);G:84.768%(3200/3775),G>A/G。采用焦磷酸测序法检测此序列时,我们默认此SNP位点为G。为验证是否此SNP位点对焦磷酸测序法的质量评估有影响,我们采用经典的Sanger测序法对SMCC-7721和BEL-7404细胞系中此序列进行测序。结果显示SMCC-7721和BEL-7404细胞系此SNP位点均为A。
3 讨论
基因CpG岛的甲基化会显著降低甚至完全沉默此基因的表达,基因CpG岛的甲基化涉及多个CpG位点,不同CpG位点甲基化状态对基因表达的调控作用不同[12]。SMP30基因的CpG岛有45个CpG位点,焦磷酸测序法1次仅能检测50~100 bp长度的序列,因此选择合适的CpG位点尤其重要。
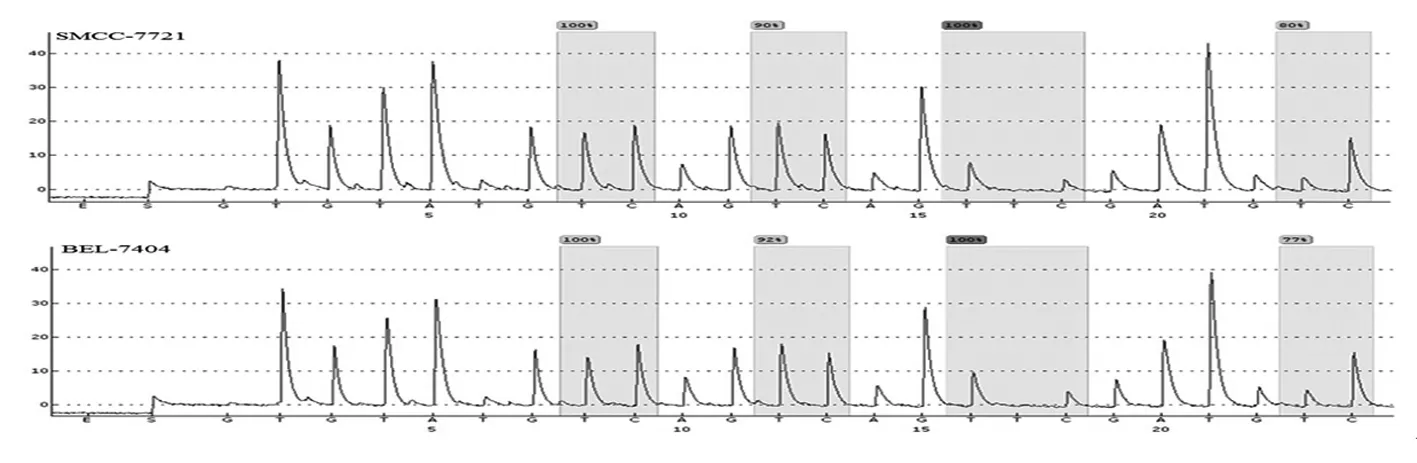
图3 序列2前4个CpG位点焦磷酸测序热解图
序列2中6个CpG位点相比序列1更接近SMP30基因的转录起始点,从检测结果看其高甲基化状态更能体现对SMP30基因低表达的调控。
焦磷酸测序时,亚硫酸盐修饰后的DNA序列中无甲基化修饰的C会转变为U,经PCR扩增转化为T,因此在富含CT的区域可能会形成poly (T)结构,峰高不能达到预期值,从而质量评估失败。序列2中的第4和第5个CpG位点间存在poly (T)结构,共有13个连续的T,峰高不可能达到13个T的高度,从而影响了poly (T)结构前后的CpG位点甲基化质量评估,测序质量不佳。为了获得高质量的检测结果,我们选择焦磷酸测序时只测poly (T)结构前面4个CpG位点,再次测序时质量明显上升,poly (T)结构前的第4个CpG位点质量评估由之前的失败转变为通过。可见,在焦磷酸测序时,如遇poly (T)结构,可只测poly (T)结构前的序列,提高测序质量。在消除poly (T)结构的影响后,序列2前4个CpG位点甲基化检测结果中,第3个CpG位点质量评估仍为失败,表明第3个CpG位点以前某个位置可能存在突变或SNP位点,使峰高与预期峰不符,影响了测序质量。为验证我们的判断,采用经典的Sanger测序法,将测得的序列与NCBI中查得的对应基因片段序列比对,发现确实在第3个CpG位点前有SNP位点:rs3814905,等位基因频率G>A/G,我们预期的位点为G,Sanger测序结果表明实际位点为A,从而峰高与预期峰高不符,测序质量的判断是软件分析位点前后的峰高判定的,所以当待测序列与理论峰高不一致时会影响测序质量的判定。而测序位点的甲基化比率是由C的峰高决定的,因此第3个CpG位点的甲基化值是可信的。
综上所述,在用焦磷酸测序法检测SMP30基因甲基化状态时,我们选择了靠近基因转录起始位点上游的CpG位点,除去了poly (T)结构的影响,并验证了第3个CpG位点的甲基化质量评估失败是由SNP位点引起的,不影响第3个CpG位点甲基化值的准确性,表明在肝癌细胞系中检测到的SMP30启动子高甲基化现象准确可信。
[1] Day J, Savani S, Krempley BD, et al. Influence of paternal preconception exposures on their offspring: through epigenetics to phenotype[J]. Am J Stem Cells, 2016,5(1):11-18.
[2] Joyce BT, Gao T, Zheng Y, et al. Prospective changes in global DNA methylation and cancer incidence and mortality[J]. Br J Cancer, 2016,115(4):465-472.
[3] Stirzaker C, Zotenko E, Clark SJ. Genome-wide DNA methylation profiling in triple-negative breast cancer reveals epigenetic signatures with important clinical value[J]. Mol Cell Oncol, 2016,3(1):e1038424.
[4] 孙泽峰,郭雪婷,李雅娟,等.人肝癌血清对人体胚胎干细胞文库的筛选及方法改进[J].生物技术通报,2008(S1):160-164.
[5] Zhang SC, Liang MK, Huang GL, et al. Inhibition of SMP30 gene expression influences the biological characteristics of human Hep G2 cells[J]. Asian Pac J Cancer Prev, 2014,15(3):1193-1196.
[6] Zhou SF, Mo FR, Bin YH, et al. Serum immunoreactivity of SMP30 and its tissues expression in hepatocellular carcinoma[J]. Clin Biochem, 2011,44(4):331-336.
[7] Lambert MP, Paliwal A, Vaissière T, et al. Aberrant DNA methylation distinguishes hepatocellular carcinoma associated with HBV and HCV infection and alcohol intake[J]. J Hepatol, 2011,54(4):705-715.
[8] Li X, Yu J, Brock MV, et al. Epigenetic silencing of BCL6B inactivates p53 signaling and causes human hepatocellular carcinoma cell resist to 5-FU[J]. Oncotarget, 2015,6(13):11547-11560.
[9] Fu Y, Feng MX, Yu J, et al. DNA methylation-mediated silencing of matricellular protein dermatopontin promotes hepatocellular carcinoma metastasis by alpha3beta1 integrin-Rho GTPase signaling[J]. Oncotarget, 2014,5(16):6701-6715.
[10] Ronaghi M. Pyrosequencing sheds light on DNA sequencing[J]. Genome Res, 2001,11(1):3-11.
[11] Tost J, Gut IG. DNA methylation analysis by pyrosequencing[J]. Nat Protoc, 2007,2(9):2265-2275.
[12] Chaikind B, Ostermeier M. Directed evolution of improved zinc finger methyltransferases[J]. PLoS One, 2014,9(5):e96931.
Effect of CpG site selection on SMP30 promoter methylation detection in hepatocellular carcinoma by pyrosequencing
MOZhijing,ZHENGShunxin,ZHOUSufang
(GuangxiMedicalUniversity,Nanning530021,China)
Objective To determine appropriate CpG sites for senescence marker protein 30 (SMP30) promoter methylation detection in hepatocellular carcinoma using pyrosequencing. Methods Genomic DNA was isolated from human hepatocellular carcinoma cell lines SMCC-7721 and BEL-7404. The amplification and sequencing primers were designed for SMP30 gene sequence 1 and sequence 2, and the methylation status of CpG sites in SMP30 gene sequence 1 and sequence 2 was determined by pyrosequencing technology. Sanger sequencing was used to validate the SNP. Results In SMCC-7721 and BEL-7404 cell lines, the 6 CpG sites in SMP30 gene sequence 1 were low methylatied, which was not consistent with the low expression of SMP30 gene, and the quality of the sequencing results all failed. The 6 CpG sites in the SMP30 gene sequence 2 were highly methylated, which was consistent with the low expression of SMP30 gene, the first 2 CpG sites passed, and the last 4 CpG sites failed. The 5th and 6th CpG sites were ignored and only the first 4 CpG sites before the poly (T) structure in SMP30 gene sequence 2 were detected, the percentage of methylation in BCC-7721 cell line was 100%, 90%, 100% and 80%. The percentage of methylation in BEL-7404 cell line was 100%, 92%, 100% and 77%. Except for the 3th CpG site, the rest of the CpG sites passed. Sanger sequencing showed that SMCC-7721 and BEL-7404 cell lines had SNP sites before the 3th CpG site, and all of them were A. Conclusion Pyrosequencing methylation analysis of CpG sites near the upstream of transcription start site and before the poly (T) structure in SMP30 promoter is more accurate.
liver carcinoma; senescence marker protein 30; methylation; pyrosequencing
国家自然科学基金委员会资助项目(81460432)。
莫之婧(1981-),女,硕士,主要研究方向为疾病的分子生物学。E-mail:36456198@qq.com
周素芳(1964-),女,博士研究生,教授,主要研究方向为肿瘤抗原分子生物学。E-mail:zsf200000@163.com
10.3969/j.issn.1002-266X.2017.09.001
R735.7
A
1002-266X(2017)09-0001-04
2016-11-19)
