Psammaplin A对离体结肠癌SW480细胞增殖、凋亡的影响及机制
2017-05-03刘海宏孟庆凯石刚
刘海宏,孟庆凯,石刚
(1东北大学医院,沈阳110004;2中国医科大学肿瘤医院)
Psammaplin A对离体结肠癌SW480细胞增殖、凋亡的影响及机制
刘海宏1,孟庆凯2,石刚2
(1东北大学医院,沈阳110004;2中国医科大学肿瘤医院)
目的 探讨组蛋白去乙酰化3(HDAC3)抑制剂Psammaplin A对离体结肠癌细胞增殖、凋亡的影响及机制。方法 取处于对数生长期结肠癌SW480细胞,随机分为Psammaplin组与对照组,Psammaplin组给予不同浓度(0.5、5、50、500、5 000 μg/mL)Psammaplin A干扰48 h,对照组不给予任何干预。采用Western blotting法检测HDAC3及DNMT3a蛋白表达:MTT法检测不同细胞培养时间(24、48、72、96 h)、不同浓度梯度Psammaplin A对SW480细胞增殖的影响。流式细胞术检测Psammaplin A对SW480细胞周期及凋亡的影响。结果 Psammaplin组0.5、5、50、500、5 000 μg/mL的Psammaplin A干扰SW480细胞48 h后,HDAC3蛋白相对表达量分别为23.28±8.91、21.72±9.18、18.63±7.26、14.17±5.64、10.58±7.22,对照组HDAC3蛋白相对表达量为24.84±7.65,与对照组比较,Psammaplin组在500及5 000 μg/mL时差异有统计学意义(P均<0.05)。Psammaplin组0.5、5、50、500、5 000 μg/mL的Psammaplin A干扰SW480细胞48 h后,DNMT3a蛋白相对表达量分别为18.36±8.43、17.51±6.29、16.12±6.54、11.27±5.31、10.54±4.26,对照组为20.15±6.31,与对照组比较,Psammaplin组在500及5 000 μg/mL时差异有统计学意义(P均<0.05)。50 μg/mL的Psammaplin A干预SW480细胞培养24、48、72及96 h后,Psammaplin组细胞存活率为时间依赖性下降,与对照组比较,在48、72及96 h时差异均有统计学意义(P均<0.05);Psammaplin组0.5、5、50、500、5 000 μg/mL的Psammaplin A作用48 h后,与对照组比较,SW480细胞存活率呈剂量依赖性下降,在50、500、5 000 μg/mL时差异有统计学意义(P均<0.05)。Psammaplin组与对照组G1期细胞所占比例分别为(69.27±0.93)%、(81.25±0.89)%,G2期细胞所占比例分别为(4.72±1.83)%、(9.62±1.34)%,S期细胞所占比例分别为(27.61±1.65)%、(10.43±0.97)%,两组各期细胞所占比例比较,P均<0.05。Psammaplin组与对照组细胞凋亡率分别为56.98%、31.67%,两组比较,P<0.01。结论 Psammaplin A可通过抑制HDAC3及DNMT3a表达降低结肠癌细胞存活率及增殖活性,诱导凋亡。
结肠癌;Psammaplin A;组蛋白去乙酰化3蛋白;DNA甲基化3a蛋白
结直肠癌是常见的消化道恶性肿瘤之一,在我国及欧美国家发病率呈逐年递增趋势,在恶性肿瘤中位居第三位,病死率位居第四位[1]。目前大肠癌治疗方式有根治性手术、辅助化疗、放疗、免疫治疗、靶向治疗及中医药综合治疗等[2~4]。对于不能手术根治的直肠癌药物治疗方法仍在探索中,多药耐药是大肠癌药物治疗受限的重要因素[5]。组蛋白去乙酰化(HDAC)及DNA甲基化(DNMT)与大肠癌关系密切,有对基因转录抑制方面的协同作用,如对DNMT3a进行靶向抑制,可能解除抑癌基因的转录抑制状态,为新的靶向药物研发提供新的候选靶点[6]。Psammaplins化合物是一类酚类化合物,Psammaplin A是其重要一员,最早从海绵体生物中分离提取出来[7],对多种肿瘤细胞有细胞毒性作用。2016年1~5月,我们用Psammaplin A处理离体结肠癌细胞株,观察细胞增殖、凋亡及细胞周期变化,探讨其作为结肠癌治疗的靶向药物可能性。
1 材料与方法
1.1 材料 人结肠癌细胞株SW480购自中科院上海细胞库,低温冰箱保存(实验前先对细胞进行复苏处理,采用含5%胎牛血清、10%FBS液、100 U/mL青霉素及链霉素的DMEM培养基于37 ℃、5%CO2饱和湿度培养箱内培养。以0.25%胰蛋白酶对融合度达到90%的细胞进行消化传代,选取对数生长期细胞进行实验,实验过程均重复3次,取平均值统计分析)。Psammaplin A(CAS No:110659-91-1)购自北京博奥派克生物有限公司,HDAC3多克隆抗体、DNMT3a多克隆抗体购自美国Santa Cruz生物技术公司,DAB显色试剂盒及BCA定量试剂盒购自大连宝生生物技术有限公司;MTT及Annexin V-FITC/PI试剂盒购自美国Invitrogen 公司。
1.2 细胞分组及Psammaplin A干预后SW480中HDAC3、DNMT3a蛋白表达检测 取处于对数生长期的人结肠癌细胞株SW480,随机分为Psammaplin组与对照组,Psammaplin组给予不同浓度梯度Psammaplin A(0.5、5、50、500、5 000 μg/mL)干扰48 h,对照组不给予任何干预。采用Western blotting法检测HDAC3及DNMT3a蛋白表达:按照蛋白提取试剂盒说明书进行细胞的蛋白提取,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白并电转移至PVDF膜。5%脱脂奶粉室温封闭90 min,分别加入一抗,孵育过夜后加入相应二抗,再次孵育,应用化学发光法显色,β-actin为内参照。应用QuantityOne进行灰度值检测,蛋白相对表达量=目标蛋白灰度值/内参照蛋白灰度值。
1.3 细胞分组及Psammaplin A干预后SW480细胞存活率测算 取处于对数生长期的人结肠癌细胞株SW480,以5×103/孔的密度接种于96孔细胞培养板内,设立3个复孔,细胞贴壁后Psammaplin组加入0.5、5、50、500、5 000 μg/mL的Psammaplin A作用48 h,对照组给予DMSO作用48 h作为Psammaplin组的平行对照,每个浓度均设3个复孔。细胞培养48 h后在每个孔内加入10% MTT液于37 ℃温箱内孵育4 h,弃上清后加150 μL DMSO,振荡20 min,测定光密度值,计算细胞存活率。另取贴壁细胞,Psammaplin组加入50 μg/mL的Psammaplin A,对照组给予DMSO作为平行对照,细胞培养24、48、72、96 h后进行MTT检测,步骤同前,测定细胞在不同培养时点存活率。
1.4 Psammaplin干预SW480后细胞周期检测 取Psammaplin组50 μg/mL Psammaplin A干预48 h的SW480细胞及对照组细胞,转移到EP管内,预冷PBS 1 mL洗涤后加入1 mL预冷70%乙醇,吹打混匀,4 ℃下固定24 h,1 200 g离心4 min。弃上清后预冷PBS 1 mL洗涤。每个样品均采用PBS液进行重悬,加0.5%PI 30 μL、15 μL RNase A(10 mg/mL),在4 ℃下避光温浴35 min。上流式细胞仪,激发波长488 nm,检测细胞周期。
1.5 Psammaplin干预SW480后细胞凋亡率检测 取Psammaplin组50 μg/mL Psammaplin A干预48 h的SW480细胞及对照组细胞,按照Annexin V-FITC/PI试剂盒说明书步骤操作,流式细胞仪Alexa FITC最大激发波长设定为488 nm,最大发射波长设定为509 nm,PI-DNA复合物最大激发波长设定为535 nm,最大发射波长设定为615 nm,每个样本采集细胞数为10 000个,应用Cell Quest软件进行分析凋亡细胞数。
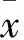
2 结果
2.1 两组HDAC3及DNMT3a蛋白表达比较 不同浓度梯度(0.5、5、50、500、5000 μg/mL)Psammaplin A干扰SW480细胞48 h后,Psammaplin组HDAC3蛋白相对表达量分别为23.28±8.91、21.72±9.18、18.63±7.26、14.17±5.64、10.58±7.22,对照组为24.84±7.65,与对照组比较,Psammaplin组在500及5 000 μg/mL时差异有统计学意义(t=3.982,P<0.05;t=7.204,P<0.01)。不同浓度梯度(0.5、5、50、500、5 000 μg/mL)Psammaplin A干扰SW480细胞48 h后,Psammaplin组DNMT3a蛋白相对表达量分别为18.36±8.43、17.51±6.29、16.12±6.54、11.27±5.31、10.54±4.26,对照组为20.15±6.31,与对照组比较,Psammaplin组在500及5 000 μg/mL时差异有统计学意义(t=3.982,P<0.05;t=7.204,P<0.01)。HDAC3及DNMT3a蛋白表达均呈现剂量依赖性下降。
2.2 两组SW480细胞存活率比较 Psammaplin A(50 μg/mL)干预SW480细胞培养24、48、72及96 h后,Psammaplin组细胞存活率呈时间依赖性下降,与对照组比较,在48、72及96 h时差异均有统计学意义(t=4.534,P<0.05;t=6.249,P<0.01;t=12.593,P<0.01),见图1A;Psammaplin组加入不同浓度(0.5、5、50、500、5 000 μg/mL)的Psammaplin A作用48 h后,与对照组比较,SW480细胞存活率呈剂量依赖性下降,在浓度(50、500、5 000 μg/mL)时差异有统计学意义(t=3.182,P<0.05;t=6.947,P<0.01;t=14.062,P<0.01),见图1B。

注:A为Psammaplin A(50 μg/mL)干预SW480细胞培养24、48、72及96 h;B为0.5、5、50、500、5 000 μg/mL的Psammaplin A作用48 h。
图1 MTT检测不同时间、不同浓度Psammaplin A处理后细胞存活率
2.3 两组细胞周期比较 Psammaplin组与对照组G1期细胞所占比例分别为(69.27±0.93)%、(81.25±0.89)%,G2期细胞所占比例分别为(4.72±1.83)%、(9.62±1.34)%,S期细胞所占比例分别为(27.61±1.65)%、(10.43±0.97)%,两组各期细胞所占比例比较,差异均有统计学意义(t=3.148,P<0.05;t=2.926,P<0.05;t=4.127,P<0.05)。
2.4 两组细胞凋亡率比较 Psammaplin 组与对照组细胞凋亡率分别为56.98%、31.67%,两组比较,差异有统计学意义(t=9.573,P<0.01)。
3 讨论
随着饮食结构改变,高蛋白、高脂肪、低纤维素饮食结构使我国大肠癌的发病率年均以4.2%速度上升,且发病年龄有年轻化趋势。结直肠癌的发病经历由正常肠上皮向侵袭性转变的癌变过程,同时上皮细胞生长抑制能力丧失,这个过程具有多因素、多步骤及内外因交互作用的多方面影响[8]。抑癌基因被异常甲基化和异常组蛋白去乙酰化沉默是恶性肿瘤发生及进展的重要因素之一,HDAC抑制剂(HDACi)会使染色质组蛋白乙酰化水平提高,因此导致特定基因激活表达,相应地导致细胞末端分化或癌细胞凋亡[9]。临床研究表明,人类可安全地通过抑制HDAC的活性来获得组蛋白高乙酰化水平。在多种肿瘤中DNMTi和HDACi同样被证明具有治疗作用,可使肿瘤中的抑癌基因重新表达,诱导细胞分化、抑制生长,诱导凋亡等[10]。以上研究结果为我们进一步研究DNMTi和HDACi抗大肠癌提供了依据。因此DNA甲基化和组蛋白去乙酰化导致的基因沉默可应用DNMT和HDAC抑制剂逆转。
Psammaplin A是HDACi抑制剂之一,其在乳腺癌、卵巢癌及头颈部肿瘤中抑制恶性肿瘤细胞生长的作用已被研究证实,但其在结直肠癌细胞中的研究目前鲜见报道。本研究结果显示,采用不同浓度梯度Psammaplin A干扰SW480细胞后,HDAC3及DNMT3a蛋白均呈剂量依赖性下降,表明Psammaplin A对HDAC3及DNMT3a具有双重抑制作用,这种抑制作用在结肠癌细胞中表现出明显效果。MTT检测结果显示,Psammaplin A干预SW480细胞存活率呈时间依赖性及剂量依赖性下降,SW480细胞表现出增殖减少,生存减低,证明了Psammaplin A的细胞毒性及杀灭结肠癌细胞的有效性。进一步流式细胞仪检测结果显示,Psammaplin A干预SW480细胞后停留于G1期及G2期比例减少,S期比例升高,SW480细胞凋亡率升高。说明Psammaplin A诱导细胞周期减缓,肿瘤细胞凋亡增加。Kim等[11]研究显示,Psammaplin A可诱发离体乳腺癌细胞的自嗜性死亡。Psammaplin A通过含水的氢键与HDAC1的Asp99位点作用,吸附于苯环的侧位,与通道激活入口处的Glu203位点作用,从而抑制HDAC1活性[12]。Psammaplin A对HDAC1的抑制作用具有高效及高选择性[13],但Psammaplin A的毒性作用目前研究较少,有研究[14]显示,其可诱发红细胞的自杀性死亡,但其对结肠癌细胞的杀灭作用及在体的毒性作用需进一步深入研究。
综上所述,Psammaplin A可通过抑制HDAC3及DNMT3a表达降低结肠癌细胞存活率及增殖活性,从离体细胞实验初步显示其可能作为结肠癌治疗靶向候选药物之一,但需进一步的在体实验及临床试验等深入研究才能证明其可应用性。
[1] Luo G, Zhang Y, Wang L, et al. Risk of colorectal cancer with hysterectomy and oophorectomy: A systematic review and meta-analysis[J]. Int J Surg, 2016,26(8):88-95.
[2] Sun X, Suo J, Yan J. Immunotherapy in human colorectal cancer: Challenges and prospective[J]. World J Gastroenterol, 2016,22(28):6362-6372.
[3] Demetter P, Jouret-Mourin A, Silversmit G, et al. Review of the quality of total mesorectal excision does not improve the prediction of outcome[J]. Colorectal Dis, 2016,18(9):883-888.
[4] Sievers CK, Kratz JD, Zurbriggen LD, et al. The multidisciplinary management of colorectal cancer: present and future paradigms[J]. Clin Colon Rectal Surg, 2016,29(3):232-238.
[5] Zhai Z, Yu X, Yang B, et al. Colorectal cancer heterogeneity and targeted therapy: clinical implications, challenges and solutions for treatment resistance[J]. Semin Cell Dev Biol, 2016,35(8)30267-30271.
[6] Flis S, Gnyszka A, Flis K. DNA methyltransferase inhibitors improve the effect of chemotherapeutic agents in SW48 and HT-29 colorectal cancer cells[J]. PLoS One, 2014,9(8):e106142.
[7] Baud MG, Leiser T, Petrucci V, et al. Thioester derivatives of the natural product psammaplin A as potent histone deacetylase inhibitors[J]. Beilstein J Org Chem, 2013,26(9):81-88.
[8] Abdelfatah E, Kerner Z, Nanda N, et al. Epigenetic therapy in gastrointestinal cancer: the right combination[J]. Therap Adv Gastroenterol, 2016,9(4):560-579.
[9]Khoram-Abadi KM, Forat-Yazdi M, Kheirandish S, et al. DNMT3B -149 C>T and -579 G> T polymorphisms and risk of gastric and colorectal cancer: a meta-analysis[J]. Asian Pac J Cancer Prev, 2016,17(6):3015-3020.
[10]Clawson GA. Histone deacetylase inhibitors as cancer therapeutics[J]. Ann Transl Med, 2016,4(15):287.
[11] Kim TH, Kim HS, Kang YJ, et al. Psammaplin A induces Sirtuin 1-dependent autophagic cell death in doxorubicin-resistant MCF-7/adr human breast cancer cells and xenografts[J]. Biochim Biophys Acta, 2015,1850(2):401-410.
[12] Wen J, Bao Y, Niu Q, et al. Synthesis, biological evaluation and molecular modeling studies of psammaplin A and its analogs as potent histone deacetylases inhibitors and cytotoxic agents[J]. Bioorg Med Chem Lett, 2016,26(17):4372-4376.
[13] Baud MG, Haus P, Leiser T, et al. Highly ligand efficient and selective N-2-(Thioethyl)picolinamide histone deacetylase inhibitors inspired by the natural product psammaplin A[J]. Chem Med Chem, 2013,8(1):149-156.
[14] Al Mamun Bhuyan A, Signoretto E, Lang F. Triggering of Suicidal Erythrocyte Death by Psammaplin A[J]. Cell Physiol Biochem, 2016,39(3):908-918.
Effect of Psammaplin A on proliferation and apoptosis of colon cancer SW480 cells in vitro
LIUHaihong1,MENGQingkai,SHIGang
(1HospitalofNortheastUniversity,Shenyang110004,China)
Objective To observe the effect of histone deacetylase 3 (HDAC3) inhibitor Psammaplin A on the proliferation and apoptosis of colon cancer cells in vitro. Methods Colon cancer SW480 cells in logarithmic phase were randomly divided into Psammaplin group and control group. Different concentrations of Psammaplin A (0.5, 5, 50, 500 and 5 000 μg/mL) were given and interfered for 48 h to cells in the Psammaplin A group, and no interference was given to cells in the control group. HDAC3 and DNMT3a protein expression was detected by Western blotting. MTT assay was used to detect the proliferation of SW480 affected by Psammaplin A in different concentrations and culture time (24, 48, 72, 96 h). Flow cytometer was used to detect the cell cycle and apoptosis affected by Psammaplin A. Results HDAC3 relative protein expression in the Psammaplin group which was interfered by 0.5, 5, 50, 500 and 5 000 μg/mL Psammaplin A for 48 h was 23.28±8.91, 21.72±9.18, 18.63±7.26, 14.17±5.64, 10.58±7.22, and 24.84±7.65 in the control group. Compared with control group, the differences were significant in the Psammaplin at 500 and 5 000 μg/mL (allP<0.05). DNMT3a relative protein expression in the Psammaplin group which was interfered by 0.5, 5, 50, 500 and 5 000 μg/mL Psammaplin A for 48 h was 8.36±8.43, 17.51±6.29, 16.12±6.54, 11.27±5.31 and 10.54±4.26, and 20.15±6.31 in the control group. Compared with control group, the differences were significant in the Psammaplin at 500 and 5 000 μg/mL (allP<0.05). After SW480 cells were interfered with 50 μg/mL Psammaplin A and cultured for 24, 48, 72 and 96 h, the survival rate in the Psammaplin group was decreased in a time-dependent manner. Compared with the control group, the difference was significant at 48, 72 and 96 h (allP<0.05). The survival rate in the Psammaplin group treated with 0.5, 5, 50, 500 and 5 000 μg/mL Psammaplin A for 48 h was decreased in a dose-dependent manner, and the different was significant at 50, 500 and 5 000 μg/mL as compared with survival rate in the control group (allP<0.05). The percentages of cells in G1phase of the Psammaplin group and control group were 69.27%±0.93% and 81.25%±0.89%, respectively, and those in the G2phase were 4.72%±1.83% and 9.62%±1.34%, in S phase were 27.61%±1.65% and 10.43%±0.97%, and the differences were significant (allP<0.05). The apoptosis rate in the Psammaplin group and control group was 56.98% and 31.67%, respectively, and the difference was significant (P<0.01). Conclusion Psammaplin A decreases the survival rate and proliferation of colon cancer cells by inhibiting the expression of HDAC3 and DNMT3a, and induces apoptosis.
colon carcinoma; Psammaplin A; histone deacetylase 3 protein; DNA methyltransferase 3a protein
辽宁省自然科学基金资助项目(2014020102);辽宁省省直医院临床能力建设青年项目(LNCCC-D46-2015)。
刘海宏(1980-),男,主治医师,主要研究方向为结直肠肿瘤的综合治疗及其机制。E-mail:bluesky2016@aliyun.com
孟庆凯(1972-),男,主任医师,主要研究方向为结直肠恶性肿瘤的基础与临床。E-mail:mqk1971@126.com
10.3969/j.issn.1002-266X.2017.09.002
R735.35
A
1002-266X(2017)09-0005-04
2016-09-10)
