非甾体类消炎药双氯芬酸抑制间充质干细胞向肌腱细胞增殖分化的研究
2017-04-26吕天旻俞富祥张甦张建国
吕天旻 俞富祥 张甦 张建国

[摘要] 目的 探討NSAIDs对间充质干细胞向肌腱细胞增殖分化过程的影响。 方法 体外建立鼠间充质干细胞系 C3H10T1/2 的肌腱细胞分化模型;CCK-8比色法分别检测双氯芬酸(diclofenac,DF)对间充质干细胞增殖的影响;用生长分化因子-7(growth differentiation factor,GDF-7)诱导鼠间充质干细胞系C3H10T1/2分化为肌腱细胞;PCR 检测间充质干细胞分化过程中肌腱细胞相关基因(腱调蛋白、胶原蛋白)的表达。PCR 分别检测 DF 对间充质干细胞分化过程中相关基因[腱调蛋白、脂肪细胞型脂肪酸结合蛋白(aP2)]表达的影响。 结果 成功建立鼠间充质干细胞系C3H10T1/2 的肌腱细胞分化模型;DF高浓度时明显抑制间充质干细胞增殖(24 h:t=2.357,3.524,P<0.05。72 h:t=3.217,3.592,P<0.05);GDF-7成功诱导鼠间充质干细胞系 C3H10T1/2 分化为肌腱细胞,肌腱细胞相关基因表达明显增加(腱调蛋白:t=124.107,P<0.05;Ⅰ型胶原蛋白α1:t=38.107,P<0.05);DF对间充质干细胞分化过程中抑制了肌腱基因的表达(DF:腱调蛋白:t=31.758,P<0.05),增强了脂肪相关基因的表达[(DF:脂肪细胞型脂肪酸结合蛋白(aP2):t=97.735,P<0.05)]。 结论 高浓度时 DF 抑制间充质干细胞增殖,改变间充质干细胞分化方向,不利于肌腱细胞再生修复。
[关键词] 间充质干细胞;肌腱细胞;增殖分化;生长分化因子
[中图分类号] R915 [文献标识码] B [文章编号] 1673-9701(2017)04-0005-05
Study of inhibition of proliferation and differentiation of mesenchymal stem cells into tendon cells by non-steroidal anti-inflammatory drugs of diclofenac
LV Tianmin YU Fuxiang ZHANG Su ZHANG Jian'guo
School of Medicine, Huzhou University, Huzhou 313000, China
[Abstract] Objective To investigate the effects of NSAIDs on the proliferation and differentiation of mesenchymal stem cells to tendon cells. Methods The differentiation model of tendon cells of rat mesenchymal stem cell line C3H10T1/2 was established in vitro. The effect of diclofenac(DF) on the proliferation of mesenchymal stem cells was detected by CCK-8 colorimetric assay. The differentiation of rat mesenchymal cell line C3H10T1/2 was induced by growth differentiation factor-7(GDF-7) into tendon cells. PCR was used to detect the expression of tendon-associated genes(tendon protein and collagen)during mesenchymal differentiation. PCR was used to detect the effect of DF on the expression of related genes[tonicgulin; adipocyte type fatty acid binding protein(aP2)] during differentiation of mesenchymal stem cells. Results The model of differentiation of tendon cells in rat mesenchymal cell line C3H10T1/2 was established successfully. When DF was at high concentration, mesenchymal cell proliferation was significantly inhibited(24 h:t=2.357,3.524,P<0.05. 72 h:t=3.217,3.592,P<0.05);GDF-7 successfully induced the differentiation of rat mesenchymal cell line C3H10T1/2 into tendon cells. The expression of related genes of tendon cells was significantly increased(TNMD:t=124.107, P<0.05;type Ⅰcollagen protein α1:t=38.107,P<0.05);DF inhibited the expression of tendon genes during the process of the differentiation of mesenchymal stem cells(DF:TNMD:t=31.758,P<0.05), and the expression of fat-related genes was increased(DF:aP2:t=97.735,P<0.05). Conclusion DF can inhibit the proliferation of mesenchymal stem cells and change the direction of mesenchymal differentiation in high concentration. It is not conducive to regeneration and repair of tendon cells.
[Key words] mesenchymal stem cells; Tendon cells; Proliferation and differentiation; Growth differentiation factors
肌腱是胶原结缔组织,连接骨骼和肌肉,是关节运动的基础。然而,在体育运动、体力劳动过程中,这种反复性的负荷运动易导致肌腱的损伤,从而引起慢性炎症,典型的表现是局部疼痛及运动障碍,这些情况下常经验性地给予NSAIDs抗炎治疗。目的在于缓解症状和改善运动障碍。然而在生物药理学上,基于这些药物的治疗对于肌腱再生的影响作用尚未明确。利用已报道的实验方法[1,2],用生长分化因子-7(GDF-7)诱导鼠间充质干细胞系C3H10T1/2分化为肌腱细胞。评估双氯芬酸(DF)对间充质干细胞向肌腱细胞增殖分化过程的影响。现报道如下。
1 材料与方法
1.1 材料及试剂
鼠间充质干细胞系C3H10T1/2,由温州医科大学外科实验中心提供;L-DMEM培养基,购自Hyclone公司;小牛血清购自Gibco公司;双氯芬酸(DF)购自Sigma公司;生长分化因子-7(GDF-7)购自R&D公司;CCK-8试剂盒购自温州长风生物科技公司;PCR试剂盒购自Invitrogen公司。
1.2 方法
(1)细胞培养 大鼠间充质干细胞(C3H10TY1/2)用含10%小牛血清的L-DMEM常规培养,孵育箱(型号:MCO-20AIC,SANYO)95%O2和5%CO2,每2~3天换液1次。
(2)CCK-8比色法检测DF对间充质干细胞增殖的影响 将处于对数生长期的间充质干细胞消化传代,细胞计数并调整细胞数为 1×104接种于 96孔板中,换无血清的 DMEM 培养液,每孔100 μL,培养24 h后按不同浓度分别向各孔中加入DF(终浓度分别为 0、1、10、100、1000 μL),每个浓度设 5个复孔,继续培养 24 h 或 72 h 后每孔加入CCK-8 溶液80 uL,继续培养2 h,用自动酶标仪(型号:WD-2102A,杭州汇尔仪器设备有限公司)于450 nm 处检测每孔的吸光度(A)值,以药物浓度为0的实验组为对照组,间接计算细胞增殖程度。
(3)GDF-7诱导间充质干细胞向肌腱细胞分化 将间充质干细胞铺于6孔板中,每孔细胞5×105,加入终浓度为50 ng/mL 的 GDF-7 及终浓度 50 μg/mL的抗坏血酸,培养 6 d,诱导间充质干细胞向肌腱细胞分化。
(4)PCR检测间充质干细胞向肌腱细胞分化过程中Ⅰ型胶原蛋白α1、腱调蛋白的mRNA表达以未加药物的实验组为对照组,在间充质干细胞向肌腱细胞诱导分化过程中,请长风生物科技公司设计大鼠胶Ⅰ型原蛋白α1、腱调蛋白及内参GAPDH的引物,利用PCR技术,分别测定各组细胞中上述基因的mRNA表达情况。具体如下:Ⅰ型胶原蛋白α1上游引物:5-GAGCGGAGAGTACTGGATCG -3,下游引物:5-GCTTCTTTTCCTTGGGGTTC -3,扩展片断长195 bp;腱调蛋白上游引物:5-TGTACTGGATCAATCCCACTCT -3,下游引物:5-GCTCATTCTGGTCAACTCCCCT-3,扩增片断长213 bp;GAPDH上游引物:5-AGGACCAGGTTGTCTCCTG-3,下游引物:5-GGATGGAATTGTGAGGGAGA-3,扩增片断长215 bp;用GAPDH为引物鉴定cDNA,分别扩增目标基因。反应条件:95℃ 20 s 预变性,扩增40个循环,每个循环包括:90℃ 变性3 s,52.1℃ 退火30 s,60℃ 延伸30 s。
(5)DF对充质细胞形态的影响 PCR检测DF对间充质干细胞向肌腱细胞分化过程中腱调蛋白、脂肪细胞型脂肪酸结合蛋白(aP2)的mRNA表达影响。在间充质干细胞向肌腱细胞诱导分化过程中,从开始分化到第6天各组细胞加入 DF 1000 μL,然后显微镜(型号:XDS-100,上海蔡康光学仪器有限公司)下觀察细胞形态的变化,并分析肌腱细胞、脂肪细胞的标志物表达。腱调蛋白、脂肪细胞型脂肪酸结合蛋白(aP2)及内参 GAPDH 的引物,具体如下:腱调蛋白上游引物:5- TGTACTGGATCAATCCCACTCT-3,下游引物:5- GCTCATTCTGGTCAACTCCCCT-3,扩增片断长213 bp;脂肪细胞型脂肪酸结合蛋白(aP2)上游引物:5- CATGGCCAAGCCCAACAT -3,下游引物:5-CGCCCAGTTTGAAGGAAATC -3,扩增片断长339 bp;GAPDH上游引物:5-GAGGACCAGGTTGTCTCCTG-3,下游引物:5-GGATGGAATTGTGAGGGAGA-3,扩增片断长 215 bp;用 GAPDH 为引物鉴定cDNA,分别扩增目标基因。反应条件:95℃ 20 s 预变性,扩增40个循环,每个循环包括:90℃ 变性3 s,52.1℃ 退火30 s,60℃ 延伸30 s。
1.3 统计学方法
实验数据资料利用SPSS 16.0进行统计学处理,计量资料以均数±标准差(x±s)表示,两样本均数间比较用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 DF抑制间充质干细胞的增殖
用 CCK-8 试剂盒做细胞增殖测定,DF 作用于间充质干细胞 24 h,浓度100 μL、1000 μL的实验组与对照组比较表现出抑制作用(t=2.357,3.524,P<0.05),而其他浓度的实验组均未显示出抑制作用。DF作用于间充质干细胞72 h,浓度100 μL、1000 μL的实验组与对照组比较表现出抑制作用(t=3.217,3.592,P<0.05),而其他浓度的实验组均未显示出抑制作用。见表1、图1。
表1 各培養体系中的吸光度比较(x±s)
2.2 GDF-7促进间充质干细胞的分化
GDF-7诱导间充质干细胞向肌腱细胞分化,可见 GDF-7增强肌腱细胞标志物腱调蛋白和胶原蛋白1α1的表达(腱调蛋白:t=124.107,P<0.05;Ⅰ型胶原蛋白α1:t=38.107,P<0.05)。见表2、图2。
图2 GDF-7促进间充质干细胞的分化
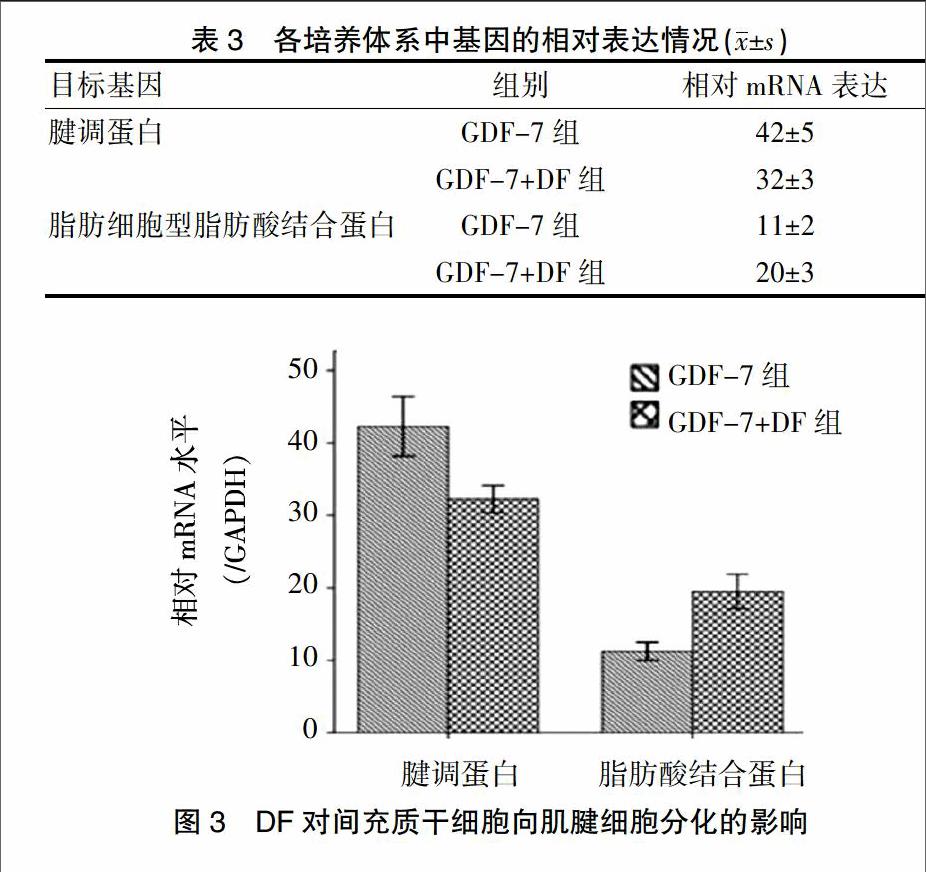
2.3 DF对间充质干细胞向肌腱细胞分化的影响
GDF-7促进了间充质干细胞向肌腱细胞分化,但加入DF后,发现将间充质干细胞中脂肪细胞出现增加,见封三图3A-B。进一步通过 PCR 检测发现 DF明显抑制了GDF-7诱导的间充质干细胞的腱调蛋白表达(DF:腱调蛋白:t=31.758,P<0.05)。同时增强了脂肪细胞标记物脂肪酸结合蛋白表达(DF:脂肪细胞型脂肪酸结合蛋白(aP2):t=97.735,P<0.05),见表3、图3。
3 讨论
肌腱前体细胞具有干细胞的性质。可分化为多种间叶组织细胞,如骨骼,脂肪,软骨另外还有肌腱[3-5]。肌腱病变在组织学上表现出肌腱细胞总数显著下降,“非肌腱细胞”堆积,包括肌成纤维细胞,脂肪细胞,软骨细胞还有成骨细胞[6]。因此,从生物学角度来说,肌腱病变可能归咎于肌腱干细胞再生活动“失去控制”,肌腱细胞分化受损而向其它间叶组织分化,肌腱损伤是最常见的运动损伤之一,包括因关节长期的运动、摩擦或劳损引起炎症后肌腱末端局部组织变性,及急性运动创伤造成的肌腱断裂缺损,是运动医学中公认的治疗难题。随着人们体育活动增多,学习、工作和生活方式的改变(电脑、手机的普及等),肌腱损伤日益增多。每亿人口中一年至少有上千万的肌腱损伤病例。同时,肌腱损伤也对许多优秀运动员的职业生涯产生巨大威胁,如我国著名跨栏运动员刘翔,英国足球运动员皆因肌腱受损而暂别赛场。目前,临床上对肌腱损伤的治疗的主要方法是理疗、手术缝合等,虽有一定效果,但是疗效有限,修复后肌腱的质量远不如正常肌腱,易出现肌腱粘连,肌腱结构和力学性能低下,常重复断裂[3,4]。即使是自体肌腱移植修复也只能达到正常肌腱力学性能的左右,且伴随有大量疤痕组织增生。相对于其他组织和器官的疾病治疗而言,对肌腱损伤的临床治疗进展缓慢,主要原因是肌腱基本发育生物学知识的相对缺乏。因此,更好的认识肌腱发育和分化的生理学和分子信号网络,可为肌腱损伤的治疗提供新的方法和思路。成熟的肌腱是由致密的胶原纤维和参与调节胶原纤维结构的大量细胞外基质分子,如胶原,纤维间基质复合物,蛋白多糖等组成的[5]。这些细胞外基质对肌腱功能的维持有重要作用。从组成结构上讲,肌腱这种特殊的细胞外基质结构,加之内部血管和神经的缺乏,也在一定程度上造成了肌腱修复的困难。用 GDF-7 诱导成纤维样细胞 C3H10T1/2 分化为肌腱细胞。GDF-7属于转化生长因子 beta 超家族,它能诱导细胞肌腱样结构形成[6]。本研究发现,当间充质干细胞暴露于GDF-7时,两种肌腱相关蛋白腱调蛋白和Ⅰ型胶原蛋白a1表达显著增加,与当前的报道一致。
NSAIDs 也广泛的应用于减轻软组织损伤疾病引起的疼痛和炎症。它们通过增强COX活性,从而减少促炎症反应因子前列腺素合成来抑制组织炎症。常被运动员用于外伤性损伤和负荷行损伤的止痛[7]。DF属于NSAIDs,可快速而持久的止痛,且有良好的耐药性。本研究发现在DF高浓度情况下,出现显著的抑制细胞生长和诱导脂肪形成,但是在较低浓度(1、10 μL情况下没有观察到这种现象,这个发现与当前体外研究一致[8,9],有研究认为 DF 在浓度 6、7 μL时对肌腱细胞增殖和糖胺聚糖合成没有负面影响。由于他们是在口服或局部使用 DF 后,血清和软组织中DF 浓度很少超过10 μL,因此,有理由认为口服和局部使用DF,肌腱有害作用不太可能发生。然而,肌肉注射DF在术后止痛中很常见[10],且局部DF注射治疗手部腱鞘炎已有报道,在这些情况下腱内的DF浓度可以超过100 μL。因此,评估其安全性的过程中应该将这些对肌腱副作用计入其中[11,12]。在美国双氯芬酸被作为成人治疗轻度至中度疼痛使用,并作为单药或与阿片类镇痛药合用中度至重度疼痛的管理[13]。在两个多中心,成人急性中度至重度的Ⅲ期研究严重的术后疼痛,HPBCD双氯芬酸显著减轻疼痛强度和对急救药物的需求与安慰剂比较[14,15]。在这些研究中,耐受性双氯芬酸的轮廓大体相似,安慰剂组和不良事件大多为轻度至中度较严重[16]。便秘、输液部位疼痛、头晕是最常见的不良反应数值更频繁发生氯灭痛比安慰剂[17,18]。与安慰剂相比双氯芬酸治疗似乎并未增加心血管、肾或出血相关的不良事件[19]。因此,目前双氯芬酸可延伸用于管理的治疗方案成人中度至重度术后疼痛的研究[20,21]。
综上所述,本研究建立了一个相对简单可靠的体外实验模型,可用来研究肌腱多功能前体细胞成肌腱细胞分化[22]。研究结果显示,一些常规用于肌肉损伤对症治疗的药物如DF,在祖细胞水平对肌腱再生有比较大的抑制作用,因此慎重使用[23]。
[参考文献]
[1] Lee JY,Zhou Z,Sun HB,et al. BMP-12 treatment of adult mesenchymal stem cells in vitro augments tendon-like tissue formation and defect repair in vivo[J]. PLoS ONE,2011,6(3):e17531.
[2] Violini S,Ramelli P,Mariani P,et al. Horse bone marrow mesenchymal stem cells express embryo stem cell markers and show the ability for tenogenic differentiation by in vitro exposure to BMP-12[J]. BMC Cell Biol,2009,10(1):29-38.
[3] Bi Y,Ehirchiou D,Young MF,et al. Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J]. Nat Med,2007,13(10):1219-1227.
[4] Zhang J,Wang JH. Characterization of differential properties of rabbit tendon stem cells and tenocytes[J]. BMC Musculoskelet Disord,2010,11:10.
[5] Mos M,Koevoet WJ,Osch GJ,et al. Intrinsic differentiation potential of adolescent human tendon tissue:An in-vitro cell differentiation study[J]. BMC Musculoskelet Disord,2007,8(1):16.
[6] Khan KM,Cook JL,Astrom M,et al. Histopathology of common tendinopathies. Update and implications for clinical management[J]. Sports Med,1999,27(6):393-408.
[7] Ziltener JL,Leal S,Fournier PE. Non-steroidal anti-inflammatory drugs for athletes:An update[J]. Ann Phys Rehabil Med,2010,53(4):278-282.
[8] Miyatake S,Ichiyama H,Yasuda K,et al. Randomized clinical comparisons of diclofenac concentration in the soft tissues and blood plasma between topical and oral applications[J]. Br J Clin Pharmacol,2009,67(1):125-129.
[9] Marsolais D,Cote CH,Frenette J. Nonsteroidal anti-inflammatory drug reduces neutrophil and macrophage accumulation but does not improve tendon regeneration[J]. Lab Invest,2003,83(7):991-999.
[10] Mccormack PL,Scott LJ. Diclofenac sodium injection (Dyloject):In postoperative pain[J]. Drugs,2008,68(1):123-130.
[11] Novartis pharmaceuticals UK Ltd. Voltarol ampoules (diclofenac sodium): Summary of product characteristics. 2014. http:// www.medicines.org.uk/,2016-7-1.
[12] A Pfizer Company. Dyloject TM (diclofenac sodium) injection,for intravenous use. 2016. http://www.fda.gov/,2016-7-1.
[13] Bauer KA,Gerson W,Wright C IV,et al. Platelet function following administration of a novel formulation of intravenous diclofenac sodium versus active comparators:A randomized,single dose,crossover study in healthy male volunteers[J]. J Clin Anesth. 2010,22(7):510-518.
[14] Carr DB,Mcdonnell MT,Bouchard A,et al. Effects of injectable HPbCD-diclofenac on the human delayed rectifier potassium channel current in vitro and on proarrhythmic QTc in vivo[J]. Clin Ther,2013,35(5):646-658.
[15] Mermelstein F,Hamilton DA,Wright C,et al. Single-dose and multiple-dose pharmacokinetics and dose proportionality of intravenous and intramuscular HPbCD-diclofenacDylojec)compared with other diclofenac formulations[J]. Pharmacotherapy,2013;33(10):1012-1021.
[16] Gan TJ,Daniels SE,Singla N,et al. A novel injectable formulation of diclofenac compared with intravenous ketorolac or placebo for acute moderate-to-severe pain after abdominal or pelvic surgery:A multicenter,double-blind,randomized,multiple-dose study[J]. Anesth Analg,2012,115(5):1212-1220.
[17] Daniels S,Melson T,Hamilton DA,et al. Analgesic efficacy and safety of a novel injectable formulation of diclofenac compared with intravenous ketorolac and placebo after orthopedic surgery:a multicenter,randomized,double-blinded,multiple-dose trial[J]. Clin J Pain,2013,29(8):655-663.
[18] Chelly JE,Singla SK,Melson TI,et al. Safety of a novel parenteral formulation of diclofenac after major orthopedic or abdominal/pelvic surgery in a population including anticoagulated,elderly or renally insufficient patients:An open-label,multiday,repeated dose clinical trial[J]. Pain Med,2013,14(5):749-761.
[19] Gan TJ,Singla N,Daniels SE,et al. Cardiovascular safety of hydroxypropyl-beta-cyclodextrin-diclofenac in the management of acute postsurgical pain:A pooled analysis of 2 randomized,double-blind,placebo-and active comparator-controlled phase III clinical trials[J]. J Clin Anesth,2016,31:249-258.
[20] Daniels SE,Gan TJ,Hamilton DA,et al. A pooled analysis evaluating renal safety in placebo-and active comparator-controlled phase III trials of multiple-dose injectable HPbCD-diclofenac in subjects with acute postoperative pain[J]. Pain Med,2016,17(12):2378-2388.
[21] Tong JGNS. Clinical and laboratory hematologic findings in patients receiving repeated-dose injectable HPBCD-diclofenac for acute postoperative pain:Pooled analysis of two randomized controlled phase III clinical trials[J]. J Anesth Clin Res,2015,6(7):1-9.
[22] Chou R,Gordon DB,de Leon-Casasola OA ,et al. Management of postoperative pain: A clinical practice guideline from the American Pain Society,the American Society of Regional Anesthesia and Pain Medicine,and the American society of Anesthesiologists committee on regional anesthesia,executive committee,and administrative council[J]. J Pain,2016,17(2):131-157.
[23] National Pharmaceutical Council. Pain:Current understanding of assessment,management,and treatments. 2001. http://www. npcnow.org/,2016-7-1.
(收稿日期:2016-10-12)
