EGFR-TKIs治疗术后复发肺腺鳞癌患者的临床研究
2017-04-20韩轲范力文杨海棠赵珩
韩轲范力文杨海棠赵珩
EGFR-TKIs治疗术后复发肺腺鳞癌患者的临床研究
韩轲①②范力文①杨海棠①赵珩①
目的:分析表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)治疗术后肺腺鳞癌(adenosquamous carcinoma of the lung,ASC)患者的疗效。方法:回顾性分析2006年1月至2014年12月上海交通大学附属胸科医院诊治的ASC 205例,采用描述性分析及Kaplan-Meier法进行生存分析。结果:筛选出27例EGFR突变并接受TKIs治疗的ASC患者,其中15例患者存在19号外显子缺失突变,12例患者存在21号外显子点突变。临床疗效方面,9例患者部分缓解(partial response,PR),11例患者疾病稳定(stable disease,SD),疾病控制率(disease control rate,DCR)为74.1%。生存分析结果显示,术后中位生存时间为39.0个月(95%CI:25.6~52.4),中位无进展生存时间为15.0个月(95%CI:12.9~17.1),3、5年生存率分别为51.9%、15.3%。结论:具有EGFR敏感突变的ASC患者能够从TKIs治疗中获益,推荐对ASC患者进行常规EGFR基因突变检测,实现个体化、多学科治疗以改善患者预后。
肺腺鳞癌 表皮生长因子受体酪氨酸激酶抑制剂 靶向治疗 生存分析 突变
肺腺鳞癌(adenosquamous carcinoma of the lung,ASC)是非小细胞肺癌(non-small cell lung cancer,NSCLC)中十分罕见的亚型,占整个肺癌的0.4%~4.0%[1-3],其主要特点是组织学具有混合特性。据2015年世界卫生组织(WHO)肺部肿瘤分类,ASC的定义为一种具有鳞癌成分与腺癌成分均≥10%的肿瘤[4]。此外,ASC侵袭性较强,预后差于腺癌或鳞癌[2,3,5],这类生物学行为上的差异也反映了ASC是一种不同于腺癌和鳞癌的组织学亚型[1,6]。由于对ASC分子生物学特性缺乏足够的认识,目前尚无标准的治疗方案。据报道,ASC中经常检测出表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变[7-8]。由于ASC的发病率较低,ASC的靶向治疗研究没有取得实际成果,研究EGFR靶向药物的前瞻性临床试验较少有开展。Iwanaga等[9]报道1例具有EGFR敏感突变的日本ASC患者,在术后接受吉非替尼作为二线治疗后取得3年无进展生存。Song等[10]研究显示,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibi⁃tors,EGFR-TKIs)治疗具有EGFR突变阳性的ASC患者是有效的。但靶向治疗对于ASC是否有效现在尚无统一结论,是否应对患者进行EGFR基因检测也存在争议。本研究就TKIs对EGFR突变的ASC患者治疗疗效进行分析评估。
1 材料与方法
1.1 临床资料
回顾性分析2006年1月至2014年12月上海交通大学附属胸科医院诊治的205例ASC患者。基本资料包括性别、年龄、吸烟史、功能状态评分等,所有资料采集于电子病历系统。肿瘤分期采用第7版NSCLC TNM分期[11]。入组标准为:1)所有患者均由术后病理学诊断为原发性ASC;2)所有的患者均检测出EGFR基因突变;3)所有患者均接受TKIs治疗;4)疾病复发通过影像学检查诊断,检查项目包括胸部和腹部CT、头部核磁共振、全身骨显像。本研究经过被研究对象或家属知情同意并获得医院伦理委员会的批准。
1.2 方法
1.2.1 病理学诊断与EGFR基因突变检测 ASC患者术后标本以10%福尔马林固定,常规石蜡包埋封存,石蜡标本由两位病理科医生独立进行阅片,免疫组织化学染色法用于组织中腺癌成分和鳞癌成分的鉴别。使用QIAamp石蜡组织DNA提取试剂盒提取五片5 μm石蜡切片中的DNA。使用突变扩增阻滞系统(ARMS)进行EGFR分子检测分析。
1.2.2 临床疗效评价 临床疗效及肿瘤反应采用体检、常规实验室检查、影像学检查进行评定,每隔4~8周检查1次直到疾病进展(progressive disease,PD),评价标准采用1.1版实体瘤疗效评价标准(RECIST 1.1)。肿瘤疗效评价:完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(sta⁃ble disease,SD)及疾病进展(PD)。客观反应率(ob⁃jective response rate,ORR)包括CR与PR的患者,疾病控制率(disease control rate,DCR)包括CR、PR与SD的患者。无进展生存期(progression-free survival,PFS)定义为从使用TKIs治疗之日起至PD或最后随访日期。术后总生存期(overall survival,OS)定义为从手术之日起至死亡或最后随访日期。
1.2.3 随访 随访信息从常规临床复查记录与电话随访中得到,所有患者每隔4~8周进行常规体检、实验室检查及影像学检查。主要观察终点是OS和PFS。中位随访时间为39.6(7~68)个月,最后随访日期为2016年7月31日,有3例患者失访。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。数值变量采用中位数与范围来描述,分类变量采用平均数与百分数来描述。分类变量比较采用χ2检验,应用Ka⁃plan-Meier法绘制生存曲线。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者特征
本研究共入组27例具有EGFR敏感突变的ASC患者,其中15例(55.6%)患者具有19号外显子缺失突变,12例(44.4%)患者具有21号外显子点突变(L858R);患者中位年龄为54.0(34~72)岁;15例患者年龄≤54岁;15例患者采用WHO体力状况评为1分;11例男性患者评为2分。7例患者有吸烟史;24例(88.9%)患者接受根治性切除(楔形切除3例,肺叶切除13例,双肺叶切除4例,全肺切除4例);3例患者行姑息性手术(袖型切除2例,肺叶切除+楔形切除1例)。19例(70.4%)病理分期为ⅢA期,其余患者为ⅠA期1例,ⅠB期1例,ⅡA期1例,ⅡB期1例,ⅢB期1例,Ⅳ期3例。ⅠB期及以上患者接受4~6个周期以铂类药物为主的术后辅助化疗,高危因素包括低分化肿瘤、侵犯血管、肿瘤直径>4 cm及侵犯脏层胸膜。所有患者均接受TKIs治疗,使用的药物包括吉非替尼、厄洛替尼或埃克替尼。8例(29.6%)患者接受TKIs作为一线治疗,19例(70.4%)患者接受TKIs作为二线治疗。一线治疗的患者在靶向治疗复发后接受以化疗为主的治疗,二线治疗的患者在使用靶向药物前接受辅助化疗。
将入组患者分成两组:靶向治疗复发组7例;靶向治疗后远处转移组20例。
2.2 疗效与生存分析
在27例接受TKIs治疗的ASC患者中,PR为9例,SD为11例,DCR为74.1%,ORR为33.3%,靶向治疗复发组与靶向治疗后远处转移组比较差异均无统计学意义(均P=0.535)。在随访期间,21例患者死亡。
总体mPFS为12.0个月(95%CI:9.1~14.9),靶向治疗复发组好于靶向治疗后远处转移组患者[靶向治疗复发组vs.靶向治疗后远处转移组,17.0个月(95%CI:13.7~20.3)vs.10.0个月(95%CI:8.9~11.1);P=0.037],差异均有统计学意义。中位术后OS为39.0个月(95%CI:25.6~52.4),靶向治疗复发组与靶向治疗后远处转移组差异无统计学意义(P= 0.191)。3年OS为51.9%,靶向治疗复发组明显好于靶向治疗后远处转移组(靶向治疗复发组vs.靶向治疗后远处转移组,85.7%vs.40.0%;P=0.037);5年OS为15.3%,靶向治疗复发组与靶向治疗后远处转移组差异无统计学意义(P=0.064,图1,2)。
19号和21号外显子突变组mPFS均为12个月,两组差异无统计学意义(P=0.845);同样,19号和21号外显子突变组中位OS分别为39个月和31个月,两组差异均无统计学意义(均P=0.490)。
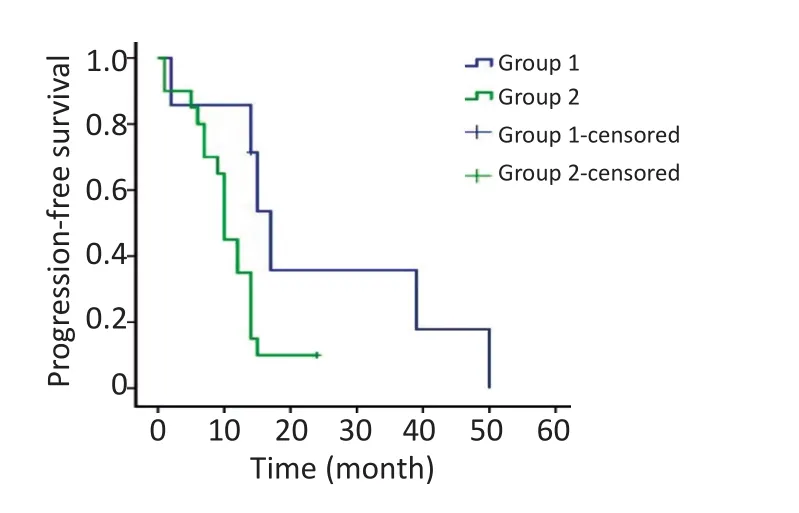
图1 靶向治疗后局部复发组与远处转移组PFS的比较Figure 1 Progression-free survival of patients with local recurrence compared to those with metastasis
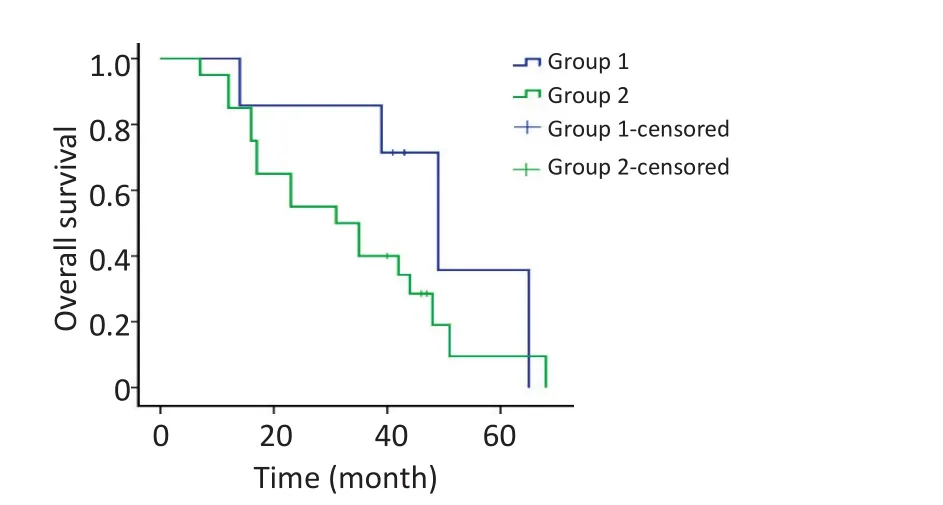
图2 靶向治疗后局部复发组与远处转移组OS的比较Figure 2 Overall survival of patients with local recurrence compared to those with metastasis
3 讨论
ASC是肺癌中不常见的组织学类型,仅占NSCLC的2.1%~3.4%[3,5]。5年OS约为20%,低于腺癌或鳞癌的40%[2,5]。目前,针对ASC靶向治疗疗效的研究较少,大部分ASC研究是描述ASC临床特征及基因突变频率。因此,研究ASC组织学成分与靶向治疗疗效的关系是十分必要的。本研究总结具有EGFR突变的ASC患者靶向治疗结果。经查阅文献,此研究中具有EGFR突变并且接受TKIs靶向治疗的患者样本数量较之前的研究要多[9-11]。研究显示,EGFR突变阳性的ASC患者接受TKIs治疗结果令人满意,对患者进行EGFR基因检测十分必要。EGFR突变检测可以筛选出对TKIs敏感的患者亚群,提高患者预后。
有研究提示,ASC患者中EGFR基因突变频率与腺癌患者相似,约为13%~44%[7,12-13],高于鳞癌,后者突变频率不足4%[14-15]。值得注意的是,在ASC中腺癌成分和鳞癌成分中观察到相同的EGFR基因突变。Jia等[7]研究报道国内ASC患者EGFR突变频率为38.2%(n=55),并与肿瘤直径≥3 cm相关。Wang等[12]报道了类似结论,中国ASC患者EGFR突变频率为31.6%(n=76),常见于不吸烟者和肿瘤直径≥3 cm者。Kang等[8]研究发现韩国ASC患者EGFR突变频率为44%。此外,Shi等[16]及Toyooka等[17]发现,EGFR突变与女性、不吸烟者相关。以上研究反映了ASC与腺癌具有相似的临床病理学特征。
目前,大量研究证实TKIs对具有EGFR敏感突变的晚期NSCLC患者疗效显著。与此相反,由于ASC发病率较低,针对ASC靶向治疗疗效的研究却十分有限。在此研究中,ASC患者对TKIs反应良好,能从中获益。
回顾以往文献与本研究相比,仅行手术未接受靶向治疗的ASC患者预后相对较差。Filosso等[6]研究显示3、5年OS分别为25%、15%,具有远处转移或局部复发患者的中位生存期为8个月,本研究3、5年OS分别为51.9%、15.3%,远处转移或局部复发患者的中位生存期为39个月。Wang等[12]报道ASC患者2年OS为51.3%,本研究结果是63.0%。另外,部分学者研究ASC患者接受靶向治疗的结果,Song等[10]开展的回顾性研究显示接受TKIs的ASC患者中,EGFR突变组PFS显著优于野生型组(8.7个月vs.2.1个月),其总体mPFS和中位OS分别为4.3个月和17.6个月。本研究结果优于上述研究,可能是由于入组患者均具有EGFR敏感突变。Iwanaga等[9]的病例报道表达了类似观点,1例ⅢB期EGFR突变阳性的日本ASC患者,在行手术与4个周期辅助化疗后出现复发,继而接受吉非替尼作为二线治疗,CR为3年,EG⁃FR敏感突变ASC患者能从TKIs治疗中获益。
ASC与腺癌有着相似的临床病理学特征,因此有必要进一步探讨二者靶向治疗之间的联系。据研究报道,接受吉非替尼或厄洛替尼作为二线或三线治疗的NSCLC患者PFS与OS分别为1.4~3.6个月和5.3~14.8个月[18-20]。接受TKIs作为一线治疗的晚期EGFR突变阳性NSCLC患者PFS、OS分别为8.0~13.7个月和19.3~36.0个月[21-26]。这些研究中的样本大部分由腺癌患者组成。上述报道的mPFS与本研究接近,但中位OS低于本研究的39个月。这可能是由于此研究入组患者TNM分期相对较早(大部分为ⅢA期),并且全部行手术切除;而上述临床试验入组患者为晚期患者(ⅢB期及Ⅳ期),未行手术治疗。因此,ASC患者能够从TKIs治疗中获益,提示应根据EGFR基因突变状态将ASC划分为不同病理学亚型。
综上所述,EGFR突变ASC患者确实对TKIs治疗反应较好,但究竟是腺癌成分在发挥作用,还是鳞癌成分,或是两种成分共同在发挥作用尚不清楚。本研究ASC的临床和基因突变特征与腺癌相似(EGFR突变率和对TKIs有所反应),这类现象提示这两种成分可能有相同的发病机制。有研究指出[12-13,27-28],EG⁃FR突变同时出现在腺癌与鳞癌成分中,表明ASC是一种单克隆肿瘤,腺癌与鳞癌成分可能起源为相同的肿瘤干细胞,在分化过程中逐渐变为不同的组织学类型,可以说ASC是一种腺癌与鳞癌之间的过渡状态。
与其他有关TKIs治疗ASC疗效的研究报道相比,本研究具有一些优势[10,30]。本研究入组的患者均行手术治疗切除原发病灶,病理学诊断及EGFR基因检测所用标本均来自手术切除的肿瘤组织。这种研究方法提高了ASC诊断的精确性,仅仅依靠经支气管针吸活检或经胸壁肺穿刺活检取得的细胞学或组织学样本进行诊断是不充分的。Chen等[31]研究表明经支气管针吸活检术诊断肺癌的组织学类型的准确率仅为63.6%,诊断ASC的准确率只有25%。此外,本研究入组患者均为EGFR敏感突变患者,探究此类患者对TKIs的反应更有意义。
本研究的局限性主要为回顾性研究、样本量较小、缺少对照组。目前探究TKIs治疗ASC疗效的临床研究非常有限,所以亟待开展更多的大样本多中心随机临床试验来证实TKIs治疗ASC的有效性。
综上所述,具有EGFR敏感突变的ASC患者能够从TKIs治疗中获益,推荐对ASC患者进行常规EGFR基因突变检测,筛选出最佳反应群体,实现个体化、多学科诊治以改善患者预后。
[1] Cooke DT,Nguyen DV,Yang Y,et al.Survival comparison of adenosquamous,squamous cell,and adenocarcinoma of the lung after lobectomy[J].Anna surg,2010,90(3):943-948.
[2] Gawrychowski J,Brulinski K,Malinowski E,et al.Prognosis and survival after radical resection of primary adenosquamous lung carcinoma[J].Eur J cardiothoracic surg,2005,27(4):686-692.
[3] Nakagawa K,Yasumitu T,Fukuhara K,et al.Poor prognosis after lung resection for patients with adenosquamous carcinoma of the lung[J].Ann Thorac surg,2003,75(6):1740-1744.
[4] Travis WD,Brambilla E,Burke AP,et al.Introduction to The 2015 Word Health Organization Chassicotion of Tumors of the Lung,Pleura, Thymas,and Heart[J].J Thorat Onclo,2015,10(9):1240-1242.
[5] Shimizu J,Oda M,Hayashi Y,et al.A clinicopathologic study of resected cases of adenosquamous carcinoma of the lung[J].Chest, 1996,109(4):989-994.
[6] Filosso PL,Ruffini E,Asioli S,et al.Adenosquamous lung carcinomas:a histologic subtype with poor prognosis[J].Lung cancer, 2011,74(1):25-29.
[7] Jia XL,Chen G.EGFR and KRAS mutations in Chinese patients with adenosquamous carcinoma of the lung[J].Lung cancer,2011,74(3): 396-400.
[8] Kang SM,Kang HJ,Shin JH,et al.Identical epidermal growth factor receptor mutations in adenocarcinomatous and squamous cell carcinomatous components of adenosquamous carcinoma of the lung [J].Cancer,2007,109(3):581-587.
[9] Iwanaga K,Sueoka-Aragane N,Nakamura T,et al.The long-term survival of a patient with adenosquamous lung carcinoma harboring EGFR-activating mutations who was treated with gefitinib[J]. Int Medi,2012,51(19):2771-2774.
[10]SongZ,LinB,ShaoL,et al.Therapeuticefficacyof gefitinibanderlotinib in patients with advanced lung adenosquamous carcinoma[J].J Chin Medi Associ(JCMA),2013,76(9):481-485.
[11]Goldstraw P,Crowley J,Chansky K,et al.The IASLC lung cancer staging project:proposals for the revision of the TNM stage groupings in the forthcoming(seventh)edition of the TNM classification of malignant tumours[J].J T oncol,2007,2(8):706-714.
[12]Wang R,Pan Y,Li C,et al.Analysis of major known driver mutations and prognosis in resected adenosquamous lung carcinomas[J].J Thorac oncol,2014,9(6):760-768.
[13]Tochigi N,Dacic S,Nikiforova M,et al.Adenosquamous carcinoma of the lung:a microdissection study of KRAS and EGFR mutational and amplification status in a western patient population[J].Am J clin pathol,2011,135(5):783-789.
[14]Tao D,Han X,Zhang N,et al.Genetic alteration profiling of patients with resected squamous cell lung carcinomas[J].Oncotarget, 2016,7(24):36590-36601.
[15]Dearden S,Stevens J,Wu YL,et al.Mutation incidence and coincidence in non small-cell lung cancer:meta-analyses by ethnicity and histology(mutMap)[J].Ann oncol,2013,24(9):2371-2376.
[16]Shi X,Wu H,Lu J,et al.Screening for major driver oncogene alterations in adenosquamous lung carcinoma using PCR coupled with next-generation and Sanger sequencing methods[J].Sci Rep, 2016,6:22297.
[17]Toyooka S,Yatabe Y,Tokumo M,et al.Mutations of epidermal growth factor receptor and K-ras genes in adenosquamous carcinoma of the lung[J].Int J cancer,2006,118(6):1588-1590.
[18]Ciuleanu T,Stelmakh L,Cicenas S,et al.Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced,non-small-cell lung cancer with poor prognosis(TITAN):a randomised multicentre,open-label,phase 3 study[J].Lancet Oncol,2012,13(3):300-308.
[19]Maruyama R,Nishiwaki Y,Tamura T,et al.PhaseⅢstudy,V-15-32,of gefitinib versus docetaxel in previously treated Japanese patients with non-small-cell lung cancer[J].J Clin Oncol,2008,26(26):4244-4252.
[20]Kim ES,Hirsh V,Mok T,et al.Gefitinib versus docetaxel in previously treated non-small-cell lung cancer(INTEREST):a randomised phaseⅢtrial[J].Lancet,2008,372(9652):1809-1818.
[21]Zhou C,Wu YL,Chen G,et al.Final overall survival results from a randomised,phaseⅢstudy of erlotinib versus chemotherapy as firstline treatment of EGFR mutation-positive advanced non-small-cell lung cancer(Optimal,ctong-0802)[J].Ann Oncol,2015,26(9):1877-1883.
[22]Rosell R,Carcereny E,Gervais R,et al.Erlotinib versus standard chemotherapy as first-line treatment for european patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre,open-label,randomised phase 3 trial[J].Lancet Oncol,2012,13(3):239-246.
[23]Han JY,Park K,Kim SW,et al.First-signal:first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung[J].J Clin Oncol,2012,30(10):1122-1128.
[24]Maemondo M,Inoue A,Kobayashi K,et al.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J].N Engl Med, 2010,362(25):2380-2388.
[25]Mitsudomi T,Morita S,Yatabe Y,et al.Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG 3405): an open label,randomised phase 3 trial[J].Lancet Oncol,2010,11 (2):121-128.
[26]Soria JC,Felip E,Cobo M,et al.Afatinib versus erlotinib as secondline treatment of patients with advanced squamous cell carcinoma of the lung(LUX-Lung 8):an open-label randomised controlled phase 3 trial[J].Lancet Oncol,2015,16(8):897-907.
[27]Vassella E,Langsch S,Dettmer MS,et al.Molecular profiling of lung adenosquamous carcinoma:hybrid or genuine type[J]?Oncotarget,2015,6(27):23905-23916.
[28]Shiozawa T,Ishii G,Goto K,et al.Clinicopathological characteristics of EGFR mutated adenosquamous carcinoma of the lung[J].Pathol Int,2013,63(2):77-84.
[29]Burkart J,Shilo K,Zhao W,et al.Metastatic squamous cell carcinoma component from an adenosquamous carcinoma of the lung with identical epidermal growth factor receptor mutations[J].Case Rep Pulmonol,2015,2015:283875.
[30]Shukuya T,Takahashi T,Kaira R,et al.Efficacy of gefitinib for non-adenocarcinoma non-small-cell lung cancer patients harboring epidermal growth factor receptor mutations:a pooled analysis of published reports[J].Cancer Sci,2011,102(5):1032-1037.
[31]Chen J,Gao YD,Cao Y,et al.Surgical specimen histology revealed inadequacy of conventional transbronchial needle aspiration sample in the diagnosis of adenosquamous lung carcinoma[J].J Thorac Dis,2015, 7(4):680-686.
(2016-10-20收稿)
(2017-01-12修回)
(编辑:杨红欣 校对:孙喜佳)
Clinical outcomes of epidermal growth factor receptor tyrosine kinase inhibitors in recurrent adenosquamous carcinoma of the lung after resection
Ke HAN1,2,Liwen FAN1,Haitang YANG1,Heng ZHAO1
1Department of Thoracic Surgery,Shanghai Chest Hospital,Shanghai Jiao Tong University,Shanghai 200030,China;2Department of Thoracic Surgery,Shiyan People's Hospital,Shiyan 442000,China
Heng ZHAO;E-mail:h_zhao28@163.com
Objective:To investigate the efficacy of epidermal growth factor receptor tyrosine kinase inhibitors(EGFR-TKIs)in adenosquamous carcinoma(ASC)of the lung after resection.Methods:Clinical data of patients suffering from ASC and receiving EGFR-TKI treatment at one institution between January 2006 and December 2014 were retrospectively reviewed.Results:A total of 27 EGFR mutation-positive patients with ASC subjected to EGFR-TKI therapy were enrolled in this study.EGFR mutations included deletion in exon 19 in 15 cases and point mutation at codon 858 in exon 21 in 12 cases.Of the 27 ASC patients who received EGFR-TKI treatment,9 exhibited a partial response and 11 manifested a stable disease,and these patients accounted for a disease control rate of 74.1%(20/27). The median overall survival(OS),median progression-free survival,and median relapse OS of the EGFR mutation-positive patients who underwent TKI therapy were 39 months[95%confidence interval(CI)=25.6-52.4],15 months(95%CI=12.9-17.1),and 19 months(95% CI=0.9-37.1),respectively.The 3-and 5-year survival rates of these patients after operation were 51.9%and 15.3%,respectively.Conclusion:The survival of EGFR mutation-positive ASC patients treated with EGFR-TKIs was satisfactory.EGFR testing was recommended for ASCs and EGFR-TKI treatment was suitable for ASCs with EGFR-sensitizing mutation.
adenosquamous carcinoma of the lung,epidermal growth factor receptor tyrosine kinase inhibitors,targeted therapy,survival analysis,mutation

10.3969/j.issn.1000-8179.2017.06.214
①上海交通大学附属胸科医院胸外科(上海市200030);②湖北省十堰市人民医院胸外科
赵珩 h_zhao28@163.com
韩轲 专业方向为肺癌的诊断与治疗。
E-mail:158001558126@163.com
