草酸脱羧酶的修饰及其对草酸钙的吸附研究
2017-04-13蔡杏华林日辉贺俊斌武怡辰王心雨
蔡杏华,巫 佳,林日辉,贺俊斌,武怡辰,王心雨
(1.广西民族大学海洋与生物技术学院,广西高校微生物与植物资源利用重点实验室,广西南宁 530006;2.广西民族大学化学化工学院,广西高校化学与生物转化过程新技术重点实验室,广西南宁 530006;3.广西多糖材料与改性重点实验室培育基地,广西南宁 530006)
草酸脱羧酶的修饰及其对草酸钙的吸附研究
蔡杏华1,巫 佳1,林日辉2,3,*,贺俊斌1,武怡辰2,王心雨2
(1.广西民族大学海洋与生物技术学院,广西高校微生物与植物资源利用重点实验室,广西南宁 530006;2.广西民族大学化学化工学院,广西高校化学与生物转化过程新技术重点实验室,广西南宁 530006;3.广西多糖材料与改性重点实验室培育基地,广西南宁 530006)
为了提高草酸脱羧酶(OXDC)的适用性及其对草酸钙的吸附性能,本实验采用乙二胺四乙酸二酐(EDTAD)对草酸脱羧酶进行了化学修饰,通过高效液相色谱-质谱联用仪(UPLC-MS)测定其修饰位点,并研究和对比了酶在修饰前后对草酸钙的吸附差异,采用动力学和热力学吸附模型对吸附实验的结果进行拟合分析。实验结果表明,EDTAD成功修饰在草酸脱羧酶上,修饰位点位于肽N端的α-氨基上;且修饰酶(EDTAD-OXDC)对草酸钙的吸附作用,在酶初始浓度为5 mg/mL,pH为7.0,温度为37 ℃的条件下,比原酶(OXDC)提高了53.37%。结论:经EDTAD修饰后的草酸脱羧酶,其稳定性和吸附性能均有所提高。
草酸脱羧酶,乙二胺四乙酸二酐(EDTAD),修饰,草酸钙结石,吸附
泌尿系统结石类疾病已成为当今社会重要的健康问题之一,且患病率和复发率不断地上升[1]。研究表明,13%的男性和7%的女性均有泌尿系统结石病的经历[2],且高达70%的患者治愈后有复发情况[3]。泌尿系统结石的成分约80%为草酸钙结石[3-5],草酸钙的化学存在形式有一水草酸钙(COM),二水草酸钙和三水草酸钙,其中一水草酸钙具有更为稳定的热力学形式[6]。草酸钙结石的形成与高尿钠、高尿钙等密切相关[3],此外,糖尿病、高血压等也与草酸钙结石的形成有关[7-9]。
采用化学、物理和天然的方法预防和治疗草酸钙结石的效果并不尽人意[4],因为人体内缺乏草酸代谢的酶类或相关代谢途径,草酸代谢酶主要有草酸脱羧酶(EC,4.1.1.2 OXDC)、草酸氧化酶(OXO,EC 1.2.3.4)和草酰乙酰辅酶A脱羧酶(EC 4.1.1.8)三种[10]。Thalji等[11]发现,向草酸钙饱和溶液中添加200 mg的草酸脱羧酶可使草酸钙的溶解度增加约15倍。Grujic等[12]给小鼠喂食草酸脱羧酶交联晶体,可使小鼠尿液和粪便中的草酸浓度分别减少44%、72%,由此表明,草酸脱羧酶可治疗高尿酸症和结石病。而实际应用中,酶制剂的浓度在泌尿系统的流动状态下会被迅速稀释,因此需寻求有效的方法或某种物质对草酸脱羧酶进行修饰改性,提高其对草酸钙的吸附性能。
贺俊斌等[13]发现,EDTA可有效地吸附在一水草酸钙上,而EDTA并无可与草酸脱羧酶发生修饰反应的基团,因此本实验采用EDTAD对OXDC进行修饰改性,并通过高效液相色谱-质谱联用仪(UPLC-MS)对修饰结果进行测定分析,同时对比了酶修饰前后对草酸钙的吸附差异,为草酸脱羧酶的改性和应用提供进一步的理论依据。
1 材料与方法
1.1 材料与仪器
草酸脱羧酶 基因工程菌E.coliBL21(DE3)/pET32a/YvrK,保存于本实验室;甲酸脱氢酶(FDH)和胰蛋白酶(测序级) 美国Sigma公司;乙腈(色谱级) 美国Fisher Scientific公司;乙二胺四乙酸二酐(EDTAD) 天津希恩思生化科技有限公司;草酸钾,甲酸钠(色谱级),2,4,6-三硝基苯磺酸(TNBS),聚乙二醇(PEG 20000) 北京索莱宝科技有限公司;β-NAD 上海楷洋生物技术有限公司。
CR-22G高速冷冻离心机 日本日立公司;液质联用串联四极杆飞行时间质谱仪 美国Waters公司;1-13高速台式离心机 美国Sigma公司;紫外可见分光光度计(TU-1901) 北京普析通用仪器有限公司;恒温培养箱 武汉瑞华仪器设备有限公司。
1.2 实验方法
1.2.1 草酸脱羧酶的修饰 由实验优化出的最佳修饰条件,按照物质的量比为nOXDC∶nEDTAD=1∶62,分别将原酶酶液和EDTAD加入到浓度为50 mmol/L,pH6.2的磷酸缓冲液(PBS)中,在30 ℃的恒温摇床中修饰反应8 h,修饰反应结束后,用透析袋(分子截留量为8000~12000)对修饰后的酶液在4 ℃下进行透析24 h,透析后的酶液用聚乙二醇(PEG,分子量为20000)对进一步浓缩,浓缩之后的酶液采用孔径为0.45 μm的微孔滤膜抽滤,所得酶液即为供实验的修饰酶。
1.2.2 修饰率的测定 修饰率的测定采用TNBS法[14]。TNBS与酶蛋白表面的游离氨基发生反应,生成三硝基苯衍生物,在420 nm有特征吸收峰。原酶在420 nm的光吸收值记为A0,修饰酶的光吸收值记为A1,按下式计算修饰率:MR(%)=[1-(A1×C0)/(A0×C1)]×100。其中:C0、C1分别为修饰前原酶的浓度及修饰后经透析浓缩所得酶的浓度。在检测时,TNBS用双蒸水稀释至0.1%(w/v),以降低TNBS浓度过大对检测结果的影响。实验测得修饰酶的修饰率为75.25%±2%。
1.2.3 修饰位点的测定 酶解反应:分别取蛋白浓度均为2 mg/mL的原酶液和修饰酶液125 μL,各加50 mmol/L Tris-HCl缓冲液(pH8.5)1 mL,按50∶1(w/w)的比例(酶液/TPCK-胰蛋白酶溶液)加入TPCK-胰蛋白酶溶液,混匀,37 ℃水浴保温酶解12 h,取出,100 ℃水浴加热15 min终止反应,12000 r/min离心5 min,收集上清液,4 ℃备用,进样前用0.45 μm的针头过滤器去除不溶物。另一组以不加原酶液和修饰酶液作为酶解空白。
UPLC条件:实验使用Waters ACQUITY UPLC I-Class系统;色谱柱为Waters ACQUITY UPLC HSS T3(1.8 μm,2.1 mm×100 mm);柱温为35 ℃;进样体积为10 μL;以流速为0.3 mL/min,时间为0~40 min进行梯度洗脱(流动相A:0.1%(v/v)甲酸/水;流动相B:0.1%(v/v)甲酸/乙腈)。MS条件:联用的质谱仪为Waters XEVO G2-S QTOF;ESI+电离模式,毛细管电压为2.7 kV,锥孔电压为40 V,离子源温度为100 ℃,脱溶剂气温度为350 ℃,锥孔反吹气流量为20 L/Hr,脱溶剂气流量为800 L/Hr,碰撞能为6 V,检测器电压为2575 V,扫描范围为100~7000 m/z。
1.2.4 酶修饰前后的最适pH比较 在50 mmol/L pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5的不同柠檬酸盐缓冲体系中分别测定相同酶浓度的OXDC和EDTAD-OXDC的酶活力,以同组实验中酶活力最高数据为100%酶活力,取平均值计算相对酶活。
1.3 吸附实验
1.3.1 实验设计 草酸钙饱和溶液的制备,添加5 g一水草酸钙晶体于500 mL锥形瓶内,加入250 mL蒸馏水,37 ℃条件下摇床反应1 d,反应结束后将未溶解的一水草酸钙晶体通过0.45 μm的微孔滤膜过滤,所得溶液则为草酸钙饱和液。
实验过程中为了消除酶活性对吸附过程的影响,草酸脱羧酶和修饰酶在100 ℃的条件下经水浴灭活10 min。酶活的测定参考Svedruzic D等[15]的方法,其测定原理为:草酸钾溶液在草酸脱羧酶的作用下生成甲酸,甲酸在甲酸脱氢酶条件下脱氢,脱下的氢与添加的β-NAD反应生成DANH,NADH在340 nm光区下有特征吸收峰,通过测定其单位时间内的吸光值变化以确定酶是否灭活彻底。
吸附体系设为2 mL,其中含草酸钙饱和溶液、草酸脱羧酶或修饰酶,0.1 g一水草酸钙晶体。反应时间设为4 h,酶初始浓度的变化范围为0.5~5.0 mg/mL,溶液的pH变化范围在4.5~7.5之间(通过0.1 mol/L的盐酸和0.1 mol/L的氢氧化钠调节pH),温度变化范围为25~40 ℃。反应后的溶液通过孔径为0.22 μm的针头过滤器过滤。吸附量(qe)的计算方法如下:
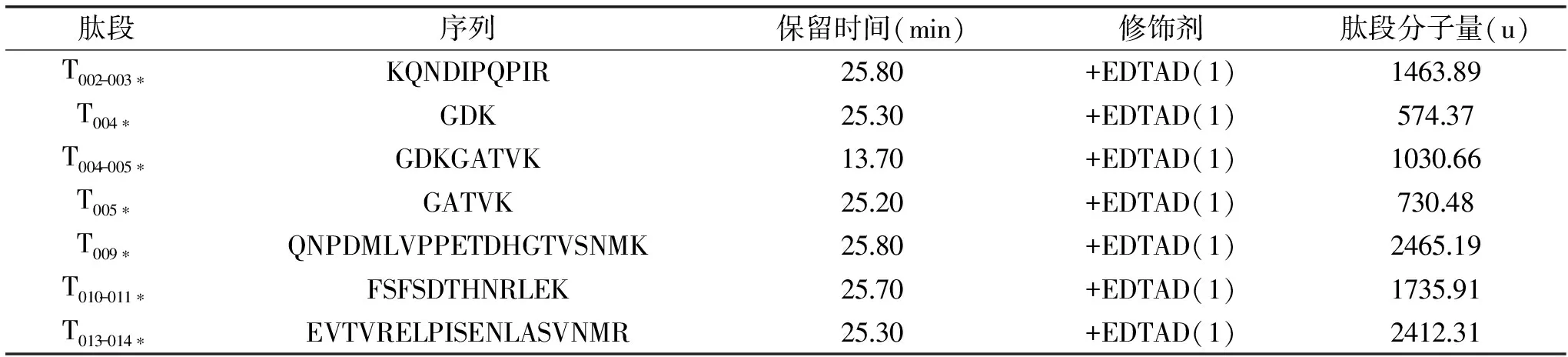
表1 UPLC-MS分析结果Table 1 UPLC-MS analysis results
注:*为被EDTAD修饰的肽段。qe=V(C0-Ce)/S
式(1)
式中:C0- 酶的初始浓度(mg/mL);Ce-平衡时酶的浓度(mg/mL);V- 吸附体系的体积(mL);S(m2/g)-草酸钙晶体的比表面积(参照何俊斌等[13]研究,S值为2.65 m2/g)。
1.3.2 分析测量 采用考马斯蓝染色法(又称Bradford法)对酶的浓度进行测定,考马斯亮蓝G-250与酶蛋白反应可生成在595 nm下有特征紫外吸收的络合物,通过双光束紫外可见分光光度计(TU-1901)测量样品在595 nm下的吸光值,根据标准曲线:y=0.7259 x-0.0084(R2=0.9990)计算出酶的浓度。
1.3.3 吸附模型分析 在本实验中,采用动力学模型(包括一级动力学、二级动力学和粒子内扩散动力学模型)和热力学模型对实验数据进行拟合分析,所有参数和结果均通过origin(Pro9.0)软件进行拟合处理。
2 结果与讨论
2.1 修饰位点的测定结果
用TPCK处理过的胰蛋白酶对上述修饰酶进行酶解,其可专一性地水解酶中的赖氨酸(Lys)和精氨酸(Arg)的羧基端。酶解样品采用UPLC-MS联用技术分析,得到的总离子流图经waters公司的BiopharmaLynx软件分析对比,结果表明:EDTAD修饰草酸脱羧酶的位点位于肽N端的α-氨基上,测定结果如表1所示,这与Gregg等[16]采用EDTAD修饰瘦素蛋白(rhu-met-leptin)得到的结果类似。
2.2 酶修饰后最适pH的变化
由图1可知,原酶(OXDC)的最适pH为3.5,而修饰酶的最适pH为5.0。经EDTAD修饰后,酶的最适pH向碱性方向偏移了约1.5个单位。这与Sangeetha 等[17]采用不同酸酐(柠康酸酐、邻苯二甲酸酐、丁二酸酐)修饰木瓜蛋白酶得到的的结果相类似。

图1 OXDC和EDTAD-OXDC的最适pH比较Fig.1 Optimum pH of OXDC and EDTAD-OXDC
2.3 反应时间对吸附过程的影响
如图2所示,草酸脱羧酶和修饰酶对草酸钙的吸附过程表现出了相同的吸附趋势,修饰酶在吸附平衡后的吸附量比原酶约提高了4.6% 。以修饰酶的吸附曲线为例,在反应达到4 h前,吸附量呈现快速上升的趋势,4 h之后吸附量则呈现缓慢增加的趋势,并且在8 h左右逐渐达到吸附平衡状态,这可能是由于草酸钙晶体能与酶结合的表面位点已逐渐达到饱和状态,剩余的部分结合位点由于酶分子间存在斥力而很难再占据草酸钙表面的结合位点[13]。修饰酶在平衡时的吸附量(11.0921 mg/m2)比在0.5 h(10.0221 mg/m2)的吸附量约提高了8.8%,而与4 h时的吸附量(10.9723 mg/m2)相比仅提高了1.2%,由于反应时间在4 h与12 h相比,其吸附量的提高很少,所以后续实验的反应时间均采用4 h。
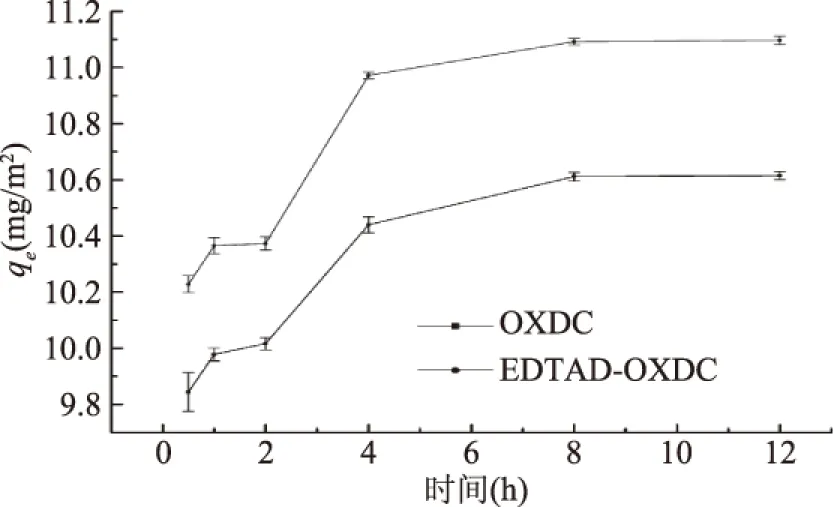
图2 反应时间对吸附过程的影响 Fig.2 Effect of reaction time on adsorption process 注:酶浓度为1.5 mg/mL;温度为37 ℃;pH为7.0。
2.4 吸附动力学
吸附动力学模型常被用于描述吸附过程中吸附质在吸附剂上的吸附速率。在本实验中,采用一级动力学,二级动力学和粒子内扩散动力学模型对实验数据进行拟合分析。
当一级动力学模型被用于预测吸附动力学时,其方程为[18]:
qt=qe(1-e-k2t)
式(2)
转化为线性形式可表示为:
ln(qe-qt)=lnqe-k1t
式(3)
式中:qe-平衡时的吸附量(mg/m2);qt-任意时间点的吸附量(mg/m2);k1-一级动力学反应的吸附速率常数;t-吸附过程的反应时间(h)。
以ln(qe-qt)为纵坐标,时间(t)为横坐标,实验结果由origin软件拟合分析,拟合结果如图3所示。
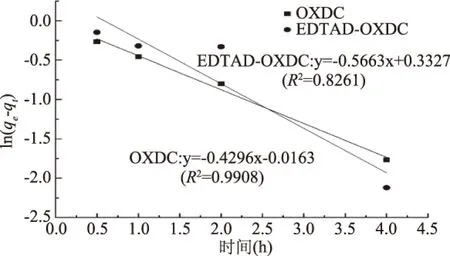
图3 一级动力学模型拟合结果 Fig.3 Pseudo-first-order kinetic fit for the adsorption
二级动力学模型,方程式为[19]:
式(4)
转化为线性形式时:
式(5)
以t/qt为纵坐标,时间(t)为横坐标,拟合结果如图4所示:

表2 草酸脱羧酶及其修饰酶的动力学参数 Table 2 Kinetic parameters of the OXDC and EDTAD-OXDC

表3 酶初始浓度对吸附过程的影响Table 3 Effect of initial enzyme concentration on the adsorption process
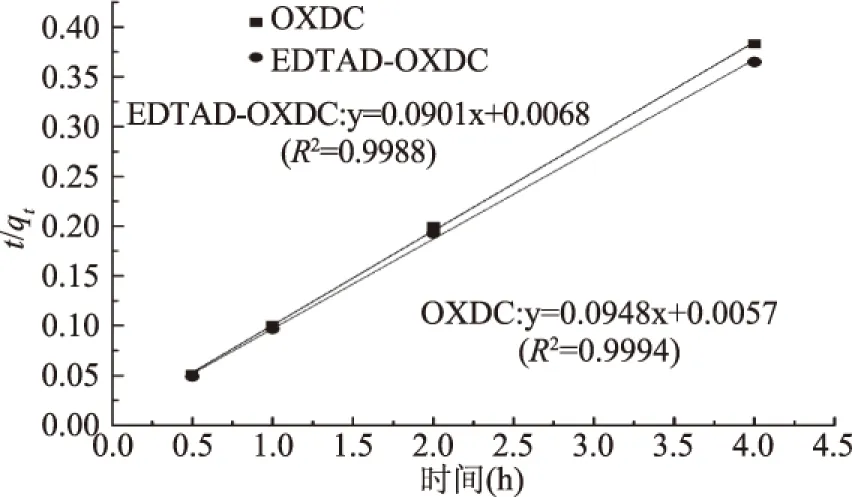
图4 二级动力学模型拟合结果 Fig.4 Pseudo-second-order kinetic fit for the adsorption
注:温度为37 ℃;pH为7.0,时间4 h。为了考察其动力学机制对吸附过程的影响,粒子内扩散模型同时用于对吸附过程的分析[20],其方程式可表示为:
qt=kidt0.5+Ci
式(6)
式中:kid-粒子内扩散速率常数;Ci-边界层厚度的相关系数;t-吸附过程中的反应时间(h)。
如果吸附过程只是发生粒子内的扩散,那么qt对t0.5的线性拟合曲线应该经过原点,否则,其他的作用机制和粒子内扩散都可能同时存在[21]。

图5 粒子内扩散模型的拟合结果 Fig.5 Intraparticle diffusion model fit for the adsorption
方程式(2)、式(3)、式(4)、式(5)、式(6)中所有的动力学参数分别由图3~图5中曲线的斜率和截距计算得出,各动力学参数的拟合值如表2所示。表2的拟合结果表明,由二级动力学模型拟合出原酶的R2值(0.9994)和修饰酶的R2值(0.9988)都大于0.99,且均大于一级动力学和粒子内扩散模型的R2值。此外,理论计算值qcal(10.4529,10.8868 mg/m2)和实验真实值qexp(10.4401,10.9723 mg/m2)也比较吻合,所以二级动力学模型更适用于描述草酸脱羧酶及其修饰酶对草酸钙的吸附过程。粒子内扩散模型的拟合结果显示其R2值(0.8962,0.8396)相关性较差,并且拟合曲线也没有经过零点,表明此模型不适合于分析此吸附过程。
2.5 不同的酶初始浓度对吸附过程的影响
如表3所示,随着酶初始酶浓度增加(0.5~5.0 mg/mL),两种酶对草酸钙的吸附量都呈现上升的趋势,然而修饰酶的增加趋势比原酶更明显,并且随着酶初始浓度的升高,修饰酶对草酸钙的吸附量和原酶相比差距逐渐增大,在酶初始浓度为5.0 mg/mL,温度为37 ℃,pH为7.0的条件下,修饰酶对草酸钙的吸附量比原酶提高了53.37%。
出现此类现象的原因可以归为三点。首先,随着溶液中酶浓度的增加,液体体积之间的传质推动力随之上升。其次,酶的扩散系数还与其浓度的增加正相关。最后,草酸钙表面的酶分子随着平衡时溶液中酶浓度的增加而增加[22-23]。
2.6 反应温度对吸附过程的影响
原酶和修饰酶对草酸钙的吸附趋势如图6所示。当温度逐渐上升时(25~40 ℃),原酶和修饰酶都呈现上升的趋势,并且修饰酶的吸附量高于原酶。由此表明此吸附过程是一个吸热的过程。

表4 原酶与修饰酶的热力学参数Table 4 Thermodynamic parameters of the OXDC and EDTAD-OXDC
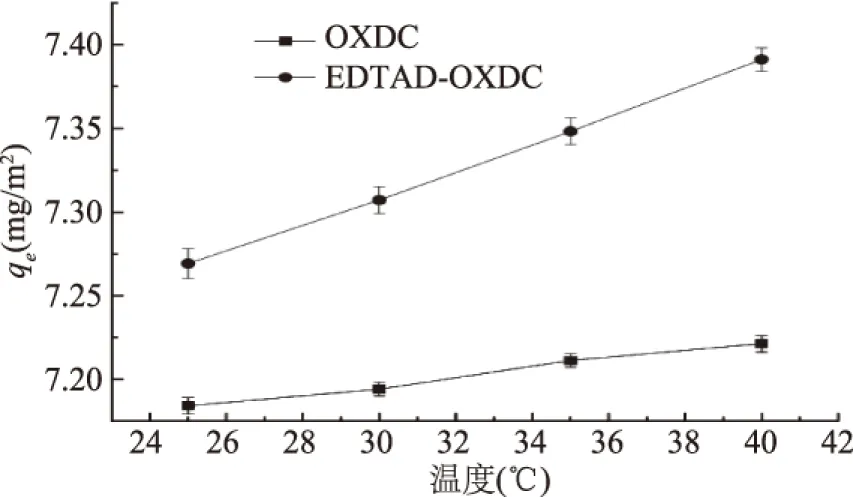
图6 反应温度对吸附过程的影响 Fig.6 Effect of temperature on the adsorption process注:浓度为1.0 mg/mL;pH为7.0;时间4 h。
2.7 吸附热力学模型
吸附热力学模型常被用于分析温度对吸附过程的影响,其方程式可表示为:
Kc=CAE/Ce=(C0-Ce)/Ce
式(7)
式中:Kc-吸附平衡常数;CAE-吸附平衡时酶的吸附量;C0-酶的初始浓度(mg/mL);Ce-平衡时酶的浓度(mg/mL)。
热力学参数:吉布斯自由能ΔG0(kJ/mol)、焓变ΔH0(kJ/mol)和熵变ΔS0(J/mol/K)等的计算如下:
ΔG0=-RTlnKc
式(8)
ΔG0=ΔH0-TΔS0
式(9)
式(10)
R是气体常数(8.314 J/mol/K);T为开尔文(K)温度;ΔH0和ΔS0的值通过图8(范托夫图)中的斜率和截距计算得出;ΔG0的值由式(8)计算得出。各热力学参数的拟合结果如表4所示。
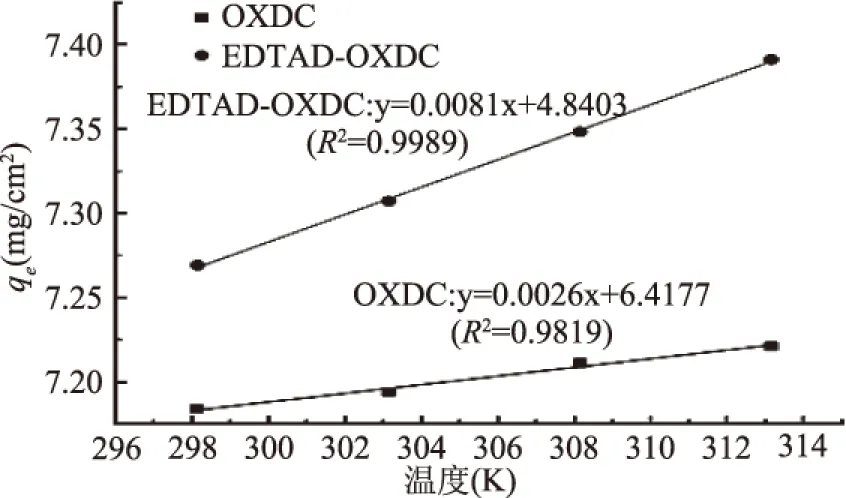
图7 温度影响的拟合结果 Fig.7 Fitting results of temperature effects

图8 范托夫图对吸附过程的拟合结果Fig.8 Fitting results of the Van’t Hoff plot for the adsorption
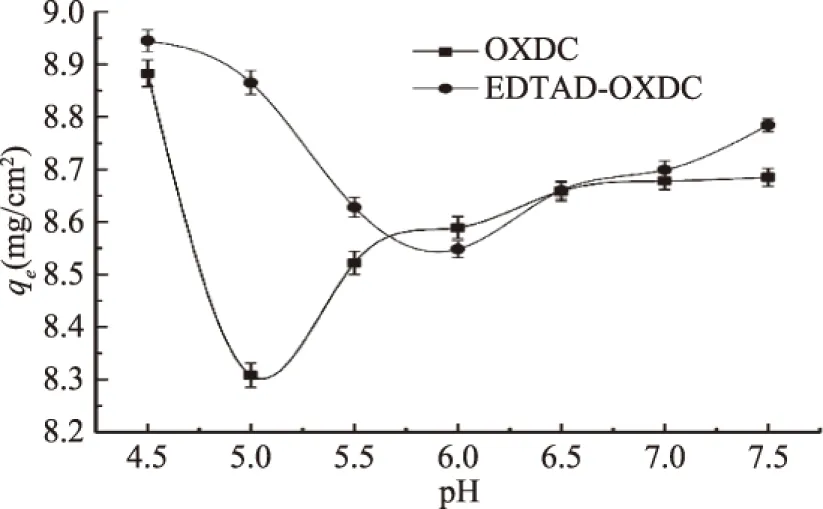
图9 反应的pH对吸附过程的影响 Fig.9 Effect of pH on the adsorption process注:体系为5 mL(便于pH的调节);浓度为0.5 mg/mL;温度为37 ℃;时间4 h。
表4的结果显示,ΔG0的值在四个温度下均为负值,这表明整个吸附过程是可自发进行的;ΔH0均为正值,表明此吸附过程是吸热过程,温度的升高有利于吸附的进行;ΔS0的值为正值则表明体系的复杂程度不断增加。
2.8 反应pH对吸附过程的影响
如图9所示,草酸脱羧酶和修饰酶表现出了相似的吸附趋势,随着溶液中的pH从4.5增加到7.5,两种酶的吸附量都呈现先下降再回升的趋势,当pH约为5.0时原酶的吸附量处于最低点,而当pH约为6.0时,修饰酶的吸附量则处于最低点;根据于俊杰等[24]的研究,草酸脱羧酶的等电点约为5.1,一水草酸钙的零电荷点约为2.92[25]。因此推测认为,当溶液的pH在等电点附近,草酸脱羧酶表面的静电荷接近于零,与非等电点相比其吸附性能下降。当溶液pH在3.0~5.0之间,草酸钙的表面带负电荷而草酸脱羧酶的表面带正电荷,与溶液的pH在5.0~7.5之间(两者都带负电)相比,其更有利于酶对草酸钙的吸附。对于修饰酶,其吸附量在pH接近6.0时处于最低点。之前的实验研究发现,草酸脱羧酶与EDTAD发生修饰反应后,其最适反应pH提高了1.5个单位,结合图9的实验结果,认为修饰酶的等电点同时也发生了变化,因此当溶液的pH在6.0附近时其吸附量处于最低点。
3 结论
乙二胺四乙酸二酐(EDTAD)成功地共价修饰在草酸脱羧酶上,修饰位点位于肽N端的α-氨基上。
在酶初始浓度为5.0 mg/mL,pH为7.0和温度为37 ℃的条件下,修饰酶对草酸钙的吸附量比原酶提高了53.37%。这表明修饰酶后的草酸脱羧酶吸附性能更强。
对比两种酶的吸附特征表明,随着酶初始浓度和温度的上升,两者对草酸钙的吸附量都呈现上升的趋势;随着溶液的pH在从4.5上升至7.5,两种酶的吸附量呈现出先下降后回升的趋势,当pH接近等电点时吸附量最低。
一级动力学、二级动力学和粒子内扩散动力学模型对实验的分析结果表明,二级动力学更适合于描述和分析整个吸附过程。热力学参数ΔG0、ΔH0和ΔS0的值表明,草酸脱羧酶对草酸钙的吸附是可行的、自发的和吸热的过程。
[1]Lotan Y. Economics and Cost of Care of Stone Disease[J]. Advances in Chronic Kidney Disease,2009,16(1):5-10.
[2]M. S. Pearle,S. Y. Nakada,J. C. C. Md and M. M. M. Facs,in Practical Controversies in Medical Management of Stone Disease,ed. M. S. Pearle and S. Y. Nakada,Springer,NewYork,2014:1-6.
[3]Finkielstein V A,Goldfarb D S. Strategies for preventing calcium oxalate stones[J]. CMAJ:Canadian Medical Association journal=journal de l’Association medicale canadienne,2006,174(10):1407-9.
[4]Pietrow P K,Karellas M E. Medical management of common urinary calculi[J]. American Family Physician,2006,74(1):86-94.
[5]Ivanovski O,Drüeke T B. A new era in the treatment of calcium oxalate stones[J]. Kidney International,2013,83(6):998-1000.
[6]Prien E L. Crystallographic analysis of urinary calculi:a 23-year survey study[J]. J Urol,1963,89(6):917-924.
[7]Hesse A. The role of overweight and obesity in calcium oxalate stone formation[J]. Obesity Research,2004,12(1):106-113.
[8]Vella M,Caramia M,Maltese M,et al. ESWL Prediction of Outcome and Failure Prevention[J]. Urologia Internationalis,2007,79(79 Suppl 1):47-50.
[9]Khan S R. Is oxidative stress,a link between nephrolithiasis and obesity,hypertension,diabetes,chronic kidney disease,metabolic syndrome[J]. Urological Research,2012,40(2):95-112.
[10]Mäkelä M R,Hildén K,Lundell T K. Oxalate decarboxylase:biotechnological update and prevalence of the enzyme in filamentous fungi[J]. Applied Microbiology & Biotechnology,2010,87(3):801-814.
[11]Thalji N K,Richards N G,Peck A B,et al. Enzymatic Dissolution of Calcium and Struvite Crystals:InVitroEvaluation of Biochemical Requirements[J]. Urology,2011,78(3):713-721.
[12]Grujic D,Salido E B,Langman C,et al. Hyperoxaluria is reduced and nephrocalcinosis prevented with an oxalate-degrading enzyme in mice with hyperoxaluria[J]. American Journal of Nephrology,2009,29(2):86-93.
[13]He J,Lin R,Li H,et al. Adsorption of EDTA onto calcium oxalate monohydrate[J]. Rsc Advances,2015,5(105):86795-86802.
[14]Habeeb A F S A. Determination of free amino groups in proteins by trinitrobenzenesulfonic acid[J]. Analytical Biochemistry,1966,14(3):328-336.
[15]Svedruzic D,Liu Y,Reinhardt L A,et al. Investigating the roles of putative active site residues in the oxalate decarboxylase from Bacillus subtilis[J]. Archives of biochemistry and biophysics,2007,464(1):36-47.
[16]Gegg C,Kinstler O. Chemical modification of proteins to improve biocompatibility and bioactivity:US,US 6204247 B1[P]. 2001.
[17]Sangeetha K,Abraham T E. Chemical modification of papain for use in alkaline medium[J]. Journal of Molecular Catalysis B:Enzymatic. 2006,38(3-6):171-177.
[18]Natrayasamy V,Meenakshi S. Effect of metal ion loaded in a resin towards fluoride retention[J]. Journal of Fluorine Chemistry,2008,129(7):645-653.
[19]Ho Y S,Mckay G. Pseudo-second order model for sorption processes[J]. Process Biochemistry,1999,34(5):451-465.
[20]Weber W J,Morris J C. Kinetics of Adsorption on Carbon From Solution[J]. Asce Sanitary Engineering Division Journal,1963,1(2):1-2.
[21]Yousef R I,El-Eswed B,Al-Muhtaseb A H. Adsorption characteristics of natural zeolites as solid adsorbents for phenol removal from aqueous solutions:Kinetics,mechanism,and thermodynamics studies[J]. Chemical Engineering Journal,2011,171(3):1143-1149.
[22]Zhu H S,Yang X J,Mao Y P,et al. Adsorption of EDTA on activated carbon from aqueous solutions[J]. Journal of Hazardous Materials,2011,185(2-3):951-957.
[23]Yang X,Long X,Yuan W. Adsorption characteristics of[Fe(III)-EDTA]-on granular activated carbon from aqueous solutions[J]. Environmental Progress & Sustainable Energy,2013,32(3):470-479.
[24]于俊杰,陈志谊,胡建坤,等. 枯草芽孢杆菌Bs-916草酸脱羧酶基因Bacisubin的克隆、原核表达及其表达产物的酶活性分析[J].江苏农业学报,2012,28(3):497-502.
Research on the adsorption of the modified oxalate decarboxylase on calcium oxalate
CAI Xing-hua1,WU Jia1,LIN Ri-hui2,3,*,HE JUN-bin1,WU Yi-chen2,WANG Xin-yu2
(1.Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources, College of Marine Sciences and Biotechnology,Guangxi University for Nationalities,Nanning 530006,China; 2.Key Laboratory of New Techniques for Chemical and Biological Conversion Process, School of Chemistry and Chemical Engineering,Guangxi University for Nationalities,Nanning 530006,China; 3.Guangxi Key Laboratory Cultivation Base for Polysaccharide Materials and their Modification,Guangxi University for Nationalities,Nanning 530006,China)
In order to improve the applicability and adsorption property of oxalate decarboxylase(OXDC)on calcium oxalate. EDTAD was used to modify the OXDC,modified site was determined by UPLC-MS,and the adsorption of the enzymes on calcium oxalate(CaOx)were studied and compared. The kinetics and thermodynamics adsorption models were used to fit and analysis the experimental data. Results showed that EDTAD was successfully grafted onto OXDC covalently as an absorption group,the modified sites were located in theα-NH2of the peptide N side,and the adsorption property of the modified enzyme(EDTAD-OXDC)on calcium oxalate was 53.37% higher than that of OXDC in initial enzyme concentration of 5 mg/mL,pH7.0,temperature of 37 ℃. Conclusion:which inclicated the stability and adsorption properties of DXDC was improved by grafting with EDTAD.
oxalate decarboxylase;EDTAD;modified;calcium oxalate stones;adsorption
2016-09-12
蔡杏华(1992-),男,硕士研究生,主要从事草酸脱羧酶的修饰改性研究,E-mail:m18007804069@163.com。
*通讯作者:林日辉(1972-),男,博士,研究员,主要从事蛋白质与酶工程方面研究,E-mail:rihuilin@aliyun.com。
国家教育部留学回国人员科研启动基金项目(教外司留[2012]1707号);广西自然科学基金项目(2014GXNSFAA118045);广西高等教育机构人才小高地创新团队计划(GJR201147)资助;广西科学研究与技术开发项目(桂科合14125008-1-2);2015年广西研究生教育创新计划资助研究生科研创新项目(YCSZ2015129)。
TS201.3
A
1002-0306(2017)07-0111-07
10.13386/j.issn1002-0306.2017.07.013
