胁迫因素对玻璃表面蜡样芽孢杆菌菌膜形成的影响分析
2017-04-13夏俊芳李晓燕张珍珍古丽娜孜木丽登张亚南
夏俊芳,刘 霞,李晓燕,张珍珍,古丽娜孜,马 瑶,木丽登,王 威,张亚南,武 运
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
胁迫因素对玻璃表面蜡样芽孢杆菌菌膜形成的影响分析
夏俊芳,刘 霞,李晓燕,张珍珍,古丽娜孜,马 瑶,木丽登,王 威,张亚南,武 运*
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
以食源性致病菌蜡样芽孢杆菌形成的菌膜为研究对象,模拟食品加工过程中温度胁迫、酸碱胁迫、营养胁迫、渗透胁迫、防腐剂胁迫等外源条件,采用超声波平板菌落计数玻璃表面菌膜形成量,结晶紫染色法观察菌膜在玻璃表面的生长形态。结果表明:温度胁迫下,低温4 ℃、高温50 ℃均能形成菌膜且随着温度升高菌膜形成量先升高后降低,温度30 ℃时菌膜形成量最大;酸碱胁迫下,pH小于或大于7.0时,菌膜的形成受到抑制,pH7.0时菌膜形成量最大;营养胁迫下,添加葡萄糖有利于菌膜形成,添加4%葡萄糖有明显的促进菌膜形成的效果;渗透胁迫下,低浓度的氯化钠对蜡样芽孢杆菌菌膜形成有促进作用,高浓度的氯化钠对菌膜形成有抑制作用,添加0.5%氯化钠有明显的促进菌膜形成的效果;防腐胁迫下,食品防腐剂浓度为0.15%高于浓度为0.10%时的菌膜形成量,在食品加工中不能仅凭加入食品防腐剂而疏忽对菌膜的控制。
蜡样芽孢杆菌,菌膜,玻璃表面,胁迫因素
食源性致病菌严重危害着人们的健康,全球每年因食源性疾病而发病的人数约10亿人,美国每年约有4800万人患病,12.8万人入院接受治疗[1],我国平均每6个人中就有1人次罹患食源性疾病[2]。蜡样芽孢杆菌(Bacilluscereus,简称B.cereus)是常见的食源性致病菌之一,广泛存在于土壤、空气、水和尘埃中[3]极易污染食物,污染后在感官无明显变化,很容易误食而发生中毒[4],引起恶心、呕吐、腹痛和腹泻等[5-6],同时B.cereus具有极强的菌膜形成能力,以及由此能力赋予的极强的抗逆生存和致病能力。据美国国家健康研究所和疾控中心报道,超过65%的由微生物引起的疾病与菌膜有关[7]。
菌膜是微生物在生长过程中为适应生存环境而形成的一种与浮游菌相对应的菌细胞群体,它附着于活力组织或无活力组织表面,由其产生的细胞外多聚基质包裹的菌体细胞构成[8]。在自然环境中B.cereus主要以生物菌膜的形式存在[9]即菌体被自身所分泌的胞外聚合物包裹聚集而形成生物群落。B.cereus在食品加工、包装、储存等过程中容易黏附于不锈钢、有机玻璃、聚氯乙烯及玻璃等非生物表面并形成生物菌膜[10]一旦形成生物菌膜,不仅会污染食品,增加设备清洗难度,还会给食品加工、贮运设备带来严重危害,引起食品安全问题[11-12]。
研究发现,大多数细菌形成生物菌膜一般经过粘附、聚集、成熟、分散等过程,环境因素如温度、pH、碳源、无机盐、培养时间等对其影响很大[13],食品加工环境营养丰富,存在高糖高酸高盐等多种胁迫因素,使食源性致病菌容易在各种加工及非加工接触面等处形成生物菌膜,增加食品受微生物污染机率成为威胁食品安全的重大隐患。因此本文以B.cereus为受试菌,模拟食品加工过程中温度胁迫、酸碱胁迫、营养胁迫、渗透胁迫、防腐剂胁迫等外源条件,采用超声波平板菌落计数和结晶紫染色法研究玻璃载体上该菌菌膜形成的变化趋势,为实际生产中有效控制B.cereus及其菌膜的形成奠定基础。
1 材料与方法
1.1 材料与仪器
蜡样芽孢杆菌(B.cereus)(CMCC63303) 由上海理工大学医疗器械与食品学院微生物实验室提供;营养琼脂培养基、LB肉汤培养基 购于北京陆桥生物技术有限公司。
山梨酸钾、苯甲酸钠、氯化钠、葡萄糖、硫酸、氢氧化钠等 均为分析纯,天津市盛淼精细化工有限公司;结晶紫 天津市科密欧化学试剂开发中心。
SK2200H超声波清洗器 上海科导超声仪器有限公司;FE20 PLUS pH计 上海梅特勒托利多仪器有限公司;LDZX-40SCI型高压灭菌锅 上海早安医疗器械厂;LHS-150SC恒温培养箱 上海森信实验仪器有限公司;FA2104N电子天平 上海民桥精密科学仪器有限公司仪器有限公司。
1.2 实验方法
1.2.1 菌悬液的制备 将B.cereus标准菌株用LB肉汤30 ℃培养18 h后取1 mL纯菌液,用无菌蒸馏水依次稀释10-1~10-7倍共7个浓度梯度(依次标记为1~7号)。取1~7号梯度菌液1 mL加入15 mL的融化并冷却到45 ℃左右无菌营养琼脂培养基,冷凝后于30 ℃恒温培养箱内培养24 h后进行平板计数(各梯度纯菌悬液分别设3个重复,并计算三个重复的计数平均值),1~7号梯度菌液计数结果分别为5.2×108~5.2×102CFU/mL,于4 ℃冰箱中贮存备用。
1.2.2 载体的清洗 将载体玻璃片(规格10 mm×10 mm)用洗涤剂清洗,置于丙酮中超声15 min,除去表面油脂,再用蒸馏水冲洗干净后置于75%的乙醇浸泡30 min,蒸馏水冲净,烘干后灭菌备用。然后放入装有10 mL LB肉汤的15 mm×150 mm试管中,灭菌备用。
1.2.3 菌膜的培养 灭菌培养皿中加入10 mL LB肉汤培养基中(灭菌)和放入已灭菌的玻璃片,接入0.1% 108CFU/mLB.cereus菌悬液,混合均匀,30 ℃培养,连续培养,隔天换液。
1.2.4B.cereus菌膜活菌计数 前处理及超声:去除培养24 h菌膜的培养液,用无菌磷酸缓冲溶液反复冲洗,洗去浮游菌,再取10 mL无菌磷酸缓冲液加入到试管中,并用超声波清洗仪(振荡频率为45 Hz)处理15 min。稀释及培养:从经过超声波清洗仪处理后的试管中吸取1 mL菌液,沿管壁慢慢注入含有9 mL无菌水的试管内,摇匀,梯度稀释后制成10-3、10-4、10-5稀释度的菌悬液,各取1 mL,分别加入培养皿内(每个稀释度做3个培养皿),再向培养皿中倾注约15 mL融化并冷却到45 ℃左右无菌营养琼脂培养基,冷凝后,于30 ℃恒温培养箱内培养24 h后取出,进行活菌计数。
总菌落数(cm2)=(同一稀释度3个平皿上的菌落平均数×稀释倍数×10)/玻璃片的面积
1.2.5 结晶紫染色法观察菌膜 从培养皿中取出培养一定时间的菌膜载体,经灭菌多次充分漂洗,去掉浮游菌,置于无菌培养皿中,加入3 mL甲醇固定15 min,在每个平皿中加入3 mL 2%结晶紫染色5 min后,自来水冲洗干净,室温下干燥30 min,再加入3 mL 33%冰醋酸脱色,晾干后光学显微镜下(100×10)观察。
1.2.6B.cereus菌膜生长曲线的绘制 将11个玻璃片分别放入装有10 mL LB肉汤培养基的试管中,灭菌后,冷却至室温,分别接入0.1% 108CFU/mL的B.cereus菌悬液,将试管放在30 ℃的培养箱中培养2、4、6、8、10、12、16、20、24、48、72 h后,对菌膜进行活菌计数。
1.2.7 不同胁迫因素对B.cereus菌膜形成的影响分析 玻璃片为载体材料,以B.cereus菌膜的活菌数lg(CFU/cm2)为指标,考察各胁迫因素(温度、pH、营养、高渗、防腐剂)对B.cereus菌膜形成的影响。
为提高未成年人的法律意识,积极贯彻落实《学校“七五”普法实施方案》,大力开展法律知识讲座。利用邀请法制副校长到校开展讲座、观看未成年人普法宣传片、举行法律知识竞赛等活动为载体,在未成年人中开展法制宣传和法律知识教育,使学生从小养成守法懂法的良好习惯。通过制作宣传版面、设计宣传橱窗、校园红领巾广播站设置法律法规宣传栏目等方式,积极宣传《宪法》《未成年人保护法》《教育法》《义务教育法》等法律法规,促使学生增强法律意识,提升依法保护自己的能力,提升运用法律法规的意识。
1.2.7.1 不同温度胁迫对B.cereus菌膜形成的影响 把玻璃片分别放入装有10 mL LB培养基的试管中,加入0.1 mL初始菌悬液浓度108CFU/mL的B.cereus菌悬液分别在4、25、30、50、60、70 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.7.2 不同酸碱胁迫对B.cereus菌膜形成的影响 把玻璃片分别放入pH为3、5、7、9、11的10 mL LB培养基试管中灭菌,然后加入0.1 mL初始菌悬液浓度108CFU/mL的B.cereus菌悬液,在30 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.7.3 不同营养胁迫对B.cereus菌膜形成的影响 把玻璃片分别放入不同质量分数为0、2%、4%、6%、8%、10%葡萄糖的10 mL LB培养基试管中灭菌,然后加入0.1 mL初始菌悬液浓度108CFU/mL的B.cereus菌悬液,在30 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.7.4 不同渗透胁迫对B.cereus菌膜形成的影响 把玻璃片分别放入NaCl浓度分别为0、0.5%、4%、6%、8%、10%、12%的10 mL LB培养基试管中灭菌,然后加入0.1 mL初始菌悬液浓度108CFU/mL的B.cereus菌悬液,30 ℃下培养24 h,进行B.cereus菌膜活菌数的测定。
1.2.7.5 不同防腐胁迫对B.cereus菌膜形成的影响 把玻璃片分别放入不同质量分数为0、0.02%、0.05%、0.10%、0.15%的食品防腐剂(苯甲酸钠、山梨酸钾)的10 mL LB培养基试管中灭菌,然后加入0.1 mL初始菌悬液浓度108CFU/mL的B.cereus菌悬液,在30 ℃条件下培养24 h,进行B.cereus菌膜活菌数的测定。
1.3 数据处理
应用EXCEL软件对数据进行统计分析,所有数据均为3次平行实验的平均值。
2 结果与讨论
2.1B.cereus菌膜生长曲线
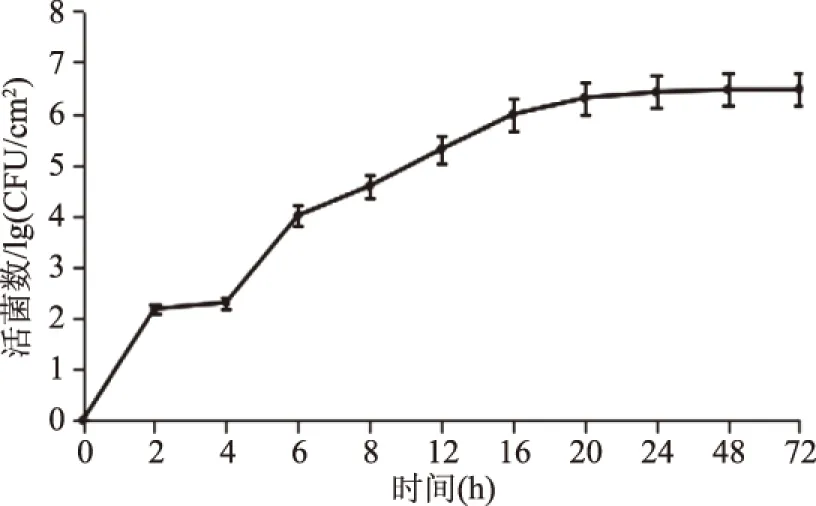
图1 B.cereus菌膜形成数随时间的变化Fig.1 Changes of the formation of B. cereus biofilms over time
2.2 不同胁迫因素对B.cereus菌膜形成的影响分析
2.2.1 不同温度胁迫对B.cereus菌膜形成的影响 由图2可知,培养温度在4~30 ℃时,B.cereus菌膜的活菌数随温度的升高而升高,4 ℃菌膜的活菌数为4.30(lg(CFU/cm2),30 ℃菌膜的活菌数达到6.58(lg(CFU/cm2),但超过30 ℃时,随温度的增加菌膜的活菌数反而有所减少,50 ℃菌膜的活菌数为4.36(lg(CFU/cm2),60、70 ℃菌膜活菌数为0(lg(CFU/cm2)。图3表示在玻璃载体上培养24 h且经过结晶紫染色后用显微镜观察B.cereus菌膜照片,其中,图3a,即空白玻璃片观察到的图片,无紫色菌体;图3b,4 ℃培养可见菌体相连呈清晰的紫色网状结构;图3c,25 ℃培养,菌体密度明显增大;图3d,30 ℃培养大量菌体相连呈紫色网状结构且菌体数目明显大幅增加,局部菌体大量密集呈团状;图3e,50 ℃菌体零星散落但仍可看见有部分网状结构;图3f,60 ℃菌体严重变形,死亡菌体粗壮无网状结构;图3g,70 ℃菌体零星散落,无网状结构。
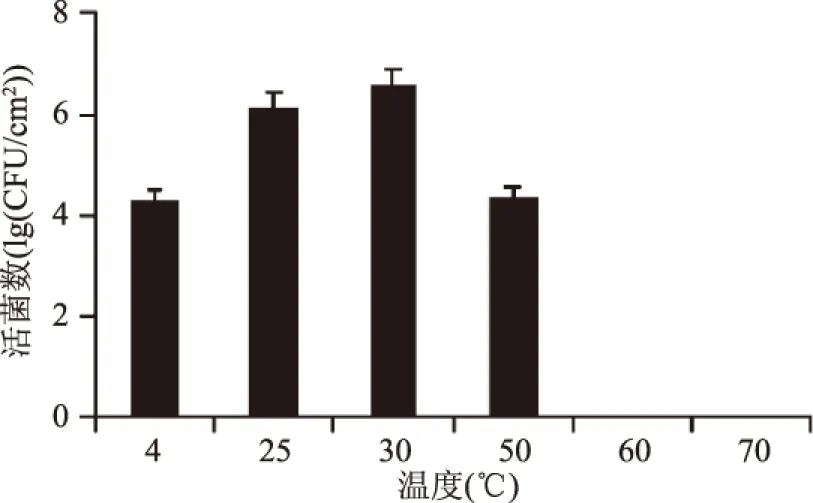
图2 不同培养温度对B.cereus形成数的影响Fig.2 Effect of temperature on the formation of B. cereus biofilms
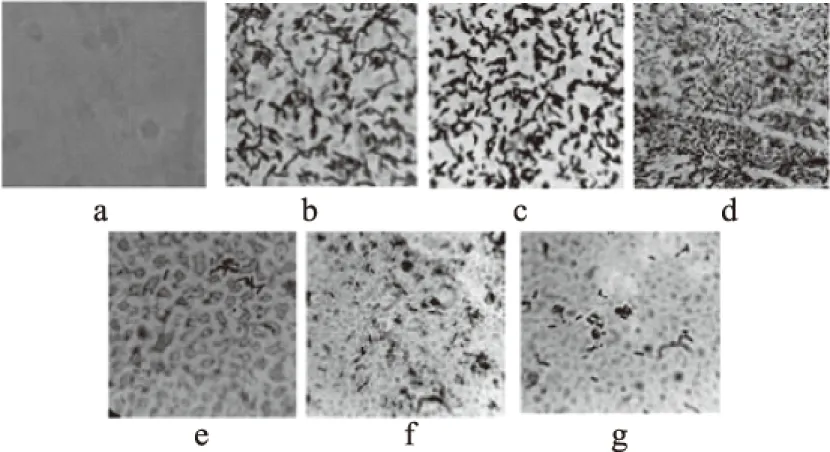
图3 结晶紫染色法观察不同培养温度对B.cereus菌膜形成数的影响Fig.3 Effect of temperature on the formation of B. cereus biofilms by crystal violet staining注:a空白玻璃片;b~g分别表示4、25、30、50、60、70 ℃ B. cereus菌膜在显微镜(100×10)观察图。
因此,温度过高或过低都会对菌膜形成数产生较大影响,30 ℃时B.cereus菌膜形成量最大,这与浮游态B.cereus的最适生长温度一致。同时,图1、图2表明不仅室温(25 ℃)条件下可以生成B.cereus菌膜,甚至低温(4 ℃),高温(50 ℃)都可形成,高温胁迫刺激会有利于蜡样芽孢杆菌菌膜形成,这一结果与Rode 等[15]报道的亚最适生长温度有利于金黄色葡萄球菌菌膜形成较一致,表明生产过程中及时清洁和有效除菌的必要性。
2.2.2 不同酸碱胁迫对B.cereus菌膜形成的影响 图4为不同 pH对B.cereus菌膜形成的影响,培养基pH在3~7时,菌膜形成数随 pH增加呈不断上升趋势,当pH在7~11 时,菌膜形成数明显下降,pH7时,菌膜形成数达到最大值为6.32(lg(CFU/cm2),说明偏酸或偏碱环境对B.cereus菌膜的形成会受到抑制;同时采用结晶紫染色观察pH对菌膜形成的影响,图5a,当pH3时,菌粘附与玻片,菌膜成团聚集呈粘液状相连,表面较强的酸度对菌体形状有显著影响;图5b,pH5时菌体散开,菌体相连呈较为清晰的紫色网状结构;图5c,pH7时,大量菌体相连呈紫色网状结构局部菌体大量密集呈团状;图5d,pH9时,菌体密集度大幅度减小,部分粘液相连菌体,网状结构较少;图5e,当pH11时,偶见散落的紫色菌体,无网状结构。与图4分析结果相吻合,pH7时B.cereus菌膜形成量最大,这与李南薇等[16]在不锈钢片表面的研究结果一致。

图4 不同pH对B.cereus菌膜形成数的影响Fig.4 Effect of pH on the formation of B.cereus biofilms
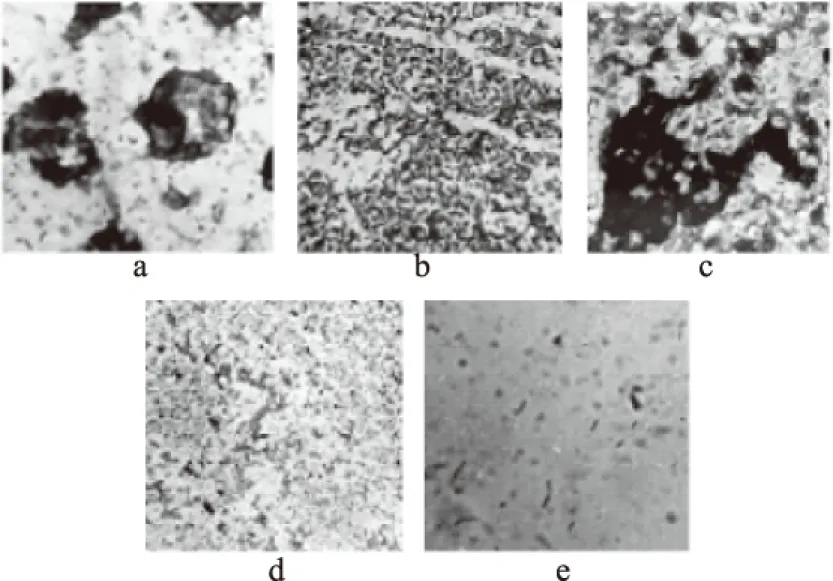
图5 结晶紫染色法观察不同pH对B.cereus菌膜形成数的影响Fig.5 Effect of pH on the formation of B.cereus biofilms by crystal violet staining注:a~e分别表示pH为2、5、7、9、11时 B.cereus菌膜在显微镜(100×10)观察图。
2.2.3 不同营养胁迫对B.cereus菌膜形成的影响 如图6所示,葡萄糖添加量<10%的范围,菌膜形成量均大于不添加葡萄糖的菌膜形成量;在0~4%时随着添加量增加B.cereus菌膜形成量呈现逐渐增强的趋势,当添加量为4%时B.cereus菌膜形成量为最大,达7.48(lg(CFU/cm2)是不添加葡萄糖时的1.70倍,同时采用结晶紫染色观察葡萄糖浓度对菌膜形成量的影响,图7a,不添加葡萄糖的观察图,紫色菌体相连;图7b,添加葡萄糖2%的观察图,紫色菌体相连密度增大;图7c,添加葡萄糖4%的观察图,菌体密集成团,结构粗壮,呈网状结构;图7d,添加葡萄糖6%的观察图,菌体密度减弱,形态无变化,网状结构减弱;图7e,添加葡萄糖8%的观察图,菌体密度减弱,菌体相连度减弱,见紫色散落菌体;图7f,添加葡萄糖10%的观察图,菌体密度进一步减弱,见紫色散落菌体。整体来看,添加葡萄糖有利于B.cereus菌膜形成,揭示富营养条件有利于B.cereus菌膜形成。在低浓度时B.cereus菌膜形成量随葡萄糖浓度增加而升高,当葡萄糖浓度超过4%时,菌膜形成量反而降低,这与马悦等[17]对B.cereus在PMMA、PVC载体研究结果一致,当碳源物质一旦超过一定限度,高浓度的葡萄糖产生高渗透压,抑制B.cereus菌膜的形成。
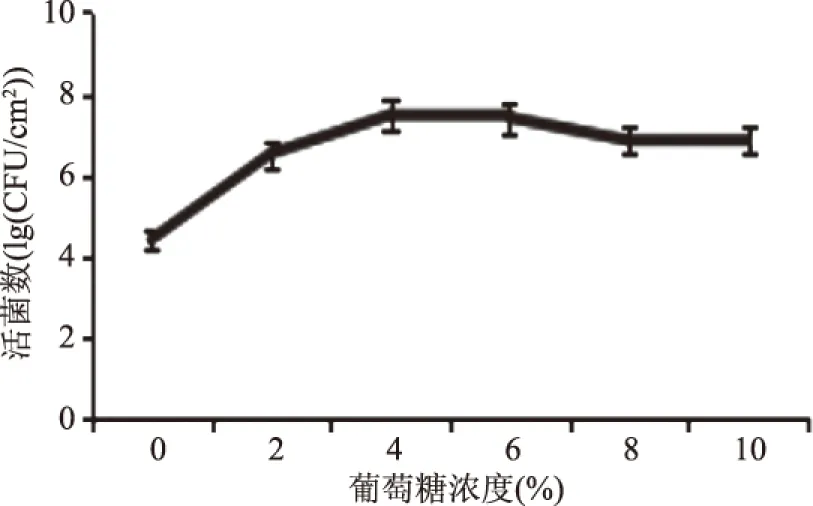
图6 B.cereus菌膜形成数随葡萄糖浓度的变化Fig.6 Changes of the formation of B. cereus biofilms over glucose concentration
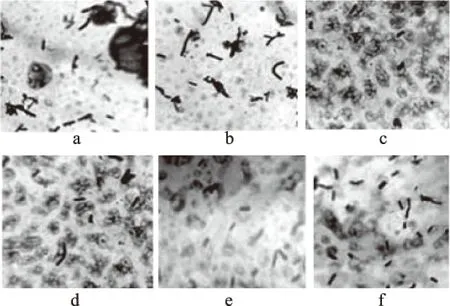
图7 结晶紫染色法观察B.cereus菌膜随葡萄糖浓度的变化Fig.7 Changes of the formation of B. cereus biofilms over glucose concentration by crystal violet staining注:a~f分别表示添加葡萄糖浓度为0%、2%、4%、6%、8%、10%时B. cereus菌膜在显微镜(100×10)观察图。
2.2.4 不同渗透胁迫对B.cereus菌膜形成的影响 图8为NaCl对B.cereus菌膜形成量的结果,添加NaCl促进了菌膜的形成,随着添加量的增加,B.cereus菌膜形成量先增后减,当NaCl添加量为0.5%时菌膜形成量最大,当NaCl浓度进一步增大,菌膜形成量逐渐降低;同时采用结晶紫染色观察NaCl浓度对菌膜形成量的影响,图9a紫色菌体相连成网状结构;图9b大量菌体相连呈紫色网状结构局部菌体大量密集呈团状;图9c,菌体部分呈团状部分粘连;图9d,菌体零星散落,单个存在未观察到网状结构;图9e~图9g,散落菌体很少,几乎无菌膜存在。表明,低渗胁迫对菌膜形成有利,而随着NaCl浓度增强,B.cereus菌膜总量逐渐减少,可能是由于高浓度的NaCl,导致细胞微生物细胞脱水死亡从而抑制菌膜的形成。
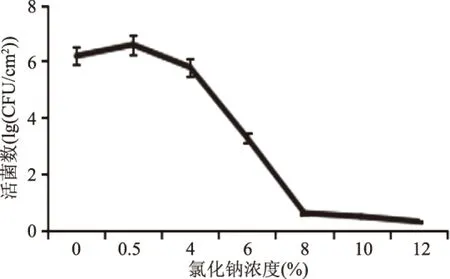
图8 B.cereus菌膜形成数随氯化钠浓度的变化Fig.8 Changes of the formation of B.cereus biofilms over sodium chloride concentration
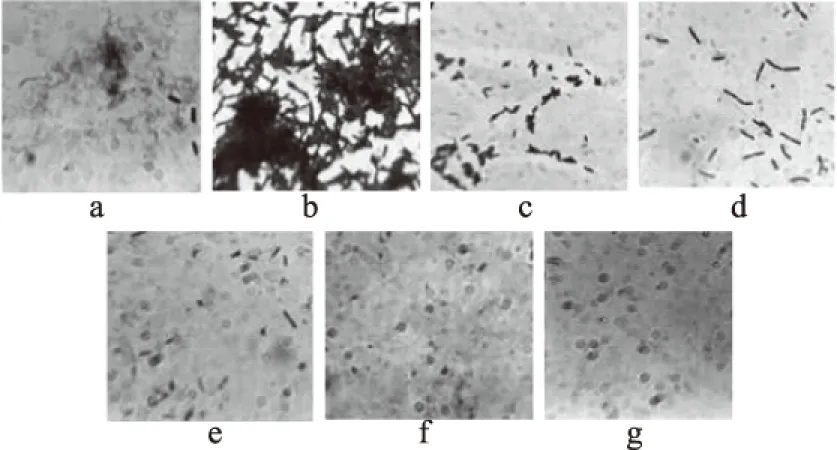
图9 结晶紫染色法观察B.cereus菌膜随氯化钠浓度的变化Fig.9 Changes in the formation of B.cereus biofilms over sodium chloride concentrationby crystal violet staining注:a~f分别表示添加NaCl浓度为0%、0.5%、4%、6%、8%、10%、12% B.cereus菌膜在显微镜(100×10)观察图。
2.2.5 不同防腐胁迫对B.cereus菌膜形成的影响 苯甲酸钠(pH2.5~pH4.0)在食品中的限量值为0.2~1.0 g/kg,山梨酸钾(pH5.0~pH6.0)在食品中的限量值0.2~2.0 g/kg,以0.02%、0.05%、0.10%、0.15%添加量加入到培养液中观察防腐剂对B.cereus菌膜形成的影响。由图10可知,不同浓度的不同防腐剂对B.cereus菌膜形成的影响不同,添加0.02%苯甲酸钠B.cereus菌膜形成量是添加该浓度山梨酸钾的1.03倍,而当添加0.05%山梨酸钾的菌膜形成量是该浓度苯甲酸钠的1.31倍。总体来看,添加防腐剂,菌膜的形成量会减少但并不呈直线下降趋势,而当添加高浓度防腐剂时菌膜形成量反而升高,如添加防腐剂浓度为0.15%时,不论是山梨酸钾还是苯甲酸钠菌膜形成量均高于添加防腐剂浓度为0.10%时的形成量,因为防腐剂能够抑制微生物的生长,而当菌膜菌在形成菌膜后,一旦处于不利环境(过高浓度防腐剂),为了保护自己反而会形成更多的菌膜,这对食品加工中菌膜的防治又提出了新的考验,在加工中不能仅凭加入食品防腐剂便疏忽对菌膜的控制。
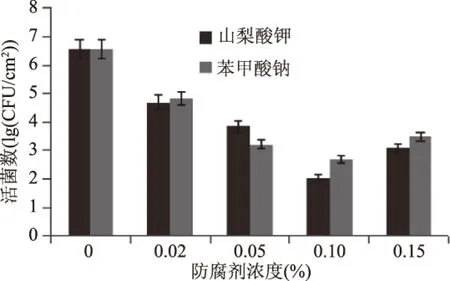
图10 防腐剂对B.cereus菌膜形成数的影响Fig.10 Effect of preservatives on B. cereus biofilms formation
3 结论
B.cereus可在玻璃表面形成菌膜,培养时间24 h时,当温度30 ℃,pH7.0,形成B.cereus菌膜量最大。同时多种胁迫因素也会形成B.cereus菌膜,温度胁迫下,低温4 ℃、高温50 ℃均能形成菌膜;酸碱胁迫下,pH小于或大于7.0时,菌膜的形成受到抑制;营养胁迫下,添加葡萄糖有利于B.cereus菌膜形成,揭示富营养环境有利于B.cereus菌膜形成,4%葡萄糖有明显的促进菌膜形成的效果;渗透胁迫下,添加低浓度的NaCl(0.5%)对B.cereus形成有促进作用而高浓度的NaCl(大于4%)对菌膜形成抑制作用明显;防腐胁迫下,在食品可添加的最高限量防腐剂浓度下仍能形成B.cereus菌膜,甚至0.15%防腐剂B.cereus菌膜形成量高于0.10%的菌膜形成量。菌膜的形成严重阻碍了致病菌的消除,它就像细菌的保护伞,增强了细菌对外界不利条件的抵抗力,因此,在食品加工中为有效防止菌膜的形成,首先应严格控制食品加工过程微生物的存在,尤其是致病菌,不能仅凭加入食品防腐剂便疏忽对菌膜的控制,其次对加工设备和包装容器进行严格清洗,防止有糖份残留滋生菌膜,最后对低温加工车间及冷库也应加强菌膜控制,有效抑制低温菌及其菌膜存在。
[1]赵桂华,孙春伟.食源性疾病引发的食品安全问题分析[J].黑龙江科技信息,2013(35):42.
[2]Chen Yan,Yan Weixing,Zhou Yijing,et al. Burden of self-reported acute gastrointestinal illness in China:a population based survey[J]. BMC Public Health,2013,13(1):1-10.
[3]Lapidus A,Goltsman E,Auger S,et al. Extending the Bacillus cereus group genomics to putative food-borne pathogens of different toxicity[J]. Chemico-Biological Interactions,2008,171(2):236-249.
[4]褚小菊.米饭中蜡样芽孢杆菌引起食物中毒的风险分析[J].粮食与饲料工业,2011(3):12-14.
[5]Ana C L,Jessica M,Pablo F P,et al. A case of intoxication due to a highly cytotoxic Bacillus cereus Strain isolated from cooked chicken[J]. Food Microbiology,2015(46):195-199.
[6]Kumbal Choi,Hyu sul Lim,Kwan Lee,et al.Epidemiological investigation for outbreak of food poisoning caused by Bacillus cereus among the workers at a local companyin 2010[J]. Journal of Preventive Medicine and Public Health,2011,44(2):65-73.
[7]Jahid I K,Ha S D.A review of microbial biofilms of produce:Future challenge to food safety[J]. Food Science and Biotechnology,2012,21(2):299-316.
[8]Donlan R M,Costerton J W. Biofilms:survival mechanismsof clinically relevant microorganisms[J].Clinical Microbiology Reviews,2002,15(2):167-193.
[9]YiHuang H,Eileen B. Somers A C,et al. Characterization of the codY gene and its influence on biofilm formation in Bacillus cereus[J].Archives of Microbiology,2008,189(6):557-568.
[10]Hamida K,Faten K,Moktar H. Impact of Lactococcus lactis spp. lactis Bio Adhesion on Pathogenic Bacillus cereus Biofilm on Silicone Flowing System[J].Indian J Microbiol 2013,7,53(3):269-275.
[11]Manuel S,Lucial C S,Maria J V. A revew of current and emergent biofilm control strat egies[J]. Food Sci Technol,2010,43(4):573-583.
[12]Furu K,Akiyo S,Oto O,et al.Sugar fatty acidesters inhibit biofilm form ation by food-bornepathogenic bacteria[J]. Int J Food Microbiol,2010(138):176-180.
[13]Dourou D,Beachamp C S,Yoon Y,et al. Attachment and biofilm formation byEscherichiaColiO157∶H7 at different temperatures,on various food-contact surfaces encountered in beef processing[J]. International Journal of Food Microbiology,2011,149(3):262-268.
[14]Lizcano A,Chin T,Sauer K,et al. Early biofilm formation on microtiterplates is not correlated with the invasive disease potential of Streptococcus pneumonia[J]. Microbial Pathogenesis,2010(48):124-130.
[15]Rode T M,Langsrud S,Holck A,et al.Different patterns of biofilm formation in Staphylococcus aureus under food-related stress conditions[J].Int J Food Microbiol,2007,116(3):372-383.
[16]李南薇,何佩倩,杜冰,等.培养条件对蜡样芽孢杆菌生物被膜生长的影响[J].食品工业,2012,33(7):108-110.
[17]马悦,吴谦,吴希阳,等.培养条件及接触材料对大米中蜡样芽孢杆菌生物被膜形成的影响[J].食品与发酵工业,2015,41(12):64-68.
Effects of stress factors on the formation ofBacilluscereusbiofilm on glass surfaces
XIA Jun-fang,LIU Xia,LI Xiao-yan,ZHANG Zhen-zhen,GuLi-nazi, MA Yao,Mu-Li-deng,WANG Wei,ZHANG Ya-nan,WU Yun*
(College of Food Science and Pharmacy,Xinjiang Agricultural University,Urumqi 830052,China)
Biofilms formed by foodborne pathogenic bacteriaBacilluscereuswas used as material,the effect of food processing temperature stress,pH stress,nutritional stress,osmotic stress and preservatives stress on the formation ofBacilluscereusbiofilms were investigated,and the formation of the biofilms were measured by ultrasonic plate method and observed crystal violet staining. The results showed that under the temperature stress,theBacilluscereusbiofilm formed at 4 ℃ and 50 ℃,the formation of biofilms were increased then decreased with increasing temperature,Bacilluscereusformed stable biofilms at 30 ℃. Under the pH stress,when the pH was less or more than 7.0,the formation of biofims were significantly reduced,Bacilluscereusformed stable biofilms at pH7.0. Under the stress of nutrition,the abilities of biofilms formation would be improved by adding proper glucose in culture medium and the 4% glucose had obvious effect on promoting the formation ofBacilluscereusbiofilms. Under the osmotic stress,low concentration of sodium chloride promoted the formation ofBacilluscereusbiofilms,high concentration of sodium chloride could inhibit the formation ofBacilluscereusbiofilms and the 0.5% sodium chloride had obvious effect on promoting the formation ofBacilluscereusbiofilms. Under preservative stress,theBacilluscereusbiofims of adding 0.15% food preservative were higher than 0.10%. In the food processing,it would not neglect controling bacteria biofilms just only adding food preservatives.
Bacilluscereus;biofilm;glass surfaces;stress factors
2016-10-24
夏俊芳(1986-),女,硕士,讲师,主要从事食品微生物安全控制,E-mail:junfangxia@126.com。
*通讯作者:武运(1965-),女,硕士,教授,主要从事食品生物技术研究,E-mail:wuyunster@sina.com。
新疆农业大学校前期资助课题(XJAU201522)。
TS201.3
B
1002-0306(2017)07-0105-06
10.13386/j.issn1002-0306.2017.07.012
