普洱茶发酵产茶多糖菌株的筛选与鉴定
2017-04-13王洪振马存强任小盈周斌星
王洪振,马存强,2,任小盈,王 潘,周斌星,3,*
(1.云南农业大学龙润普洱茶学院,云南昆明 650201; 2.昆明大朴茶业有限公司,云南昆明 650224; 3.安徽农业大学茶与食品科技学院,安徽合肥 230036)
普洱茶发酵产茶多糖菌株的筛选与鉴定
王洪振1,马存强1,2,任小盈1,王 潘1,周斌星1,3,*
(1.云南农业大学龙润普洱茶学院,云南昆明 650201; 2.昆明大朴茶业有限公司,云南昆明 650224; 3.安徽农业大学茶与食品科技学院,安徽合肥 230036)
以不同阶段的普洱茶发酵样为实验材料进行真菌的分离纯化,将分离纯化出的优势真菌在理想条件下和自然状态下分别进行茶叶接种发酵,筛选出产茶多糖的优势菌。结果表明,在普洱渥堆发酵中共分离纯化出22株菌株,其中5株菌株在渥堆发酵的不同阶段频繁检出,可用于接种发酵实验。在接种发酵中,茶多糖均有显著增加(p<0.05)。其中PEZJ-1菌株提高茶多糖含量最为显著,在理想条件下和自然状态下的接种发酵中茶多糖含量分别达到23.57%和27.85%。通过菌落形态、分生孢子显微特征、18S rDNA序列,对PEZJ-1进行鉴定,确定该菌株为Aspergillusniger(GenBank登录号为JX863374),属于曲霉属。在普洱茶渥堆发酵中接种外源微生物能显著提高茶多糖含量,Aspergillusniger能大幅度提高茶多糖含量,为茶多糖的开发应用提供了微生物菌种。
茶多糖,普洱茶,筛选,鉴定,黑曲霉
茶叶中的糖类物质主要包括单糖、寡糖、多糖及少量其它糖类。茶多糖(tea polysaccharides)是一类从茶叶中分离出溶于水的具有生理活性的糖蛋白[1]。现代医学研究表明茶多糖具有降血糖[2-4]、降血脂[5-6]、降血压[7]等多种保健功效,并对肺癌细胞增殖有一定抑制作用[8],是一种具有广阔开发前景的天然药物。
普洱茶是以云南大叶种茶树鲜叶[Camelliasinensis(Linn)var.assamica(MastersKitamura)]加工而成的晒青毛茶为原料,采取特定的加工工艺,形成具有独特品质特征的茶叶[9]。按照加工工艺不同分为普洱茶(生茶)和普洱茶(熟茶)。普洱茶(熟茶)具有减少腰部脂肪堆积[10]、抗菌[11-12]、抗氧化[13]、减少动脉粥样硬化几率[14]和一定的防癌抗癌作用[15-16]功效。渥堆(固态发酵)是普洱茶(熟茶)品质形成的关键工序。在普洱茶渥堆过程中分离鉴定出多种微生物,其中包括真菌[17-18]、细菌[17]、嗜热菌[19]等。真菌主要以曲霉菌、酵母菌、青霉菌和根霉菌为主[20],它们对普洱茶(熟茶)品质形成以及物质变化起主要作用。
普洱茶多糖是指从普洱茶中分离纯化出的茶多糖。郭威等[21-22]研究证实普洱茶多糖共有TPS1、TPS2、TPS3、TPS4四种组分,含有甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、岩藻糖8种单糖。在渥堆发酵过程中,真菌、细菌、嗜热菌的繁殖代谢对茶多糖的含量、构成、分子量大小产生深刻影响。本文以普洱茶渥堆发酵样为材料,筛选鉴定出在渥堆发酵过程中可显著增加茶多糖含量的菌株,为未来开发普洱茶多糖提供优良菌株。
1 材料与方法
1.1 材料与仪器
普洱茶渥堆发酵样和云南大叶种晒青毛茶 昆明大朴茶业有限公司。普洱茶自然渥堆与单一微生物接种渥堆发酵在昆明大朴茶厂完成。
Labonce-150TH恒温恒湿培养箱 北京兰贝石恒温技术有限公司;Agilent1200型高效液相色谱仪 美国安捷伦公司;JH-752型紫外可见分光亮度计 上海菁华科技仪器有限公司;SW-CJ-ID型单人净化工作台。
1.2 实验方法
1.2.1 无菌与传统渥堆发酵处理 无菌发酵处理:称取潮水量为38%的云南大叶种晒青毛茶,高压灭菌锅内121 ℃灭菌15 min,冷却至室温后,放置于恒温恒湿培养箱(27 ℃,85%)内进行无菌发酵,每隔5 d取样一次,测定其含水量,并提取茶多糖。传统渥堆处理:准确称取200 kg云南大叶种晒青毛茶添加适量生活饮用水,使晒青毛茶潮水量维持在38%~45%之间,在自然状态下进行传统渥堆,每隔5 d取样一次,测定其含水量,提取茶多糖。
1.2.2 普洱茶渥堆过程中真菌的分离纯化 无菌操作称取不同渥堆阶段茶样1.000 g,加入9 mL无菌生理盐水,并依次稀释级数为10-1、10-2、10-3、10-4、10-5,用PDA培养基进行基内接种,采用稀释涂布法,每个稀释度做3个平行、两次重复,27 ℃倒置培养。培养3 d后,每日观察并记录各个菌株生长的颜色、形态、大小及质地的变化。通过以上的观察记录,对菌株进行形态鉴定。
1.2.3 单一微生物发酵样的制备 称取20 g晒青毛茶与12.25 mL蒸馏水混合,高温高压灭菌后,每培养瓶接种1 mL目标菌株的种子液。培养瓶均放置于恒温恒湿培养箱内(30 ℃,85%)进行茶叶发酵。每隔5 d取样一次,测定其含水量和茶多糖。
1.2.4 单一微生物菌粉的制备和自然条件下单一微生物渥堆发酵 菌粉的制备:采用200 g大米、20 g葡萄糖、200 mL蒸馏水的常规真菌种子培养基,分别接种优势菌的孢子菌悬液,在恒温恒湿培养箱(27 ℃,85%)内培养至菌落成熟后,在55 ℃恒温下干燥,在无菌条件下于研磨成粉状。自然条件下单一微生物接种渥堆发酵:设置相同潮水量的50 kg晒青毛茶发酵堆,在紫外线辐射灭菌处理后,分别接种0.1%的优势菌菌粉,在自然条件下进行渥堆发酵,每隔5 d取样一次。
1.2.5 化学成分测定 水分测定采取GBT 8304-2013中120 ℃烘干法(快速法)测定。
茶多糖提取与测定[22]粉碎(过40目筛)→称样→加蒸馏水→浸提→过滤→浓缩→乙醇沉淀→静置→离心(4000 r/min)→无水乙醇、丙酮、乙醚重复洗涤三次→干燥→茶多糖成品。茶多糖含量采取苯酚-硫酸法比色测定[23]。
1.2.6 优势菌株的鉴定 菌落及菌株形态观察:无菌操作接种在PDA和察氏培养基上7 d后观察菌落形态。并在显微镜下观察细胞形态。分子鉴定方法如下:
DNA提取:目标菌株分别接种至PDA培养基以及察氏固态培养基,27 ℃培养观察菌落生长状况,并在高倍显微镜观察菌株形态特征。并将目标菌株接种至察氏(CYA)液态培养基中培养、收集菌丝体、-80 ℃冷冻干燥后采取真菌DNA提取试剂盒法提取DNA。
PCR扩增:ITS序列通过引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行扩增。PCR反应程序为:95 ℃预变性5 min;94 ℃变性1 min;54 ℃退火1 min;72 ℃延伸1.5 min;共35个循环;72 ℃延伸10 min.程序结束后进入10 ℃状态。
rDNA序列分析:对PCR产物通过DNA自动测序仪进行测序,并将所获序列提交到NCBI的Genbank数据库进行同源序列搜索,并调出相关菌株ITS1-5.8S-ITS2 rRNA基因序列,用ClustalX1.8软件进行多序列比对,通过MEGA4软件选用Kimura2-parameter距离模型计算进化距离,用Nerghbor-Joining 法构建系统发育树,1000次随机抽样计算Bootstrap值以评估系统发育的置信度。
1.3 数据统计与分析
数据分析采用SPSS 20.0软件。数值表示为平均值±S.D.并通过单因素方法(one-way ANOVA)分析不同样品之间差异的显著性(p<0.05)。
2 结果与分析
2.1 无菌发酵与传统渥堆发酵茶多糖含量的变化
在普洱茶(熟茶)发酵渥堆中,微生物对茶多酚、茶色素、氨基酸、游离总糖[17]均有显著影响。本文以云南大叶种晒青毛茶为原料,分别进行的无菌处理和传统渥堆发酵,并测定不同发酵阶段茶样中茶多糖含量(图1)。在无菌发酵中,茶多糖含量基本稳定在9.13%~11.22%之间。在普洱茶传统的渥堆发酵中,茶多糖呈现先增加后减少的变化趋势;在发酵第10 d,含量达到最大,与原料相比,茶多糖增加了67%左右。通过无菌处理作为对照,可知在普洱茶渥堆发酵中,微生物可显著提高茶多糖含量。研究人员[24]在普洱茶渥堆过程中共分离出40余种真菌,分属于19个不同的属,其中曲霉属、青霉属、酵母菌属占普洱茶菌落的80%左右[25]。在普洱茶渥堆发酵中可显著提高茶多糖含量的优势菌值得进一步研究。

图1 无菌发酵与传统渥堆发酵过程中茶多糖的含量变化Fig.1 The variation of tea polysaccharides in sterile and traditional fermentation
2.2 普洱茶渥堆发酵样中分离纯化出的真菌
以不同发酵阶段的普洱茶渥堆样(共21个)为材料,对普洱茶渥堆发酵中真菌进行分离纯化,并统计不同菌株出现的频率。如表1所示,共计22种。其中PEZJ-1,PEZJ-5,PEZJ-8,PEZJ-9,PEZJ-10为普洱茶渥堆发酵的优势菌,在不同阶段的普洱茶发酵样中经常反复出现,并可将单菌种接种至茶叶中进行茶叶微生物发酵。其他菌株仅在普洱茶渥堆发酵的某一阶段检出或在某个渥堆发酵样中偶尔检出,且单菌种接种至茶叶中不存活或不引起茶叶的显著变化。因此,以PEZJ-1,PEZJ-5,PEZJ-8,PEZJ-9,PEZJ-10为普洱茶渥堆发酵的优势菌筛选出可增加茶多糖含量的优势菌。

表1 不同微生物形态特征描述Table 1 The description of different microorganism characteristics
2.3 优势菌单菌种发酵对茶多糖含量的影响
在实验室的无菌条件下接种单菌种,茶多糖的变化趋势如图2所示。在单菌种茶叶发酵前期,茶多糖含量均显著性增加。这与微生物对纤维素的分解代谢有关。在发酵后期,由于微生物对茶多糖代谢的差异,茶多糖的保留量明显不同。在PEZJ-5,PEZJ-9的单菌种茶叶发酵中,茶多糖整体无显著性变化。在PEZJ-1的单菌种茶叶发酵中,茶多糖含量持续上升,在发酵第35 d达到最大,为23.57%±0.7%,是原料的2.58倍。PEZJ-1可能为增加茶多糖含量的优势菌。茶多糖的大幅度增加与该菌对茶多糖的利用有限有关。
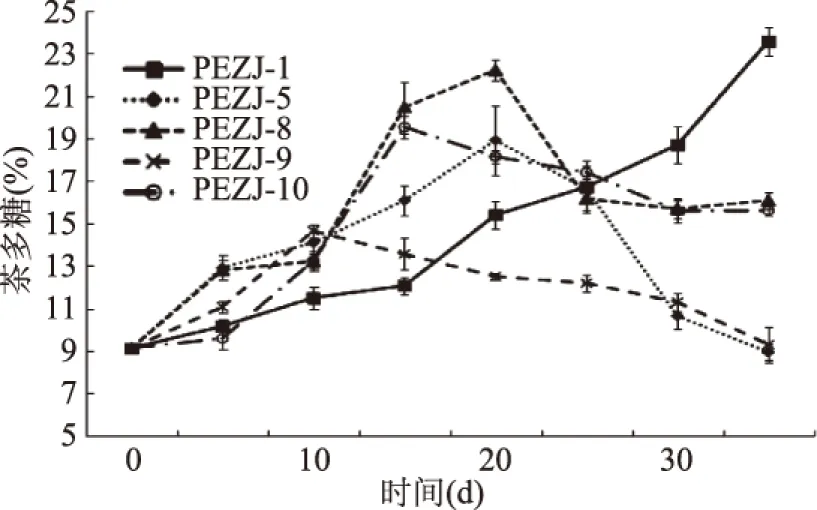
图2 茶叶单菌种发酵过程中茶多糖含量的变化Fig.2 The variation of tea polysaccharides in tea fermentation by single strain
2.4 自然状态优势菌接种发酵对茶多糖含量的影响
为了探究在自然状态下,微生物对茶多糖含量的影响,筛选出可应用于生产中的产茶多糖菌株,5株菌株的菌粉按照一定比例分别添加到云南大叶种晒青毛茶进行自然潮水渥堆发酵,并测定不同阶段茶多糖含量。不同菌株茶叶发酵中茶多糖含量如图3所示。在自然条件下,五株菌株的接种发酵实验中,茶多糖的变化规律与实验室条件下单菌种茶叶发酵基本一致。整体上,PEZJ-5,PEZJ-9对茶多糖含量影响不大;在发酵末期,茶多糖含量较原料有所下降,降幅分别为17.7%和4.8%。PEZJ-1,PEZJ-8和PEZJ-10均能显著提高茶多糖含量。在PEZJ-8和PEZJ-10的自然接种发酵实验中,茶多糖呈现先增加后减少的变化趋势;在发酵结束时,茶多糖含量较原料分别增加73.8%和48.9%。在PEZJ-1发酵过程中茶多糖含量持续上升。在发酵第35d后,茶多糖含量达到最大,为27.85%±0.5%,为原料的2.21倍。因此断定PEZJ-1为普洱茶发酵中产茶多糖的优势菌株。
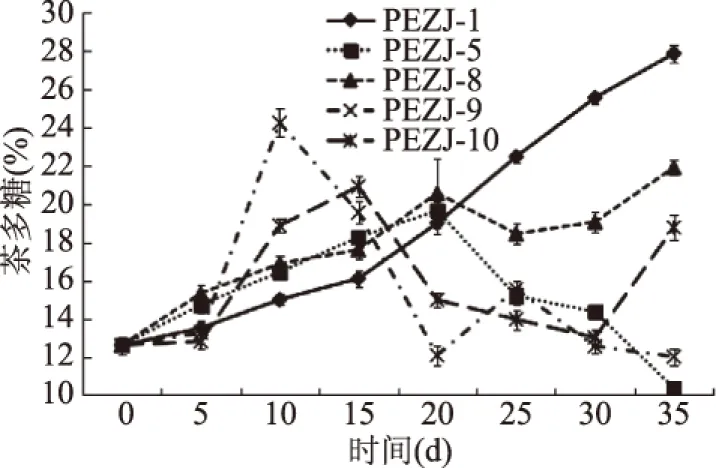
图3 自然状态下茶叶接种发酵过程中茶多糖含量变化Fig.3 The variation of tea polysaccharides during tea inoculated fermentation under natural conditions
2.5 优势菌株的鉴定结果
PEZJ-1在PDA培养基和察氏培养基上菌落形态特征如图4所示。PEZJ-1在PDA培养基上菌落直径3.4 cm,黑色粉状,扁平,边缘白色整齐,气生菌丝稀少;菌落背面乳白夹黑色。PEZJ-1在察氏培养基上菌落直径达3.2cm,白色至棕黑色,扁平,绒粉状边缘整齐,有放射状沟纹,中间有粉红色颗粒状菌核;菌落背面浅棕褐色,有曲线状放射沟纹。PEZJ-1的分生孢子形态特征如图5所示。PEZJ-1菌株的菌丝发达多分枝、有隔膜多核;分生孢子梗由特化了的厚壁而膨大的菌丝细胞(足细胞)上垂直生出,顶部形成球形顶囊,其上全面覆盖一层梗基和一层小梗,小梗上长有成串褐黑色的球状分生孢子,粗糙,直径3.0~4.75 μm;分生孢子头球状如“菊花”,呈褐黑色直径700~800 μm。

图4 PEZJ-1菌株在培养基上的菌落形态Fig.4 Colony morphology of PEZJ-1 strain on culture medium 注:a为PDA培养基正面,b为PDA培养基背面,c为察氏培养基正面,d为察氏培养基背面。
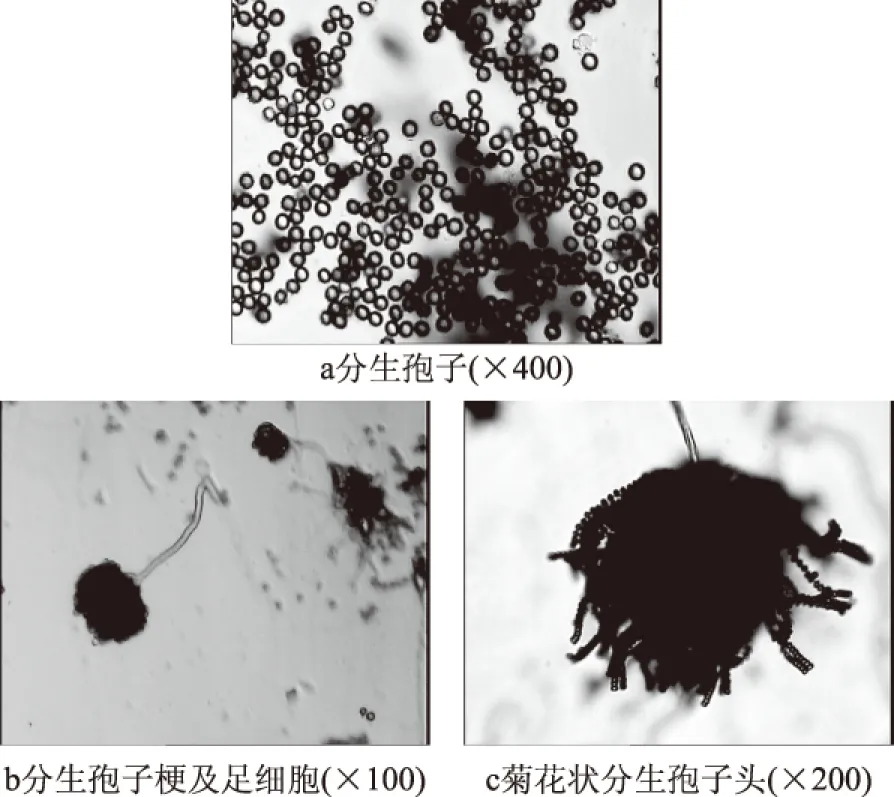
图5 PEZJ-1在电子显微镜下的形态特征Fig.5 Morphological characteristics of PEZJ-1 under transmission electron microscope
对PCR产物通过DNA自动测序仪进行测序,测序结果并将所获序列提交到NCBI的Genbank数据库进行同源序列搜索,并调出相关菌株ITS1-5.8S-ITS2 rRNA基因序列(图6)。通过在线Blast比对检索,目标菌株属于曲霉属,与菌株AspergillusnigerNCBT110A相似性为99.8%。通过系统进化树(图7),结合其菌落形态特征和显微形态观察,将目标菌株鉴定为:黑曲霉(Aspergillusniger)。

图7 系统进化树Fig.7 Phylogenetic tree

图6 ITS1-5.8S-ITS2 rRNA序列Fig.6 The sequences of ITS1-5.8S-ITS2 rRNA
3 结论与讨论
在普洱茶传统渥堆发酵过程中,由于微生物的参与,茶多糖含量有一定程度的增加。本文以理想条件下的灭菌处理作为对比,推断出茶多糖的增加与普洱茶渥堆中微生物的参与,特别是种类繁多、代谢旺盛的真菌密切有关。
本研究以不同阶段的普洱茶渥堆发酵样为实验材料,通过PDA培养基对普洱茶渥堆发酵中出现的真菌进行分离纯化,共分离纯化出22株真菌。大多数菌株仅在发酵的某一阶段或某一个发酵样中偶尔检出。而PEZJ-1、PEZJ-5、PEZJ-8、PEZJ-9、PEZJ-10等5株真菌在不同阶段普洱茶渥堆发酵样中频繁检出,且能单菌种接种至茶叶使茶叶形态发生深刻变化。因此,以此5株真菌为实验菌株,通过单菌种发酵和接种发酵,筛选可增加茶多糖含量的优势菌株。并根据菌落特征、分生孢子结构、DNA序列,对优势菌进行鉴定。
在5种菌株中,PEZJ-5,PEZJ-9整体上对茶多糖无显著影响,PEZJ-1、PEZJ-8、EZJ-10等3种菌株在理想条件下的单菌种发酵和自然状态下的接种发酵中均能显著提高茶多糖。特别是PEZJ-1能大幅度提高茶多糖含量,在单菌种发酵与接种发酵中,茶多糖含量分别为23.57%和27.85%,与原料相比,茶多糖增幅分别为158%和121%,为普洱茶渥堆发酵中可增加茶多糖含量的优势菌株。通过菌落形态观察、分生孢子显微特征分析以及18S rDNA测序鉴定PEZJ-1菌株为黑曲霉(Aspergillusniger),为茶多糖保健品的开发提供一定参考。
[1]宛晓春.茶叶生物化学(第三版)[M].北京:中国农业出版社,2007:54-55,340-344,419-420.
[2]杨军国,陈泉宾,王秀萍,等.茶多糖组成结构及其降血糖作用研究进展[J].福建农业学报,2014,29(12):1260-1264.
[3]Chen X,Wang Y,Wu Y,et al. Green tea polysaccharide conjugates protect human umbilical vein endothelial cells against impairments triggered by high glucose[J].International Journal of Biological Macromolecules,2011,49(1):50-54.
[4]俞东宁,陈萍,王爽,等.龙井茶多糖对ALX糖尿病模型小鼠氧化应激的影响[J].中国食品学报,2016,16(4):30-34.
[5]潘见,陈彦,方伟,等.具有抗氧化活性茶多糖TPS-Ⅱ的分离纯化及其性质研究[J].食品科学,2009(3):25-28.
[6]王媛,荣华,初晓辉,等.普洱茶提取物及普洱茶多糖对人成纤维细胞抗衰老作用机制研究[J].云南农业大学学报,2015,30(2):219-227.
[7]Yang Jianjun,Chen Bin,Gu Yan. Pharmacological evaluation of tea polysaccharides with antioxidant activity in gastric cancer mice[J]. Carbohydrate Polymers,2012,90:943-947.
[8]魏楠,朱强强,陈标名,等.茶多糖对阿霉素抑制肺癌A549细胞增殖作用的影响[J]. 茶叶科学,2016,36(5):477-483.
[9]蔡新,张理珉,杨善禧,等.GB/T 22111-2008,地理标志产品 普洱茶[S]. 北京:中国标准出版社,2008.
[10]Kazumitsu Kubota,Shunichiro Sumi,Hideaki Tojo,et al.Improvements of mean body mass index and body weight in preobese and overweight Japanse adults with balck Chinese tea(pu-erh)water extract[J].Nutrition Research,2011,31:421-428.
[11]Hu Yongjin,Jia Junjing,Qiao Jinling,et al.Antimicrobial activity of pu-erh tea extractsinvitroand its effects on the preservation of cooled mutton[J]. Journal of Food safety,2010,30:177-195.
[12]Su Yajuan,Zhang Chenlu,Wang Yan,et al. Antibacterial property and mechanism of a novel Pu-erh tea nanofibrous membrane[J]. Appl. Microbiol Biotechnol,2012,93:1663-1671.
[13]Gong Jia-Shun,Peng Chun-Xiu,He Xiang,et al. Antioxidant activity of extracts of pu-erh tea and its material[J]. Asian Journal of Agricultural Sciences,2009,1(2):48-54.
[14]Hou Yan,Shao Wanfang,Xiao Rong,et al. Pu-erh tea aqueous extracts lower atherosclerotic risk factors in a rat hyperlipidemia model[J]. Experimental Gerontlogy,2009,44:434-439.
[15]Zhao Hang,Zhang Min,Zhao Lu,et al.Chang of constituents and activity to apoptosis and cell cycle during fermentation of tea[J].International Journal of Molecular Sciences,2011,12:1862-1875.
[16]Way Tzong-Der,Lin Hui-Yi,Kuo Daih-Huang,et al. Pu-erh tea attenuates hyperlipogenesis and induces hepatoma cells growth arrest through activating AMP-Activatd Protein Kinase(AMPK)in human HepG2 cells[J].J Agric. Food Chem,2009,57:5257-5264.
[17]Lv Hai-peng,Zhang Ying-jun,Lin Zhi,et al.Processing and chemical constituents of pu-erh tea[J].Food research international,2013,53:608-618.
[18]Wang Qiu-ping,Gong Jia-shun,Chisti Yusuf,et al.Fungal isolates from a pu-erh type tea fermentation and their ability to convert tea polyphenols to theabrownins[J]. Journal of food science,2015,80:809-817.
[19]杨瑞娟,吕杰,严亮,等. 普洱茶渥堆发酵中嗜热真菌的分离和鉴定[J]. 茶叶科学,2011,31(4):371-378.
[20]Qin Jin-Hua,Li Ning,Tu Peng-Fei,et al. Change in Tea Polyphenol and Purine Alkaloid Composition during Solid-State Fungal Fermentation of Postfermented Tea[J]. J. Agric.Food Chem. 2012,60:1213-1217.
[21]Guo Wei,Zhou Bin-xing,Luo Ling,et al. Analysis of Monosaccharide Composition of Puerh Tea Polysaccaride by Precolumn Derivatization HPLC[J].Agricultural Science & Technology,2013,04:556-558,572.
[22]罗玲,周斌星,郭威,等.普洱茶茶多糖的提取工艺的响应面分析研究[J].中国农学通报,2012,30:263-266.
[23]杨军国,陈键,王丽丽,等.醇沉分级粗茶多糖的抗氧化活性比较及变化机制[J].食品工业科技,2016,(17):96-100.
[24]Zhao Z.J,Tong HR,Zhou L,et al.Fungal colonization of pu-erh tea in Yunnan[J].Journal of Food Safety,2010,30:769-784.
[25]赵振军,童华荣,周黎,等. 普洱茶中真菌种群的分离与分子鉴定[J]. 茶叶科学,2009,29(6):436-442.
Screening and identification of a strain capable of producing tea polysaccharide from pu-erh tea fermentation
WANG Hong-zhen1,MA Cun-qiang1,2,REN Xiao-ying2,WANG Pan1,ZHOU Bin-xing1,3,*
(1.LongRun Pu-erh Tea College,Yunnan Agricultural University,Kunming 650201,China; 2.Kunming Dapu Tea Industry Co.,Kunming 650224,China; 3.College of Tea and Food Science and Technology,Anhui Agricultural University,Hefei 230036,China)
With samples from different stages of pu-erh tea fermentation as experimental material,fungi were isolated and purified. The isolated strains were conducted tea single strain fermentation under ideal condition and inoculated fermentation to screen out a dominant strain capable of increasing tea polysaccharides.The results showed that 22 strains were isolated and purified from pu-erh tea solid-state fermentation,5 dominant strain used in inoculated fermentation were high frequency in pu-erh tea.During the fermentation by isolated strains,tea polysaccharides increased significantly(p<0.05). Especially in fermentation inoculated by PEZJ-1,tea polysaccharides increased most obviously and reached 23.57% and 27.85% under ideal condition and inoculated fermentation,respectively. Based on the colonial morphology,conidium microscopic characteristics and 18S rDNA gene sequence,the strain of PEZJ-1 was identified asAspergillusniger. Therefore,in pu-erh tea solid-state fermentation,exogenous inoculation could improve tea polysaccharides significantly. AndAspergillusnigerenhanced tea polysaccharides by a wide margin,which provides the microbial strain for the development of tea polysaccharides.
tea polysaccharides;pu-erh tea;screening;identification;Aspergillusniger
2016-09-06
王洪振(1989-),男,硕士研究生,研究方向:茶叶加工与综合利用,E-mail:1711842897@qq.com。
*通讯作者:周斌星(1963-),男,博士,副教授,研究方向:茶叶加工,E-mail:bxzhou01@126.com。
紫鹃茶树调控花色苷生物合成的MBW转录因子复合体研究(C161104);保山市名优绿茶加工工艺研制开发。
TS201.3
A
1002-0306(2017)07-0156-06
10.13386/j.issn1002-0306.2017.07.022
