EGCG乙酰化衍生物清除自由基活性的构效分析
2017-04-13王伟伟江和源张建勇施莉婷
王伟伟,苏 威,2,江和源,*,张建勇,施莉婷,2
(1.中国农业科学院茶叶研究所 农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,浙江杭州 310008;2.中国农业科学院研究生院,北京 100081)
EGCG乙酰化衍生物清除自由基活性的构效分析
王伟伟1,苏 威1,2,江和源1,*,张建勇1,施莉婷1,2
(1.中国农业科学院茶叶研究所 农业部茶树生物学与资源利用重点实验室,浙江省茶叶加工工程重点实验室,浙江杭州 310008;2.中国农业科学院研究生院,北京 100081)
以不同取代度乙酰化表没食子儿茶素没食子酸酯(EGCG)为对象,研究了在逐步取代过程中高效液相色谱图出峰时间的变化,以及总抗氧化活性、清除羟自由基、超氧阴离子自由基和DPPH自由基活性。结果表明:乙酰化EGCG出峰时间为14.6~30.6 min,随着乙酸酐添加量的增多,取代羟基数逐渐增加,出峰时间逐渐向后推移。乙酰化EGCG的清除自由基活性表现出不同的规律,其中,总抗氧化活性、清除DPPH自由基活性和清除羟自由基活性随着取代度增加逐渐减弱,其中乙酰化EGCG清除羟自由基活性转变为产生羟自由基活性,清除超氧阴离子自由基活性随着取代度的增加会先升高后降低。由此可见,随着乙酰化程度的增加,EGCG的抗氧化活性有所下降,为乙酰化EGCG产品的研发提供理论依据。
EGCG,乙酰化,总抗氧化能力,羟自由基,超氧阴离子
表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)是茶叶中的一种重要活性成分,约占茶叶中儿茶素总量的40%~60%[1],具有抗氧化、抗肿瘤、抑制肝癌、抗病毒、保护神经系统和心血管系统等功效[2-6]。由于EGCG突出的功能活性,自发现以来一直是科研人员研究的热点之一,但是EGCG存在自身降解和异构化现象,稳定性差、脂溶性和生物利用度低等问题[7-9],导致其应用受到了较大阻碍。
近年来国内外的学者开展了大量的EGCG分子修饰的研究,通过化学合成和生物的方法将EGCG分子上的基团进行取代,提高EGCG的脂溶性,目前EGCG的主要修饰方法有:甲基化、酰基化、酯化、糖苷化等[10-14]。其中酰基化EGCG采用酰基取代羟基,合成的产物脂溶性增加,活性有所下降,有研究表明,EGCG经过乙酰基修饰后稳定性增强,且生物利用度有所提高,是抗癌药物的一种潜在前提物质[15-16]。清除自由基的能力是评价酰基化儿茶素类活性的重要指标[17],EGCG的羟基被乙酰基逐步取代过程中的总抗氧化和清除自由基等活性变化研究尚未见报道,本研究以EGCG为底物,添加不同比例的乙酸酐进行乙酰化,探究EGCG的羟基被乙酰基逐步取代的过程中活性的变化规律,为乙酰化EGCG的进一步研究和应用提供理论基础。
1 材料与方法
1.1 材料与仪器
纯度大于98%的EGCG单体 无锡太阳绿宝科技有限公司;总抗氧化试剂盒、清除超氧阴离子自由基试剂盒、清除和产生羟自由基试剂盒 南京建成生物研究所;乙腈、乙酸乙酯、乙酸酐、吡啶、哇哈哈纯净水、DPPH、碳酸氢钠、氯化钠、无水硫酸钠、乙酸,乙腈为色谱纯,其余试剂为分析纯。
高效液相色谱仪 Waters 600,美国Waters公司;磁力搅拌器 MR3001,德国Heidolph公司。
1.2 不同乙酰化程度EGCG的合成
乙酰化EGCG的合成参照白艳[18]的研究方法,称取4.877 g浓度98%的EGCG样品,溶于500 mL乙酸乙酯溶液中,分别加入一定量的乙酸酐和2.5 mL吡啶,在磁力搅拌器作用下搅拌反应5 h,转速为700 r/min,结束后加入50 mL水搅拌终止反应,在分液漏斗中静置分层,放出水层,倒出乙酸乙酯层,然后分别用水、饱和碳酸氢钠、饱和氯化钠分别洗涤,收集有机层,作为不同取代度EGCG的溶液用于活性分析,各溶液过0.45 μm有机膜后液相检测。其中乙酸酐的添加量分别设定为摩尔比(乙酸酐和EGCG的摩尔比)1∶0、1∶2、1∶4、1∶6、1∶8、1∶12、1∶16、1∶20、1∶24、1∶48、1∶80,依次编号每个处理为处理A、B、C、D、E、F、G、H、I、J、K。
1.3 乙酰化EGCG的HPLC分析方法
乙酰化EGCG的检测参照白艳[19]的研究方法,色谱柱:Hyper-sil ODS2(4.6 mm×250 mm,5 μm)。流速为1.0 mL/min,柱温30 ℃,检测波长280 nm,进样体积10 μL,运行时间50 min,延迟3 min。流动相A为乙腈∶水∶乙酸=5∶94.8∶0.2,流动相B为乙腈∶水∶乙酸=95∶4.8∶0.2,洗脱梯度为0~36 min,A相由100%降至0,36~37 min,A相由0升至100%,并保持至45 min。
1.4 取代羟基数估算
根据不同取代度EGCG的HPLC图谱可以看出,EGCG和全乙酰化EGCG出峰时间之间明显可分为7个时间段,猜测是取代1个羟基至取代7个羟基的EGCG,根据不同取代羟基EGCG的峰面积占总峰面积的比例,推算EGCG的取代羟基数,公式如下:
EGCG取代羟基数=0×A0+1×A1+2×A2+3×A3+4×A4+5×A5+6×A6+7×A7+8×A8
其中A0为取代0个羟基的EGCG占总峰面积的比例,A1为取代1个羟基的EGCG占总峰面积的比例,以此类推。
1.5 活性分析方法
1.5.1 总抗氧化能力 按照试剂盒测定方法,依次加入试剂一1 mL、待测样品0.1 mL、试剂二2 mL、试剂三应用液0.5 mL,充分混匀后37 ℃水浴30 min,再加入试剂四0.1 mL,在波长520 nm处测定吸光值,对照管中待测样本添加顺序改为加入试剂四后添加。
总抗氧化能力=(OD测定-OD对照)/(0.01×30)
式中:OD测定为测定管吸光值,OD对照为对照管吸光值。37 ℃时,每分钟每0.1 mL样品使反应体系的吸光度值每增加0.01为一个总抗氧化能力单位。
1.5.2 产生和抑制羟自由基能力 按照试剂盒测定方法,依次加入底物应用液0.2 mL、待测样品0.2 mL、试剂三应用液0.4 mL、在37 ℃水浴中条件下精确反应1 min,立即加入显色剂2 mL,室温放置20 min后在波长550 nm处测定吸光值,空白管用双蒸水代替底物应用液和待测样品,标准管用双蒸水和0.03% H2O2分别代替底物应用液和待测样品,对照管用双蒸水代替待测样品。
抑制羟自由基能力=(OD对照-OD测定)/(OD标准-OD空白)×8.824×(1/0.2)
产生羟自由基能力=(OD测定-OD对照)/(OD标准-OD空白)×8.824×(1/0.2)
式中:OD测定为测定管吸光值,OD对照为对照管吸光值,OD标准为标准管吸光值,OD空白为空白管吸光值,8.824为标准品浓度8.824 mmol/L。
1.5.3 清除超氧阴离子自由基活性 按照试剂盒测定方法,依次加入试剂一1 mL,样品0.05 mL、试剂二0.1 mL、试剂三0.1 mL、试剂四应用液0.1 mL,混匀后37 ℃水浴反应40 min,加入显色剂2 mL,在波长550 nm处测定吸光值,对照管用双蒸水代替样品,标准管用VC标准品代替样品。
抗超氧阴离子自由基活力=(OD对照-OD测定)/(OD对照-OD标准)×0.15×1000
式中:OD测定为测定管吸光值,OD对照为对照管吸光值,OD标准为标准管吸光值,0.15为标准品浓度0.15 mg/mL。

表1 各处理不同取代度乙酰化EGCG所占的比例和取代羟基数Table 1 Substituted hydroxyl number and proportion of acetylated EGCG with different substituting degrees of each treatment
1.5.4 清除DPPH自由基 清除DPPH自由基的方法参考李熙灿[20]的研究方法,取DPPH·溶液4 mL,逐步添加A溶液,并及时混匀,观察溶液褪色情况,当溶液颜色基本褪去时记录A的添加量,以该添加量的一半作为反应液添加量(设为x mL),加入(2-x) mL无水乙醇,再加入DPPH·溶液4 mL,静置30 min后在519 nm下测量吸光值作为A,以DPPH·溶液4 mL加入2 mL无水乙醇测量吸光值作为A0。
DPPH自由基的清除率(%)=(A0-A)/A0×100
1.6 数据统计方法
采用SAS 9.2进行显著性和相关性分析,检测数据重复三次,采用Excel 2007整理实验数据、作图。
2 结果与分析
2.1 不同取代度乙酰化EGCG的合成结果
处理A到处理K乙酸酐的添加量从摩尔比1∶0增加至1∶80,不同处理的合成物经HPLC检测,结果如图1和表1所示,处理C的乙酸酐添加比例为1∶4,得到的产物以EGCG和取代1~5个乙酰基的EGCG为主,EGCG的出峰时间为14.6 min;处理K的乙酸酐添加比例为1∶80,此时大于96%的EGCG中的8个羟基被全部取代,得到全乙酰化EGCG,出峰时间为30.6 min;中间产物为不同取代度EGCG的混合物,随着乙酸酐添加量的增多,EGCG中的羟基被取代数逐渐增加,出峰时间逐渐向后推移,且取代羟基数越多,越难继续取代,需要添加更多的乙酸酐才能得到更高的取代产物;EGCG共有8个羟基,从未被取代的EGCG和全取代的EGCG出峰情况可以明显看出有7个出峰的时间段,因此,可以定义不同取代度EGCG的出峰时间,从取代1个羟基到取代8个羟基的出峰时间分别为:16.1~16.8、17.8~18.3、19.6~20.5、21.7~22.7、24.0~24.6、26.1~26.6、28.3~28.8、30.6 min,由于可能出现取代位置不同和同分异构体等因素,取代1~7个羟基之间的出峰时间为区间值。

图1 处理C的高效液相图谱Fig.1 HPLC chromatogram of treatment C
2.2 不同取代度乙酰化EGCG的总抗氧化能力
总抗氧化能力是评价体系中分子和酶的综合抗氧化能力,其能力强弱与机体的健康程度有密切的关系,总抗氧化能力测定的原理是将反应体系中的Fe3+还原成Fe2+,然后与菲啉类物质形成稳定的络合物。试剂盒法测定不同取代度乙酰化EGCG的总抗氧化能力变化规律,如图2所示,随着羟基取代数的增多,乙酰化EGCG的总抗氧化能力逐渐降低,且前期降幅较大,处理C的总抗氧化能力为对照A的51.6%,处理F的总抗氧化能力为对照A的12.2%,乙酸酐添加量超过1∶12时,合成的不同取代度乙酰化EGCG的总抗氧化能力下降幅度减缓,处理J的总抗氧化能力已不足对照A的3%。EGCG的酚羟基具有较强的还原性,酚羟基数是影响EGCG总抗氧化能力的主要因子,经统计分析得到,取代的酚羟基数与总抗氧化能力呈极显著的正线性相关(p<0.01),线性方程如下:
Y=-0.298X+2.186R2=0.964

图2 不同取代度乙酰化EGCG的总抗氧化能力Fig.2 Total antioxidant activity of acetylated EGCG with different substituting degrees注:不同字母表示差异显著(p<0.05),图4、图5同。
2.3 不同取代度乙酰化EGCG的抑制和产生羟自由基能力
羟自由基是氧化性最强的自由基,其化学反应能严重破坏蛋白质和核酸等,导致细胞衰老、死亡[21],试剂盒法检测产生羟自由基采用Fenton反应,反应式为:Fe2++H2O2→Fe3++OH-+·OH,加入显色剂后呈色与羟自由基的多少成正比。不同取代度和浓度的EGCG对抑制和产生羟自由基能力有较大的影响,由图3可见,测定不同取代度EGCG合成液(浓度约为9.6 mg/mL)的抑制和产生羟自由基能力,结果表明,随着羟基取代数的增多,乙酰化EGCG抑制羟自由基能力逐渐减弱,当乙酸酐添加量为1∶6时,合成的化合物由抑制羟自由基转为产生羟自由基能力,且随着羟基取代数继续增多,产生羟自由基能力逐渐增强,当乙酸酐添加量达到1∶12以后,合成的乙酰化EGCG产生羟自由基的能力基本稳定。将合成液稀释10倍(浓度约为0.96 mg/mL)后测定其抑制和产生羟自由基能力,结果如图3所示,稀释10倍后乙酰化EGCG随着取代度的增加抑制或产生羟自由基能力的变化规律不变,仍然是抑制能力逐渐变弱,逐渐变为产生羟自由基能力,但是处理D和E由产生羟自由基转变为抑制羟自由基。

图3 不同取代度乙酰化EGCG的抑制和产生羟自由基能力Fig.3 Inhibition and generation hydroxyl free radical activity of acetylated EGCG with different substituting degrees注:图中a、b、c、d、e、f、g表示在p<0.05水平的存在显著性差异;图中正值表示抑制羟自由基能力,负值表示产生羟自由基能力。J、K两个处理乙酰化取代度高,显色反应出现沉淀,数据不作分析,图4同。
由此可见,酚羟基数是乙酰化EGCG抑制和产生羟自由基的能力的重要影响因子,酚羟基数多时能抑制Fenton反应进行,生成较少的羟自由基,随着酚羟基逐渐被取代,合成的乙酰化EGCG抑制能力逐渐减弱,乙酰化EGCG能与Fenton反应的产物OH-反应,将乙酰基置换出来,因此,高取代度的乙酰化EGCG会加速Fenton反应,使之呈现产生羟自由基能力,并且浓度对乙酰化EGCG抑制和产生羟自由基的能力有较大影响,一定程度下,较高的取代度和浓度利于乙酰化EGCG产生羟自由基。
2.4 不同取代度乙酰化EGCG的清除超氧阴离子自由基能力
超氧阴离子自由基性质不活泼,但可以通过自身化学反应危害机体,还能衍生具有细胞毒性的自由基,是生物体中其他自由基的来源方式之一。试剂盒法通过模拟机体中黄嘌呤和黄嘌呤氧化酶反应体系,产生超氧阴离子自由基,加入电子传递物质和染色剂进行显色反应,分光光度检测抗超氧阴离子自由基能力,反应式为:黄嘌呤+H2O+2O2→尿酸+2O2-+2 H+,EGCG具有清除超氧阴离子自由基能力,一是能直接提供H+,延缓黄嘌呤的氧化作用,二是自身的邻苯二酚结构能络合金属离子,影响氧化反应进程[22]。不同取代度EGCG的清除超氧阴离子自由基能力结果如图4所示,随着EGCG取代度的提高,抗超氧阴离子自由基的能力先升高后降低,乙酸酐添加量为1∶4时,合成的乙酰化EGCG抗超氧阴离子自由基的能力最强,随着取代度增加乙酰化EGCG的清除超氧阴离子自由基能力的下降幅度,比抗氧化能力和清除羟自由基小,当乙酸酐添加量为1∶24时,合成的乙酰化EGCG抗超氧阴离子自由基的能力仍占对照的65.8%。

图4 不同取代度乙酰化EGCG的抗超氧阴离子自由基能力Fig.4 Superoxide anion free radical activity of acetylated EGCG with different substituting degrees
2.5 不同取代度乙酰化EGCG的清除DPPH自由基能力
DPPH自由基中存在-NO2和共轭苯环,决定了氮自由基能稳定存在,能清除DPPH自由基的物质一般也能清除稳定性不如它的自由基,通过测定DPPH自由基的清除能力可以评价待测物的抗氧化能力。不同取代度的EGCG清除DPPH自由基的能力如图5所示,整体来看,随着乙酰化程度的提高,清除DPPH自由基的能力逐渐下降,但处理A到处理C清除率无显著变化,处理D和E的清除率略微下降,处理E清除能力仍然占对照的94.4%,当乙酸酐添加量达到1∶12后,合成的乙酰化EGCG清除DPPH自由基能力显著降低,处理J的DPPH清除率已不足3%,处理K基本无清除DPPH自由基能力。乙酰化EGCG清除DPPH自由基能力的变化规律与总抗氧化能力和清除羟自由基不同,清除DPPH自由基从处理A到处理E降低幅度较小,有研究表明,EGCG的B环和D环上的羟基决定了其抗氧化活性能力[23],王川丕等[24]的研究表明,EGCG的D环优先发生接受电子的反应,A环、B环和C环优先发生给出电子的反应。因此,导致乙酰化EGCG不同的抗氧化活性规律可能是乙酰化取代的位点差异,取代的位点不同,乙酰化EGCG能表现出不同的清除自由基活性。
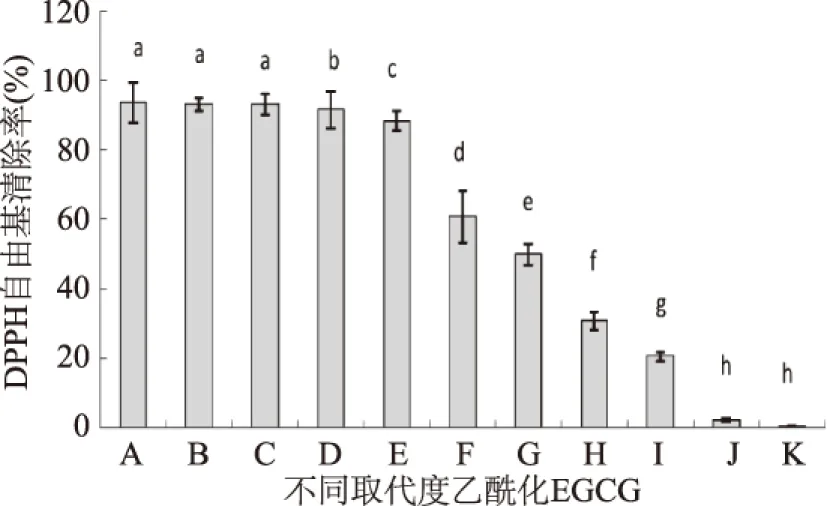
图5 不同取代度乙酰化EGCG的清除DPPH自由基能力Fig.5 DPPH free radical scavenging activity of acetylated EGCG with different substituting degrees
3 结论
本实验研究发现,当乙酸酐添加量为1∶0~1∶80之间时,合成的乙酰化EGCG为不同取代度的混合物,并得到了取代不同羟基数乙酰化EGCG的出峰时间,通过高效液相色谱法可以计算出混合物中不同取代度EGCG的组成比例,为进一步研究不同取代度乙酰化EGCG提供了检测基础。
本实验检测了不同取代度乙酰化EGCG的抗氧化活性、清除羟自由基、超氧阴离子自由基和DPPH自由基能力,较全面探索了其清除各类自由基的能力变化规律,发现不同取代度EGCG的总抗氧化能力和清除DPPH自由基能力的规律相似,均随着取代度的增加能力下降,但变化规律仍有不同之处,总抗氧化能力为取代少量羟基即有较大幅度下降,清除DPPH自由基能力则为乙酸酐添加量为1∶8前降幅较小,之后降幅较大;清除羟自由基能力与浓度密切相关,浓度为0.96、9.6 mg/mL时,取代度高的EGCG具有产生羟自由基能力,浓度升高会使部分具有抑制羟自由基能力的EGCG转为具有产生羟自由基能力的EGCG;清除超氧阴离子自由基的能力随着EGCG取代度的提高先升高后降低,清除超氧阴离子自由基能力降幅低于其余三种。不同取代度乙酰化EGCG清除自由基活性存在上述规律的主要原因是羟自由基数的减少直接降低了体外活性,取代羟基的位点不同和络合金属离子的能力差异又导致了不同的清除规律。不同取代度乙酰化EGCG的四种抗氧化能力表现出的不同规律,可以为乙酰化EGCG将来应用于食品和日化用品提供理论基础。
[1]宛晓春. 茶叶生物化学[M]. 北京:中国农业出版社,2006.
[2]刘晓慧,揭国良,林康,等. EGCG和茶氨酸对细胞氧化损伤的协同保护和修复作用研究[J]. 茶叶科学,2014,34(3):239-247.
[3]Harvey B S,Musgrave I F,Ohlsson K S,et al. The green tea polyphenol(-)-epigallocatechin-3-gallate inhibits amyloid-βevoked fibril formation and neuronal cell deathinvitro[J]. Food Chemistry,2011,129(4):1729-1736.
[4]Xu J,Wang J,Deng F,et al. Green tea extract and its major component epigallocatechin gallate inhibits hepatitis B virusinvitro[J]. Antiviral Research,2008,78(3):242-249.
[5]Sur S,Pal D,Roy R,et al. Tea polyphenols EGCG and TF restrict tongue and liver carcinogenesis simultaneously induced by N-nitrosodiethylamine in mice.[J]. Toxicology and Applied Pharmacology,2016,300(1):34-46.
[6]Jianfei C,Way Kwok-Wai L,Michelle Justine H,et al. A pro-drug of the green tea polyphenol(-)-epigallocatechin-3-gallate(EGCG)prevents differentiated SH-SY5Y cells from toxicity induced by 6-hydroxydopamine.[J]. Neuroscience Letters,2010,469(3):360-364.
[7]Lambert J D,Lee M H,Meng X,et al. Epigallocatechin-3-gallate is absorbed but extensively glucuronidated following oral administration to mice.[J]. Journal of Nutrition,2003,133(12):4172-4177.
[8]Sang S,Lambert J D,Yang C S. Bioavailability and stability issues in understanding the cancer preventive effects of tea polyphenols[J]. Journal of the Science of Food & Agriculture,2006,86(14):2256-2265.
[9]Krupkova O,Ferguson S J,Wuertz-Kozak K. Stability of(-)-epigallocatechin gallate and its activity in liquid formulations and delivery systems[J]. Journal of Nutritional Biochemistry,2016,37:1-12.
[10]Satomi Y,Yoshinori F,Daisuke U,et al. Relationship between the biological activities of methylated derivatives of(-)-epigallocatechin-3-O-gallate(EGCG)and their cell surface binding activities.[J]. Journal of Agricultural & Food Chemistry,2007,55(17):7144-7148.
[11]刘晓辉,江和源,张建勇,等. 乙酰化EGCG的制备研究[J]. 安徽农业科学,2009,37(24):11360-11363.
[12]Lin S F,Lin Y H,Lin M,et al. Synthesis and structure-activity relationship of 3-O-acylated(-)-epigallocatechins as 5α-reductase inhibitors[J]. European Journal of Medicinal Chemistry,2010,45(12):6068-6076.
[13]孙东,陈平. EGCG肉豆蔻酸酯的制备、结构及其抗氧化活性[J]. 温州医科大学学报,2006,36(3):225-227.
[14]Young-Hwan M,Jin-Ha L,Joon-Seob A,et al. Synthesis,structure analyses,and characterization of novel epigallocatechin gallate(EGCG)glycosides using the glucansucrase from Leuconostoc mesenteroides B-1299CB.[J]. Journal of Agricultural & Food Chemistry,2006,54(4):1230-1237.
[15]Wai Har L,Aslamuzzaman K,Kuhn D J,et al. A potential prodrug for a green tea polyphenol proteasome inhibitor:evaluation of the peracetate ester of(-)-epigallocatechin gallate[(-)-EGCG].[J]. Bioorganic & Medicinal Chemistry,2004,12(21):5587-5593.
[16]Landis-Piwowar K R,Congde H,Di C,et al. A novel prodrug of the green tea polyphenol(-)-epigallocatechin-3-gallate as apotential anticancer agent.[J]. Cancer Research,2007,67(9):4303-4310.
[17]Hong S,Liu S. Targeted acylation for all the hydroxyls of(+)-catechin and evaluation of their individual contribution to radical scavenging activity[J]. Food Chemistry,2016,197(Pt A):415-421.
[18]白艳. 不同取代度乙酰化儿茶素的合成及应用研究[D]. 北京:中国农业科学院,2012.
[19]白艳,江和源,江用文,等. 不同取代度乙酰化儿茶素的合成及体外抗氧化活性的研究[J]. 安徽农业科学,2012,40(31):15408-15412.
[20]Li X,Lin J,Gao Y,et al. Antioxidant activity and mechanism of Rhizoma Cimicifugae[J]. Chemistry Central Journal,2012,6(1):1-10.
[21]Zhang J,Hui Z,Li W,et al. Antioxidant activities of the rice endosperm protein hydrolysate:identification of the active peptide[J]. European food research and technology=,2009,229(4):709-719.
[22]朱松. 表没食子儿茶素没食子酸酯(EGCG)酶法乙酰化分子修饰及其产物的抗氧化性能研究[D]. 江南大学,2014.
[23]贾洪锋,范文教,孙俊秀,等. 茶多酚的生理活性及其在肉类中的应用[C]//中国茶叶科技创新与产业发展学术研讨会论文集. 2009.
[24]王川丕,诸力,周苏娟,等. 儿茶素EGCG与其空间异构体GCG的抗氧化活性和反应活性的密度泛函理论研究[J]. 天然产物研究与开发,2015,27(4):645-650.
Analysis on structure-activity of EGCG acetylated derivative to scavenge free radical
WANG Wei-wei1,SU Wei1,2,JIANG He-yuan1,*,ZHANG Jian-yong1,SHI Li-ting1,2
(1.Tea Research Institute,Chinese Academy of Agricultural Sciences,Key Laboratory of Tea Plants Biology and Resources Utilization of Agriculture Ministry,Key Laboratory of Tea Processing Engineering of Zhejiang Province,Hangzhou 310008,China; 2.Graduate School of Chinese Academy of Agricultural Sciences,Beijing 100081,China)
Epigallocatechin gallate(EGCG)with different degrees of acetylating was used in this study,peak reserving time of HPLC and the activity of total antioxidant activity,hydroxyl free radical scavenging,superoxide anion free radical and DPPH free radical scavenging during gradually substituting processing were investigated. The results showed that the peak reserving time of acetylated EGCG was 14.6~30.6 min,the number of replacing hydroxyl increased and the peak reserving time was delayed with the increasing of acetic anhydride. Free radical scavenging activity of acetylated EGCG exhibited different laws,the total antioxidant activity and DPPH free radical scavenging activity gradually weakened with the increasing of substitution degree,Superoxide anion free radical scavenging activity increased first and then decreased with the increasing of substitution degree,hydroxyl free radical scavenging activity reduced with the increasing of substitution degree,and converted to generating hydroxyl free radicals activity. This suggested that the antioxidant activity of EGCG decreased as the degree of acetylation increased,thus provided the basis for development of acetylated EGCG products.
EGCG;acetylated;total antioxidant activity;hydroxyl free radical;superoxide anion free radical
2016-10-08
王伟伟(1986-),男,硕士,助理研究员,研究方向:茶叶深加工技术,E-mail:wangwei11211@tricaas.com。
*通讯作者:江和源(1974-),男,博士,研究员,研究方向:茶叶化学与加工,E-mail:jianghy@tricaas.com。
国家自然科学基金(31670692);公益性行业(农业)科研专项(201503142-11);中国农业科学院科技创新工程(CAAS-ASTIP-2016-TRICAAS)。
TS202
A
1002-0306(2017)07-0059-06
10.13386/j.issn1002-0306.2017.07.003
