活动性系统性红斑狼疮患者外周血嗜碱性粒细胞CD62L、BAFF和CD40L表达变化及意义
2017-04-04冯永民陈秋萍黄柳涛潘庆军刘华锋
冯永民,陈秋萍,黄柳涛,潘庆军,刘华锋
(广东医科大学附属医院,广东湛江 524001)
活动性系统性红斑狼疮患者外周血嗜碱性粒细胞CD62L、BAFF和CD40L表达变化及意义
冯永民,陈秋萍,黄柳涛,潘庆军,刘华锋
(广东医科大学附属医院,广东湛江 524001)
目的 探讨活动性系统性红斑狼疮(SLE)患者外周血嗜碱性粒细胞淋巴归巢受体(CD62L)、B淋巴细胞活化刺激因子(BAFF和CD40L)表达变化及意义。方法 选取SLE患者57例,根据SLEDAI评分将SLE患者分为活动组(SLEDAI评分≥10分)29例和非活动组(SLEDAI评分<10分)28例,选取同期20例查体健康者作为对照组,应用流式细胞术检测SLE患者和正常人外周血CD62L、BAFF和CD40L表达,并采用Spearman法分析其与血清Anti-dsDNA水平的相关性。结果 活动组与非活动组外周血CD62L表达水平均高于对照组(P均<0.05),且活动组高于非活动组(P<0.05)。活动组外周血BAFF和CD40L表达水平均高于对照组和非活动组(P均<0.05);而非活动组与对照组BAFF和CD40L表达差异无统计学意义(P均>0.05)。SLE患者外周血嗜碱性粒细胞CD62L和CD40L表达与血清Anti-dsDNA抗体水平均呈正相关(r分别为0.34、0.36,P均<0.05);而外周血嗜碱性粒细胞BAFF表达与血清Anti-dsDNA抗体水平无关(r=0.26,P=0.14)。结论 活动性SLE患者外周血CD62L、BAFF和CD40L表达升高,嗜碱性粒细胞可能通过CD62L介导向次级淋巴器官迁移,通过BAFF和CD40L活化自身反应性B淋巴细胞而产生多种自身抗体,进而参与SLE的发病。
系统性红斑狼疮;嗜碱性粒细胞;嗜碱性粒细胞淋巴归巢受体;B淋巴细胞活化刺激因子
系统性红斑狼疮(SLE)是一种多因素参与、累及多系统、多脏器的高度异质性的自身免疫性疾病,以产生多种高滴度自身抗体为显著特点。目前SLE机体免疫功能异常的机制尚未完全明了,Th1/Th2失衡[1~3]、多克隆自身反应性B细胞的过度活化并伴以免疫负调节机制的缺损导致多种自身抗体产生[4],被认为是SLE发病的重要机制。研究报道,嗜碱性粒细胞表面表达B淋巴细胞刺激因子(BAFF)[5]及CD40L[6]。BAFF在B淋巴细胞存活和分化中发挥重要作用。CD40L是B淋巴细胞活化的共刺激分子,能提供B细胞活化的第二信号。此外,有学者将嗜碱性粒细胞与B细胞共培养,发现培养上清中免疫球蛋白IgE及IgG4明显增加[7]。嗜碱性粒细胞可通过增强Th2应答而活化B细胞或直接作用于B细胞而产生多种自身抗体,可能参与多种自身免疫性疾病的发病过程。2012年5月,我们检测了57例SLE患者外周血嗜碱性粒细胞CD62L、BAFF和CD40L表达,并探讨其意义。
1 资料与方法
1.1 临床资料 选取2012年5月~2013年3月广东医学院附属医院肾病内科确诊的57例SLE患者,男7例、女50例,均符合美国风湿病学会1997推荐的SLE诊断标准。排除合并感染、过敏、合并其他自身免疫性疾病、肾功能受损(以血肌酐超过基础值2倍以上)的患者。收集SLE患者的临床资料和实验室检查数据,并计算患者SLE活动指数(SLEDAI),根据SLEDAI评分将SLE患者分为活动组(SLEDAI评分≥10分)29例(男3例,女26例)和非活动组(SLEDAI评分<10分)28例(男4例,女24例),活动组与非活动组年龄分别为(26.8±10.1)、(31.6±8.7)岁。同时按照性别和年龄相匹配的原则选取健康志愿者20例(男4例,女16例)作为对照组,年龄(28.3±6.7)岁。
1.2 外周血嗜碱性粒细胞CD62L、BAFF和CD40L表达的检测方法 采用流式细胞术。采集受试者清晨空腹外周静脉血3 mL,EDTA抗凝。取流式上样管进行编号,每一例标本分为3管,依次为A、B、C管。在每一流式上样管内加入4 mL现配的1×红细胞裂解液,再加入200 μL EDTA抗凝外周静脉血充分混匀,避光放置15 min。1 500 r/min(300 g)×6 min离心后弃上清液,加入细胞染色液2 mL,充分混匀,再次离心,去上清,加入细胞染色液100 μL重悬细胞。A 管为空白管,不加入任何抗体;B 管为同型对照管,加入与C管所加抗体等量的同种属同型对照抗体;C管滴加荧光素标记的鼠抗人相应抗体各5 μL。各管均用震荡器充分混匀,室温避光孵育30 min。加染色液2 mL,离心,去上清,重复2次。滴加细胞染色液200 μL重悬细胞,流式检测备用。加荧光标记抗体及之后的操作均在避光下进行。常规采用空白对照、同型对照试剂和荧光微球Flow Check对流式细胞仪进行调控,以荧光微球上机调定荧光变异系数值小于4%;各荧光素之间荧光补偿调至标准值范围内。根据前向散射角(FSC)和侧向散射角(SSC),对单个核细胞群进行设门,以SSC/CD203c 标记嗜碱性粒细胞。对荧光标记的细胞进行分析,以同型对照组为基准设门,确定嗜碱性粒细胞阳性表达位置。使用FCS Express软件分析数据,以特异性标记物平均荧光强度(MFI)与相应同型对照MFI的差值,代表相应生物学指标的相对表达水平。 Anti-dsDNA采用ELISA法检测(上海科新生物技术股份有限公司)。
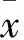
2 结果
2.1 外周血嗜碱性粒细胞流式细胞术定位 外周血嗜碱性粒细胞主要分布于单个核细胞群,更接近于淋巴细胞群。
2.2 各组外周血CD62L表达比较 非活动组、活动组、对照组外周血CD62L表达水平分别为261.3(154.8,352.0)、322.5(279.0,444.4)、129.0(107.5,174.0),三组间比较,P均<0.05。
2.3 各组外周血BAFF和CD40L表达比较 非活动组、活动组、对照组外周血BAFF表达水平分别为102.0(37.9,217.3)、220.5(99.2,280.6)、106.0(51.0,153.0),CD40L表达水平分别为78.0(53.7,140.0)、146.0(109.5,240.5)、84.5(37.0,281.5),活动组与另外两组BAFF和CD40L表达比较,P均<0.05;对照组与非活动组BAFF和CD40L表达比较,P均>0.05。
2.4 外周血嗜碱性粒细胞CD62L、CD40L及BAFF表达与SLE患者血anti-dsDNA抗体水平的关系 SLE患者外周血嗜碱性粒细胞CD62L和CD40L表达与血清Anti-dsDNA抗体水平均呈线性正相关(r=0.340,P=0.015;r=0.360,P=0.017);而外周血嗜碱性粒细胞BAFF表达与血清Anti-dsDNA抗体水平无线性相关关系(r=0.260,P=0.140)。
3 讨论
SLE是典型的自身免疫性疾病,以自身反应性T、B细胞异常活化及多种自身抗体产生为特点,常伴有多个组织器官损伤。研究发现,嗜碱性粒细胞参与天然免疫、获得性免疫、免疫平衡调节等[8],但在SLE发病中的作用,至今少见文献报道。嗜碱性粒细胞参与过敏反应已被熟知[9],近年有关嗜碱性粒细胞在天然免疫、获得性免疫、免疫平衡调节等方面的研究取得较大进展[8]。在免疫调节方面,嗜碱性粒细胞表面表达高水平的IgE受体FcεRI,通过与抗原特异IgE交联,或其他的活化途径,能产生Th2型细胞因子如IL-4和IL-13[10]。研究[11~13]发现,碱性粒细胞可通过MHC Ⅱ分子参与抗原提呈,在体内介导Th0向Th2细胞分化[13,14]而增强体液免疫应答[15]。Charles等[16]报道,蛋白酪氨酸激酶Lyn 缺陷(Lyn-/-)的老年小鼠外周血嗜碱性粒细胞能被自身反应性免疫复合物(IgE-CICs)活化后高表达膜性BAFF。
本研究中我们以外周血嗜碱性粒细胞为研究对象,应用流式细胞术检测其CD62L、BAFF和CD40L表达,初步探讨嗜碱性粒细胞在SLE发病中的作用。首先,我们应用流式细胞术明确嗜碱性粒细胞在流式外周血白细胞散点图中的位置,结果显示,外周血嗜碱性粒细胞主要分布于流式细胞术血细胞散点图中单个核细胞群,更接近于淋巴细胞群,与国外研究报道一致[17,18]。
文献报道,嗜碱性粒细胞表达黏附分子CD62L,CD62L是一种淋巴归巢受体[16,19]。Martin等[20]在乳腺瘤病毒感染的BALB/c小鼠淋巴结中发现明显的树突状细胞浸润,而预先用anti-CD62L抗体处理后小鼠淋巴结浸润的树突状细胞明显减少,此提示树突状细胞向淋巴结的迁移依赖于CD62L的作用。同样,CD62L可介导淋巴细胞通过高静脉内皮细胞向次级淋巴组织器官迁移[21]。有研究报道,在以Th2应答为主的Lyn-/-SLE样小鼠外周血嗜碱性粒细胞CD62L表达上调,同时在其脾脏和淋巴结均可见嗜碱性粒细胞浸润[13],提示CD62L可能介导外周血嗜碱性粒细胞向次级淋巴组织器官迁移。而本研究结果显示,活动性SLE患者嗜碱性粒细胞CD62L表达高于非活动性SLE患者,提示外周血嗜碱性粒细胞CD62L表达与SLE病情活动有关,且高表达CD62L的活动性SLE患者嗜碱性粒细胞可能向次级淋巴细胞迁移。但基于伦理问题,本研究未能在SLE患者次级淋巴器官中检测嗜碱性粒细胞的浸润情况。此外,SLE患者外周血嗜碱性粒细胞CD62L表达高于正常人,且与血清抗-dsDNA抗体水平呈正相关,提示外周血嗜碱性粒细胞CD62L可能与SLE自身抗体的产生有关,参与SLE的病理生理过程。
自身抗体主要由SLE患者体内自身反应性B淋巴细胞异常活化分化为浆细胞而产生。文献报道,嗜碱性粒细胞可延长浆细胞的存活,促进浆细胞产生更多免疫球蛋白IgG1及IgG2[22]。此外,有学者将嗜碱性粒细胞与B细胞体外共培养,发现培养上清中免疫球蛋白IgE及IgG4明显增加[16]。研究报道,嗜碱性粒细胞表面表达BAFF[5]及CD40L[6]。过表达于树突状细胞的BAFF可促进浆母细胞的存活和浆细胞分化[23]。Mackay等[24]研究发现,BAFF转基因小鼠可出现B细胞功能失常而呈现SLE样综合征。CD40L是B淋巴细胞活化的共刺激分子,与表达于B淋巴细胞表面的CD40相互作用,可提供B细胞活化的第二信号。本研究结果显示,活动性SLE患者外周血嗜碱性粒细胞BAFF和CD40L表达均高于非活动性SLE及正常人,提示嗜碱性粒细胞BAFF和CD40L表达与SLE病情活动有关。最近,美国FDA批准Belimumab用于SLE的治疗,该药主要靶向BAFF,疗效显著[25,26]。其机制除了抑制B淋巴细胞活化,有可能亦清除了部分表达BAFF的嗜碱性粒细胞,从而控制SLE活动。此外,CD40L水平与血清抗-dsDNA抗体水平呈正相关,提示CD40L可能与自身抗体产生有关。因此,我们推测活动性SLE外周血嗜碱性粒细胞由CD62L介导向次级淋巴组织器官迁移,一方面通过BAFF作用延长自身反应性B淋巴细胞的存活,一方面通过CD40L活化自身反应性B淋巴细胞而产生多种自身抗体,从而参与SLE发病。
[1] Funauchi M, Ikoma S, Enomoto H, et al. Decreased Th1-like and increased Th2-like cells in systemic lupus erythematosus[J]. Scand J Rheumatol, 1998,27(3):219-224.
[2] Richaud-Patin Y, Alcocer-Varela J, Llorente L. High levels of TH2 cytokine gene expression in systemic lupus erythematosus[J]. Rev Invest Clin, 1995,47(4):267-272.
[3] Li WX, Chen GM, Yuan H, et al. Polymorphisms of the TIM-1 and TIM-3 genes are not associated with systemic lupus erythematosus in a Chinese population[J]. Mutagenesis, 2011,26(4):507-511.
[4] Sanz I, Lee FE. B cells as therapeutic targets in SLE[J]. Nat Rev Rheumatol, 2010,6(6):326-337.
[5] Chen K, Xu W, Wilson M, et al. Immunoglobulin D enhances immune surveillance by activating antimicrobial, proinflammatory and B cell-stimulating programs in basophils[J]. Nat Immunol, 2009,10(8):889-898.
[6] Vishnevetsky D, Kiyanista VA, Gandhi PJ. CD40 ligand: a novel target in the fight against cardiovascular disease[J]. Ann Pharmacother, 2004,38(9):1500-1508.
[7] Yanagihara Y, Kajiwara K, Basaki Y, et al. Cultured basophils but not cultured mast cells induce human IgE synthesis in B cells after immunologic stimulation[J]. Clin Exp Immunol, 1998,111(1):136-143.
[8] Schneider E, Thieblemont N, De Moraes ML, et al. Basophils: new players in the cytokine network[J]. Eur Cytokine Netw, 2010,21(3):142-153.
[9] Javaloyes G, Goikoetxea MJ, Sanz ML, et al. Basophil activation test in the diagnosis of gadobutrol anaphylaxis[J]. Ann Allergy Asthma Immunol, 2012,108(4):286-287.
[10] Ben-Sasson SZ, Le Gros G, Conrad DH, et al. Cross-linking Fc receptors stimulate splenic non-B, non-T cells to secrete interleukin 4 and other lymphokines[J]. Proc Natl Acad Sci U S A, 1990,87(4):1421-1425.
[11] Perrigoue JG, Saenz SA, Siracusa MC, et al. MHC class II-dependent basophil-CD4+T cell interactions promote T(H)2 cytokine-dependent immunity[J]. Nat Immunol, 2009,10(7):697-705.
[12] Yoshimoto T, Yasuda K, Tanaka H, et al. Basophils contribute to T(H)2-IgE responses in vivo via IL-4 production and presentation of peptide-MHC class II complexes to CD4+T cells[J]. Nat Immunol, 2009,10(7):706-712.
[13] Sokol CL, Barton GM, Farr AG, et al. A mechanism for the initiation of allergen-induced T helper type 2 responses[J]. Nat Immunol, 2008,9(3):310-318.
[14] Charles N, Watford WT, Ramos HL, et al. Lyn kinase controls basophil GATA-3 transcription factor expression and induction of Th2 cell differentiation[J]. Immunity, 2009,30(4):533-543.
[15] Denzel A, Maus UA, Rodriguez Gomez M, et al. Basophils enhance immunological memory responses[J]. Nat Immunol, 2008,9(7):733-742.
[16] Charles N, Hardwick D, Daugas E, et al. Basophils and the T helper 2 environment can promote the development of lupus nephritis[J]. Nat Med, 2010,16(6):701-707.
[17] Chirumbolo S. State-of-the-art review about basophil research in immunology and allergy: is the time right to treat these cells with the respect they deserve [J]. Blood Transfus, 2012,10(2):148-164.
[18] Dijkstra D, Hennig C, Witte T, et al. Basophils from humans with systemic lupus erythematosus do not express MHC-Ⅱ[J]. Nat Med, 2012,18(4):488-489.
[19] Wimazal F, Ghannadan M, Muller MR, et al. Expression of homing receptors and related molecules on human mast cells and basophils: a comparative analysis using multi-color flow cytometry and toluidine blue/immunofluorescence staining techniques[J]. Tissue Antigens, 1999,54(5):499-507.
[20] Martin P, Ruiz SR, del Hoyo GM, et al. Dramatic increase in lymph node dendritic cell number during infection by the mouse mammary tumor virus occurs by a CD62L-dependent blood-borne DC recruitment[J]. Blood, 2002,99(4):1282-1288.
[21] Girard JP, Springer TA. High endothelial venules (HEVs): specialized endothelium for lymphocyte migration[J]. Immunol Today, 1995,16(9):449-457.
[22] Rodriguez Gomez M, Talke Y, Goebel N, et al. Basophils support the survival of plasma cells in mice[J]. J Immunol, 2010,185(12):7180-7185.
[23] MacLennan I, Vinuesa C. Dendritic cells, BAFF, and APRIL: innate players in adaptive antibody responses[J]. Immunity, 2002,17(3):235-238.
[24] Mackay F, Woodcock SA, Lawton P, et al. Mice transgenic for BAFF develop lymphocytic disorders along with autoimmune manifestations[J]. J Exp Med, 1999,190(11):1697-1710.
[25] Kaveri SV, Mouthon L, Bayry J. Basophils and nephritis in lupus[J]. N Engl J Med, 2010,363(11):1080-1082.
[26] Navarra SV, Guzman RM, Gallacher AE, et al. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial[J]. Lancet, 2011,377(9767):721-731.
Expression changes of CD62L, BAFF and CD40L in basophils of patients with systemic lupus erythematosus
FENGYongmin,CHENQiuping,HUANGLiutao,PANQingjun,LIUHuafeng
(AffiliatedHospitalofGuangdongMedicalUniversity,Zhanjiang524001,China)
Objective To investigate expression changes of lymph homing receptor (CD62L) and B-lymphocyte activation factors (BAFF and CD40L) in peripheral blood basophils of patients with active systemic lupus erythematosus (SLE) and their significance. Methods Fifty-seven SLE patients were selected and were divided into the active group (SLEDAI score≥10,n=29) and inactive group (SLEDAI score <10,n=28) according to the SLEDAI score. Twenty healthy volunteers were selected as the control group. The levels of CD62L, BAFF and CD40L in the peripheral blood basophils were detected by flow cytometry and their correlations with the Serum anti-dsDNA levels were analyzed by Spearman correlation analysis. Results The expression of CD62L in peripheral blood basophils of the active group and inactive group was higher than that of the control group, and the active group was significantly higher than the inactive group (P<0.05). The expression of BAFF and CD40L in peripheral blood basophils of the active group was significantly higher than that of the inactive group and control group (allP<0.05), while there was no significant difference between inactive group and control group (P>0.05). Expression of CD62L and CD40L in the peripheral blood basophils was positively correlated with serum anti-dsDNA levels in SLE patients (r=0.34,r=0.36; allP<0.05). The expression of BAFF in peripheral blood basophils was not related with serum anti-dsDNA levels in SLE patients (r=0.26,P=0.14). Conclusions Expression of CD62L, BAFF and CD40L in basophils of patients with active SLE increases. CD62L may mediate the basophils migrating to the secondary lymph organs where the basophils could activate the self-reactive B-lymphocytes producing diverse antibodies through BAFF and CD40L to participate in the pathogenesis of SLE.
systemic lupus erythematosus; basophil; CD62L; B-lymphocyte activation factors
国家自然科学基金资助项目(81202346);广东省自然科学基金项目(S2012040006216);广东省医学科学技术研究基金项目(A2015520)。
冯永民(1978-),男,硕士,副主任医师,主要研究方向为免疫性肾小球疾病发病机制。E-mail:fymcqp@163.com
刘华锋(1969-),男,博士,教授,博士生导师,主要研究方向为免疫性肾小球疾病发病机制。E-mail:hf-liu@263.net
10.3969/j.issn.1002-266X.2017.09.006
R593.24
A
1002-266X(2017)09-0020-04
2016-11-20)
