Burkholderia sp. JXJ16低温耐有机溶剂脂肪酶产酶条件优化及粗酶酶学性质
2017-03-14谢玉婷查代明石红璆张炳火李汉全
谢玉婷,查代明,石红璆,张炳火,李汉全
(九江学院药学与生命科学学院,江西九江 332000)

谢玉婷,查代明*,石红璆,张炳火,李汉全
(九江学院药学与生命科学学院,江西九江 332000)
以Burkholderiasp. JXJ-16为出发菌株,对其低温耐有机溶剂脂肪酶的产酶条件进行单因素实验并研究其粗酶酶学性质。该菌株的最佳产酶条件为:蔗糖3.75 g/L、尿素11.25 g/L、K2HPO42 g/L、(NH4)2SO41 g/L、MnSO40.25 g/L、猪油乳化液体积分数2.5%,初始pH9.0、培养温度30 ℃、装样量20 mL/250 mL、接种量3%、发酵时间20 h。JXJ-16脂肪酶粗酶对中链对硝基苯酚酯有最大水解活力,最适底物为对硝基苯酚辛酸酯;该粗酶在35 ℃、pH8.5~9.0时酶活力最高,且具有较好的温度(30~60 ℃)和pH(5.0~10.5)稳定性;Na+、Mg2+、Ca2+、Mn2+、EDTA对粗酶活力具有激活作用,Zn2+、Cu2+、Fe3+对粗酶活力具有抑制作用,K+对粗酶活力没有显著性影响;除乙醇和乙腈外,该粗酶在一定体积分数的异丙醇、甲醇、丙酮、乙酸乙酯、三氯甲烷、二甲苯和正己烷中具有良好耐受性,且处于激活状态。综上,该菌株能利用廉价易得的培养基原料达到最佳产酶效果,其所产脂肪酶为低温碱性脂肪酶,具有较好的温度和pH稳定性,对多数供试有机溶剂具有良好耐受性。
低温脂肪酶,伯克霍尔德属,有机溶剂耐受性
脂肪酶(triacylglycerol acylhydrolases,EC 3.1.1.3)属于α/β型水解酶超家族,在油水界面上能催化长链脂肪酸甘油酯水解为甘油和脂肪酸,而在有机相中的催化反应能极大地拓宽其应用,如酯化、转酯、醇解、氨解、酸解反应等,因而脂肪酶具有良好的有机溶剂耐受性对其应用非常有利[1-3]。与水相相比,脂肪酶在有机相中的催化反应一般来说表现出多种优势:更高的活性、稳定性、区域选择性和/或立体选择性;更好的底物溶解性和相对容易的产物回收;降低底物和/或产物的抑制程度;使反应平衡向合成方向移动[4]。因此,脂肪酶的有机相催化反应已被广泛应用于多个工业领域,比如食品、油脂、新型材料、精细化工、医药、生物能源等[5-6]。
大多数脂肪酶在有机溶剂中的稳定性很差,不能有效地发挥其催化功能[7],因此从自然界中筛选有机溶剂耐受性脂肪酶是当前和今后的热点方向之一。Fan等[8]利用宏基因组技术从油田土壤中克隆到一个脂肪酶基因,其表达产物具有较好的有机溶剂耐受性。李俊峰等[9]以苯作为选择压力,从花生地土壤中筛选出一株耐有机溶剂脂肪酶产生菌。Xie等[10]以二甲基亚砜和甲苯为选择压力筛选出一株有机溶剂耐受性菌株BurkholderiacepaciaRQ3,其分泌的脂肪酶具有广谱有机溶剂耐受性。伯克霍尔德属(Burkholderia)脂肪酶具有活性高、抗逆性好等优良特性,已被广泛应用于工业生产,比如药品生产、洗涤剂配方、有机合成、生物能源生产等[11-12]。本实验以Burkholderiasp. JXJ-16为出发菌株,对其脂肪酶的产酶条件以及粗酶酶学性质进行研究,旨在为进一步应用提供理论基础和技术指导。
1 材料与方法
1.1 材料与仪器
Burkholderiasp. JXJ-16 本实验室分离并保藏;对硝基苯酚酯(p-nitrophenyl esters,pNP酯)、Tris碱 美国Sigma公司;聚乙烯醇(PVA)、橄榄油、牛肉浸膏 国药集团化学试剂有限公司;其他植物油 中粮集团有限公司;蛋白胨、酵母提取物 安琪酵母股份有限公司;酵母浸膏 北京双旋微生物培养基制品厂;其他化学试剂 均为国产分析纯;LB平板培养基(g/L) 蛋白胨10、酵母提取物5、NaCl 10、琼脂条20,自然pH;种子培养基(g/L) 蛋白胨10、酵母提取物5、NaCl 10,自然pH;基础发酵培养基(g/L) 麦芽糖5、蛋白胨10、K2HPO42、(NH4)2SO41、MgSO40.5、橄榄油乳化液体积分数2%,pH7.0;橄榄油乳化液 橄榄油与体积分数2%的PVA按1∶3的比例混合,10000 r/min乳化10 min即可。
Sartorius电子天平、PB-10型pH计 赛多利斯科学仪器(北京)有限公司;XHF-D型高速分散器 宁波新芝生物科技有限公司;DHP-9162型电热恒温培养箱 上海一恒科学仪器有限公司;SKY-2112C型恒温培养摇床 上海苏坤实业有限公司;CT15RT型高速冷冻离心机 上海天美生化仪器设备工程有限公司;HH-4型数显恒温水浴锅 常州荣华仪器制造有限公司;UV-3200PC型紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 脂肪酶活力的测定 挑取LB平板培养基上的Burkholderiasp. JXJ-16单菌落,接种于种子培养基中,28 ℃、180 r/min培养20 h获得种子液,再以2%的接种量接种于发酵培养基中,28 ℃、180 r/min培养24 h;4 ℃、5000 r/min离心10 min,取上清液测定脂肪酶活力,其测定方法为基于pNP酯底物的分光光度法[4]。具体操作为:配制反应体系,包括1.45 mL Tris-HCl(50 mmol/L,pH8.0)和10 μLpNP酯(10 mmol/L);30 ℃预热5 min后,实验组加入40 μL脂肪酶样品,对照组加入等量的失活脂肪酶样品;30 ℃反应5 min后,冰上放置5 min终止反应;取适量反应液,410 nm下测量吸光值。
1.2.2 培养基的确定
1.2.2.1 碳源对产酶的影响 以基础发酵培养基为基础,分别加入等量的葡萄糖、蔗糖、乳糖、可溶性淀粉以代替麦芽糖进行发酵培养,测定酶活力以确定最佳碳源,不添加碳源设为对照组;添加不同量的最佳碳源(1.250、1.875、2.500、3.125、3.750、4.375 g/L),以确定最佳碳源添加量。
1.2.2.2 氮源对产酶的影响 以基础发酵培养基为基础,分别加入等量的NaNO3、牛肉浸膏、酵母浸膏、尿素以代替蛋白胨进行发酵培养,测定酶活力以确定最佳氮源,不添加氮源设为对照组;添加不同量的最佳氮源(7.50、8.75、10.00、11.25、12.50 g/L),以确定最佳氮源添加量。
1.2.2.3 诱导剂对菌株产酶的影响 以基础发酵培养基为基础,分别加入等量的菜籽油乳化液、猪油乳化液、玉米油乳化液、花生油乳化液以代替橄榄油乳化液作为诱导剂进行发酵培养,测定酶活力以确定最佳诱导剂,不添加诱导剂设为对照组;添加不同量的最佳诱导剂(2.00%、2.25%、2.50%、2.75%、3.00%),以确定最佳诱导剂添加量。
1.2.2.4 金属离子对产酶的影响 以基础发酵培养基为基础,分别加入等量的CuSO4、CaSO4、FeSO4、MnSO4以代替MgSO4进行发酵培养,测定酶活力以确定金属离子对产酶的影响,不添加金属离子设为对照组;添加不同量的最佳金属离子(0.1250、0.1875、0.2500、0.3125、0.3750 g/L),以确定最佳金属离子添加量。
1.2.3 发酵条件的确定 采用优化后的发酵培养基,以初始发酵条件(初始pH7.0、培养温度28 ℃、装样量20 mL/250 mL、接种量2%、发酵时间24 h)为基础,按照以下操作分别优化初始pH、培养温度、装样量、接种量和发酵时间,以确定发酵条件。
1.2.3.1 初始pH对产酶的影响 将发酵培养基的初始pH设置为4、5、6、7、8、9、10七个梯度,发酵培养后测定酶活力,以确定最佳产酶pH。
1.2.3.2 培养温度对产酶的影响 种子液接种于发酵培养基中后,分别选定15、20、25、30、35 ℃五个温度梯度进行发酵培养,测定酶活力以确定最佳产酶温度。
1.2.3.3 装样量对产酶的影响 250 mL三角瓶中分别装有10、20、30、40 mL培养基进行发酵培养,测定酶活力以确定产酶的最佳装样量。
1.2.3.4 接种量对产酶的影响 种子液分别以0.5%、1%、2%、3%、4%、5%的接种量接种于发酵培养基中,发酵培养后测定酶活力,以确定产酶的最佳接种量。
1.2.3.5 发酵时间曲线的确定 种子液分别接种于7瓶发酵培养基中同时进行培养,每隔4 h取发酵液进行酶活力测定,以确定发酵时间曲线。
1.2.4 粗酶酶学性质研究
1.2.4.1 底物特异性 以对硝基苯酚乙酸酯(C2)、对硝基苯酚丁酸酯(C4)、对硝基苯酚辛酸酯(C8)、对硝基苯酚葵酸酯(C10)、对硝基苯酚月桂酸酯(C12)、对硝基苯酚豆蔻酸酯(C14)和对硝基苯酚棕榈酸酯(C16)为底物分别测定酶活力,最高酶活力设为100%。
1.2.4.2 温度对酶活力的影响 在50 mmol/L Tris-HCl缓冲液(pH8.0)中测定不同反应温度(15~45 ℃)下的酶活力,最高酶活力设为100%。粗酶样品在不同温度(30~60 ℃)下温浴1 h,测定残余酶活力以确定温度稳定性,处理前的酶活力设为100%。
1.2.4.3 pH对酶活力的影响 在50 mmol/L Na2HPO4-柠檬酸缓冲液(pH5.0~8.0)和50 mmol/L Tris-HCl缓冲液(pH8.0~10.5)中测定不同反应pH下的酶活力,最高酶活力设为100%。在不同pH缓冲液中,28 ℃水浴处理1 h,测定残余酶活力以确定pH稳定性,pH7.0时的残余酶活力设为100%。
1.2.4.4 金属离子和EDTA对酶活力的影响 粗酶样品中分别加入终浓度为10 mmol/L的金属离子(Na+、K+、Ca2+、Mg2+、Mn2+、Cu2+、Zn2+和Fe3+)和EDTA,加入等量双蒸水的粗酶样品设为对照,28 ℃摇床处理1 h,测定残余酶活力,对照组的酶活力设为100%。
1.2.4.5 有机溶剂对酶活力的影响 粗酶样品中分别加入有机溶剂(甲醇、乙醇、异丙醇、乙酸乙酯、二甲苯、乙腈、丙酮、三氯甲烷和正己烷),有机溶剂的体积分数设置三个水平,分别为10%、30%、50%,加入等量双蒸水的粗酶样品设为对照,28 ℃摇床处理1 h,测定残余酶活力,对照组的酶活力设为100%。
1.2.5 统计学分析 实验数据来自三次独立重复实验,以平均数±标准差表示。
2 结果与分析
2.1 产酶条件的确定
2.1.1 培养基的确定
2.1.1.1 碳源对产酶的影响 由图1A可知,供试碳源对菌株JXJ-16产酶的影响较小;蔗糖和麦芽糖对菌株产酶具有促进作用,但是它们的影响没有显著性;葡萄糖、乳糖和可溶性淀粉不同程度地抑制菌株产酶,其中葡萄糖对产酶没有显著性影响。因此,选择相对廉价的蔗糖作为菌株产酶的最适碳源。由图1B可知,蔗糖加入量为3.75 g/L时,菌株的产酶活力最强,因此选择该浓度为蔗糖的最适加入量。

图1 碳源(A)及蔗糖加入量(B)对菌株JXJ-16产脂肪酶的影响Fig.1 Effects of carbon sources(A)and sucrose concentration(B)on lipase production of strain JXJ-16
2.1.1.2 氮源对产酶的影响 由图2A可知,供试氮源对菌株JXJ-16产酶的影响非常显著,其中尿素对菌株产酶的促进作用最强,其次是酵母浸膏、蛋白胨和牛肉浸膏,而NaNO3对菌株产酶具有抑制作用,但是其影响没有显著性。由图2B可知,尿素加入量为11.25 g/L时,菌株的产酶活力最强,因此选择该浓度为尿素的最适加入量。
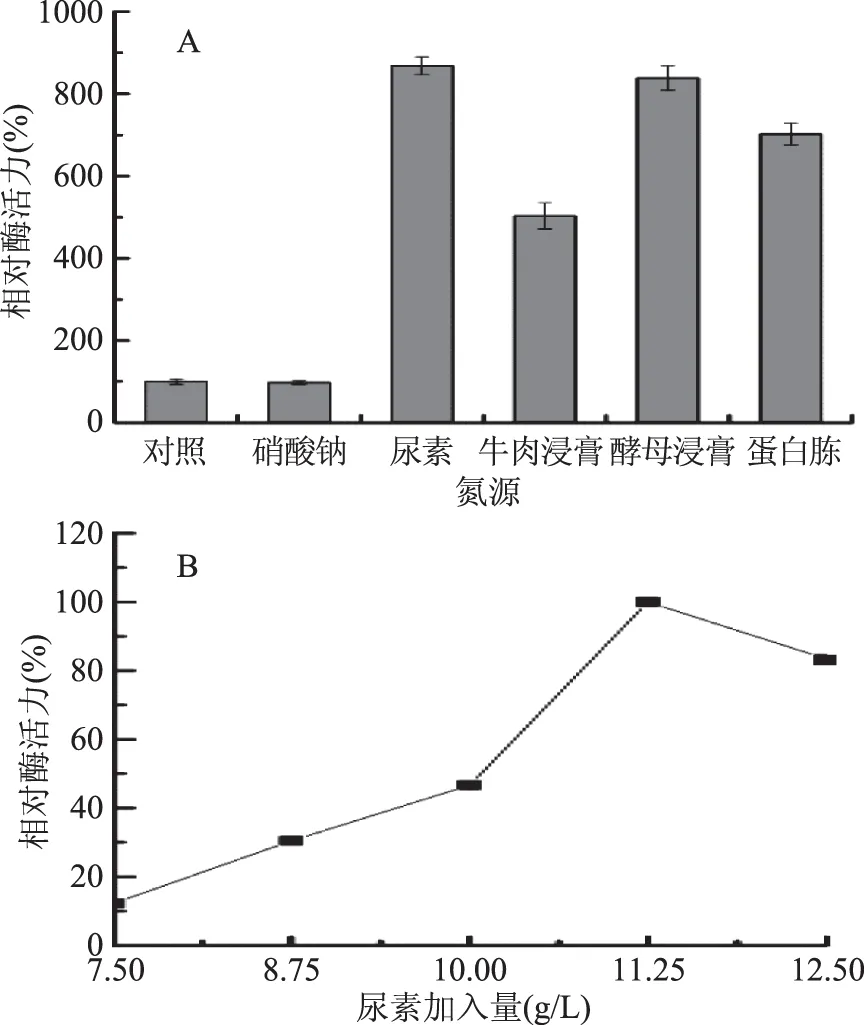
图2 氮源(A)及尿素加入量(B)对菌株JXJ-16产脂肪酶的影响Fig.2 Effects of nitrogen sources(A)and urea concentration(B)on lipase production of strain JXJ-16
2.1.1.3 诱导物对产酶的影响 由图3A可知,供试油脂乳化液作为诱导物对菌株JXJ-16产酶均具有显著性促进作用,其中菜籽油的诱导效果最好,其次是橄榄油、花生油、猪油和玉米油,表明该菌株以诱导型方式表达脂肪酶。菜籽油、橄榄油、花生油和猪油之间的诱导效果没有显著性差异,因此选择廉价易得的猪油作为菌株产酶的最适诱导物。由图3B可知,猪油乳化液加入量为体积分数2.5%时,菌株的产酶活力最强,因此选择该体积分数为猪油乳化液的最适加入量。
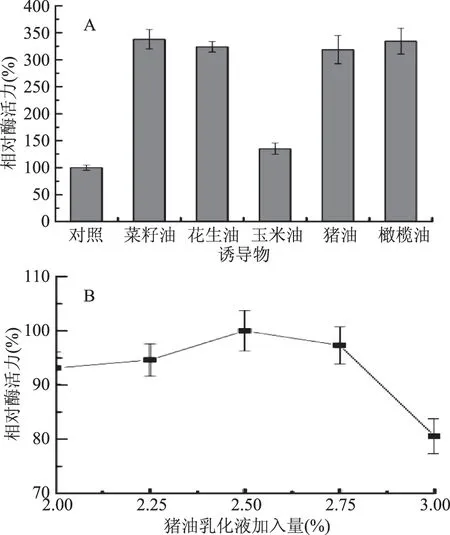
图3 诱导物(A)及猪油乳化液加入量(B)对菌株JXJ-16产脂肪酶的影响Fig.3 Effects of inducers(A)and lard emulsion concentration(B)on lipase production of strain JXJ-16
2.1.1.4 金属离子对产酶的影响 由图4A可知,供试金属离子对菌株JXJ-16产酶具有不同的影响,除Cu2+显著性抑制菌株产酶外,其他4种金属离子对菌株产酶均没有显著性影响,其中Mg2+、Fe2+和Mn2+有促进作用,而Ca2+有抑制作用。由图4B可知,MnSO4加入量为0.25 g/L时,菌株的产酶活力最强,因此选择该浓度为MnSO4的最适加入量。
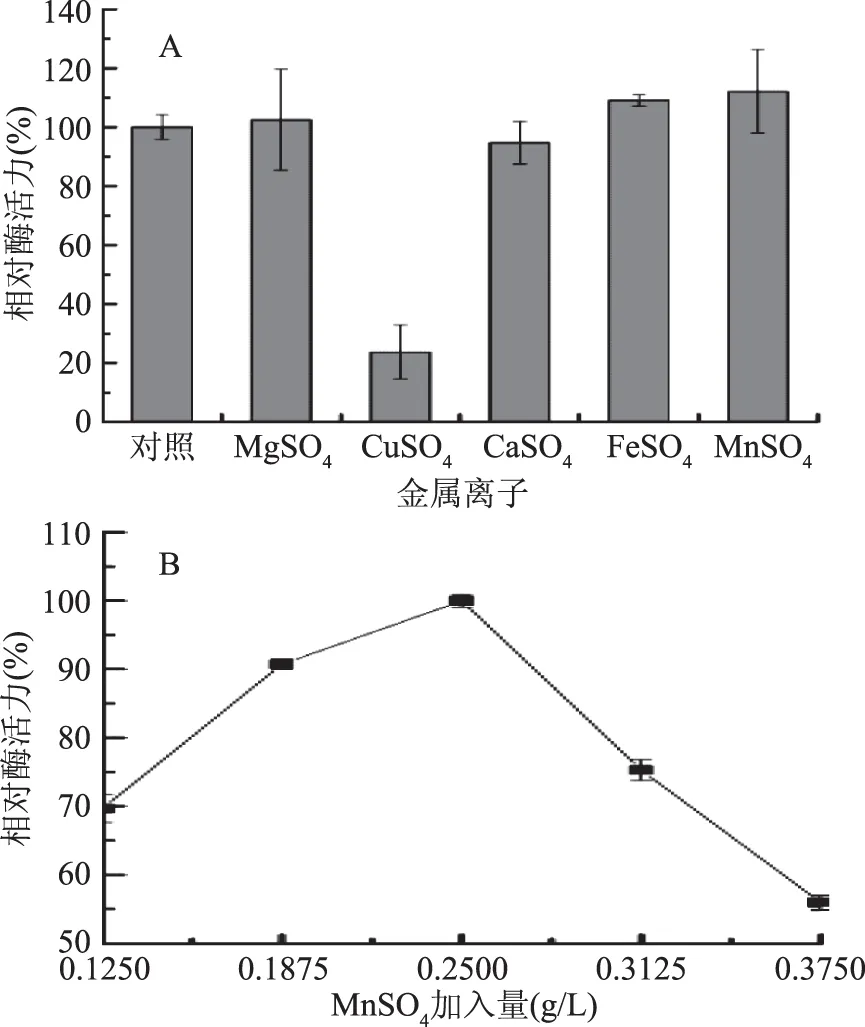
图4 金属离子(A)及MnSO4加入量(B)对菌株JXJ-16产脂肪酶的影响Fig.4 Effects of metal ions(A)and MnSO4 concentration(B) on lipase production of strain JXJ-16
2.1.2 发酵条件的确定 培养基初始pH、培养温度、摇瓶装样量、菌种接种量和发酵时间对菌株JXJ-16产酶具有较大影响(图5)。
由图5A可知,菌株JXJ-16在初始pH为5.0~10.0的发酵培养基中具有较强的产酶活力,其中最佳产酶pH为9.0,而在初始pH为4.0的发酵培养基中几乎没有产酶活力。
由图5B可知,培养温度对菌株JXJ-16产酶的影响非常显著,随着温度升高,菌株产酶活力逐渐增强,30 ℃时达到最佳,随后迅速下降。
由图5C可知,250 mL三角瓶装样量为10 mL时,菌株JXJ-16产酶活力最强,随着装样量增加,菌株产酶活力逐渐下降。由于10 mL与20 mL时的酶活力没有显著性差异,因此选择20 mL作为最佳装样量。
由图5D可知,接种量是影响菌株JXJ-16产酶的关键因素之一,随着接种量加大,菌株产酶活力逐渐增强,接种量为3%时达到最大,随后略微下降。
由图5E可知,菌株JXJ-16从培养8 h后开始逐渐增强产酶活力,培养16 h达到峰值,随后略微下降。培养20 h的酶活力与培养16 h相比没有显著性差异,因此选择培养20 h作为最佳发酵时间。
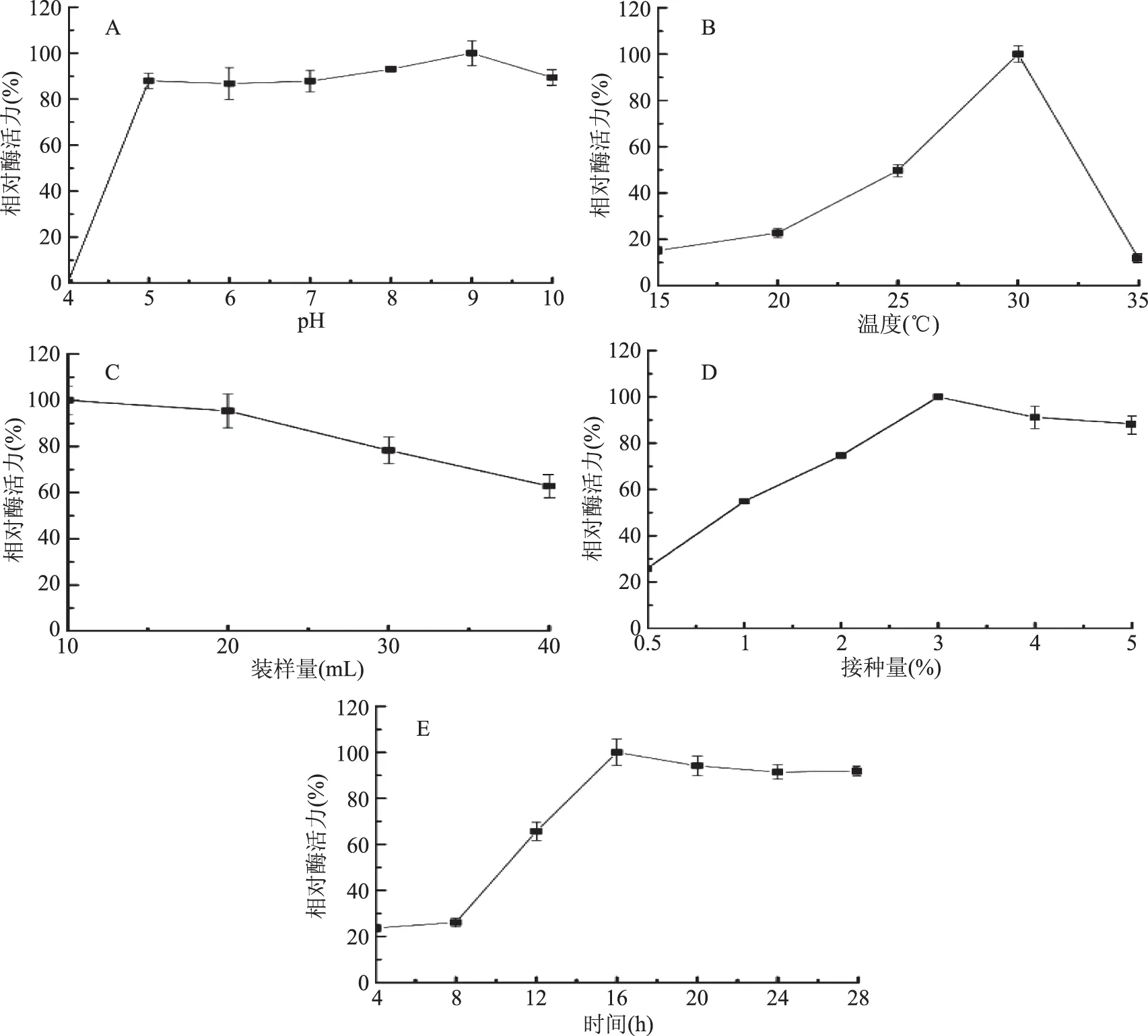
图5 发酵条件对菌株JXJ-16产脂肪酶的影响Fig.5 Effects of fermentation conditions on lipase production of strain JXJ-16
2.2 粗酶酶学性质研究
2.2.1 底物特异性 由图6可知,JXJ-16脂肪酶粗酶对中链pNP酯有最大水解活力,其最适底物为C8对硝基苯酚辛酸酯,其次为C10对硝基苯酚葵酸酯、C12对硝基苯酚月桂酸酯、C4对硝基苯酚丁酸酯、C14对硝基苯酚豆蔻酸酯、C2对硝基苯酚乙酸酯和C16对硝基苯酚棕榈酸酯。
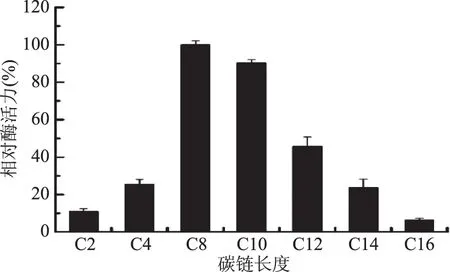
图6 JXJ-16脂肪酶粗酶的底物特异性Fig.6 Substrate specificity of crude lipasefrom strain JXJ-16
2.2.2 温度对酶活力的影响 由图7A可知,JXJ-16脂肪酶粗酶的最适反应温度为35 ℃,15~45 ℃时其酶活力保持在75%以上。由图7B可知,30~60 ℃下温浴1 h后,其残余酶活力均保持在80%以上,其中30 ℃下处理1 h对酶活力没有显著性影响。低温酶的最适反应温度一般低于40 ℃,且通常具有一定的温度稳定性[13]。因此,JXJ-16脂肪酶属于低温脂肪酶,且具有较好的温度稳定性,这一特性非常有利于脂肪酶应用于生物转化领域,特别是食品加工领域[14]。
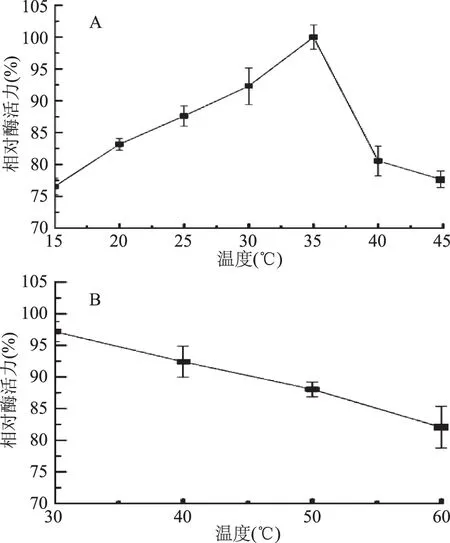
图7 温度对JXJ-16脂肪酶粗酶活力(A)和稳定性(B)的影响Fig.7 Effects of temperature on the activity(A) and the stability(B)of crude lipase from strain JXJ-16
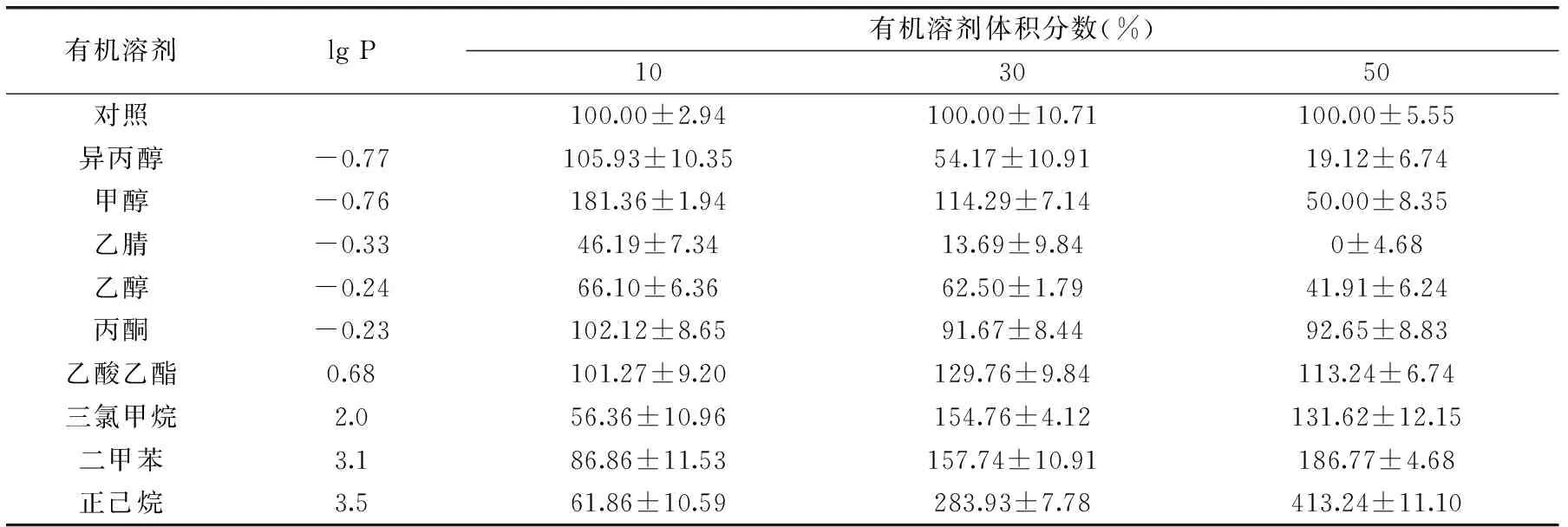
表1 有机溶剂对JXJ-16脂肪酶粗酶活力(%)的影响Table 1 Effects of organic solvents on the activity of crude lipase(%)from strain JXJ-16
2.2.3 pH对酶活力的影响 由图8A可知,JXJ-16脂肪酶粗酶的最适反应pH为8.5~9.0,pH8.0~10.0时其酶活力保持在60%以上,pH低于8.0或高于10.0时其酶活力急剧下降。不同pH缓冲液(5.0~10.5)中30 ℃处理1 h后,残余酶活力均保持在75%以上(图8B)。可见,JXJ-16脂肪酶为低温碱性脂肪酶,且具有较好的pH稳定性。
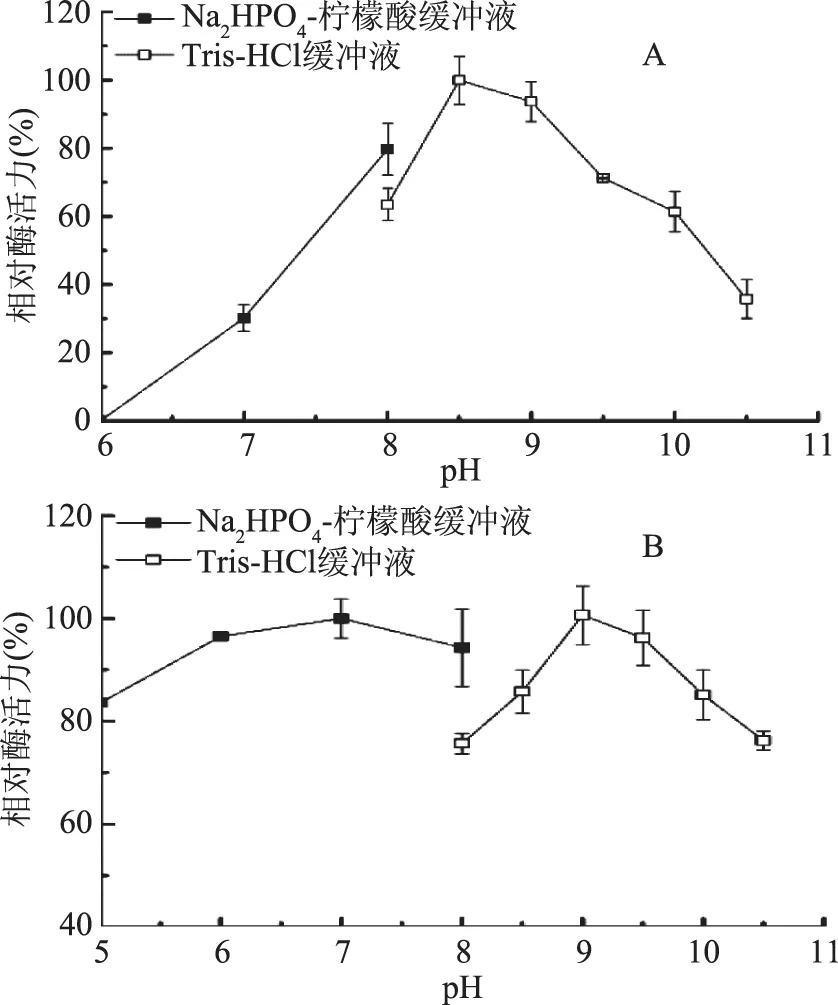
图8 pH对JXJ-16脂肪酶粗酶活力(A)和稳定性(B)的影响Fig.8 Effects of pH on the activity(A) and the stability(B)of crude lipase from strain JXJ-16
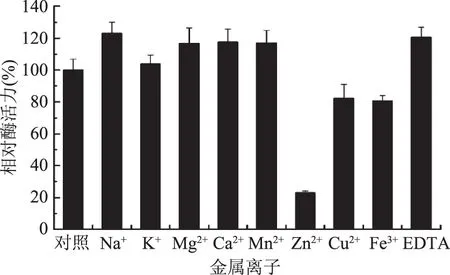
图9 金属离子和EDTA对JXJ-16脂肪酶粗酶活力的影响Fig.9 Effects of metal ions and EDTA on the activity of crude lipase from strain JXJ-16
2.2.4 金属离子和EDTA对酶活力的影响 由图9可知,供试金属离子和EDTA对JXJ-16脂肪酶粗酶活力具有不同的影响,Na+、Mg2+、Ca2+、Mn2+、EDTA显著性激活粗酶活力,Zn2+、Cu2+、Fe3+显著性抑制粗酶活力,K+对粗酶活力没有显著性影响。可见,JXJ-16脂肪酶发挥催化作用不需要金属离子的参与,因此其不属于金属酶。Mg2+、Ca2+、Mn2+的激活作用可能是由于它们与脂肪酸形成不溶性盐而避免了产物的抑制作用[7]。
2.2.5 有机溶剂对酶活力的影响 由表1可知,有机溶剂对JXJ-16脂肪酶粗酶活力的影响与其lg P值有关。当lg P<0时,粗酶活力随着有机溶剂体积分数的增大而降低,粗酶溶液在丙酮(10%~50%)、甲醇(10%~30%)和异丙醇(10%)中具有良好的耐受性,但是在乙醇(10%~50%)和乙腈(10%~50%)中其活力急剧下降甚至丧失。当0
3 结论
通过单因素分析,对影响菌株Burkholderiasp. JXJ-16产脂肪酶的发酵条件和培养基成分进行了单因素实验,最佳产酶培养基为:蔗糖3.75 g/L、尿素11.25 g/L、K2HPO42 g/L、(NH4)2SO41 g/L、MnSO40.25 g/L、猪油乳化液体积分数2.5%。其最佳产酶发酵条件为:初始pH9、培养温度30 ℃、装样量20 mL/250 mL、接种量3%、发酵时间20 h。总之,该菌株能够利用蔗糖、尿素和猪油等廉价易得的培养基原料达到最佳产酶效果。
从底物、温度、pH、金属离子、EDTA、有机溶剂等方面研究了Burkholderiasp. JXJ-16所产脂肪酶粗酶的酶学性质,其特异性水解中链pNP酯,最适底物为对硝基苯酚辛酸酯;在35 ℃、pH8.5~9.0时酶活力最高,且在温度(30~60 ℃)和pH(5.0~10.5)具有较好的稳定性;Na+、Mg2+、Ca2+、Mn2+、EDTA对酶活力具有激活作用,Zn2+、Cu2+、Fe3+对酶活力具有抑制作用,K+对酶活力没有显著性影响;除乙醇和乙腈外,粗酶在一定体积分数的异丙醇、甲醇、丙酮、乙酸乙酯、三氯甲烷、二甲苯和正己烷中具有良好耐受性,且处于激活状态。总之,JXJ-16脂肪酶为低温碱性脂肪酶,具有较好的温度和pH稳定性,对多数供试有机溶剂具有良好耐受性。
[1]Peng R,Lin J,Wei D. Purification and characterization of an organic solvent-tolerant lipase fromPseudomonasaeruginosaCS-2[J]. Applied Biochemistry and Biotechnology,2010,162(3):733-743.
[2]查代明,闫云君. 细菌脂肪酶基因表达调控的研究进展[J]. 微生物学报,2015,55(11):1378-1384.
[3]查代明,张炳火,李汉全,等. 假单胞菌属脂肪酶的分子生物学研究进展[J]. 中国生物工程杂志,2015,35(9):114-121.
[4]Zha D,Xu L,Zhang H,et al. Molecular identification of lipase LipA fromPseudomonasprotegensPf-5 and characterization of two whole-cell biocatalysts Pf-5 and Top10lipA[J]. Journal of Microbiology and Biotechnology,2014,24(5):619-628.
[5]Jaeger K E,Eggert T. Lipases for biotechnology[J]. Current Opinion in Biotechnology,2002,13(4):390-397.
[6]Hasan F,Shah A A,Hameed A. Industrial applications of microbial lipases[J]. Enzyme and Microbial Technology,2006,39(2):235-251.
[7]Khan M,Jithesh K. Expression and purification of organic solvent stable lipase from soil metagenomic library[J]. World Journal of Microbiology and Biotechnology,2012,28(6):2417-2424.
[8]Fan X,Liu X,Wang K,et al. Highly soluble expression and molecular characterization of an organic solvent-stable and thermotolerant lipase originating from the metagenome[J]. Journal of Molecular Catalysis B:Enzymatic,2011,72(3):319-326.
[9]李俊峰,李红芳,段效辉,等. 耐有机溶剂脂肪酶产生菌的筛选及其粗酶酶学性质[J]. 食品科学,2012(3):116-120.
[10]Xie C,Wu B,Song Q,et al. A lipase with broad solvent stability fromBurkholderiacepaciaRQ3:isolation,characteristics and application for chiral resolution of 1-phenylethanol[J].Bioprocess and Biosystems Engineering,2015,39(1):1-8.
[11]于玉凤,陆兆新,汪瑾,等. 高效产脂肪酶菌株BurkholderiacepaciaC1产酶条件优化[J]. 食品科学,2010,31(17):218-223.
[12]Yang W,He Y,Xu L,et al. A new extracellular thermo-solvent-stable lipase fromBurkholderiaubonensisSL-4:Identification,characterization and application for biodiesel production[J]. Journal of Molecular Catalysis B:Enzymatic,2016,126:76-89.
[13]Nichols D,Bowman J,Sanderson K,et al. Developments with Antarctic microorganisms:culture collections,bioactivity screening,taxonomy,PUFA production and cold-adapted enzymes[J]. Current Opinion in Biotechnology,1999,10(3):240-246.
[14]梁秋艳. 低温脂肪酶产生菌株的筛选,发酵条件优化及其酶学性质研究[D]. 石河子:石河子大学,2014:7-9.
[15]Shu Z,Wu J,Cheng L,et al. Production and characteristics of the whole-cell lipase from organic solvent tolerantBurkholderiasp. ZYB002[J]. Applied Biochemistry and Biotechnology,2012,166(3):536-548.
[16]Yao C,Cao Y,Wu S,et al. An organic solvent and thermally stable lipase fromBurkholderiaambifariaYCJ01:Purification,characteristics and application for chiral resolution of mandelic acid[J]. Journal of Molecular Catalysis B:Enzymatic,2013,85-86:105-110.
[17]Xie C,Wu B,Qin S,et al. A lipase with broad solvent stability fromBurkholderiacepaciaRQ3:isolation,characteristics and application for chiral resolution of 1-phenylethanol[J]. Bioprocess and Biosystems Engineering,2016,39(1):59-66.
[18]Kim K R,Kwon D Y,Yoon S H,et al. Purification,refolding,and characterization of recombinantPseudomonasfluorescenslipase[J]. Protein Expression and Purification,2005,39(1):124-129.
[19]Zheng X,Chu X,Zhang W,et al. A novel cold-adapted lipase fromAcinetobactersp. XMZ-26:gene cloning and characterisation[J]. Applied Microbiology and Biotechnology,2011,90(3):971-980.
Optimization of enzyme production conditions and enzymatic properties of cold-adapted and organic solvent-tolerant lipase fromBurkholderiasp. JXJ-16
XIE Yu-ting,ZHA Dai-ming*,SHI Hong-qiu,ZHANG Bing-huo,LI Han-quan
(School of Pharmacy and Life Sciences,Jiujiang University,Jiujiang 332000,China)
Enzyme production conditions forBurkholderiasp. JXJ-16 producing cold-adapted and organic solvent-tolerant lipase were optimized by signal factor analysis to maximize lipase production. A maximum lipase production was obtained after 20 h fermentation of 20 mL of medium containing sucrose 3.75 g/L,urea 11.25 g/L,K2HPO42 g/L,(NH4)2SO41 g/L,MnSO40.25 g/L,and lard emulsion 2.5%(v/v)at an initial pH9.0 in 250 mL Erlenmeyer flask with 3% inoculum at 30 ℃. The crude JXJ-16 lipase preferentially catalyzed thep-nitrophenyl esters of different fatty acids with medium chains,and its best substrate wasp-nitrophenyl caprylate. The optimal reaction temperature for the crude lipase was 35 ℃,and it remained better stability at temperatures ranging from 30 to 60 ℃. The optimum hydrolytic activity of the crude lipase was observed at pH8.5 to 9.0,and it exhibited better stability at pH5.0 to 10.5. The activity of the crude lipase was activated by Na+,Mg2+,Ca2+,Mn2+,and EDTA,respectively,whereas inhibited by Zn2+,Cu2+and Fe3+,respectively. Moreover,K+had no remarkable effect on its activity. The crude lipase had high tolerance and enhanced activity in the presence of different concentration of isopropyl alcohol,methanol,acetone,ethyl acetate,chloroform,benzene,and n-hexane,respectively,except ethanol and acetonitrile. In a word,the strain JXJ-16 could utilize cheap raw materials as a fermentation medium to achieve the optimal lipase production,and its cold-adapted alkaline lipase had better temperature and pH stability and showed high tolerance to most of the tested organic solvents.
cold-adapted lipase;Burkholderia;organic solvent tolerance
2016-07-05
谢玉婷(1995-),女,大学本科,研究方向:微生物脂肪酶资源,E-mail:retar1995xyt@163.com。
*通讯作者:查代明(1985-),男,博士,研究方向:微生物脂肪酶资源及基因表达调控,E-mail:dmzha2015@126.com。
九江学院博士启动基金(8879416)。
TS201.3
A
:1002-0306(2017)04-0207-07
10.13386/j.issn1002-0306.2017.04.031
