寨卡病毒E蛋白在重组杆状病毒中的表达
2017-03-10高寒春姚立红王超郑丽舒
高寒春 姚立红 王超 郑丽舒
100052北京,中国疾病预防控制中心病毒病预防控制所高寒春、姚立红对本文同等贡献
寨卡病毒(Zika virus,ZIKV)是一种由蚊子传播的虫媒病病毒,可以导致新生儿“小头症”。该病毒于1947年最早发现于乌干达寨卡丛林的恒河猴体内,1956年研究者通过喂食小鼠和猴子感染ZIKV的伊蚊,成功地复制了ZIKV的感染[1],1952年第一次从人体分离出来[2-3]。
ZIKV属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),有包膜的球状病毒,直径40~70 nm。基因组长度约10.8 kb,为单股正链RNA[4]。只有一个开放阅读框(ORF),编码一个多聚蛋白。多聚蛋白在宿主细胞内表达后,剪切加工成3个结构蛋白,即衣壳蛋白(Capsid protein,C)、膜蛋白前体/膜蛋白(Premembrane/Membrane protein,prM/M)和包膜蛋白(Envelope protein,E),以及7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)[5]。其中E蛋白与病毒进入、组装和出芽相关[6]。
杆状病毒载体表达系统(BEVS)是当今基因工程领域4大表达系统之一,安全性高,外源基因克隆容量大,重组病毒易于筛选,不但具备翻译后加工修饰系统还有高效表达外源基因的能力[7-8]。本研究采用BEVS成功表达了ZIKV E蛋白,为ZIKV E蛋白功能研究及疫苗研发奠定了基础。
1 材料与方法
1.1细胞及表达载体sf9细胞和pFastBacl表达载体由本科室保存。
1.2主要试剂基因组DNA提取试剂购自Qiagen公司;蛋白质Marker购自Fermentas公司;MAX Efficiency DH10BacTM 感受态细胞,PureLinkTM HiPure Plasmid Miniprep Kit,CellfectinⅡ转染试剂,昆虫细胞培养基sf900-Ⅱ SFM均购自Invitrogen公司;ZIKV E蛋白兔血清抗体,HRP标记的山羊抗兔IgG均由北京生物制品所赠送;FITC标记的羊抗鼠IgG 购自北京中杉金桥生物技术有限公司。
1.3重组杆状病毒转移载体的构建根据sf9昆虫细胞密码子使用偏性,参考GenBank中ZIKV E蛋白的基因序列,在不改变氨基酸序列的前提下由Invitrogen 公司进行优化合成,序列两端分别添加BamHI和EcoRI限制性酶切位点。将优化合成的目的片段与pFastBac1载体连接、转化,提取质粒,经BamHI和EcoRI双酶切鉴定,并送Invitrogen公司测序。将鉴定正确的质粒命名为pFB1-E。
1.4重组杆状病毒骨架质粒的构建转移载体pFB1-E 转化感受细态胞DH10Bac,经抗生素和蓝白斑筛选,挑取阳性克隆,采用通用引物M13F和M13R进行PCR鉴定。反应条件为:95 ℃ 5 min;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 5 min,30 cycle;72 ℃ 10 min。鉴定正确的重组杆状病毒骨架质粒命名为rBacmid-E。以pFB1转化DH10Bac得到质粒rBacmid-N为空白对照。
1.5重组杆状病毒的包装及滴度测定将rBacmid-E和rBacmid-N分别转染sf9细胞,阴性对照为不含质粒的等量转染试剂,镜下观察。细胞7 d后明显病变,收集细胞经3次反复冻融,离心后上清为P1代重组杆状病毒,命名为rBac-E-P1。rBac-E-P1按MOI=0.1感染对数生长期的sf9细胞,出现明显细胞病变时得到P2代病毒,命名为rBac-E-P2,同法获得P3代病毒。rBacmid-N转染sf9 细胞重组病毒rBac-N为空白对照。噬斑形成法,检测重组病毒rBac-E-P3病毒滴度。
1.6检测重组杆状病毒E基因插入感染rBac-E和rBac-N的sf9细胞的病毒基因组为模板,M13F、M13R为引物进行PCR,反应条件同前,产物经1%琼脂糖凝胶电泳鉴定。
1.7E蛋白检测
1.7.1 间接免疫荧光检测:rBac-N 和rBac-E分别感染96 孔板中sf9 细胞,72 h后,甲醇固定细胞,一抗为鼠ZIKV E蛋白单克隆抗体(1∶500稀释),二抗为FITC 标记的山羊抗鼠IgG(1∶200稀释),显微镜下观察荧光。
1.7.2 Western blot检测:rBac-N和rBac-E分别感染sf9 细胞3 d,反复冻融细胞3次,离心,弃上清,200 μl PBS 重悬沉淀,取20 μl上样,经SDS-PAGE后,电转至硝酸纤维素膜上,5%脱脂奶封闭过夜,一抗为ZIKV E蛋白兔抗血清(1∶500稀释),二抗为HRP 标记的山羊抗兔IgG(1∶5 000稀释),TMB显色。
2 结果
2.1转移载体的鉴定转移载体质粒pFB1-E经BamHI和EcoRI双酶切鉴定,可见1 518 bp的E基因片段,大小与预期相符。测序结果与E基因序列同源性为100%。
2.2重组杆状病毒骨架质粒的鉴定rBacmid-E和Rbacmid-N的PCR产物经1%琼脂糖凝胶电泳鉴定,基因片段大小3 830 bp(2 300 bp+1 530 bp)和2 300 bp符合预期,Bacmid质粒上成功整合E基因。
2.3重组杆状病毒的包装及病毒滴度转染3 d后,显微镜下观察可见,与阴性对照相比,rBacmid-N、rBacmid-E转染的sf9细胞变大、变圆,细胞间距增大;7 d后,大部分细胞破碎脱落,见图1。经噬斑形成法检测,第3代重组病毒rBac-E-P3滴度为2.58×105pfu/ml。
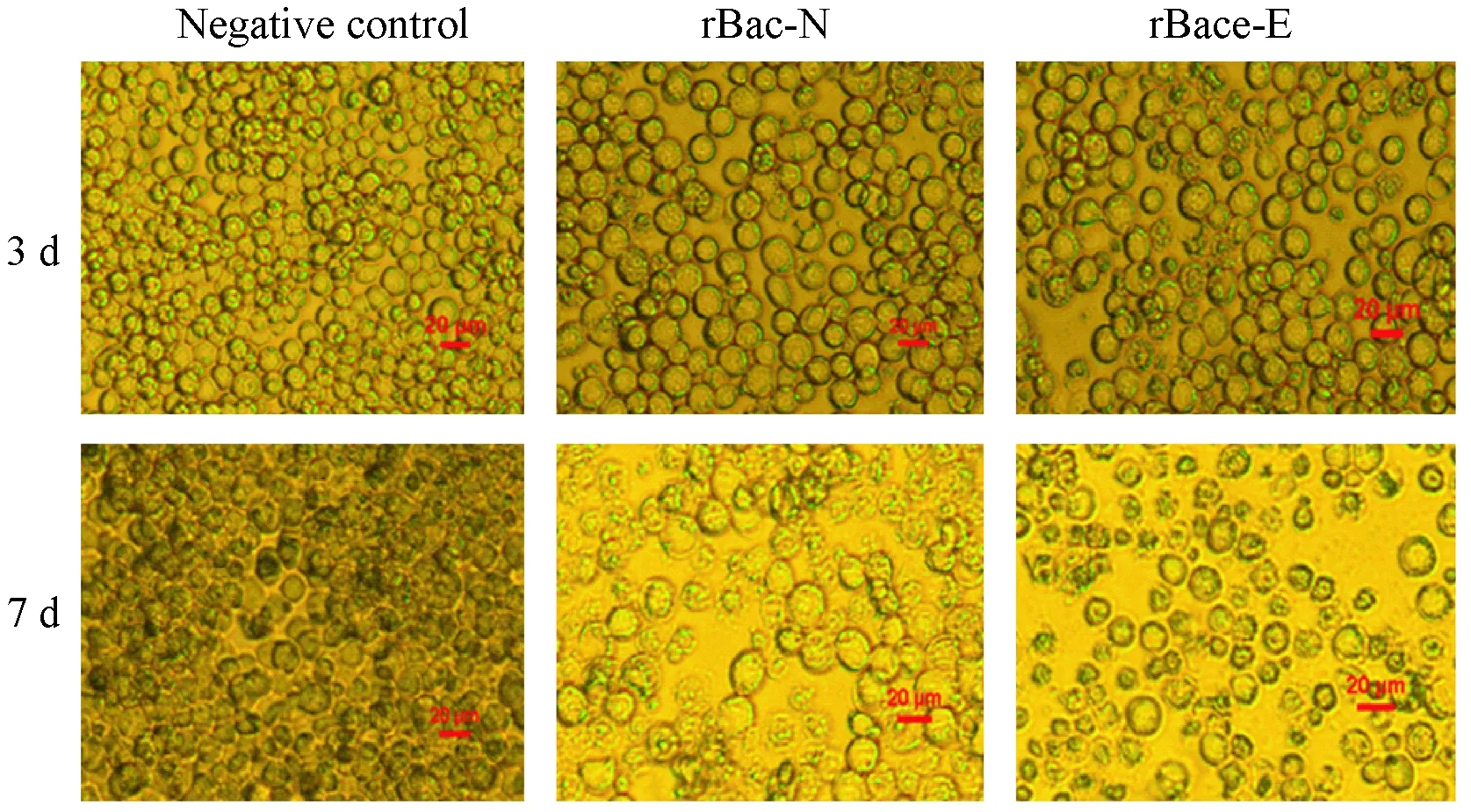
图1 转染后sf9细胞病变效应(100×)Fig.1 Cytopathic effect of transfected sf9 cells(100×)
2.4重组杆状病毒E基因插入提取感染rBac-N、rBac-E 的sf9细胞上清中病毒基因组DNA,以M13F、M13R为引物经PCR扩增鉴定,产物大小与预期一致,分别为2 300 bp和3 830 bp,见图2,成功得到ZIKV E基因重组杆状病毒,命名为rBac-E。
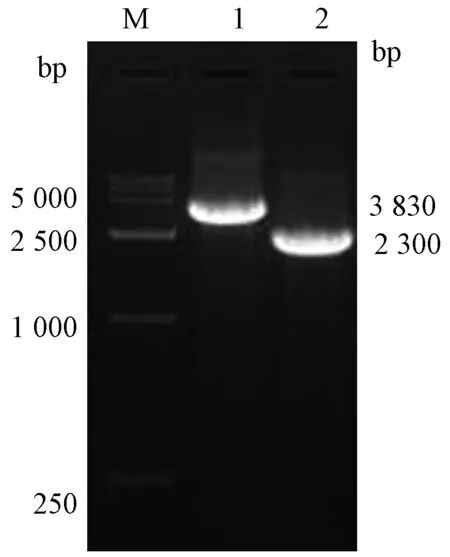
注:M,DNA marker DL15000;1,rBacmid-E基因的PCR产物; 2,rBacmid-N基因的PCR 产物图2 重组杆状病毒E基因的PCR 鉴定Note: M,DNA marker DL15000; 1,PCR product of rBacmid-E;2, PCR product of rBacmid-NFig.2 Identification of E gene of rBac-E by PCR
2.5E蛋白的表达
2.5.1 间接免疫荧光检测:有强烈的绿色荧光出现的是感染rBac-E的sf9细胞,而感染rBac-N的阴性对照无荧光,见图3。说明sf9细胞经重组杆状病毒rBac-E感染后,ZIKV的E蛋白被成功表达。

注:A, rBac-N 感染的sf9 细胞;B, rBac-E 感染的sf9 细胞;图3 间接免疫荧光检测E 蛋白的表达Note: A, sf9 cell infectioned by rBac-N; B, sf9 cell infectioned by rBac-EFig.3 IFA of expression of E protein
2.5.2 Western blot检测:感染rBac-N的sf9细胞裂解上清中未见特异性条带,感染rBac-E的sf9细胞裂解上清在相对分子质量55×103处有特异性反应条带出现,见图4。说明E蛋白在rBac-E感染的sf9细胞中成功表达。
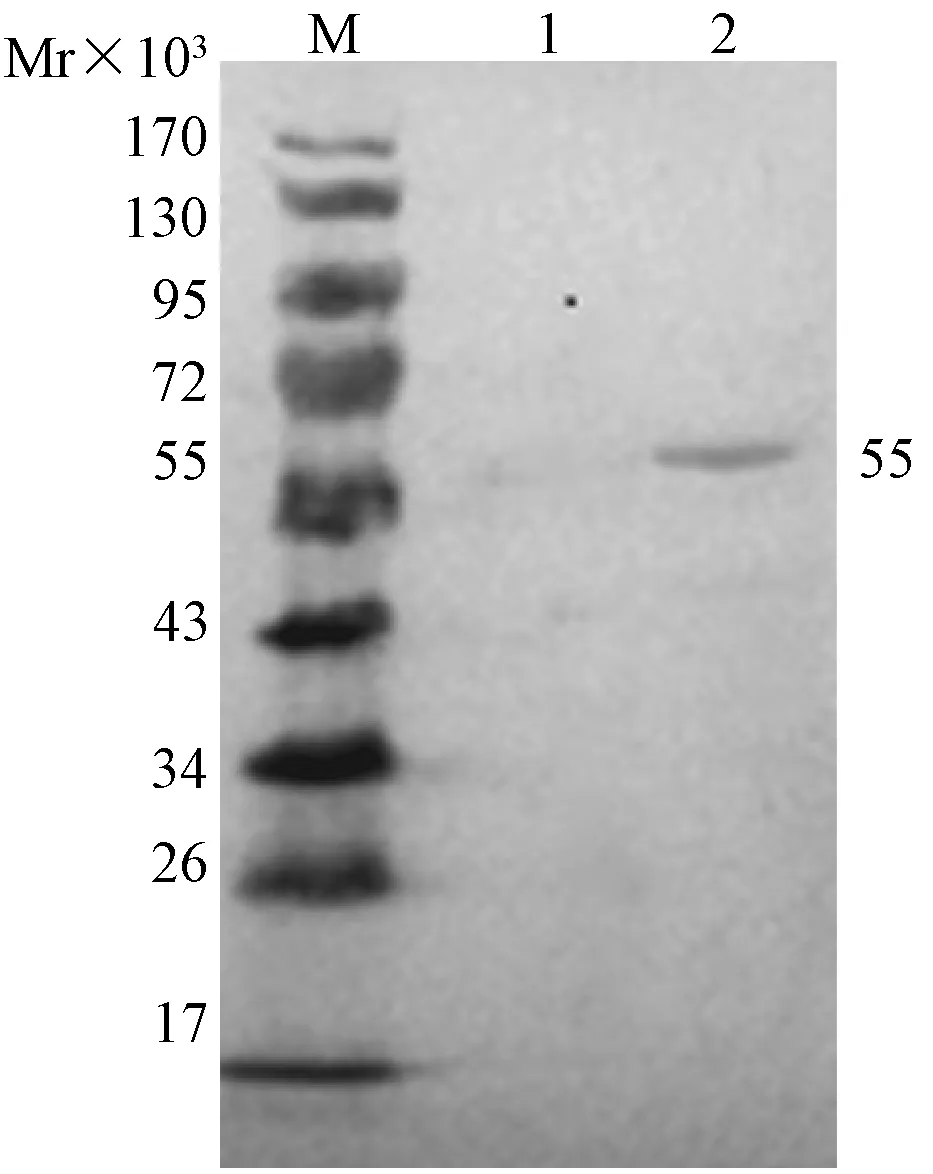
注:M,蛋白质marker;1,rBac-N感染的sf9 细胞;2,rBac-E 感染的sf9 细胞图4 Western blot 检测E蛋白的表达Note: M, Protein marker; 1, sf9 cell infectioned by rBac-N; 2, sf9 cell infectioned by rBac-EFig.4 Western blot of expressed E protein
3 讨论
ZIKV于1947年被发现,1952年首次从人体分离出来[2-3],该病毒在2007年开始出现暴发流行[3,9],2015年和2016年,ZIKV在巴西引起了疫情,WHO将该疫情列为国际紧急卫生事件[10]。目前认为ZIKV通过伊蚊传播,埃及伊蚊为主要传播媒介[11],同时也可能存在其他传播方式。近日,Tetro等[12]在母亲体内和胎儿羊水中均检测出ZIKV核酸,说明其可能垂直感染胎儿。此外,ZIKV还可通过血液接触或性接触传播[13-15]。
当ZIKV入侵宿主细胞时,E蛋白与细胞表面的受体结合诱导病毒包膜与细胞膜融合,核衣壳通过受体介导的內吞作用进入细胞质[16]。研究表明,ZIKV E蛋白与其他黄病毒属病毒具有较高的同源性[17]。我国科研人员已经确定了ZIKV E蛋白的晶体结构,发现其具有明确的3个结构域,与其他黄病毒属病毒类似[18]。ZIKV E蛋白的结构域III是特异性中和抗体的结合位点,是ZIKV抗体及疫苗研发的重要靶点[19]。
美国华尔特里德陆军研究所针对ZIKV包膜prM和E蛋白研发出ZIKV灭活疫苗,免疫接种的8只恒河猴均产生了特异性抗体,感染ZIKV后,在血液、尿液及其他分泌物中均未检测到ZIKV[20]。美国Inovio 公司和韩国Gene One Life Science 公司合作开发了ZIKV DNA疫苗GLS5700。法国Valneva 公司、日本Takeda公司、巴西免疫生物技术研究所、美国NewLink公司等也已展开ZIKV灭活疫苗的研发。哈佛大学构建了表达ZIKV E蛋白的52型恒河猴重组腺病毒载体,免疫小鼠后可产生中和抗体,且在恒河猴体内产生较强的细胞免疫应答和体液免疫应答[21]。此外,美国Protein Sciences公司利用基因工程杆状病毒昆虫细胞表达技术平台与阿根廷Sinergium公司合作,正在进行ZIKV重组E蛋白疫苗的研发。综上所述,全球有30多个机构在进行ZIKV疫苗的研发,涉及到灭活疫苗、嵌合病毒疫苗、核酸疫苗、载体疫苗、亚单位疫苗、病毒样颗粒疫苗和合成肽疫苗7大类。
Bac-to-Bac杆状病毒表达系统是一种常见的外源基因表达体系,其特点是高效、迅速、易于操作能够在大肠杆菌内快速构建重组病毒[22]。本研究根据所要表达ZIKV E蛋白的基因和结构特性以pFastBac1为供体质粒构建转移载体转化DH10Bac大肠杆菌,得到重组质粒rBacmid-E,转染sf9细胞,获得重组杆状病毒rBac-E,并进行了ZIKV E蛋白的表达和鉴定,为进一步研究ZIKV E蛋白的功能及ZIKV疫苗的研制奠定了基础。
[1] Faqbami AH. Zika virus infection in Nigeria: virological and seroepidemiological investigations in Oyo State [J]. J Hyg (Lond), 1979, 83(2):213-219. doi:10.1017/S0022172400025997.
[2] Dick GW. Zika virus.II. Pathogenicity and physical properties [J].Trans R Soc Trop Med Hyg, 1952, 46(5):521-534.
[3] Ioos S, Mallet HP, Leparc Goffart I, et al. Current Zika virus epidemiology and recent epidemics [J]. Med Mal Infect, 2014, 44(7):302-307. doi: 10.1016/j. medmal.2014.04.008.
[4] Campos GS, Banderia C, Sardi SI. Zika Virus Outbreak, Bahia, Brazil [J]. Emerg Infect Dis, 2015, 21(10):1885-1886. doi:10.3201/eid2110.150847.
[5] Kuno G, Chang GJ. Full-length sequencing and genomic characterization of Bagaza, Kedoufou, and Zika virus [J]. Arch Virol, 2007, 152(4):687-696. doi:10. 1007/s00705-006-0903-z.
[6] Ishikawa T, Yamanaka A, Konoshi E. A review of successful flavivirus vaccines and the problems with those flavivirus for which vaccines are not yet available [J]. Vaccine, 2014, 32(12):1326-1337. doi:10.1016/j.vaccine.2014.01.040.
[7] Ailor E, Betenbaugh MJ. Modifying secretion and post-translational processing in insect cells [J]. Curr Opin Biotechnol, 1999, 10:142-145.
[8] Joshi L, Davis TR, Mattu TS, et al. Influence of baculovirus-host cell interactions on complex n-linked glycosylation of a recombinant human protein [J]. Biotechnol Prog, 2000, 16:650-656. doi:10.1021/bp000057p.
[9] Cao-lormeau VM, Roche C, Teissier A, et al. Zika virus, French polynesia, South pacific, 2013 [J]. Emerg Infect Dis, 2014, 20(6):1085-1086. doi:10.3201/eid 2006.140138.
[10] Messina JP, Kraemer MU, Brady OJ, et al. Mapping global environmental suitability for Zika virus [J]. fElife, 2016, 19(5):el5272. doi:10.7554/eLife. 15272.
[11] Petersen E, Wilson ME, Touch S, et al. Rapid spread of Zika virus in the Americas-implications for public health preparedness for mass gatherings at the 2016 Brazil Olympic Games [J]. Int J Infect Dis, 2016, 44:11-15. doi: 10.1016/ j.ijid.2016.02.001.
[12] Tetro JA. Zika and microcephaly: Causation, correlation, or coincidence? [J]. Microbes Infect, 2016, 18(3):1-2. doi: 10.1016/j.micinf.2015.12.010.
[13] Musso D, Nhan T, Robin E, et al. Potential for Zika virus transmission through blood transfusion demonstrated during an outbreak in French Polynesia, Novemeber 2013 to February 2014 [J]. Eur Surveill, 2014, 19 (15):pii/20771.
[14] Foy BD, Kobylinski KC, Chilson Foy JL, et al. Probable non-vector-borne transmission of Zika virus, Colorado, USA [J]. Emerg Infect Dis, 2011, 17(5): 880-882. doi: 10.3201/eid1705.101939.
[15] Mccarthy M. Zika virus was transmitted by sexual contact in Texas, health officials report [J]. BMJ, 2016, 352:i720. doi: 10.1136/bmj.i720.
[16] Hamel R, Dejarnac O, Wichit S, et al. Biology of Zika virus infection in human skin cells [J]. J Virol, 2015, 89(17):8880-8896. doi: 10.1128/JVI.00354-15.
[17] Sirohi D, Chen ZG, Sun L, et al. The 3.8 A resolution cryo-EM structure of Zika virus [J]. Science, 2016, 352(6284): 467-470. doi: 10.1126/science.aaf5316.
[18] Dai LP, Song J, Lu XS, et al. Structures of the Zika virus envelope protein and its complex with a Flavivirus broadly protective antibody [J]. Cell Host Microbe, 2016, 19(5):696-704. doi: 10.1016/j.chom.2016.04.013.
[19] Zhao HY, Fernandez E, Dowd KA, et al. Structural basis of Zika virus-specific antibody protection [J]. Cell, 2016, 166(4):1016-1027. doi: 10.1016/j.cell.2016. 07.020.
[20] Abbink P, Larocca RA, de La Barrera RA, et al. Protective efficacy of multiple vaccine platforms against Zika virus challenge in rhesus monkeys [J]. Science, 2016, 353(6304):1129-1132. doi: 10.1126/science.aah6157.
[21] 田德桥,陈薇.寨卡病毒及其疫苗研究[J].生物工程学报,2017,33(1):1-15.doi:10.13345/j.cjb.1.
[22] Luckow VA, Lee SC, Barry GF, et al. Efficient generation of infectious recombinant baculoviruses by site-specific transposon-mediated insertion of foreign genes into a baculovirus genome propagated in Escherichia coli [J]. J Virol, 1993, 67(8):45660-4579.
