小鼠肠道类组织三维培养体系的建立及用于喜马拉雅旱獭甲型肝炎病毒增殖研究
2017-03-10林琳陈爱珺李利利李金松
林琳 陈爱珺 李利利 李金松
100052 北京,中国疾病预防控制中心病毒病预防控制所(林琳、陈爱珺、李利利、李金松);250014 济南,山东省疾病预防控制中心艾滋病防治所 山东大学预防医学研究院 山东省传染病预防控制重点实验室(林琳)
甲型肝炎病毒(Hepatitis A virus,HAV)为小RNA病毒科嗜肝病毒属,正链RNA病毒。甲肝病毒在人和灵长类动物、旱獭和鸭群中广泛存在[1-4]。甲肝病毒主要通过粪口途径传播,在人群中常通过食物和水传播,并引起暴发和流行。人类感染甲肝病毒后,大多表现为亚临床或隐性感染,仅少数人发展为急性甲型肝炎。一般可完全恢复,不会转为慢性肝炎,亦无慢性携带者。据世界卫生组织估计每年全球约有一千万人感染甲肝病毒,约有100万人发病[2, 5]。
喜马拉雅旱獭病毒(Marmota himalayana hepato-virus,MHHAV)是近年来在我国青海的旱獭粪便中发现的一种新型的甲肝病毒。该病毒在旱獭粪便中检出率为16.16%,并且在肝、脾、肺、血液等器官中均可检测到病毒RNA。进化分析提示该病毒与以往发现的灵长类甲肝病毒、人甲肝病毒和海豹甲肝病毒属于不同分支[1]。
类器官或类组织三维培养是近年来发展起来的一种干细胞培养法,常见的有肠道、肝和甲状腺等类器官或类组织三维培养体系等[6]。肠道类组织培养是将小鼠或人的小肠组织在消化酶的作用下,分离出肠道隐窝,在体外通过含有多种细胞因子的培养基使肠道隐窝中的干细胞分化,形成拥有部分肠道隐窝体内结构和功能的类组织[7]。目前类组织主要用于药物研究、病毒分离、疾病模型等研究[6]。已有报道肠道类组织成功实现多种体外难培养或常规二维细胞培养不能分离培养的病毒,如轮状病毒和诺如病毒等[8]。
1 材料与方法
1.1材料Vero、Vero-E6、DH82、人胚肺二倍体细胞(2BS)来自中国疾病预防控制中心病毒病防制所腹泻室实验室冻存或购于国家实验细胞资源共享平台,MHHAV粪便标本为检测阳性的野外采集的旱獭MMHAV阳性标本,经实验室Real-time qPCR定量确定为阳性的粪便标本。胎牛血清,MEM培养基、1640培养基,Advanced DMEM/F12、Glutamax 100x、HEPES 1 M、Penicillin-streptomycin 100x、B27 supplement 50x、N2 supplement 100x、Glutamax、Mouse EGF 500 μg/ml、EDTA、0.25%胰酶等购自Invitrogen;Standard BD Matrigel matrix(BD Bios-ciences, 美国),Mouse Noggin 100 μg/ml(Peprotech,美国),Nicotinamide(Sigma,美国),核酸提取试剂盒购自QIAgen, Real-time qPCR试剂盒购自ABI,引物探针等在Invitrogen公司合成。Balb/C小鼠购自中国人民解放军军事医学科学院实验动物中心。
1.2方法
1.2.1 常规二维细胞分离培养MHHAV:复苏Vero、Vero-E6、DH82、人胚肺二倍体细胞(2BS)细胞,待细胞生长良好后,将旱獭甲肝阳性粪便标本用MEM培养基稀释成10%便悬液,8 000×g离心后,吸取上清,分别用0.45 μm和0.22 μm的滤器过滤。96孔板细胞接种次日,去掉培养基,每孔接种100 μl病毒悬液,病毒孵育1 h后,去掉上清,清洗三遍后,加入含1%血清和双抗的培养基。于0、1、6、12、24 d各取5孔培养上清(包括细胞),冻于-80 ℃待用[9-10]。
1.2.2 小鼠肠道类组织培养: 肠道隐窝分离培养:颈部脱臼处死小鼠(Balb/C);用酒精消毒浸泡小鼠1 min:取出小肠,放于装有已预冷的PBS的培养皿中。取小肠中段(去掉胃以及胃下约2~3 cm的肠段,然后切下约10 cm的空肠),去除小肠上附着的脂肪;换到新的装有预冷的PBS培养皿中,纵向剪开小肠;在预冷的PBS中冲洗,用盖玻片轻柔缓慢的刮掉小肠绒毛,用PBS洗两遍;将小肠切成约0.2 cm~0.5 cm长的小段,转移到含有20 ml预冷的PBS的50 ml离心管内,震荡去除游离绒毛等。为了松动隐窝,用10 ml吸头上下吹打10次使组织完全悬浮,然后用70 μm细胞过滤器把组织滤掉。 滤过的液体中加入终浓度10%的FBS,吹打几次,4 ℃,300×g离心5 min,去上清;将隐窝重悬于10 ml CM-GF培养液(97% Advanced DMEM/F12+1% 100×Glutamax+1% 100× Pen/Strep)中,4 ℃、150×g离心5 min以收集隐窝。将约100个隐窝悬浮于30 μl的基质胶(Matrigel)中,放入37 ℃二氧化碳培养箱中约15 min。等待基质胶凝固后,每孔加入500 μl含有各类生长因子的CMGF培养液。观察类组织生长情况,每2 d更换一次CMGF培养液[11-12]。
1.2.3 病毒接种:新分离或复苏的肠道类组织,培养6 d后,去上清后加入4 ℃的CM-GF培养液,吹打几次,使基质胶融化,使用预冷CM-GF培养液清洗三遍,并用预冷PBS清洗一遍,加入含有0.5 mmol/L EDTA的PBS将类组织分散,而后使用CM-GF培养液洗去EDTA,离心去上清,并加入4%基质胶的CMGF培养液与类组织混匀,50 μl每孔接种于96孔板,每孔含约20~25个类组织,培养2 d。小心吸去培养基,将处理好的病毒标本过滤液每孔接种100 μl,37 ℃孵育1 h后,小心去上清,使用CM-GF培养液小心清洗三遍后,加入100 μl CMGF培养液 1,于0、6、24、48、96 h各取3孔,并仔细将细胞冲洗下来,冻于-80 ℃待用[13]。
1.2.4 核酸提取:将收集的培养液在-80 ℃和37 ℃反复冻融5次,使细胞或肠道隐窝破裂释放出病毒颗粒,用PBS将每个标本配成140 μl总量,采用Viral Nucleic Acid Extract Kit II,按说明书提取核酸。
1.2.5 标准品制备:使用PS (MHHAVF: 5′- GTCCTCTTTAAGGCACTCAT -3′)20 pmol/L,PX(MHHAVR:5′ -TGGGTCAGTCCATCTGGCAAG-3′)20 pmol/L扩增后,回收条带,测序确认后,克隆进入DH5α。扩增后,提取质粒,并转录成RNA[1]。
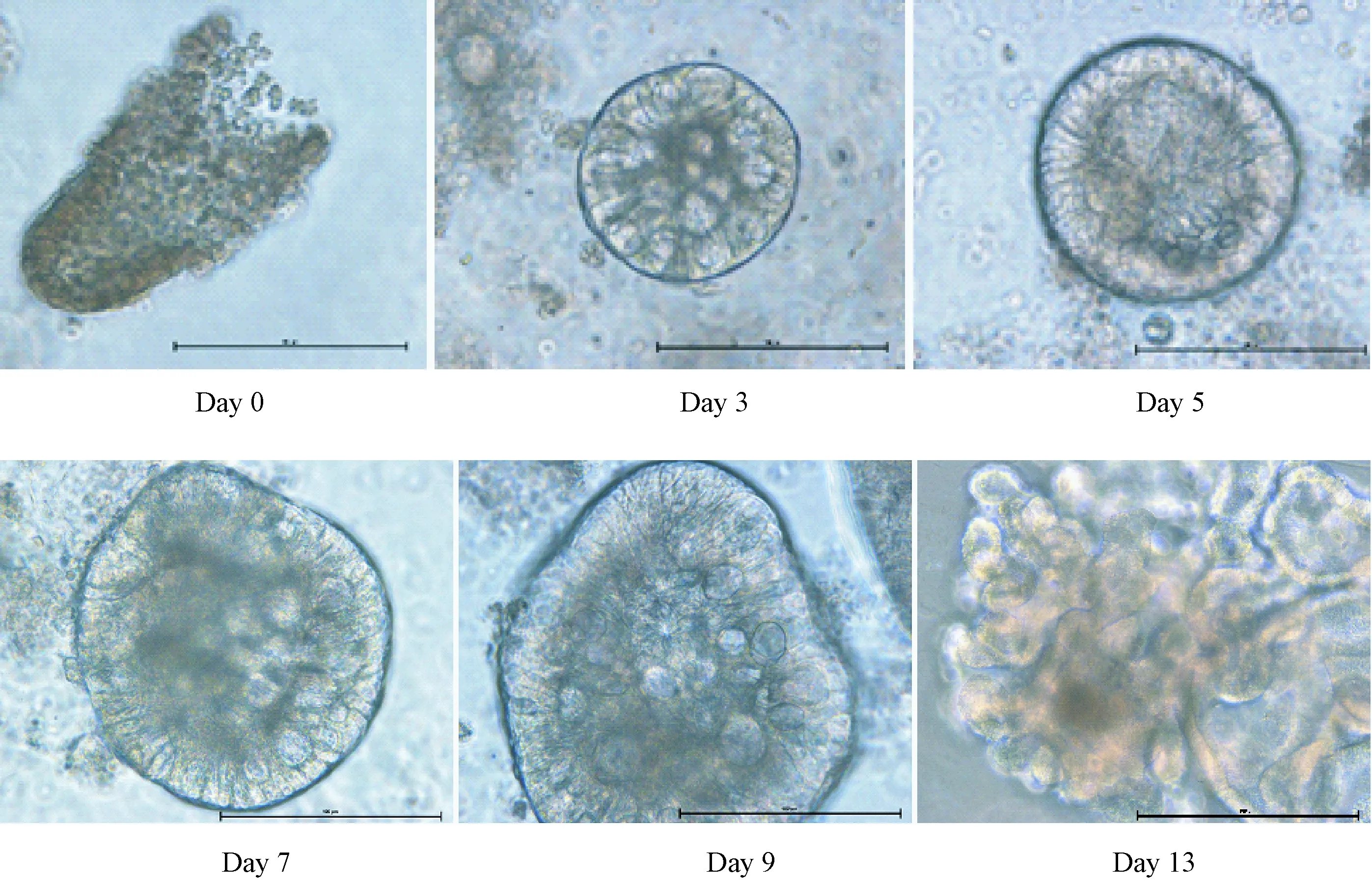
图1 显微镜下小鼠肠道类组织生长状态 比例尺:100 μmFig.1 Growth of mouse intestinal enteroids under microscope Scale bar: 100 μm)
1.2.6 病毒增殖检测:病毒拷贝数使用Real-time qPCR方法测定:2×QuantiTect Probe RT-PCR Master Mix 12.5 μl;QuantiTect RT Mix 0.25 μl;20 pmol/L PS 1 μl,20 pM PX 1 μl,(MHHAV Probe: 5′-FAM- CATCTTCATTTCCCTGGCTCTCACC-MGB -3′)探针10 PM 0.5 μl,RNAse-FREE水7.25 μl;2.5 μl 模板RNA或108至100拷贝/ μl的10倍稀释的标准品。反应条件为:50 ℃ 30 min; 95 ℃ min;95 ℃ 15 s、58 ℃ 30 s,40个循环,在58 ℃收集荧光信号[1]。
2 结果
2.1常见二维培养细胞系中未见病毒增殖在上述几种常见的甲肝病毒分离细胞系,不同时间点收集的培养液和相应的孵育细胞所提取的核酸中,使用Real-time qPCR定量检测,除0 h外,各时间点均未检测到病毒核酸。在细胞培养液和培养的细胞收集前也未观察到细胞有病变。
2.2建立肠道类组织培养体系分离出的小鼠肠道隐窝在培养液中存活,在显微镜下可见肠隐窝在分离后分布在基质胶中。在24 h左右,隐窝闭合,开始膨胀形成肠球。5~7 d后,形成类似空肠肠腔样结构,并在7 d的时候出现萌芽突起,13 d后形成肠管样结构(图1)。
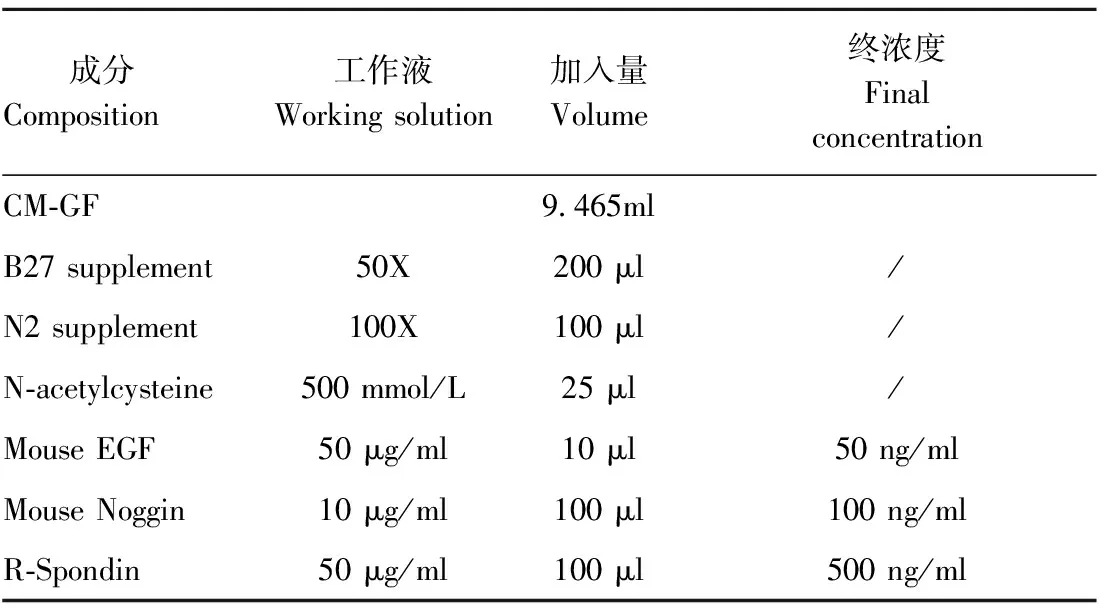
表1 CMGF培养基(4℃保存期2周)
2.3MHHAV在小鼠肠道类组织上增殖MHHAV可以在小鼠肠道类组织上增殖,在接种6 h后,几乎检不出病毒,但在接下来的时间节点上病毒拷贝数逐渐增高,但整个过程未见细胞病变。计算拷贝数0 h点平均病毒RNA载量为3.6×103拷贝/ml(3.6×103±306 拷贝/ml),6 h点未检测到病毒核酸,24 h点为1.5×104拷贝/ml(1.5×104±1.2×103拷贝/ml);48 h点为5.4×105拷贝/ml(5.4×105±1.32×103拷贝/ml),96 h点为1.34×107拷贝/ml(1.34×107±4.33×103拷贝/ml),病毒在4 d时间有大约3 700倍增殖。
3 讨论
病毒进入细胞体内通常通过细胞的受体或某些特殊的细胞结构或成分,如丙型肝炎病毒通常通过低密度脂蛋白受体进入细胞[14],病毒不能在某些细胞上培养通常是因为该类细胞缺乏病毒的特异受体,病毒不能进入细胞内,导致分离培养失败;病毒能够进入细胞内,但是细胞内缺乏病毒复制、转录、装配和释放出细胞的某些条件,可能会导致病毒分离培养失败,如腺相关病毒等需要辅助病毒相助才能在细胞内装配出新的子代病毒[15]。人甲肝病毒具有嗜肝特征,并能通过粪口途径感染,也能在多种细胞系上生长,但是滴度很低、生长很慢,初次分离的甲肝病毒能适应的细胞系很局限,而经过细胞适应的甲肝病毒毒株核酸序列变异较大,并且能够感染多种细胞[16]。
MHHAV具有与其他类型甲肝病毒不一样的特征,其核酸序列与已知的甲肝序列差异较大,如抗原位点的氨基酸序列与人和灵长类甲肝病毒不一样;与人的甲肝病毒相比,5′-UTR区缺乏第一个结构域和颈环结构Ia,还缺乏第V结构域的假结,而MHHAV的第III茎环结构是一个多回路的三叶草结构,可能有内部核糖体进入位点(IRES),这个区域与人甲肝病毒一样非常保守,但是这个IRES的3′边缘,有UUUCC和AUG两个box基因,与人甲肝病毒的RNA复制顺式作用元件功能相似,但是这个区域核酸与人甲肝病毒也有较大差异[1]。基于上述MHHAV和人甲肝病毒的差异,本研究使用二维培养的多种细胞系的培养过程中均未见甲肝病毒的增殖。
体外三维培养的肠道类组织在基质胶上形成了肠道隐窝的基本结构,与二维培养时具有较大区别:首先其拥有多种细胞,是多种肠道上皮细胞,并分化出了肠道绒毛,多种细胞具有的受体更加丰富,可能包含了MHHAV的受体,使其更容易进入细胞内;其次三维培养的肠道隐窝具有体内肠道隐窝的基本功能[7-8],使MHHAV在细胞内能更容易复制、装配和释放等;另外旱獭也是啮齿类动物,小鼠是典型的啮齿类动物,没有种属特异性干扰,因此MHHAV在小鼠肠道类组织中更容易感染和复制。本研究的三维培养结果与国外报道一致[17- 18],MHHAV在小鼠肠道类组织中被检测到的时间也比人甲肝病毒在细胞培养时早,可能与肠道类组织具有肠道隐窝体内基本功能有关,还需进一步研究。
[1] Yu JM, Li LL, Zhang CY, et al. A novel hepatovirus identified in wild woodchuck Marmota himalayana[J]. Sci Rep, 2016,6:22361. doi: 10.1038/srep22361.
[2] WHO position paper on hepatitis A vaccines[J]. Can Commun Dis Rep, 2000,26(5):33-38.
[3] Jacobsen KH, Wiersma ST. Hepatitis A virus seroprevalence by age and world region, 1990 and 2005[J]. Vaccine, 2010,28(41):6653-6657. doi: 10.1016/j.vaccine.2010.08.037.
[4] Ou X, Mao S, Cao J, et al. Comparative analysis of virus-host interactions caused by a virulent and an attenuated duck hepatitis A virus genotype 1[J]. PLoS One, 2017,12(6):e178993. doi: 10.1371/journal.pone.0178993.
[5] Wasley A, Fiore A, Bell BP. Hepatitis A in the era of vaccin-ation[J]. Epidemiol Rev, 2006,28:101-111. doi: 10.1093/epirev/mxj012.
[6] Clevers H. Modeling Development and Disease with Organoids[J]. Cell, 2016,165(7):1586-1597. doi: 10.1016/j.cell.2016.05.082.
[7] Mahe MM, Sundaram N, Watson CL, et al. Establishment of human epithelial enteroids and colonoids from whole tissue and biopsy[J]. J Vis Exp, 2015,97:52483. doi: 10.3791/52483.
[8] Ettayebi K, Crawford SE, Murakami K, et al. Replication of human noroviruses in stem cell-derived human enteroids[J]. Science, 2016,353(6306):1387-1393. doi: 10.1126/science.aaf5211.
[9] 李成明, 陈立礼, 殷大常, 等. 甲型肝炎病毒分离及培养特性的研究[J]. 病毒学杂志, 1986,1(4):30-36.
[10] 季国芳, 李显, 黄红玉, 等. 从海水毛蚶中分离出甲型肝炎病毒[J]. 病毒学杂志, 1990,5(3):240-244.
[11] Liu J, Walker NM, Cook MT, et al. Functional Cftr in crypt epithelium of organotypic enteroid cultures from murine small intestine[J]. Am J Physiol Cell Physiol, 2012,302(10):C1492-C1503. doi: 10.1152/ajpcell.00392.2011.
[12] Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009,459(7244):262-265. doi: 10.1038/nature07935.
[13] Wang F, Scoville D, He XC, et al. Isolation and characterization of intestinal stem cells based on surface marker combinations and colony-formation assay[J]. Gastroenterology, 2013,145(2):383-395. doi: 10.1053/j.gastro.2013.02.050.
[14] Agnello V, Abel G, Elfahal M, et al. Hepatitis C virus and other flaviviridae viruses enter cells via low density lipoprotein receptor[J]. Proc Natl Acad Sci U S A, 1999,96(22):12766-12771.
[15] Wang Z, Deng X, Zou W, et al. Human Bocavirus 1 Is a Novel Helper for Adeno-Associated Virus Replication[J]. J Virol, 2017,91(18):e00710-17. doi: 10.1128/JVI.00710-17.
[16] Updike WS, Tesar M, Ehrenfeld E. Detection of hepatitis A virus proteins in infected BS-C-1 cells[J]. Virology, 1991,185(1):411-418.
[17] Rogoz A, Reis BS, Karssemeijer RA, et al. A 3-D enteroid-based model to study T-cell and epithelial cell interaction[J]. J Immunol Methods, 2015,421(3):89-95. doi: 10.1016/j.jim.2015.03.014.
[18] Moore SR, Guedes MM, Costa TB, et al. Glutamine and alanyl-glutamine promote crypt expansion and mTOR signaling in murine enteroids[J]. Am J Physiol Gastrointest Liver Physiol, 2015,308(10):G831-G839. doi: 10.1152/ajpgi.00422.2014.
