贲门失弛缓症患者食管硫化氢合成酶表达的研究*
2017-03-09张莉莉王邦茂
张莉莉 赵 威 晋 弘 王邦茂
天津医科大学总医院消化内科(300052)
贲门失弛缓症患者食管硫化氢合成酶表达的研究*
张莉莉#赵 威 晋 弘 王邦茂&
天津医科大学总医院消化内科(300052)
背景:贲门失弛缓症是一种原发性食管动力障碍性疾病,目前普遍认为其发生与抑制性神经递质减少有关。硫化氢为胃肠道抑制性神经递质之一,胱硫醚-β-合酶(CBS)和胱硫醚-γ-裂解酶(CSE)是参与其合成的关键酶。目的:比较CBS和CSE在贲门失弛缓症患者与对照者食管组织中的表达差异,初步探讨硫化氢与贲门失弛缓症之间的关系。方法:纳入2013年1月—2015年6月在天津医科大学总医院行经口内镜肌切开术治疗的贲门失弛缓症患者25例,10例因食管鳞状细胞癌行食管切除术的患者作为对照组,分别取病变和正常下食管括约肌(LES)环肌组织,行CBS、CSE免疫组化染色,以半定量法评估两者的表达减少程度。结果:CBS、CSE免疫阳性物质主要分布于LES肌间神经丛。与对照组相比,贲门失弛缓症组LES组织中的CBS、CSE表达显著减少(P均<0.05),60.0%以上的患者几乎或完全无表达,而对照组多为强阳性表达。结论:贲门失弛缓症患者LES组织中硫化氢合成酶表达减少甚至缺失,提示硫化氢合成减少与贲门失弛缓症的发生、发展之间存在关联。
食管失弛症; 硫化氢; 硫化氢合成酶; 免疫组织化学
贲门失弛缓症是一种原发性食管动力障碍性疾病,以食管体部蠕动缺失和下食管括约肌(lower esophageal sphincter, LES)松弛障碍为特征。目前该病病因虽尚未明确,但普遍认为其发生与抑制性神经递质减少有关。与食管动力相关的抑制性神经递质主要包括一氧化氮(NO)和血管活性肠肽(VIP)。硫化氢(hydrogen sulfide)与NO相似,是一种气体信号分子,且同样在胃肠道发挥抑制性递质作用[1]。近年来,越来越多的证据表明硫化氢可松弛胃肠道平滑肌[2-5],并可与NO协同调节平滑肌张力[6]。由此推测内源性硫化氢合成减少可能与贲门失弛缓症的发生有关。
在哺乳动物组织中,内源性硫化氢系由左旋半胱氨酸合成,胱硫醚-β-合酶(cystathionine beta-synthetase, CBS)和胱硫醚-γ-裂解酶(cystathionine gamma-lyase, CSE)是参与其合成的关键酶。既往研究发现,CBS和CSE除表达于胃、小肠和结肠外[6-9],在食管中亦有表达[10],然而关于两者在贲门失弛缓症患者食管中的表达情况少见报道。本研究通过检测、比较CBS和CSE在贲门失弛缓症患者与对照者食管组织中的表达差异,初步探讨硫化氢与贲门失弛缓症之间的关系。
对象与方法
一、研究对象
纳入2013年1月—2015年6月在天津医科大学总 医院行经口内镜肌切开术(peroral endoscopic myotomy, POEM)治疗的贲门失弛缓症患者25例,贲门失弛缓症均经临床症状、典型内镜表现、上消化道造影和高分辨率食管测压确诊。10例因食管鳞状细胞癌行食管切除术的患者作为对照组。
二、方法
1. 组织标本获取:贲门失弛缓症患者获得知情同意后行POEM治疗,建立由LES至贲门的黏膜下隧道,切开环肌,使用活检钳于LES部位取大小约1.5 cm×0.2 cm的环肌组织。食管鳞状细胞癌患者 术后立即于手术标本的LES部位切取大小约1.5 cm×0.2 cm的环肌组织,切取部位距肿瘤组织至少2 cm,大体和组织学表现均正常。标本获取后立即置于4%甲醛溶液中固定,用于制作病理切片。
2. 硫化氢合成酶免疫组化染色:平滑肌标本常规制作石蜡切片,行CBS、CSE免疫组化染色。组织切片依次置于二甲苯和梯度浓度乙醇中脱蜡、水化,pH 6.0枸橼酸盐缓冲液95 ℃ 10 min,微波抗原修复,冷却,3%过氧化氢室温孵育10 min,蒸馏水洗,PBS浸泡,加入兔抗人CBS或CSE多克隆抗体(Santa Cruz Biotechnology, Inc.),4 ℃过夜,PBS洗3×3 min,加入生物素化羊抗兔二抗,室温30 min,PBS洗3×3 min,加入HRP标记的链霉亲和素,室温30 min,PBS洗3×3 min,加入新鲜配制的DAB显色,水洗,苏木精复染,吹干,封片。
评分标准:光学显微镜下观察染色情况,参考既往文献报道的免疫组化染色评分标准进行半定量评分[11-12]。将标本中的CBS、CSE表达减少程度分为四级:Ⅰ级(3分),大量阳性细胞均匀分布在观察视野内,即正常或少量减少;Ⅱ级(2分):阳性细胞呈斑片状分布,高倍视野下易发现,即明显减少;Ⅲ级(1分):仅有稀少或单个阳性结构,即严重减少;Ⅳ级(0分):无免疫阳性反应。
三、统计学分析

结 果
一、一般资料
纳入研究的25例行POEM治疗的贲门失弛缓症患者中,男性12例,女性13例,平均年龄43岁(23~63岁)。术前高分辨率食管测压显示4 s完整松弛压(4-second integrated relaxation pressure, 4-s IRP)均值为18.5 mm Hg(16~29 mm Hg, 1 mm Hg=0.133 kPa)。根据食管动力障碍芝加哥分型(2014年3.0版)[13],Ⅰ型贲门失弛缓症13例,Ⅱ型10例,Ⅲ型2例。贲门失弛缓症状持续时间平均6年(1~20年)。吞咽困难评分平均3分(2~4分):从1分无吞咽困难症状至5分唾液吞咽困难,由患者自评[14]。4例患者曾接受球囊扩张术(3例)和Heller肌切开术(1例)治疗。
10例对照组患者中男性和女性各5例,平均年龄45岁(35~62岁)。两组间性别构成和年龄差异无统计学意义(χ2=0.011,P=0.915;t=1.537,P=0.174)。
二、CBS在LES组织中的表达
免疫组化染色显示,CBS免疫阳性物质主要分布于LES肌间神经丛。与对照组相比,贲门失弛缓症组LES环肌组织中的CBS表达显著减少(χ2=19.538,P<0.001),几乎或完全无表达者(Ⅲ、Ⅳ级)占64.0%,强阳性表达者(Ⅰ级)仅占8.0%,而对照组80.0%为强阳性表达,未见Ⅲ、Ⅳ级表达者(表1、图 1)。

表1 两组LES组织中CBS表达减少程度比较 n(%)

箭头所示为阳性染色
图1 贲门失弛缓症组(A)与对照组(B)LES组织中的CBS表达(免疫组化染色,×400)
三、CSE在LES组织中的表达
免疫组化染色显示,CSE免疫阳性物质主要分布于LES肌间神经丛。与对照组相比,贲门失弛缓症组LES环肌组织中的CSE表达显著减少(χ2=13.767,P=0.003),几乎或完全无表达者(Ⅲ、Ⅳ级)占68.0%,强阳性表达者(Ⅰ级)仅占8.0%,而对照组40.0%为强阳性表达,未见Ⅲ、Ⅳ级表达者(表2、图2)。
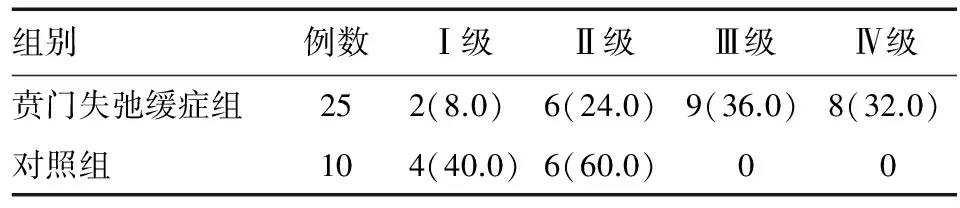
表2 两组LES组织中CSE表达减少程度比较 n(%)
讨 论
食管的神经支配主要包括肾上腺素能神经、胆碱能神经和非肾上腺素能非胆碱能 (non-adrenergic

箭头所示为阳性染色
图2 贲门失弛缓症组(A)与对照组(B)LES组织中的CSE表达(免疫组化染色,×400)
non-cholinergic, NANC)神经,通过分泌不同神经递质调节食管平滑肌运动。肠神经元或Cajal间质细胞(interstitial cells of Cajal, ICCs)分泌的NANC神经递质可松弛LES并参与了食管运动的调节[15]。NANC抑制性神经递质主要包括NO、VIP、硫化氢等。硫化氢是继NO和一氧化碳(CO)后发现的第三种气体信号分子[1],既往众多研究表明其可松弛胃、结肠和小肠平滑肌[2-5]。CBS和CSE是参与内源性硫化氢合成的关键酶,哺乳动物的胃、小肠、结肠中均存在两者表达[6-9]。此外,有研究报道鲑鱼食管中可见CBS免疫阳性神经元[16],本课题组的前期研究亦发现人食管平滑肌组织中存在CBS、CSE阳性神经元[10],由此推测硫化氢可能在调节食管运动功能方面发挥一定作用。
目前观点认为NANC神经分泌的抑制性神经递质减少致LES功能异常是贲门失弛缓症的可能发病机制之一。研究证实,贲门失弛缓症患者食管和LES组织中的肠神经元和ICC数量、NO合成关键酶一氧化氮合酶(NOS)和VIP表达均明显减少甚至缺失[11-12,17-18],然而关于硫化氢合成酶在贲门失弛缓症患者食管中表达情况的报道尚少。本研究结果显示,硫化氢合成酶CBS和CSE在贲门失弛缓症患者LES环肌组织中的表达较非贲门失弛缓症患者显著减少,60%以上的患者几乎或完全无表达。由此推测CBS和CSE减少可能通过减少硫化氢合成而引起LES松弛不良或增加LES压力,最终引起或加重贲门失弛缓症状,但此推测需进一步研究加以验证。
综上所述,本研究发现硫化氢合成酶CBS、CSE在贲门失弛缓症患者的LES组织中表达减少甚至缺失,可能通过减少内源性硫化氢合成而导致LES运动功能障碍,进而参与贲门失弛缓症的发生、发展。然而,亦不能排除CBS、CSE减少系贲门失弛缓症的结果而非原因,如亦存在贲门失弛缓症患者肠神经元缺失导致CBS、CSE减少的可能性。因此,需开展进一步的研究以明确硫化氢与贲门失弛缓症之间的关系,从而为该病提供新的治疗方向。
1 Wang R. Hydrogen sulfide: the third gasotransmitter in biology and medicine[J]. Antioxid Redox Signal, 2010, 12 (9): 1061-1064.
2 Gallego D, Clavé P, Donovan J, et al. The gaseous mediator, hydrogen sulphide, inhibitsinvitromotor patterns in the human, rat and mouse colon and jejunum[J]. Neurogastroenterol Motil, 2008, 20 (12): 1306-1316.
3 Dhaese I, Lefebvre RA. Myosin light chain phosphatase activation is involved in the hydrogen sulfide-induced relaxation in mouse gastric fundus[J]. Eur J Pharmacol, 2009, 606 (1-3): 180-186.
4 Dhaese I, Van Colen I, Lefebvre RA. Mechanisms of action of hydrogen sulfide in relaxation of mouse distal colonic smooth muscle[J]. Eur J Pharmacol, 2010, 628 (1-3): 179-186.
5 Nagao M, Linden DR, Duenes JA, et al. Mechanisms of action of the gasotransmitter hydrogen sulfide in modulating contractile activity of longitudinal muscle of rat ileum[J]. J Gastrointest Surg, 2011, 15 (1): 12-22.
6 Hosoki R, Matsuki N, Kimura H. The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide[J]. Biochem Biophys Res Commun, 1997, 237 (3): 527-531.
7 Han YF, Huang X, Guo X, et al. Evidence that endogenous hydrogen sulfide exerts an excitatory effect on gastric motility in mice[J]. Eur J Pharmacol, 2011, 673 (1-3): 85-95.
8 Schicho R, Krueger D, Zeller F, et al. Hydrogen sulfide is a novel prosecretory neuromodulator in the Guinea-pig and human colon[J]. Gastroenterology, 2006, 131 (5): 1542-1552.
9 Kasparek MS, Linden DR, Kreis ME, et al. Gasotrans-mitters in the gastrointestinal tract[J]. Surgery, 2008, 143 (4): 455-459.
10 张莉莉,赵威,郑忠青,等. 人食管H2S合成酶的免疫组化研究[J]. 胃肠病学和肝病学杂志, 2014, 23 (12): 1478-1479.
11 Villanacci V, Annese V, Cuttitta A, et al. An immuno-histochemical study of the myenteric plexus in idiopathic achalasia[J]. J Clin Gastroenterol, 2010, 44 (6): 407-410.
12 Gockel I, Bohl JR, Eckardt VF, et al. Reduction of interstitial cells of Cajal (ICC) associated with neuronal nitric oxide synthase (n-NOS) in patients with achalasia[J]. Am J Gastroenterol, 2008, 103 (4): 856-864.
13 Kahrilas PJ, Bredenoord AJ, Fox M, et al; International High Resolution Manometry Working Group. The Chicago Classification of esophageal motility disorders, v3.0[J]. Neurogastroenterol Motil, 2015, 27 (2): 160-174.
14 Kilic A, Luketich JD, Landreneau RJ, et al. Alterations in the density of interstitial cells of Cajal in achalasia[J]. Dig Dis Sci, 2008, 53 (6): 1488-1492.
15 Bennett MR. Non-adrenergic non-cholinergic (NANC) transmission to smooth muscle: 35 years on[J]. Prog Neurobiol, 1997, 52 (3): 159-195.
16 Pimenova EA, Varaksin AA. Localization of cystathionine beta-synthase in digestive tract of the masu salmon Onchorhynchus masou (Teleostei)[Article in Russian][J]. Zh Evol Biokhim Fiziol, 2012, 48 (4): 390-398.
17 Mearin F, Mourelle M, Guarner F, et al. Patients with achalasia lack nitric oxide synthase in the gastro-oesophageal junction[J]. Eur J Clin Invest, 1993, 23 (11): 724-728.
18 Wattchow DA, Costa M. Distribution of peptide-containing nerve fibres in achalasia of the oesophagus[J]. J Gastroenterol Hepatol, 1996, 11 (5): 478-485.
(2016-07-13收稿;2016-08-20修回)
Study on Expressions of Hydrogen Sulfide-producing Enzymes in Esophagus of Patients with Achalasia
ZHANGLili,ZHAOWei,JINHong,WANGBangmao.
DepartmentofGastroenterology,TianjinMedicalUniversityGeneralHospital,Tianjin(300052)
WANG Bangmao, Email: gi.tmuh@sohu.com
Esophageal Achalasia; Hydrogen Sulfide; Hydrogen Sulfide-Producing Enzymes; Immunohistochemistry
10.3969/j.issn.1008-7125.2017.02.005
国家自然科学基金(81370492)
#Email: lili724916@163.com
&本文通信作者,Email: gi.tmuh@sohu.com
Background: Achalasia is a primary esophageal motility disorder. It has been widely accepted that the occurrence of achalasia is associated with reduction of inhibitory neurotransmitters. Hydrogen sulfide, which is known as a gastrointestinal inhibitory neurotransmitter, is produced endogenously from L-cysteine mainly via cystathionine beta-synthetase (CBS) and cystathionine gamma-lyase (CSE). Aims: To explore the relationship between hydrogen sulfide and achalasia by comparing the expressions of CBS and CSE in esophagus of patients with achalasia and the control subjects. Methods: Twenty-five achalasia patients undergoing peroral endoscopic myotomy from Jan. 2013 to Jun. 2015 at the Tianjin Medical University General Hospital were enrolled. Circular muscle samples in lower esophageal sphincter (LES) were obtained for detection of CBS and CSE immunohistochemically, and normal LES circular muscle samples from 10 patients with esophageal squamous carcinoma were served as controls. Reductions of CBS and CSE were evaluated semi-quantitatively. Results: Immunoreactivities for CBS and CSE were observed mainly in myenteric nerve plexus of LES. Compared with control subjects, expressions of CBS and CSE in LES of achalasia patients were significantly reduced (Pall <0.05). More than 60% of the achalasia patients revealed severe reduction to complete loss of CBS and CSE immunoreactivities, whereas most of the control subjects were strongly positive for these two enzymes. Conclusions: Hydrogen sulfide-producing enzymes are significantly reduced and even absent in LES of patients with achalasia, which indicates that there exists a correlation between reduced hydrogen sulfide synthesis and achalasia.
