胰腺神经内分泌肿瘤的内科治疗进展
2017-03-09陈旻湖
张 雨 陈旻湖 陈 洁
中山大学附属第一医院消化内科(510080)
·特约文稿·
胰腺神经内分泌肿瘤的内科治疗进展
张 雨 陈旻湖 陈 洁*
中山大学附属第一医院消化内科(510080)
胰腺神经内分泌肿瘤(pNEN)是一类高度异质的少见肿瘤,对于局部可切除的肿瘤,手术是惟一的根治性治疗方式;而对于确诊时已有局部进展或远处转移的患者,内科治疗是主要的治疗方式。内科治疗包括生物治疗、靶向治疗和化学治疗。在内科治疗药物的选择上需综合考虑肿瘤功能状态、生长抑素受体表达情况、病理分级、肿瘤分期和药物毒性谱。
胰腺; 神经内分泌瘤; 生物治疗; 分子靶向治疗; 化学治疗
神经内分泌肿瘤(neuroendocrine neoplasms, NEN)是起源于具有胺前体摄取和脱羧功能的神经内分泌细胞的一类高度异质性的少见肿瘤,发病率近年来呈持续升高趋势,达5.25/100 000。胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms, pNEN)约占NEN的4%~8%,60%以上的pNEN患者确诊时已发生远处转移[1-3]。NEN根据是否产生激素以及存在激素相关症状可分为功能性肿瘤和非功能性肿瘤。约30%~40%的pNEN为功能性肿瘤[4],最常见的功能性pNEN为胰岛素瘤,其次为胃泌素瘤,约25%的胃泌素瘤发生于胰腺。其他罕见的功能性pNEN(rare functional pancreatic neuroendo-crine tumors, RFTs)如舒血管肠肽瘤(VIPoma)、胰高血糖素瘤、促肾上腺皮质激素(ACTH)瘤等的发病率均在0.02/100 000以下。小部分pNEN与遗传综合征如多发性内分泌腺瘤病1型(multiple endocrine neoplasia type 1, MEN-1)、VHL综合征(Von Hippel-Lindau syndrome)等相关。约20%~30%的胃泌素瘤和小于5%的胰岛素瘤或RFTs与MEN-1相关[5]。
根据2010年第4版世界卫生组织(WHO)消化系统肿瘤病理的最新分类方法,NEN按分化程度可分为分化好的神经内分泌瘤(neuroendocrine tumors, NET)和分化差的神经内分泌癌(neuroendocrine carcinoma, NEC)以及混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma, MANEC)。在分化程度的基础上可进一步按增殖活性将NEN分为3组:G1级,核分裂象数<2/10高倍视野和(或)Ki67指数≤2%;G2级,核分裂象数2~20/10高倍视野和(或)Ki67指数3%~20%;G3级,核分裂象数>20/10高倍视野和(或)Ki67指数>20%。其中G1、G2级为分化好的NET,G3级多为分化差的NEC/MANEC。少部分G3级肿瘤分化良好,Ki67指数介于20%~60%之间,且多发生在胰腺,这部分肿瘤目前尚无法按照2010年版WHO消化系统肿瘤病理分类标准进行分类。2013年我国胃肠胰神经内分泌肿瘤病理诊断共识专家组发布的共识建议将其命名为“高增殖活性的NET”,国外文献常表述为分化好的G3 NET[6-8]。
由于pNEN的高度异质性以及临床表现的复杂性,患者的个体化治疗依赖于多学科的共同协作。现有的治疗方式包括内科药物治疗、外科手术治疗、放射介入治疗、肽受体介导的放射性核素治疗(peptide receptor radionuclide therapy, PRRT)等。内科治疗药物包括生物治疗药物、分子靶向治疗药物和细胞毒化疗药物。根据治疗目的可分为控制功能性pNEN激素相关症状的药物和控制肿瘤生长的药物。临床医师需结合肿瘤功能状态、生长抑素受体表达情况、病理分级、肿瘤分期和药物毒性谱进行具体的药物选择。本文将针对pNEN的内科治疗作一系统概述。
一、主要药物
1. 生物治疗药物:主要包括干扰素(IFN)α-2b和生长抑素类似物(somatostatin analogues, SSA)。IFN自20世纪80年代开始用于pNEN的治疗,其可在一定程度上改善pNEN患者的临床症状和生化指标[9],但既往研究样本量均较小,且缺乏高水平的Ⅲ期随机对照临床研究验证。2016年版欧洲神经内分泌肿瘤学会(European Neuroendocrine Tumor Society, ENETS)指南推荐其与SSA联合用于难治性功能性pNEN激素相关症状的控制[10]。
SSA通过与pNEN细胞膜表面的生长抑素受体(somatostatin receptor, SSTR)结合抑制激素释放,从而改善激素过度分泌导致的症状。此外,SSA与受体结合后尚可通过调控肿瘤细胞增殖、凋亡和血管生成相关信号通路而发挥直接抑瘤作用。SSTR属于G蛋白偶联受体,有5个亚型(SSTR1~5),其中SSTR2和SSTR5是pNEN的优势受体[11]。临床常用的SSA主要包括长效奥曲肽(octreotide LAR)和长效兰瑞肽(lanreotide Autogel®)。这两种药物均通过与SSTR2/5结合而发挥作用。2014年发表的随机双盲安慰剂对照Ⅲ期临床研究即CLARINET研究纳入204例无功能性中高分化的转移性胰腺、中后肠以及不明原发灶的NET患者,结果证实长效兰瑞肽较之安慰剂能明显延长分化良好的转移性胰肠以及不明原发灶患者的中位无进展生存期(progression-free survival, PFS)(18个月对未达到);亚组分析提示长效兰瑞肽治疗无论是对于G1级还是G2级NET,无论肝转移瘤负荷是否小于25%,均可有PFS获益。CLARINET研究首次证实SSA可用于pNET抗肿瘤治疗[12]。此外,可同时结合SSTR1、SSTR2、SSTR3、SSTR5的新一代SSA长效帕瑞肽(pasireotide LAR)在抗肿瘤治疗方面亦显示出一定潜力。一项以症状控制率为首要观察终点的Ⅲ期临床试验结果显示,长效帕瑞肽在对激素分泌相关症状的控制上与长效奥曲肽等效,但与长效奥曲肽相比,长效帕瑞肽可使晚期功能性中高分化的胰腺、肠道、肝脏和不明原发灶NET患者在PFS方面获益更多(11.8 个月对6.8个月)[13]。对于长效帕瑞肽的抗肿瘤作用仍需更大样本量且以抗肿瘤疗效为首要观察终点的Ⅲ期临床试验进一步验证。
2. 靶向治疗药物:目前NEN治疗领域最受关注的分子靶向治疗药物是哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂依维 莫司(everolimus)和针对血管内皮生长因子(vascular endothelial growth factor, VEGF)受体信号通路的多靶点受体酪氨酸激酶抑制剂舒尼替尼(sunitinib)。上述两种分子靶向药物均已在晚期pNEN患者中完成Ⅲ期临床试验,并被证实可延长pNEN患者的PFS。2011年发表在新英格兰医学杂志(New England Journal of Medicine, NEJM)上的一项随机对照Ⅲ期临床试验纳入171例晚期分化良好的pNET患者,结果证实舒尼替尼较之安慰剂能显著延长患者的中位PFS(11.4个月对5.5个月)[14]。发表于同期NEJM上的RADIANT-3研究纳入410例晚期中高分化的pNET患者,结果证实依维莫司较之安慰剂也能明显延长患者的中位PFS(11.0 个月对 4.6个月);亚组分析提示依维莫司治疗无论是 对于高分化还是中等分化患者均可有PFS获益[15]。遗憾的是,上述两项研究显示舒尼替尼和依维莫司治疗晚期pNET患者的客观缓解率(objective response rate, ORR)均较低,分别为9.3%和5%。最新报道的关于上述两项研究中患者总生存期(overall survival, OS)的结果显示,不论是舒尼替尼还是依维莫司,治疗后患者的中位OS均较安慰剂组有所提高,但差异均未达到统计学意义,可能与两项研究均允许安慰剂组患者在疾病进展后交叉入组药物治疗组有关[16-17]。
3. 细胞毒化疗药物:化疗药物对于不同分化程度的pNEN均有一定的疗效,但是需根据肿瘤分化程度选择不同的化疗方案。链脲霉素联合5-氟尿嘧啶(streptozocin/5-fluorouracil, STZ/5FU)或阿霉素可用于中高分化pNET的治疗,ORR可达40%~70%,中位OS>2年,其中链脲霉素联合阿霉素的ORR较STZ/5FU方案更高(69%对45%),但链脲霉素联合阿霉素的不良反应更严重[9,18]。
近年来一系列以替莫唑胺(temozolomide)为基础的化疗方案治疗晚期pNET患者的研究显示,替莫唑胺单药治疗的ORR为8%[19],替莫唑胺联合卡培他滨(CAPTEM)方案的ORR为20%~70%[20-23],替莫唑胺联合抗血管生成药物如贝伐单抗或沙利度胺的ORR在33%~45%之间[24-25]。其中部分研究还发现DNA修复酶O-6甲基鸟嘌呤DNA甲基转移酶(O-6-methylguanine DNA methyltransferase, MGMT)表达缺失可能是替莫唑胺疗效较好的预测因子[26-29],但也有研究表明MGMT表达与替莫唑胺疗效无关[21]。关于替莫唑胺为基础化疗方案治疗晚期pNET患者的疗效以及MGMT能否作为其疗效预测分子,仍需大样本临床试验进一步验证。
铂类为基础的化疗方案,主要是顺铂或卡铂联合依托泊苷(EP)和顺铂或卡铂联合伊立替康(IP)方案,用于分化差的pNEC的一线化疗。FOLFOX(奥沙利铂联合5-氟尿嘧啶/亚叶酸钙)或FOLFIRI(伊立替康联合5-氟尿嘧啶/亚叶酸钙)方案可作为pNEC患者一线化疗进展后的二线化疗方案[10]。2013年发表的NORDIC研究纳入252例接受过化疗的食管、胃肠胰和不明原发灶的NEC患者进行回顾性分析,结果显示以铂类为基础的化疗方案一线治疗后的ORR为31%,中位OS为11个月。一线治疗敏感而停药3个月以上进展的患者重新使用EP/IP方案化疗的ORR仍可达到15%。且该研究提示以顺铂或卡铂为基础的方案疗效并无统计学差异。该研究的另一个重要发现是Ki67指数<55%的NEC患者接受EP/IP方案化疗的ORR明显低于Ki67指数>55%的患者(15%对42%),但Ki67指数<55%的NEC患者生存期较长(14个月对10个月)[30]。这一结果提示,对于Ki67指数<55%的NEC患者,可能需选择铂类为基础化疗方案以外的方案,如替莫唑胺为基础的化疗方案进行治疗[10]。
二、功能性pNEN激素相关症状控制的药物治疗
1. 胰岛素瘤:胰岛素瘤因过度分泌胰岛素而导致患者出现低血糖症状。目前控制胰岛素瘤患者的低血糖症状最有效的药物是二氮嗪(剂量50~300 mg/d,最高可用到600 mg/d);SSTR阳性胰岛素瘤患者尚可选用SSA类药物,但由于SSA在抑制胰岛素分泌的同时也会抑制胰高血糖素分泌,在胰高血糖素被过度抑制的情况下,患者的低血糖症状可能无法缓解甚至加重,故在使用SSA类药物治疗胰岛素瘤时需密切监测血糖。SSTR阴性的胰岛素瘤患者则可选用IFNα-2b;对于某些难治性病例,可尝试SSA增量或联用IFNα-2b,也可选择糖皮质激素或mTOR抑制剂依维莫司[5]。
2. 胃泌素瘤:胃泌素瘤因过度分泌胃泌素、进而作用于胃黏膜壁细胞导致胃酸分泌增多,最终引起Zollinger-Ellison综合征,控制其酸相关症状的基础药物是质子泵抑制剂(proton pump inhibitor, PPI),可根据患者症状选择每日一次或每日2次剂量的PPI。对于部分已手术切除病灶的患者,由于胃底、胃体肠嗜铬样细胞增多、进而分泌过多组胺刺激壁细胞分泌胃酸而使其继续遭受Zollinger-Ellison综合征的困扰,这部分患者需继续使用PPI抑制酸分泌,通常使用每日一次剂量的PPI即可有效控制症状[5]。
3. RFTs:RFTs激素相关症状的控制主要采用SSA类药物作为一线治疗。SSA一线治疗效果不佳的患者可加用IFNα-2b。对于ACTH瘤患者,多巴胺激动剂卡麦角林对抑制异位ACTH分泌也可能有一定疗效[5,10,31]。
三、局部进展或远处转移pNEN的抗肿瘤药物治疗
根据2016年版ENETS指南,对于低肿瘤负荷、肿瘤稳定或初诊的G1级或Ki67指数≤10%的G2级pNET患者,首选SSA作为一线治疗,进展后可选用依维莫司或舒尼替尼,也可选用链脲霉素为基础的方案或CAPTEM方案化疗;而对于肿瘤负荷较高和(或)疾病处于进展期的G2级pNET患者,首选链脲霉素为基础的方案或CAPTEM方案化疗,进展后可选用依维莫司或舒尼替尼;对于G3 NET患者,首选链脲霉素为基础的方案或CAPTEM方案化疗,G3 NEC患者推荐EP方案化疗作为一线治疗。G3 NET或G3 NEC患者一线方案化疗进展后可选择FOLFOX或FOLFIRI方案化疗[10]。
四、最新pNEN药物治疗临床试验进展
在分化良好的pNET抗肿瘤治疗方面,靶向药物与化疗序贯治疗的顺序研究、SSA作为一线治疗有效后的维持治疗或SSA增量作为标准剂量治疗失败后的二线治疗、SSA联合化疗以及替莫唑胺联合卡培他滨是主要探索方向。而在分级较高的G3 NET 和G3 NEC的抗肿瘤治疗方面,依维莫司联合化疗作为一线治疗、依维莫司单药作为一线治疗有效后的维持治疗或一线治疗失败后的二线治疗是主要探索方向(表1)。
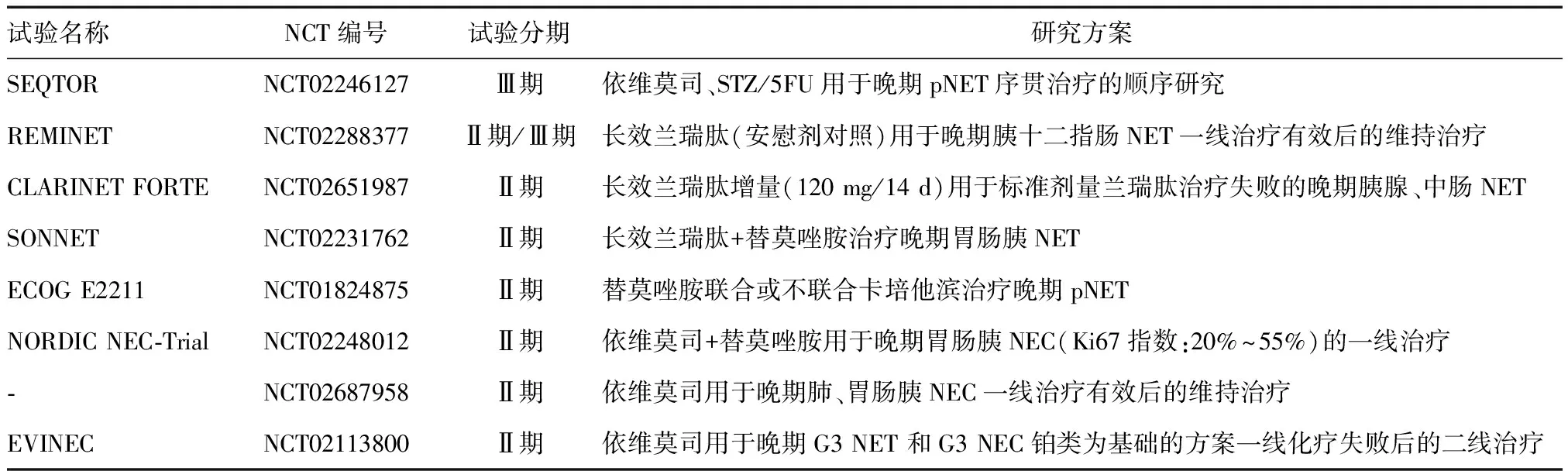
表1 正在进行的pNEN主要药物临床试验
1 Yao JC, Hassan M, Phan A, et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J]. J Clin Oncol, 2008, 26 (18): 3063-3072.
2 Tsai HJ, Wu CC, Tsai CR, et al. The epidemiology of neuroendocrine tumors in Taiwan: a nation-wide cancer registry-based study[J]. PLoS One, 2013, 8 (4): e62487.
3 Hauso O, Gustafsson BI, Kidd M, et al. Neuroendocrine tumor epidemiology: contrasting Norway and North America[J]. Cancer, 2008, 113 (10): 2655-2664.
4 Strosberg J, Gardner N, Kvols L. Survival and prognostic factor analysis in patients with metastatic pancreatic endocrine carcinomas[J]. Pancreas, 2009, 38 (3): 255-258.
5 Falconi M, Eriksson B, Kaltsas G, et al; Vienna Consensus Conference participants. ENETS Consensus Guidelines Update for the Management of Patients with Functional Pancreatic Neuroendocrine Tumors and Non-Functional Pancreatic Neuroendocrine Tumors[J]. Neuroendocrinology, 2016, 103 (2): 153-171.
6 Bosman FT, Carneiro F, Hruban RH, et al. WHO classification of tumours of the digestive system[M]. International Agency for Research on Cancer, 2010.
7 2013年中国胃肠胰神经内分泌肿瘤病理诊断共识专家组. 中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J]. 中华病理学杂志, 2013, 42 (10): 691-694.
8 Garcia-Carbonero R, Sorbye H, Baudin E, et al; Vienna Consensus Conference participants. ENETS Consensus Guidelines for High-Grade Gastroenteropancreatic Neuro-endocrine Tumors and Neuroendocrine Carcinomas[J]. Neuroendocrinology, 2016, 103 (2): 186-194.
9 Grande E, Díez JJ, Pachón V, et al. Advances in the therapy of gastroenteropancreatic-neuroendocrine tumours (GEP-NETs) [J]. Clin Transl Oncol, 2010, 12 (7): 481-492.
10 Pavel M, O’Toole D, Costa F, et al; Vienna Consensus Conference participants. ENETS Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal, Pancreatic, Bronchial Neuroendocrine Neoplasms (NEN) and NEN of Unknown Primary Site[J]. Neuroendocrinology, 2016, 103 (2): 172-185.
11 Florio T. Molecular mechanisms of the antiproliferative activity of somatostatin receptors (SSTRs) in neuroendo-crine tumors[J]. Front Biosci, 2008, 13: 822-840.
12 Caplin ME, Pavel M, Ruszniewski P. Lanreotide in metastatic enteropancreatic neuroendocrine tumors[J]. N Engl J Med, 2014, 371 (16): 1556-1557.
13 Wolin EM, Jarzab B, Eriksson B, et al. Phase Ⅲ study of pasireotide long-acting release in patients with metastatic neuroendocrine tumors and carcinoid symptoms refractory to available somatostatin analogues[J]. Drug Des Devel Ther, 2015, 9: 5075-5086.
14 Raymond E, Dahan L, Raoul JL, et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors[J]. N Engl J Med, 2011, 364 (6): 501-513.
15 Yao JC, Shah MH, Ito T, et al; RAD001 in Advanced Neuroendocrine Tumors, Third Trial (RADIANT-3) Study Group. Everolimus for advanced pancreatic neuroendocrine tumors[J]. N Engl J Med, 2011, 364 (6): 514-523.
16 Faivre S, Niccoli P, Castellano D, et al. Sunitinib in Pancreatic Neuroendocrine Tumors: Updated Progression-Free Survival and Final Overall Survival From a Phase Ⅲ Randomized Study[J]. Ann Oncol, 2016. [Epub ahead of print]
17 Yao JC, Pavel M, Lombard-Bohas C, et al. Everolimus for the Treatment of Advanced Pancreatic Neuroendocrine Tumors: Overall Survival and Circulating Biomarkers From the Randomized, Phase Ⅲ RADIANT-3 Study[J]. J Clin Oncol, 2016. [Epub ahead of print]
18 Moertel CG, Lefkopoulo M, Lipsitz S, et al. Streptozocin-doxorubicin, streptozocin-fluorouracil or chlorozotocin in the treatment of advanced islet-cell carcinoma[J]. N Engl J Med, 1992, 326 (8): 519-523.
19 Ekeblad S, Sundin A, Janson ET, et al. Temozolomide as monotherapy is effective in treatment of advanced malignant neuroendocrine tumors[J]. Clin Cancer Res, 2007, 13 (10): 2986-2991.
20 Crespo G, Jiménez-Fonseca P, Custodio A, et al. Capecitabine and temozolomide in grade 1/2 neuroendo-crine tumors: a Spanish multicenter experience[J]. Future Oncol, 2016. [Epub ahead of print]
21 Cives M, Ghayouri M, Morse B, et al. Analysis of potential response predictors to capecitabine/temozolomide in metastatic pancreatic neuroendocrine tumors[J]. Endocr Relat Cancer, 2016, 23 (9): 759-767.
22 Ramirez RA, Beyer DT, Chauhan A, et al. The Role of Capecitabine/Temozolomide in Metastatic Neuroendocrine Tumors[J]. Oncologist, 2016, 21 (6): 671-675.
23 Strosberg JR, Fine RL, Choi J, et al. First-line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas[J]. Cancer, 2011, 117 (2): 268-275.
24 Kulke MH, Stuart K, Enzinger PC, et al. Phase Ⅱ study of temozolomide and thalidomide in patients with metastatic neuroendocrine tumors[J]. J Clin Oncol, 2006, 24 (3): 401-406.
25 Chan JA, Stuart K, Earle CC, et al. Prospective study of bevacizumab plus temozolomide in patients with advanced neuroendocrine tumors[J]. J Clin Oncol, 2012, 30 (24): 2963-2968.
26 Cros J, Hentic O, Rebours V, et al. MGMT expression predicts response to temozolomide in pancreatic neuroendo-crine tumors[J]. Endocr Relat Cancer, 2016, 23 (8): 625-633.
27 Kulke MH, Hornick JL, Frauenhoffer C, et al. O6-methylguanine DNA methyltransferase deficiency and response to temozolomide-based therapy in patients with neuroendocrine tumors[J]. Clin Cancer Res, 2009, 15 (1): 338-345.
28 Walter T, van Brakel B, Vercherat C, et al. O6-Methylguanine-DNA methyltransferase status in neuro-endocrine tumours: prognostic relevance and association with response to alkylating agents[J]. Br J Cancer, 2015, 112 (3): 523-531.
29 Schmitt AM, Pavel M, Rudolph T, et al. Prognostic and predictive roles of MGMT protein expression and promoter methylation in sporadic pancreatic neuroendocrine neoplasms[J]. Neuroendocrinology, 2014, 100 (1): 35-44.
30 Sorbye H, Welin S, Langer SW, et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3): the NORDIC NEC study[J]. Ann Oncol, 2013, 24 (1): 152-160.
31 Jensen RT, Cadiot G, Brandi ML, et al; Barcelona Consensus Conference participants. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: functional pancreatic endocrine tumor syndromes[J]. Neuroendocrinology, 2012, 95 (2): 98-119.
(2016-12-28收稿)
Advances in Medical Treatment for Pancreatic Neuroendocrine Neoplasms
ZHANGYu,CHENMinhu,CHENJie.
DepartmentofGastroenterology,theFirstAffiliatedHospital,SunYat-SenUniversity,Guangzhou(510080)
CHEN Jie, Email: chen0jie@hotmail.com
Pancreatic neuroendocrine neoplasm (pNEN) is a kind of rare neoplasms with high heterogeneity. Surgery is the first choice to cure local resectable tumor. However, for patients with local advanced tumor or distant metastasis, medical treatment is the main option. Medical treatment mainly encompasses biotherapy, targeted therapy and chemotherapy. Clinicians should make therapeutic option for patients based on the functional status and somatostatin receptor status of the tumor, tumor grade, tumor stage and drug toxicity profile.
Pancreas; Neuroendocrine Tumors; Biotherapy; Molecular Targeted Therapy; Chemotherapy
10.3969/j.issn.1008-7125.2017.02.001
*本文通信作者,Email: chen0jie@hotmail.com
