709例药品不良反应/事件报告调查分析
2017-02-13邵丹,李忻,王华
邵 丹,李 忻,王 华
(吉林大学中日联谊医院 药学部,吉林 长春130033)
709例药品不良反应/事件报告调查分析
邵 丹,李 忻,王 华*
(吉林大学中日联谊医院 药学部,吉林 长春130033)
药品不良反应主要是指合格药品在正常用法用量下出现的与用药目的无关的有害反应[1]。随着越来越多的新药不断上市,联合用药及抗菌药物使用日益增多,药物在发挥治疗作用的同时,ADR/ADE发生率也不断增加,为提高临床治疗质量,需要防治药源性疾病的发生[2]。现就我院在2015年上报国家药品不良反应监测系统的709份ADR/ADE进行统计分析,为临床合理用药提供参考。
1 资料与方法
1.1 资料来源
“国家药品不良反应监测系统”中按报告接收时间为2015年1月1日至2015年12月31日,吉林大学中日联谊医院共上报并合格的ADR/ADE报告709份。
1.2 分析方法
依据WHO药品不良反应术语集,对ADR/ADE名称进行规范和完善。利用“国家药品不良反应监测系统”数据对患者情况、药品品种、给药途径、ADR/ADE累及系统-器官及临床表现类型、不良反应结果等项目汇总分析。
2 结果
2.1 患者的一般情况
709例ADR/ADE报告中,男性318例(44.85%),
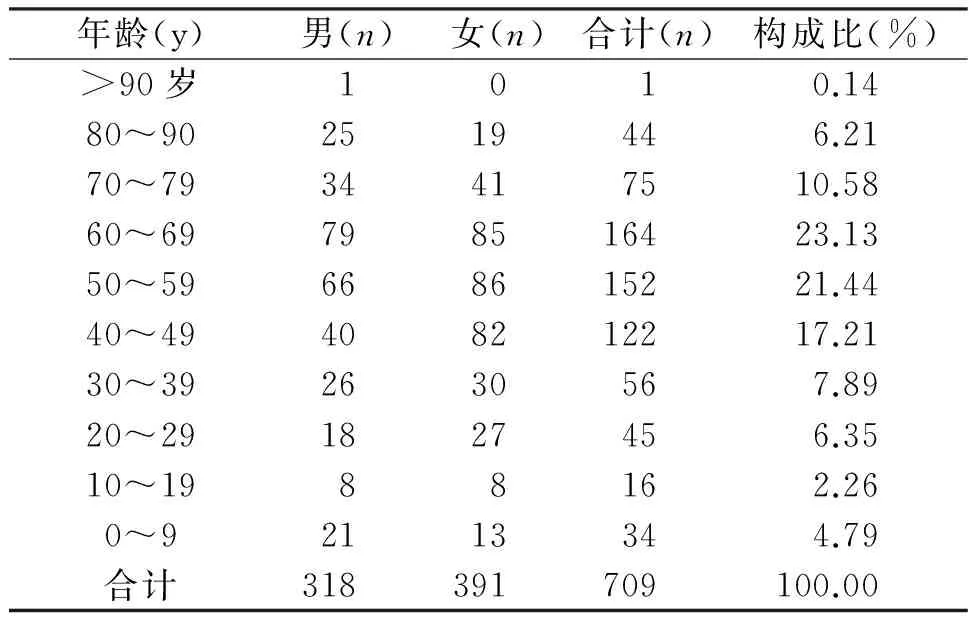
表1 患者性别及年龄分布情况
2.2 累及系统-器官及临床表现[3]
709例ADR/ADE报告中所涉及的系统-器官较多,以皮肤及其附件损害为最,主要表现为皮疹、瘙痒等症状,给予停药、针对性的抗过敏治疗后,症状均能消退(表2)。

表2 ADR/ADE累及系统-器官及主要临床表现
注:由于不良反应同时累及多个系统-器官,ADR/ADE例次大于病例数。
2.3 联合用药及给药途径
合并使用时易诱发ADR/ADE。合并用药种类越多,其ADR/ADE的发生率越高。我院709例ADR/ADE报告中,静脉给药发生ADR/ADE多种药物并用情况(表3)。引发ADE/ADE的给药途径以静脉注射为主603例(85.05%)(表4)。
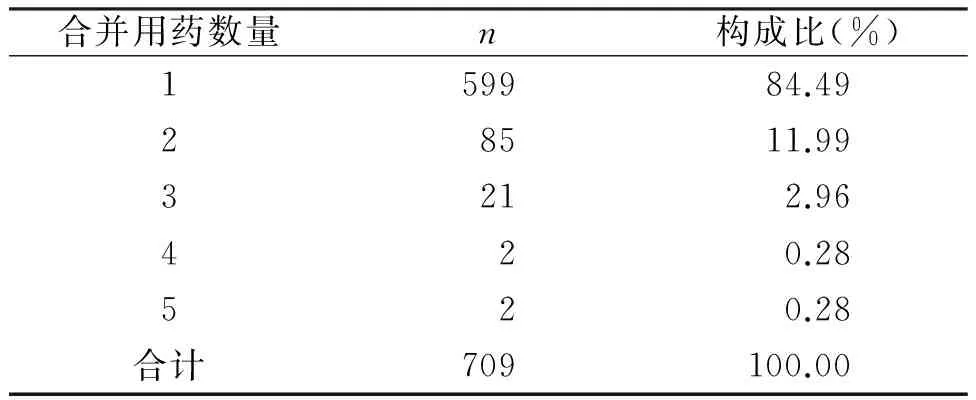
表3 静脉给药发生ADR/ADE情况
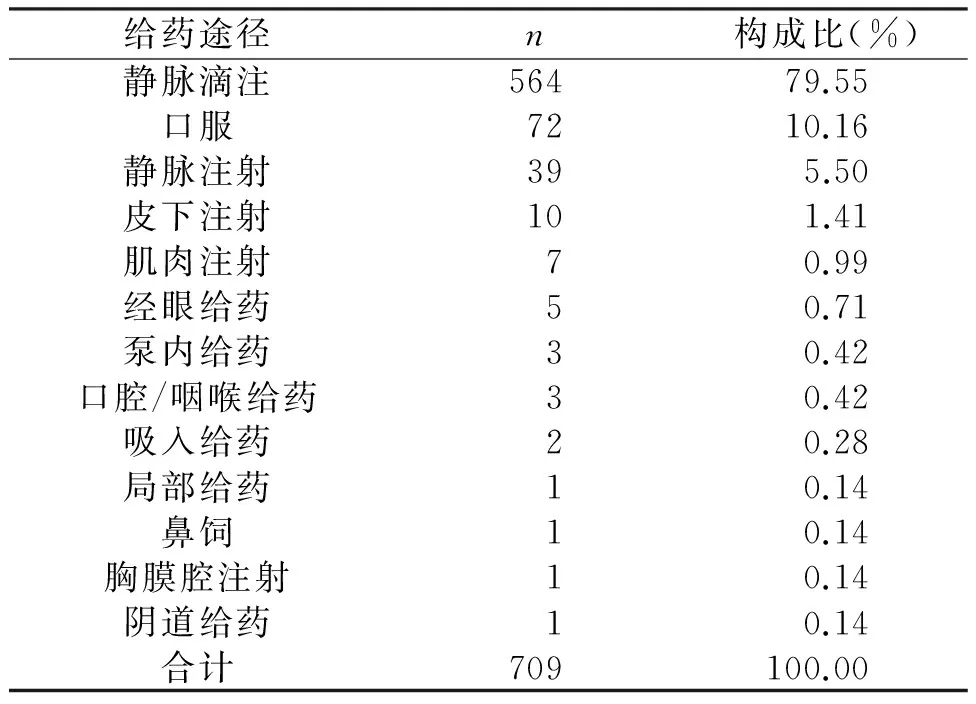
表4 发生ADR/ADE药品不良反应涉及药品给药途径情况
2.4 发生ADR/ADE的药品种类
709发生ADR/ADE病例,怀疑由化学药品(82.94%)及中药制剂(15.37%)引发的ADR/ADE例数及构成比(表5)。
2.5 发生ADR/ADE中抗菌药物的种类与构成比
The output signal vectors of sub-arrays Xa1,Xa2,Ya1and Ya2can be expressed separately as
抗菌药物引发的ADR/ADE共138例,位居首位,占19.46%;抗菌药物中头孢菌素类药物发生ADR/ADE49例,占35.51%,其次为喹诺酮类药物38例,占27.54%(表6)。
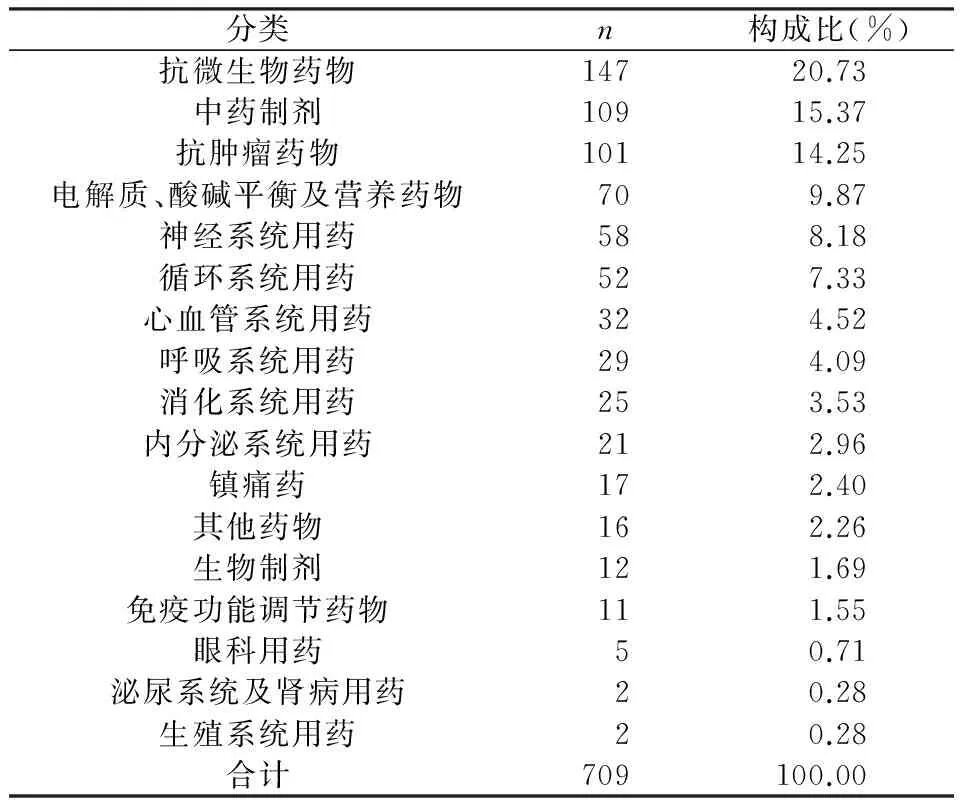
表5 发生ADR/ADE的药品种类及构成比
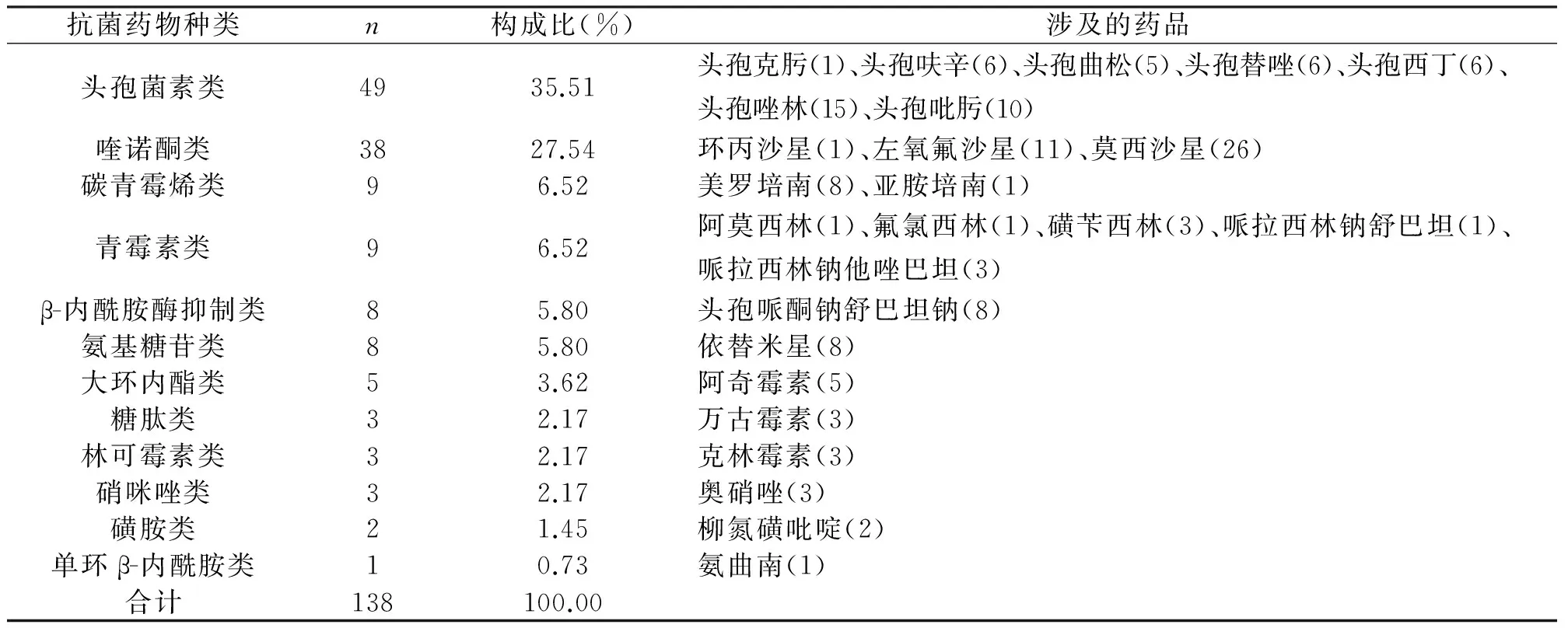
表6 ADR/ADE抗菌药物品种分布情况
2.6 发生ADR/ADE的中药注射剂的种类与构成比
中药注射剂发生ADR/ADE109例,居第二位,占15.37%。其中红花黄色素注射液发生ADR/ADE20例,占18.35%,注射用丹参多酚酸盐19例,占17.43%(表7)。
2.7 ADR/ADE上报情况分析
2014及2015年ADR/ADE上报抽查病例情况(表8)。
3 讨论
3.1 ADR/ADE发生率较高的人群
由表1可以看出60岁以上ADR/ADE 284例,占40.06%,明显高于其他人群。
老年人发生ADR/ADE较高的原因分析:老年人器官功能的老化及生理功能的减退,致使药物在机体吸收和代谢等环节发生改变,从而使老年人发生ADR/ADE的几率大大增加;同时由于老年人神经功能的减退,反应迟钝,使一些不良反应体征表现的不够明显,而且多数老年人原患疾病种类较多,可能出现不良反应的体征与某些疾病本身的变化相混淆的情况,增加诊疗困难,进而加大了ADR/ADE发生的几率,因此老年人用药应针对疾病慎重选择药物,注意药物间相互作用,以口服给药为主,药物剂量应根据个体情况酌减,用药过程中注意监测肝肾功能及ADR/ADE[4-6]。
14岁以下儿童发生ADR/ADE 的39例,占5.50%,由于儿童生理代谢、排泄功能差异,药动学与药效学特征与成人差异显著,对药物敏感性高,疾病治疗过程中机体处于免疫力低下状态等因素,易引起ADR/ADE。因此,老年人和儿童的用药问题应引起临床医师的高度重视。
3.2 ADR/ADE联合用药及给药途径分析
据相关报道,5种药物并用时,ADR/ADE发生率为4.2%;6-10种药物并用时,ADR/ADE发生率为 7.4%;20种药物并用时,ADR/ADE发生率为40%[7]。对我院709例发生ADR/ADE 时用药医嘱进行统计分析,结果单一用药引发的ADR/ADE 599例(84.49%),2种药物联用的为85例(11.99%),3种药物联用的21例(2.96%),4种药物联用的2例(0.28%),5种药物联用的2例(0.28%)。其发生ADR/ADE与很多药物说明书中对药物相互作用信息描述不完善有关。故在药物联用及配伍上应严格控制,密切监测,尤其是中、化药注射剂联用时,应中药组与化药组分别进行输注,以最大限度地减少ADR/ADE的发生[1]。静脉注射给药占85.05%,其他注射给药占2.82%,口服给药占10.16%,其他给药途径占1.97%。静脉注射的ADR/ADE发生率居于首位,高于国家年度报告[3]。静脉给药时,由于药物未经过肝脏代谢,直接进入到血液循环中,所以在毒素、pH值等因素的影响下,大大增加发生不良反应的几率,而且输液过程中可能产生微粒,增加了机体伤害的风险[1,8]。因此,从药物使用的安全性层面上,应该倡导针对患者病情的轻重及患者的个体差异的情况,选择合适的给药途径,以口服给药为主。对于这一点,WHO已将注射剂人均用药次数作为判定是否为合理用药的一项重要标准,使注射给药途径得以有效控制。
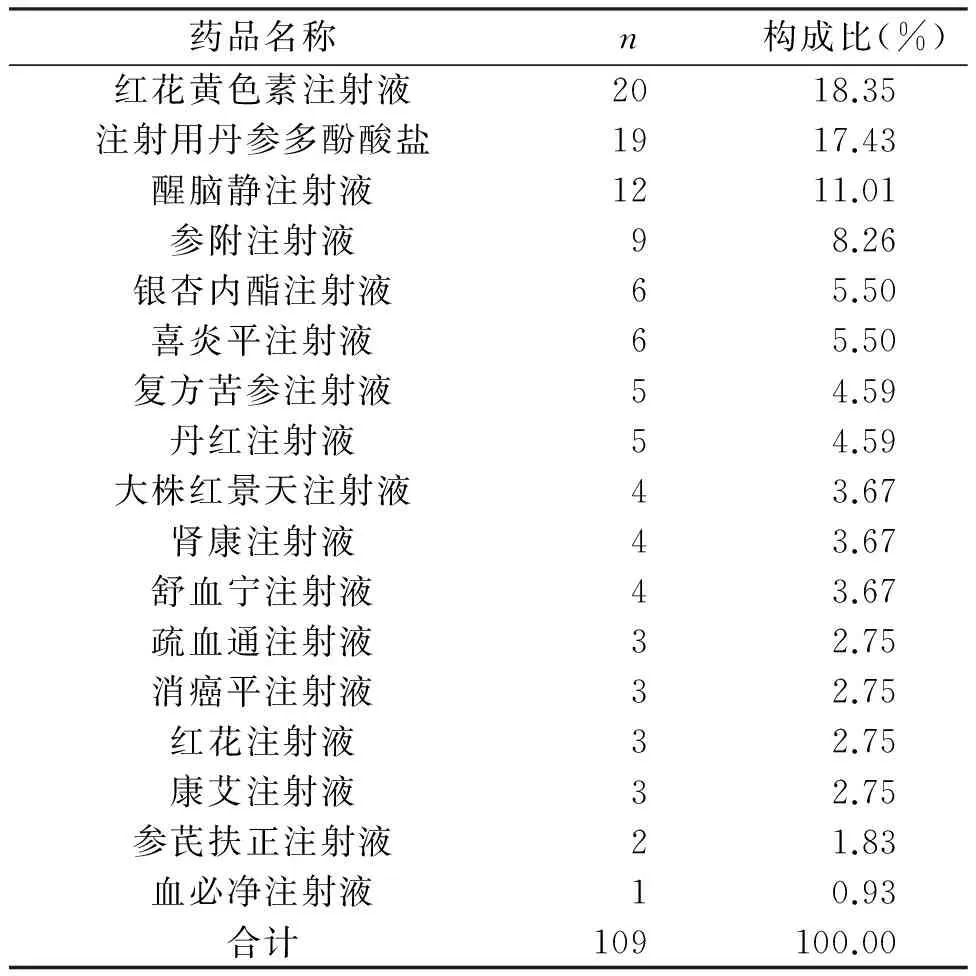
表7 ADR/ADE中药注射剂品种分布情况

表8 ADR/ADE上报率和上报合格率
3.3 ADR/ADE使用的抗感染药物
抗感染药物的ADR/ADE报告138例,占报告总数的20.73%,共涉及12类药品,共25个品种。抗感染药物引发的ADR/ADE中,儿童有27例,占18.37%。在抗感染药物引起的ADR/ADE中,头孢菌素类药物引发了49例ADR/ADE,位居第一,其次为氟喹诺酮类药物38例。考虑可能与头孢菌素类药物和氟喹诺酮类药物的广泛应用有关。其中头孢菌素类药物的优点在于安全有效,种类繁多;而氟喹诺酮类药物的优点则在于广谱高效,免做皮肤过敏试验的优点。在单个品种中,以盐酸莫西沙星氯化钠注射液的ADR/ADE最多26例,占18.84%。盐酸莫西沙星氯化钠注射液引发ADR/ADE数量居首位,一方面是因为广谱高效、免做皮试的优点得以广泛应用,另一方面因盐酸莫西沙星氯化钠注射液易导致光敏反应[9]。因此对于抗感染药物的使用,一定要严格遵循药品说明书、临床应用指导原则及相关使用指南的要求,力求使用抗感染药物引发的ADR/ADE降至最低。
3.4 ADR/ADE使用的中药注射剂
中药注射剂的ADR/ADE报告109例,占报告总数的15.37%。中药注射剂引发的ADR/ADE所占比例较高,原因在于中药注射剂大多由复方组成,成分复杂,制剂工艺有待完善,质量标准有待提高,且存放或使用过程中易发生变化[10],一些中药注射剂的有效成分被认为有致敏作用,同时多数中药注射剂溶解、配置及使用过程中,pH值、静置时间过长等因素均有可能会影响药物成分物理化学性质的变化,导致ADR/ADE发生,因此,在中药注射剂的配置、使用过程中,均应严格遵循药品说明书及相关的药品配置规范,注意药物适应症、用法用量等方面的合理使用,尽力避免ADR/ADE的发生。
3.5 ADR/ADE累及系统-器官及临床表现和转归
709例ADR/ADE报告中所涉及的系统-器官较多,以皮肤及其附件损害为最,主要表现为皮疹、瘙痒等症状;其次为消化系统损害,主要表现为恶心、呕吐,腹泻、腹痛等症状[3]。发生的ADR/ADE给予停药及抗过敏治疗后,症状均消退。709例ADR/ADE有60.23%(427例)好转;39.21%(278例)痊愈;未好转的有2例,结果不详的有2例。严重不良反应表现为牙关紧闭、呼吸困难、意识模糊等。给予异丙嗪肌注,地塞米松静推,尼可刹米静推后症状缓解。发生ADR/ADE99.44%的患者最终好转或痊愈。
3.6 ADR/ADE上报率和上报合格率
2014年上报国家药品不良反应监测中心的病例218份,有病例记录未上报的638份;2015年上报国家药品不良反应监测中心病例709份,有病例记录未上报的为314份。2014年ADR上报率和合格率仅为25.47%和23.85%。2015年前5个月筛选病例的基础上,从2015年6月起对筛查中漏报、怀疑药物过敏、上报病历无记录及上报药物与医嘱中记录不符的病例与相关临床科室进行沟通。2015年1-5月ADR/ADE上报率和合格率为31.06%和27.04%。经过有效沟通和监管措施,2015年6-12月ADR/ADE上报率和合格率为91.12%和87.29%。2015年ADR/ADE上报的整体水平较2014年有很大的提高。
[1]桂 月,华国栋.我院254例药品不良反应/事件调查分析[J].中国药物评价,2014,31(4):226.
[2]王 燕,安 琳.卫生统计学[M].北京:北京大学医学出版社,2009:102.
[3]国家食品药品监督管理局.国家药品不良反应监测年度报告(2014年),2015-07-17.
[4]朱明德,石应康.临床医学概要[M].第2版.北京:人民卫生出版社,2010:536-537.
[5]鹂章安,吴春福,李经才.现代老年药学[M].北京:中国医药科技出版社,2001:47- 47.
[6]高东宸,张丽雅.药物不良反应监测指南[M].北京:中国医药科学技术出版社,1996: 5-6.
[7]医学全在线.医院药学目录[EB/OL].(2014-8-29)[2016-4-14].http://www.med126.com/tcm/2014/20140829164531_1021985.shtml.
[8]吴永佩,焦亚辉.临床静脉用药调配与使用指南[M].北京:人民卫生出版社,2010:49.
[9]杨宝峰.药理学[M].第7版.北京:人民卫生出版社,2011:414-418.
[10]杨国正,何 燕,高 天,等.354例中药注射剂不良反应报告分析[J].四川医学,2012,33(2):248.
1007-4287(2017)01-0123-04
吉林省食品药品安全检测中心资助[(2015)科技字(474)号]
2016-04-20)
*通讯作者
