痰热清注射液对慢性阻塞性肺疾病模型大鼠气道黏液高分泌的影响*
2017-01-07蔡凌峰王慧贤林观康黄东晖
蔡凌峰,王慧贤,林观康,黄东晖△
1. 广州中医药大学 (广州 510000);2广东省中医院珠海医院 呼吸内科(珠海 519000);3.广州市中西医结合医院 呼吸内科(广州 510000)
·论 著·
痰热清注射液对慢性阻塞性肺疾病模型大鼠气道黏液高分泌的影响*
蔡凌峰1,王慧贤2,林观康3,黄东晖2△
1. 广州中医药大学 (广州 510000);2广东省中医院珠海医院 呼吸内科(珠海 519000);3.广州市中西医结合医院 呼吸内科(广州 510000)
目的 观察痰热清注射液对慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)模型大鼠气道黏液高分泌的影响,探讨“清热化痰”的效应机制。方法 采用简单随机法将SD大鼠60只分为正常组、模型组和痰热清组,每组20只。采用香烟烟熏加气道内滴注脂多糖的方法建立COPD大鼠模型,于实验第41日开始,痰热清组予痰热清注射液、模型组及正常组予生理盐水腹腔注射,1次/d,连续10 d。运用实时荧光定量聚合酶链式反应法(real-time polymerase chain reaction,RT-PCR)检测大鼠肺组织中黏蛋白5AC(MUC5AC)mRNA水平,并观察肺组织病理形态的变化。结果 RT-PCR检测显示,痰热清组MUC5AC mRNA的表达程度较模型组低(P<0.05)。病理学检测(HE染色)示模型大鼠肺组织出现肺泡壁破裂、肺泡腔扩大、肺泡融合,并伴有炎细胞浸润。过碘酸雪夫染色(AB-PAS)下可见痰热清组大鼠支气管黏膜上皮内杯状细胞较模型组明显减少,痰热清组PAS阳性区域面积明显小于模型组(P<0.05)。结论 痰热清注射液能抑制COPD模型大鼠MUC5AC mRNA的表达,并可能藉此减轻气道黏液高分泌,改善气道阻塞。
痰热清注射液;慢性阻塞性肺疾病;气道黏液高分泌;MUC5AC mRNA
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)居全球死亡原因第4位,世界卫生组织研究显示,COPD的全球经济负担至2020年将攀至所有疾病的第5位[1]。气道黏液高分泌是COPD的主要特征之一,也是COPD急性发作和预后变差的独立危险因素;既易致呼吸道细菌定植,又会使肺通气功能下降。然而,目前气道黏液高分泌的治疗疗效不佳,患者从中获益极小,故其已成为COPD防治研究的新热点。现代中医学研究认为,COPD急性加重时证候多为痰热壅肺证[2-3],而清热化痰法则是逆转COPD急性加重的重要治法;研究证明祛痰中药可减少黏液分泌量,降低痰黏稠度,从而缩短气道黏液高分泌亢进状态的时间[4-5],同时大量研究已证实痰热清注射液具有抗炎、祛痰止咳的效果,对慢性支气管炎和慢性阻塞性肺病急性加重具有显著作用[6-7]。本研究采用气道内滴注脂多糖联合烟熏的复合方法建立COPD大鼠模型,通过观察肺组织杯状细胞增生程度及RT-PCR法检测MUC5AC蛋白转录子表达,探讨痰热清注射液的效应机制。
1 材料与方法
1.1 材料
1.1.1 主要药物 痰热清注射液(10 mL/支),上海凯宝药业股份有限公司,生产批号Z20030054;脂多糖(LPS),货号L2880-10MG。大前门香烟,焦油量23 mg/支,上海卷烟厂。
1.1.2 实验动物 清洁级健康SD大鼠,雄性,共60只,鼠龄10~12周,体质量(200±20) g,购自南方医科大学实验动物中心,合格证号4400210000 4220。动物适应性饲养2 d后开始实验,于实验流程第1天采用随机数字表法将其随机分为3组:正常组、模型组和痰热清组,每组20只,记录大鼠体质量。
1.1.3 主要仪器与试剂 Veriti 96-Well Thermal Cycler PCR仪(Thermo Scientific公司);7500 Real Time PCR System荧光定量基因扩增仪(Thermo Scientific公司);Allegra X-22R多功能台式冷冻离心机(Beckman Coulter 公司); Eppendorf 系列微量移液器(德国 Eppendorf 公司);光学显微镜、显微摄像仪(日本OLYMPUS 公司);自制动物熏吸箱(60 cm×50 cm×40 cm)。SYBR®Premix Ex TaqTMII (Tli RNaseH Plus,型号RR820A,批号AK6703);PrimeScriptTMRT Master Mix (Perfect Real Time,型号RR036A,批号A3601-1);上述试剂盒均由Takara公司生产;Trizol(型号15596026)由invitrogen公司生产。
1.2 实验方法
1.2.1 动物造模及给药方法 在第1、8和15天,用1%的戊巴比妥钠(40 mg /kg) 腹腔注射麻醉,仰卧位固定于大鼠固定板,暴露声门,将18号静脉套管针快速插入气管,拔出针芯,用1 mL 注射器注入溶于生理盐水的LPS 200 μL(1 g/L) ,然后将大鼠固定板直立旋转,使LPS 能够均匀分布于两肺。正常组同期气管内注入生理盐水,其余无特殊处理。第2~40天(第8、15天除外)将大鼠置入熏吸箱内,内熏10支香烟,每天上午、下午各30 min。实验第41~50天停止烟熏,痰热清组予痰热清注射液腹腔注射(痰热清注射液以1∶5的比例用生理盐水稀释,剂量按成人最大40 mL/60 kg计算),每日一次;正常组及模型组则予腹腔注射相应体积的生理盐水,每日一次。以上给药共10 d。
1.2.2 取材及标本制备方法 从实验第51天起进行取材及指标检测。1 %(40 mg/kg)戊巴比妥钠腹腔注射麻醉后,腹主动脉放血处死动物,开胸取左肺迅速置入-80 ℃超低温冰箱保存,用于RT-PCR检测;每组随机选取7只大鼠,取右肺用4 %多聚甲醛灌注固定,石蜡包埋,行HE染色及AB-PAS染色;每张切片随机选取4个视野,各取照片1张(HE:100 ×,AB-PAS:400 ×)。
1.2.3 RT-PCR检测方法 左肺制作组织匀浆后,从组织匀浆中以Trizol法提取RNA,再按试剂盒说明书步骤以RT-PCR法检测组织中MUC5AC mRNA表达程度 (引物序列见表1)。
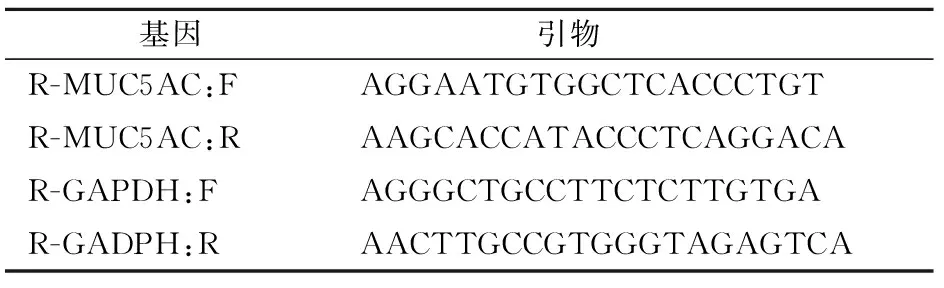
表1 引物序列
1.3 图片处理
运用Image-pro Plus(v6.0)对摄取的AB-PAS染色切片图像进行计算。
1.4 统计学方法
2 结果
2.1 一般资料
共60只实验动物,实验过程中死亡5只,其中痰热清组3只,模型组2只,分别于实验第8日、第15日气道内滴入LPS后或其后2 d内的烟熏中死亡。可能的死亡原因为造模后大鼠的基础状况及肺功能明显变差,对麻醉药物以及烟熏的耐受程度下降。
2.2 HE染色观察
对3组大鼠肺组织病理切片进行观察,正常组可见肺内各级支气管黏膜上皮细胞排列整齐,支气管周围无明显炎症细胞浸润;肺泡结构连续,肺泡壁完整。模型组则可见支气管黏膜充血水肿,上皮细胞变性坏死糜烂脱落,支气管周围大量慢性炎性细胞浸润;肺泡管、肺泡囊及肺泡明显扩大,间隔变薄、断裂,肺泡扩大融合形成大的囊腔。痰热清组与模型组相比,支气管黏膜上皮细胞变性坏死以及炎细胞浸润程度均明显减轻,肺大泡数量减少。提示痰热清注射液能减轻炎症反应程度,还可减轻危险因素对肺泡结构的破坏 (图1)。
2.3 AB-PAS染色观察
正常组大鼠肺组织病理切片未见支气管黏膜含有紫红色颗粒的杯状细胞。在模型组大鼠肺组织病理切片中,则可见支气管黏膜上皮含有较多杯状细胞。痰热清组大鼠肺组织与模型组相比,支气管黏膜上皮内杯状细胞明显减少(结果见图2)。黏液PAS反应阳性,镜下呈现紫红色,模型组、痰热清组PAS阳性区域面积均大于正常组,痰热清组PAS阳性区域面积明显小于模型组(表2),提示痰热清注射液能抑制杯状细胞化生,减少黏液分泌。
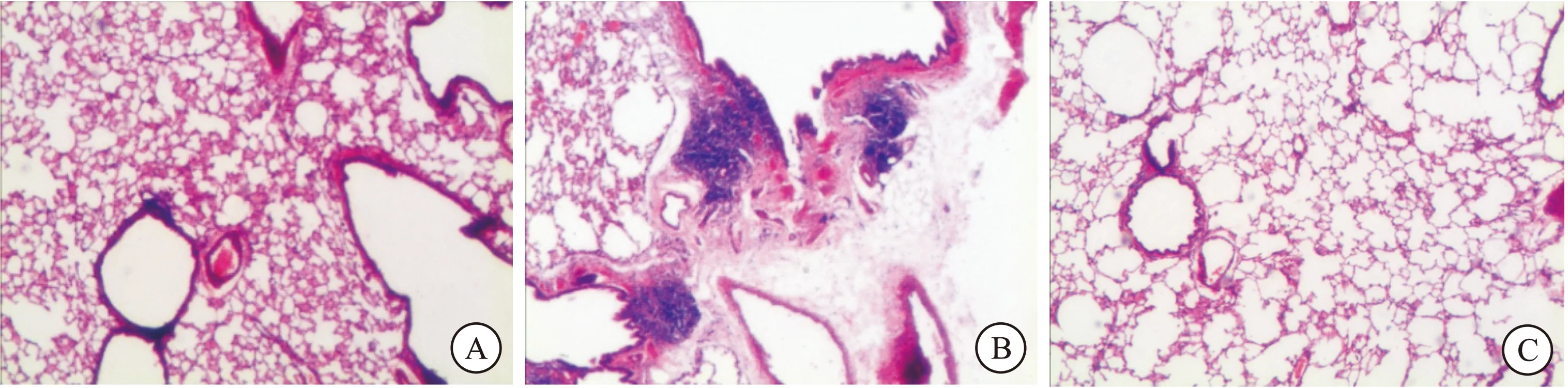
图1 HE染色各组肺组织病理切片(100 ×)
注:A.正常组;B.模型组;C.痰热清组
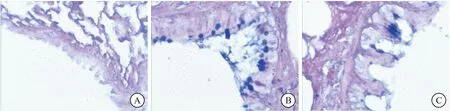
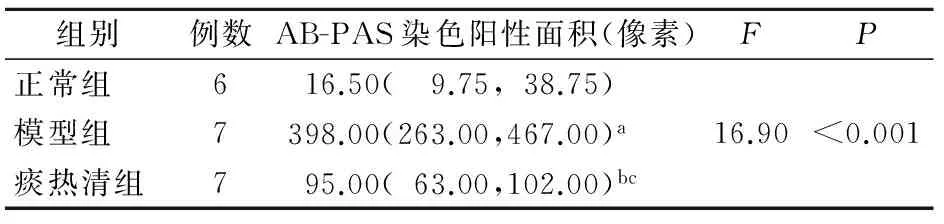
图2 AB-PAS染色各组肺组织病理切片(400 ×)
注:与正常组相比,其余两组阳性面积较大,aP<0.001,bP=0.048;与模型组相比,痰热清组面积较小,cP=0.027;以上差异均有统计学意义
2.4 MUC5AC mRNA表达程度
肺组织中MUC5AC mRNA表达比较,痰热清组2-△△CT值低于模型组,差异有统计学意义(表3)。
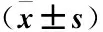
表3 肺组织中MUC5AC mRNA比较
3 讨论
气道黏液高分泌是COPD的主要特征,也是其急性发作和预后变差的独立危险因素,对此进行针对性治疗具有重要意义。一方面,存在气道黏液高分泌和反复发作的患者FEV1下降程度更严重[8];气道黏液高分泌使得病原体定植及气道阻塞加重,进而使COPD急性发作频率和病死率升高[9-10]。另一方面,针对气道病理性黏液的治疗可改善COPD的症状、减少发作频率、减缓疾病进展[11]。因此,在慢性阻塞性肺病的评估与治疗方面,应充分考虑气道黏液高分泌的重要作用[12]。
气道黏液高分泌的产生与炎症反应、氧化应激、蛋白酶失衡和胆碱能神经功能紊乱等多种病理生理机制有关。数种机制的中间关键环节均为对MUC基因表达的调控。IL-1β可通过与其受体IL-1R结合增强环氧化酶-2(Cyclooxygenase-2,COX-2)活性,进而通过环磷酸腺苷/蛋白激酶A(cAMP/PKA)通路上调MUC基因表达。TNF-α可活化NF-κB,随之NF-κB移入细胞核,使得MUC基因表达上调。中性粒细胞弹性蛋白酶(neutrophi elastase,NE)可通过蛋白酶激活受体2(protease activated receptor-2,PAR2)增加细胞内钙浓度,由此激活蛋白激酶C (protein kinases-C,PKC),进一步导致MUC5AC的分泌[13]。抑制NE的药物可降低MUC的转录水平[14],也说明了NE对MUC基因存在调控作用。上述多种机制导致MUC基因表达上调,进而导致杯状细胞增生/化生,黏蛋白分泌增加。在慢性气道炎症性疾病中,病理性黏蛋白分泌增加,主要表型是MUC5AC,同时杯状细胞产生的黏蛋白MUC5AC 被认为是该细胞增生的标志[15];在COPD急性发作期MUC5AC mRNA表达水平显著增高。COPD急性加重时,杯状细胞分泌为主的、过度的MUC5AC表达具有突出病理意义[16]。
气道黏液高分泌属于中医“痰热壅肺证”范畴,现代药理研究证实痰热清注射液在治疗慢性阻塞性肺疾病急性加重时可取得较好的疗效[17-18],但其发挥清热化痰功效的机理尚未明确。因此,本研究通过观察MUC5AC mRNA表达及肺组织杯状细胞增生程度,探讨痰热清注射液清热化痰的效应机制和对气道黏液高分泌的影响。
本研究模型大鼠肺组织RT-PCR检测结果显示,痰热清组的MUC5AC表达低于模型组,提示痰热清注射液可以抑制MUC5AC mRNA的表达,说明痰热清注射液可能通过调节MUC5AC mRNA的表达,抑制气道黏液高分泌,改善气道阻塞。
本研究中肺组织AB-PAS染色病理切片观察结果显示,与模型组相比,痰热清组大鼠肺组织的杯状细胞明显减少;痰热清组PAS阳性区域面积明显小于模型组,说明在痰热清注射液的干预下,杯状细胞化生减少、增生程度降低,黏液分泌减少。因此,通过对MUC5AC mRNA表达的下调来减轻杯状细胞增生/化生以及抑制气道黏液高分泌,是痰热清注射液“清热化痰”效应产生的可能作用环节之一。
综上所述,痰热清注射液清热化痰,使得肺气宣发肃降无所阻碍,则咳止喘平。本研究展现了其作为COPD气道黏液高分泌针对性治疗药物的潜力,为基于“清热化痰”的气道黏液高分泌治疗研究提供了实验依据。然而,痰热清注射液干预气道黏液高分泌的其他机制有待研究;其干预MUC5AC mRNA的上游机制尚未明确。清热化痰药物调控MUC5AC的多种分子通路的作用可能将成为下一步研究的热点。
[1]Vestbo J, Hurd S, Agusti A,etal.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease, GOLD Revised 2011 [EB/OL]. (2011-12-30) [2012-03-15]. https://www.mendeley.com.
[2]王至婉, 李建生,余学庆,等. COPD急性加重期基础证及特征的临床调查研究[J].北京中医药大学学报,2010,33(10):703-708.
[3]陈凯佳, 梁直英. 500例慢性阻塞性肺疾病中医证型规律探讨[J]. 现代中西医结合杂志,2002,11(18):1755-1757.
[4]李文, 毛兵,王刚,等. 从气道炎症和气道黏液高分泌研究清热化痰法治疗慢性阻塞性肺疾病急性加重期痰热阻肺证的机制[J].中西医结合学报,2008(8):799-805.
[5]邬海桥, 丁阳平,周向东. 红茶提取物在炎性气道黏液高分泌中的作用[J]. 上海交通大学学报(医学版),2009,29(2):126-129,144.
[6]潘颖, 付秀华,高俊珍,等. 痰热清注射液联合基础疗法治疗AECOPD的疗效及对血清细胞因子的影响[J]. 中医药导报,2015(15):66-69.
[7]龚国良, 李欣. 痰热清注射液治疗慢性阻塞性肺病急性加重期的临床疗效及细胞因子水平的研究[J]. 中国中药杂志, 2009, 34(1): 104-105.
[8]Allinson J P,Hardy R,Donaldson G C,etal. The presence of chronic mucus hypersecretion across adult life in relation to COPD development[J]. Am J Respir Crit Care Med,2016,193(6):662-672.
[9]Silverman E K. Exacerbations in chronic obstructive pulmonary disease: do they contribute to disease progression[J]. Proc Am Thorac Soc, 2007,4(8):586-590.
[10] Langsetmo L,Platt R W, Ernst P,etal. Underreporting exacerbation of chronic obstructive pulmonary disease in a longitudinal cohort[J]. Am J Respir Crit Care Med,2008,177(4):396-401.
[11] Fahy J V,Dickey B F. Airway mucus function and dysfunction[J]. N Engl J Med,2010,363(23): 2233-2247.
[12] Miravitlles M.Cough and sputum production as risk factors for poor outcomes in patients with COPD[J].Respir Med,2011,105(8):1118-1128.
[13] Zhou J, Perelman J M, Kolosov V P,etal. Neutrophil elastase induces MUC5AC secretion via protease-activated receptor 2[J].Mol Cell Biochem,2013,377(1):75-85.
[14] 王晓龙, 周向东. 中性粒细胞弹性蛋白酶抑制剂对慢性炎症气道高分泌的干预作用[J]. 临床肺科杂志,2004,9(3):231-232.
[15] Rose M C,Voynow J A.Respiratory tract mucin genes and mucin glycoproteins in health and disease[J].Physiological Rev,2006,86(1):245-278.
[16] 周向东, 童瑾,兰箭. 慢性阻塞性肺疾病患者气道粘蛋白分子表型的研究[J]. 中华结核和呼吸杂志,2002,25(7): 437.
[17] 黄东晖, 李硕. 痰热清注射液治疗慢性阻塞性肺疾病急性加重期临床观察[J].辽宁中医药大学学报, 2009, 11(10): 99-100.
[18] 王铁琼. 应用痰热清治疗慢性阻塞性肺病急性加重期患者的疗效观察[J].中国医药指南, 2010, 8(19): 280-281.
The Effect of Tanreqing Injection on the Airway Mucus Hypersecretion of COPD Rats
CaiLingfeng1,WangHuixian2,LinGuankang3,HuangDonghui2△.
1.GuangzhouUniversityofTCM,Guangzhou510000,China; 2.DepartmentofRespiratory,ZhuhaiBranchHospitalofGuangdongHospitalofTCM,Zhuhai519000,China; 3.DepartmentofRespiratory,GuangzhouHospitalofIntegratedTCMandWesternMedicine,Guangzhou510000,China
Objective To investigate the effect of Tanreqing injection on the airway mucus hypersecretion in rats with chronic obstructive pulmonary disease (COPD), and explore the effect mechanism of “clearing heat and dissipating phlegm”. Methods 60 SD rats were randomly divided into the normal group, model group and experiment group, and each group consists of 20 rats. The models of COPD rats were established by means of cigarette smoking and tracheal instillation of lipopolysaccharide (LPS). The normal and model groups were given saline via intraperitoneal injection once per day from the 41st day to the 50th day of the experiment, while the experiment group was given Tanreqing injection once per day on the corresponding days. Real-time polymerase chain reaction (RT-PCR) was adopted to measure the gene expression levels of MUC5AC mRNA of the rats′ lung tissues, and the pathological section of these lung tissues were observed. Results The RT-PCR results showed that the expression levels of MUC5AC mRNA were significantly lower in the experiment group than in the model group (P<0.05). The results of HE staining showed that the rupture of alveolar wall, expansion of alveolar space, alveolar fusion, and infiltration of inflammation cells were observed in the model group. The results of alcian blue-periodic acid schiff stain (AB-PAS) showed that the goblet cells of the bronchial epithelium in the experiment group decreased significantly (P<0.05) and the positive staining areas of AB-PAS were also significantly smaller in the experiment group than in the model group. Conclusion Tanreqing injection can inhibit the expression levels of MUC5AC mRNA in the models of COPD rats, which can probably relieve their airway mucus hypersecretion and ameliorate their airway obstruction.
Tanreqing injection; Chronic obstructive pulmonary disease; Airway mucus hypersecretion; MUC5AC mRNA
10.3969/j.issn.1674-2257.2016.06.003
广东省科技计划自筹经费项目(No:00462830227154043)
R285.5
A
△通信作者:黄东晖,E-mail:13600001163@139.com
