金葡菌主动外排蛋白QacA α-螺旋1、2及TMS1氨基酸的功能研究*
2016-12-26赵启全黄文祥
简 丽, 赵启全, 贾 蓓, 黄文祥
(重庆市大足区人民医院 1内分泌科, 2呼吸内科,重庆 402360;3重庆市传染病寄生虫病学重点实验室,重庆医科大学附属第一医院感染科,重庆 400016)
·短篇论著·
金葡菌主动外排蛋白QacA α-螺旋1、2及TMS1氨基酸的功能研究*
简 丽1, 赵启全2, 贾 蓓3△, 黄文祥3
(重庆市大足区人民医院1内分泌科,2呼吸内科,重庆 402360;3重庆市传染病寄生虫病学重点实验室,重庆医科大学附属第一医院感染科,重庆 400016)
目的: 评价金黄色葡萄球菌多药耐药主动外排蛋白QacA α-螺旋1和2及跨膜区(TMS)1上的氨基酸对于底物转运的重要性。方法:采用半胱氨酸定点诱变的方法诱变QacA蛋白α-螺旋1和2及TMS1上的氨基酸I2、S3、F4、F5、T6、K7、D10、M11、R17、W18、T19、A20、V21、V22、V23、F29、D34、P43、E48、E50、P51和Q55。测定诱变菌株最低抑菌浓度(MIC)和最低杀菌浓度(MBC)以及荧光运输试验分析氨基酸的功能变化。结果:MIC和MBC结果分析提示获得的诱变菌株S3C、T6C、R17C、T19C、A20C、F29C和E50C对所测药物完全恢复敏感性,F4C、F5C和P51C对所测药物耐药性明显降低。运输试验结果与MIC、MBC结果一致,提示10株诱变菌株失去对底物的转运能力。结论:QacA蛋白α-螺旋1和2及TMS1上的氨基酸S3、F4、F5、T6、R17、T19、A20、F29、E50 和 P51可能与QacA蛋白一价和二价阳离子底物的结合和转运功能密切相关。
金黄色葡萄球菌; QacA蛋白;跨膜区; α-螺旋; 半胱氨酸定点诱变
金黄色葡萄球菌是导致社区感染和院内感染的重要病原菌[1]。金黄色葡萄球菌胞壁及其分泌的外毒素具有极强的致病力[2-3]。该菌对多种抗菌药物的高度耐药性给临床治疗带来了极大的困难。据国内耐药监测统计,2008~2011年金黄色葡萄球菌院内感染率分别为32.2%、32.5%、32.8%和35.56%,感染的分布各地区虽有不同,但总体上有逐年上升的趋势。事实上,经医护人员传播是导致院内感染的主要原因之一,因此,阻断其传播的重要措施就是使用消毒剂和杀菌剂对潜在污染的手、工作服、器具、房间等进行去污处理。研究发现金黄色葡萄球菌对消毒剂和杀菌剂耐药的主要机制即多药外排泵,其中最主要的是qac基因编码的Qac多药外排泵。近年来的研究表明qac基因家族有qacA、qacB、qacC、qacD、qacE、qacF、qacG、qacH、qacJ等,其中以金葡菌多重耐药质粒如pSK1[4-5]上的qacA基因研究较多。qacA基因编码的QacA外排蛋白至少对30种一价和二价的亲脂性阳离子类抗菌药物耐药[6],其外排的多数抗菌药物为临床重要的消毒剂和杀菌剂,包括溴化乙锭(ethidium bromide,EB)、苯扎氯铵(benzalkonium chloride,BC)、派若宁(pyronin Y,PY)、地喹氯铵(dequanlinium chloride,DC)、氯己定(chlorhexidine,CH)等。QacA蛋白有514个氨基酸,约54 kD,属于主动外排蛋白的主要易化超家族中的DHA14亚类,具有14个跨膜α-螺旋[4]。既往研究显示QacA 蛋白中的甘氨酸、脯氨酸、芳香族氨基酸,如在TMS1的D34,TMS2的Y63,TMS4的R114,TMS5的P161,TMS6的H174,TMS10的M319、D323、P328,TMS10的G313,TMS11 的Y358C,TMS13的D411和Y410,TMS13的Y429等[5-6]与其外排作用密切相关,这些氨基酸定点诱变后,能使QacA 蛋白对一价和二价的亲脂性阳离子类抗菌剂的耐药性和运输活性均降低。因此对金黄色葡萄球菌QacA蛋白上氨基酸的研究可以进一步了解金葡菌的耐消毒剂和杀菌剂机制。本研究对QacA蛋白α-螺旋(α-helix)1、2细胞膜上的14个氨基酸和跨膜区(transmembrane segment, TMS)1的8个氨基酸位点进行半胱氨酸定点诱变,测定诱变后菌株最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration, MBC)的变化,并进行运输试验比较诱变前后细菌的转运功能变化。
材 料 和 方 法
1 菌株和质粒
重组质粒pBluescript II SK(+)/qacA由本实验室提供,大小为4 511 bp,具有氨苄青霉素抗性,该克隆质粒经序列测定和分析,证明其编码框序列完整,无突变、缺失。大肠杆菌DH5α感受态细胞购于北京鼎国公司。
2 主要试剂及材料
溴化乙锭、苯扎氯胺、派若宁、地喹氯铵、氯己定等购于Sigma。
3 半胱氨酸定点诱变
根据qacA基因的全序列及氨基酸序列,设计寡核苷酸引物(可引入适合的内切酶位点),以QacA 野生型(wild-type,WT)的质粒 [qacA克隆入pBluescript II SK(+)] 为模板,用PCR扩增基因,用DpnI除去模板质粒后,转化大肠杆菌DH5α感受态细胞,挑选12株转化菌株,提取质粒用相应的内切酶筛选可能的突变株,并测序(由重庆医科大学省部共建感染性疾病分子生物学重点实验室完成)确证无二次突变,保存菌株。然后以MIC和MBC检测各突变株突变后的耐药情况并比较表达量。诱变引物序列见表1。诱变PCR条件为95 ℃ 4 min;95 ℃ 50 s,60 ℃ 30 s,68 ℃ 9 min。
4 最低抑菌浓度和最低杀菌浓度的测定
选取有代表性的一价和二价化合物(Py、Dc、Ch、Bc和Eb),采用琼脂平板稀释法,以QacA WT为阳性对照,pBluescript II SK(+)转化入大肠杆菌DH5α为阴性对照,测试诱变株的药物敏感性。分别于接种后24 h观察细菌生长情况界定MIC,48 h后观察MBC。
5 运输试验
本实验使用EB进行荧光运输试验。将离心过夜培养的半胱氨酸定点诱变成功的菌株用20 mmol/L的HEPES(pH 7.0)重悬,均将A650值调整到0.6。每 1 mL细菌液中加入甲酸钠溶液,再加入不同浓度(0.1 mg/L、0.3 mg/L、0.5 mg/L、0.7 mg/L、0.9 mg/L、10.0 mg/L、11.0 mg/L)的EB,37 ℃ 培养箱中培养2 h后,用荧光分光光度仪(Eppendorf)测定菌株的运输活性。
结 果
1 MIC的测定结果
22株诱变菌株的MIC值测定结果提示,S3C、T6C、R17C、T19C、A20C、F29C和E50C对所测药物完全恢复敏感性;F4C、F5C和P51C对所测药物耐药性明显降低;I2C、K7C、D10C、M11C、W18C、V21C、V22C、V23C、D34C、P43C、E48C和Q55C与阳性对照菌株(QacA WT)结果近似。其中T6C菌株的生长能力有所下降,多次摇床培养均较其余菌株需要更多的时间,见表2。

表1 诱变的引物序列
F: forward; R: reverse.
表2 半胱氨酸定点诱变株MIC的变化
Table 2.The changes of the MIC (mg/L ) from the mutants after cysteine site-directed mutagenesis

StrainPYDCCHBCEBVector64320.2512816QacAWT1282562256512I2C2563222561024S3C16320.56416F4C641281256256F5C64640.5128256T6C64320.25256512K7C2562562256>1024D10C2562562256>1024M11C2562562256>1024R17C8320.2525616W18C322562256128T19C16320.525616A20C32320.564128L21C322560.25128512V22C642561256256V23C642562512512F29C32320.25256256D34C2562564256>1024P43C2562562256>1024E48C2562562256>1024E50C8320.512816P51C64320.5128256Q55C2562562128>1024
2 MBC的测定结果
22株诱变菌株的MBC值测定结果大致同MIC值,S3C、T6C、R17C、T19C、A20C、F29C和E50C对所测药物完全恢复敏感性;F4C、F5C和P51C对所测药物耐药性明显降低;I2C、K7C、D10C、M11C、W18C、V21C、V22C、V23C、D34C、P43C、E48C和Q55C与阳性对照菌株(QacA WT)结果近似,见表3。
表3 半胱氨酸定点诱变株MBC的变化
Table 3.The changes of the MBC (mg/L) from the mutants after cysteine site-directed mutagenesis

StrainPYDCCHBCEBVector1282560.564256QacAWT25651222561024I2C51212825122048S3C64640.525632F4C1282561256512F5C1282561256512T6C1281280.5256512K7C25625622562048D10C256102422562048M11C25625622562048R17C64640.2525616W18C12810242256512T19C1282560.525632A20C32641128256L21C1285121256512V22C12851222561024V23C1285122512512F29C64640.52561024D34C25651242562048P43C25651221282048E48C25625622562048E50C128640.5128256P51C128641128512Q55C25651221282048
3 运输试验的结果
运输试验的结果如图1、图2所示,S3C、F4C、F5C、T6C、R17C、T19C、A20C、F29C、E50C和P51C诱变菌株失去对EB的转运能力;I2C、K7C、D10C、M11C、W18C、V21C、V22C、V23C、D34C、P43C、E48C和Q55C仍保持较高的转运活性。
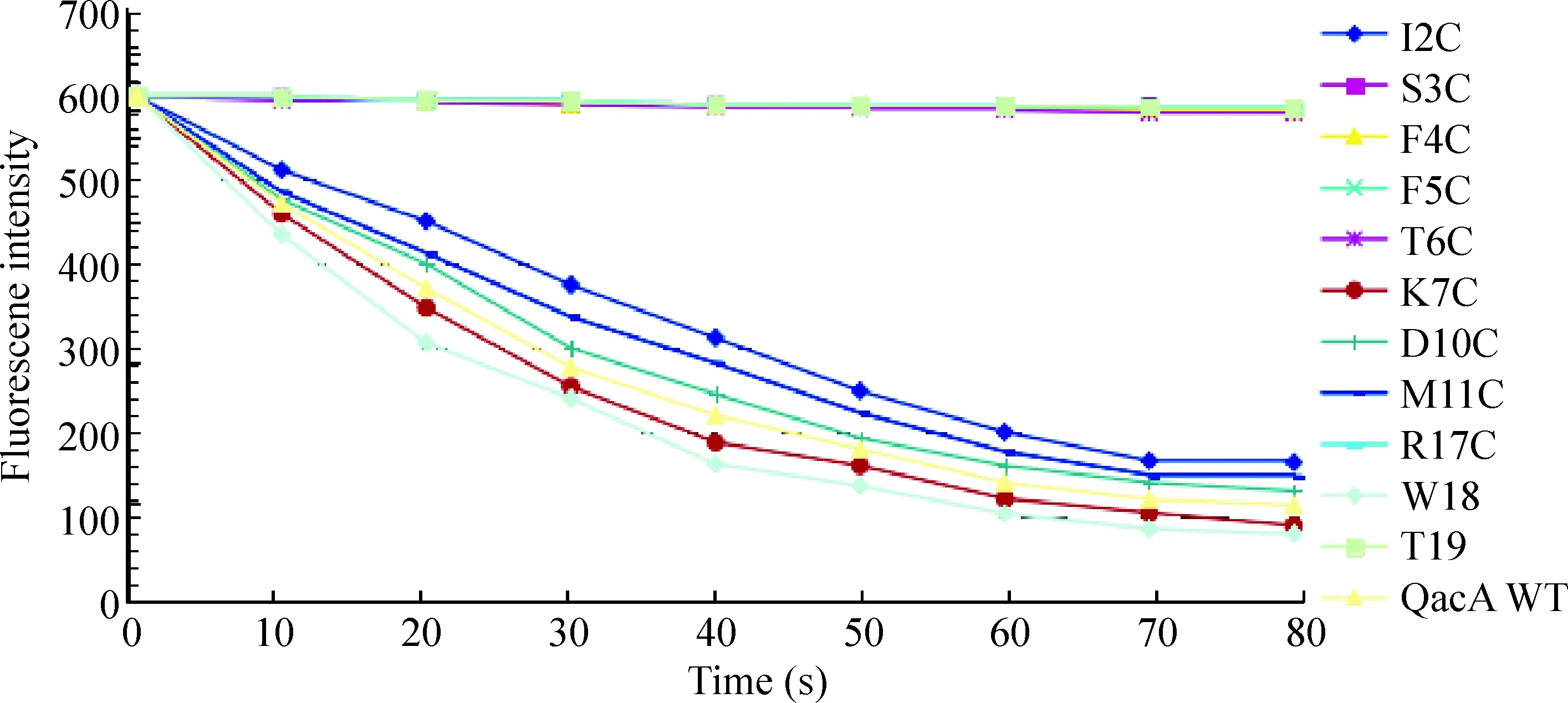
Figure 1.The activity of transporting EB in the QacA mutants of I2C, S3C, F4C, F5C, T6C, K7C, D10C, M11C, R17C, W18C and T19C strains.
图1 QacA诱变株I2C、S3C、F4C、F5C、T6C、K7C、D10C、M11C、R17C、W18C和T19C对EB的运输活性

Figure 2.The activity of transporting EB in the QacA mutants of A20C, V21C, V22C, V23C, F29C, D34C, P43C, E48C, E50C, P51C and Q55C strains.
图2 QacA诱变株A20C、V21C、V22C、V23C、F29C、D34C、P43C、E48C、E50C、P51C和Q55C对EB的运输活性
讨 论
Rouch等1990年在金黄色葡萄球菌中发现了qacA基因。Miyazaki等2001年在部分欧洲医院中发现耐甲氧西林金黄色葡萄菌(methicillin-resistantStaphylococcusaureus, MRSA)中qacA基因的阳性率达到62.6%。Wang等[7]2008年对国内多家医院的调查中发现在MRSA中qacA基因阳性率达到55%。大量抗菌剂的不合理使用是导致细菌耐药的重要原因[8-9]。以前有人认为细菌外膜通透性降低是细菌多重耐药的主要机制,但是随着主动外排系统研究的深入,现在人们普遍认为主动外排机制比细菌外膜通透性机制更加重要。在金黄色葡萄球菌中,QacA就是一个对消毒剂及杀菌剂的多药外排蛋白,在转运物质出细胞膜的过程中涉及单向转运、同向转运、反向转运等机制[7,10]。对QacA多药外排蛋白结构与功能的深入理解将为设计有效的外排泵抑制剂提供有力的分子生物学理论基础。
定点诱变技术是研究蛋白结构与功能的重要方法,由于半胱氨酸体积中等,替换后对原蛋白结构影响小,而且QacA蛋白不含半胱氨酸,因此可对QacA蛋白每个氨基酸进行半胱氨酸定点诱变。我们成功运用半胱氨酸定点诱变技术替换QacA蛋白单个氨基酸获得22株诱变菌株。S3C、F4C 、F5C 、T6C, R17C 、T19C 、A20C 、F29C 、E50C和P51C诱变株与qacA克隆菌株相比MIC 及MBC值降低明显,且转运能力也下降,提示它们在QacA蛋白一价和二价底物的转运中可能具有重要作用。其中S3(丝氨酸)和T6(苏氨酸)属于羟基类氨基酸,R17(精氨酸)和E50(谷氨酸)属于带电荷氨基酸,F4、F5和F29(苯丙氨酸)属于芳香族氨基酸。既往国内外有研究表明,谷氨酸和精氨酸都是属于带负电荷的氨基酸,它们在羧基基团结构上虽然只有微小的差别,但它们在功能上是不能被替换的[11];芳香族氨基酸的苯环能提供被称为阳离子-π相互作用的负性静电区,它能比较牢固的结合阳离子底物;多药转运蛋白中对于转运和/或结合亲脂性阳离子,位于膜内的芳香族氨基酸许多也是必须的。本实验大部分结果与既往国内外研究结果一致。但本次实验中D34C的实验结果与前期研究结果不一致,需进一步研究加以验证。T6C菌株较为特殊,其生长能力有所下降,多次摇床培养均较其余菌株需要更长时间,其原因可能与T6C诱变菌株的生长受到抑制有关。目前国内外尚无对T6(苏氨酸)的研究报道,有待深入进一步研究其与QacA蛋白的关系。
我们对QacA蛋白部分氨基酸进行了功能的研究,下一步可进一步比较突变株蛋白表达的差异,也可根据N-己基顺丁烯二酰亚胺(N-ethylmaleimide,NEM)与半胱氨酸的反应强度判断每个氨基酸所处的环境,判断各氨基酸的位置处于周质,膜亦或细胞质,更加深入全面了解QacA蛋白与外排底物功能密切相关的氨基酸,进一步明确各个氨基酸在QacA蛋白一价和二价底物的转运中的重要性。目前国内对QacA蛋白二级结构的获得还是主要通过对一级蛋白的测序预测,对获得的2-D模型再通过物理、生物学、遗传学等分析的方式进行验证。对于QacA蛋白功能评估的文献报道也较少,国际上对外排蛋白的研究方法也是对数个或某种氨基酸进行定点诱变后进行药敏实验以及动力学实验来分析和判断氨基酸的重要性[5-6, 12-17]。研究外排蛋白系统分子水平的结构和功能,对弄清多药结合转运机制,获得三维结晶结构等起着关键性的作用,同时也是开发新外排泵抑制剂的必要基础。因此本研究可促进我国相关研究的进展,为下一步进行三维结晶结构的研究奠定基础,同时从理论上也有利于降低金黄色葡萄球菌的耐药率,具有重要的临床意义和流行病学意义[14, 18-19]。
[1] Lu Z, Chen Y, Chen W, et al. Characteristics ofqacA/B-positiveStaphylococcusaureusisolated from patients and a hospital environment in China[J]. J Antimicrob Chemo-ther, 2015, 70(3):653-657.
[2] 袁钊辉,龙崇德,林晓峰,等. 金黄色葡萄球菌胞壁成分在细菌性眼内炎中的致病作用[J]. 中国病理生理杂志, 2010, 26(10):1901-1907.
[3] 姚咏明. 金黄色葡萄球菌外毒素在脓毒症发病中的作用与机制探讨[J]. 中国病理生理杂志, 2005, 21(8):1661.
[4] Brown MH, Skurray RA. Staphylococcal multidrug efflux protein QacA[J]. J Mol Microbiol Biotechnol, 2001, 3(2):163-170.
[5] Hassan KA, Souhani T, Skurray RA, et al. Functional effects of intramembranous proline substitutions in the staphylococcal multidrug transporter QacA[J]. FEMS Microbiol Lett, 2006, 263(1):76-85.
[6] Xu Z, O’Rourke BA, Skurray RA, et al. Role of transmembrane segment 10 in efflux mediated by the staphylococcal multidrug transport protein QacA[J]. J Biol Chem, 2006, 281(2):792-799.
[7] Wang C, Cai P, Zhan Q, et al. Distribution of antiseptic-resistance genesqacA/Bin clinical isolates of meticillin-resistantStaphylococcusaureusin China[J]. J Hosp Infect, 2008, 69(4): 393-394.
[8] Zhou Z, Li L, Yu Y, et al. The status of drug resistance andampCgene expression inEnterobactercloacae[J]. Chin Med J (Engl), 2003, 116(8):1244-1247.
[9] Shi WF, Jiang JP, Mi ZH. Relationship between antimicrobial resistance and aminoglycoside-modifying enzyme gene expressions inAcinetobacterbaumannii[J]. Chin Med J (Engl), 2005, 118(2):141-145.
[10]Longtin J, Seah C, Siebert K, et al. Distribution of antiseptic resistance genesqacA,qacB, andsmrin methicillin-resistantStaphylococcusaureusisolated in Toronto, Canada, from 2005 to 2009[J]. Antimicrob Agents Chemother, 2011, 55(6):2999-3001.
[11]Steiner-Mordoch S, Shirvan A, Schuldiner S. Modification of the pH profile and tetrabenazine sensitivity of rat VMAT1 by replacement of aspartate 404 with glutamate[J]. J Biol Chem, 1996, 271(22):13048-13054.
[12]Hassan KA, Souhani T, Skurray RA, et al. Analysis of tryptophan residues in the staphylococcal multidrug transporter QacA reveals long-distance functional associations of residues on opposite sides of the membrane[J]. J Bacteriol, 2008l 190(7):2441-2449.
[13]Neyfakh AA. The ostensible paradox of multidrug recognition[J]. J Mol Microbiol Biotechnol, 2001, 3(2):151-154.
[14]Schumacher MA, Miller MC, Grkovic S, et al. Structural mechanisms of QacR induction and multidrug recognition[J]. Science, 2001, 294(5549):2158-2163.
[15]Brooks BE, Piro KM, Brennan RG. Multidrug-binding transcription factor QacR binds the bivalent aromatic diamidines DB75 and DB359 in multiple positions[J]. J Am Chem Soc, 2007, 129(26):8389-8395.
[16]Murakami S, Nakashima R, Yamashita E, et al. Crystal structures of a multidrug transporter reveal a functionally rotating mechanism[J]. Nature, 2006, 443(7108):173-179.
[17]Murray DS, Schumacher MA, Brennan RG. Crystal structures of QacR-diamidine complexes reveal additional multidrug-binding modes and a novel mechanism of drug charge neutralization[J]. J Biol Chem, 2004, 279(14):14365-14371.
[18]Adler J, Bibi E. Promiscuity in the geometry of electrostatic interactions between theEscherichiacolimultidrug resistance transporter MdfA and cationic substrates[J]. J Biol Chem, 2005, 280(4):2721-2729.
[19]Murray DS, Schumacher MA, Brennan RG. Crystal structures of QacR-diamidine complexes reveal additional multidrug-binding modes and a novel mechanism of drug charge neutralization[J]. J Biol Chem, 2004, 279(14):14365-14371.
(责任编辑: 卢 萍, 罗 森)
Functional study on amino acid residues in α-helix 1, 2 and TMS1 of multidrug exporter QacA from Staphylococcus aureus
JIAN Li1, ZHAO Qi-quan2, JIA Bei3, HUANG Wen-xiang3
(1DepartmentofEndocrinology,2DepartmentofRespiratoryMedicine,People’sHospitalofDazuDistrict,Chongqing402360,China;3TheKeyLaboratoryofInfectiousandParasiticDiseasesinChongqing,DepartmentofInfectiousDiseases,FirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China.E-mail:beijia7410@163.com)
AIM: To determine the importance of the amino acid residues in α-helix 1, 2 and transmembrane segment (TMS) 1 of multidrug exporter QacA fromStaphylococcusaureus. METHODS: Cysteine site-directed mutagenesis was used to mutate the residues including I2, S3, F4, F5, T6, K7, D10, M11, R17, W18, T19, A20, V21, V22, V23, F29, D34, P43, E48, E50, P51 and Q55. Minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC)determination and transport assay were performed to analyze the function of these mutants. RESULTS: The results of MIC and MBC analysis suggested that the drug sensitivity of the mutants S3C, T6C, R17C, T19C, A20C, F29C and E50C to the detected substrates restored completely, and the resistance of the mutants F4C, F5C and P51C to the detected substrates reduced significantly. The results of the fluorimetric transport assay were in agreement with those of MIC and MBC analysis, which indicated that the mutants of S3C, F4C,F5C, T6C, R17C, T19C, A20C, F29C, E50C and P51C could not transport the tested substrates.CONCLUSION: The residues including S3, F4, F5, T6, R17, T19, A20, F29, E50 and P51 are probably involved in the substrate binding and translocation in α-helix 1, 2 and TMS1 of multidrug exporter QacA.
Staphylococcusaureus; QacA protein; Transmembrane segment; α-helix; Cysteine site-directed mutagenesis
1000- 4718(2016)11- 2073- 06
2016- 05- 23
2016- 10- 09
国家自然科学基金资助项目(No. 30973592)
R378.1+1; R363
A
10.3969/j.issn.1000- 4718.2016.11.026
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 023-89012429; E-mail: beijia7410@163.com
